Фенотипическая гетерогенность сердечных макрофагов в постинфарктной регенерации миокарда: перспективы клинических исследований
Автор: Гомбожапова Александра Энхэевна, Роговская Юлия Викторовна, Ребенкова Мария Сергеевна, Кжышковская Юлия Георгиевна, Рябов Вячеслав Валерьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.33, 2018 года.
Бесплатный доступ
Регенерация миокарда является одним из наиболее многообещающих направлений в профилактике развития неблагоприятного ремоделирования сердца. Макрофаги стали предметом научного интереса благодаря их важной роли в переходе воспалительной фазы постинфарктного восстановления миокарда в регенераторную. К настоящему времени результаты экспериментальных наработок по изучению фенотипической гетерогенности сердечных макрофагов пока не нашли своего отражения в клинических исследованиях. Цель настоящего исследования: изучить фенотипическую гетерогенность сердечных макрофагов в процессе постинфарктной регенерации миокарда, транслируя экспериментальные данные в клинические. Материал и методы. В исследование включен 41 больной с фатальным инфарктом миокарда I типа. Помимо патогистологического анализа был проведен иммуногистохимический анализ макрофагальной инфильтрации. В качестве биомаркера клеток общей макрофагальной линии мы использовали CD68. CD163, CD206 и стабилин-1 были использованы как биомаркеры М2 клеток. Группу контроля составили 9 погибших пациентов, не имевших заболеваний сердечно-сосудистой системы. Результаты. Степень интенсивности макрофагальной инфильтрации увеличивалась в фазу регенерации. Нами выявлен бифазный ответ сердечных макрофагов в ответ на острую ишемию миокарда, продемонстрирована фенотипическая гетерогенность M2-клеток. Выявлено наличие сильной положительной корреляции между числом CD68+, CD163+, CD206+ и стабилин-1+ макрофагов и сроками ИМ. Заключение. Результаты нашей работы подтверждают перспективность дальнейшего изучения макрофагов, их фенотипов, механизмов активации и поляризации для последующей разработки и внедрения технологий, основанных на свойствах и функциях данных клеток, в клиническую практику.
Инфаркт миокарда, ремоделирование сердца, макрофаги, сердечная недостаточность, биомаркеры
Короткий адрес: https://sciup.org/149125218
IDR: 149125218 | УДК: 616.127-005.8 | DOI: 10.29001/2073-8552-2018-33-2-70-76
Текст научной статьи Фенотипическая гетерогенность сердечных макрофагов в постинфарктной регенерации миокарда: перспективы клинических исследований
Применение современных методик лечения инфаркта миокарда (ИМ) привело не только к снижению смертности, но и к увеличению числа больных с сердечной недостаточностью (СН). Регенерация миокарда стала одним из наиболее многообещающих направлений в профилактике развития неблагоприятного ремоделирования сердца [1, 2].
Макрофаги стали предметом научного интереса благодаря их важной роли в переходе воспалительной фазы постинфарктного восстановления миокарда в регенераторную [3, 4]. Исследование по моделированию ИМ у мышей продемонстрировало наличие двухфазной реакции в миокарде в ответ на острую ишемию [3]. Провос-палительные М1 макрофаги преобладали в ранней фазе постинфарктного ремоделирования сердца (с 1-го по 4-й день ИМ), в то время как противовоспалительные М2 макрофаги преобладали в течение фазы разрешения воспаления (с 4-го по 10-й день ИМ).
Данные последних исследований продемонстрировали наличие множества фенотипов тканевых макрофагов при той или иной патологии [5, 6]. Биомаркеры позволяют более детально охарактеризовать ту или иную субпо- пуляцию клеток и предоставляют основу для внедрения технологий, основанных на свойствах и функциях моно-цитов/макрофагов, в клиническую практику [7, 8].
Изменения, происходящие в миокарде в ответ на острую ишемию, имеют свою закономерную динамику. Она отражается в клиническом течении инфаркта, данных лабораторных, инструментальных и рутинных гистологических методов исследования. Тем не менее новые методы диагностики позволяют получить дополнительные знания о процессах, протекающих в инфарцированном миокарде. Вместе с тем к настоящему времени результаты экспериментальных исследований по изучению фенотипической гетерогенности сердечных макрофагов пока не нашли своего отражения в клинических. Одной из сложностей является отсутствие возможности проведения эндомиокардиальной биопсии у пациентов с ИМ. Нами предложен протокол по изучению фенотипов сердечных макрофагов у больных фатальным ИМ при помощи иммуногистохимического анализа с использованием биомаркеров данных клеток. Цель настоящего исследования: изучить фенотипическую гетерогенность сердечных макрофагов в процессе постинфарктной регенерации миокарда, транслируя экспериментальные данные в клинические.
Материал и методы
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен Комитетом по биомедицинской этике НИИ кардиологии (г. Томск), протокол № 128 от 23.12.2014.
В настоящей работе объектом исследования являлись фрагменты миокарда больных, умерших от ИМ I типа в 2013–2014 гг. Критериями исключения являлись ИМ II–V типов, инфекционные осложнения (сепсис, пневмония), онкологические заболевания, клапанные пороки, требующие хирургической коррекции, а также случаи, когда ИМ не являлся причиной смерти пациента.
Аутопсия проводилась на базе патологоанатомического отделения. С парафиновых блоков были приготовлены микротомные срезы для последующего исследования. В каждом случае проводился забор от трех до пяти парафиновых блоков. С каждого блока выполнено по двадцать срезов. Срезы фиксировались на стеклах с полилизиновым покрытием.
Гистологическое и иммуногистохимическое исследование проводилось на универсальном исследовательском микроскопе. Локализация и давность ИМ определялась рутинным гистопатологическим анализом. Пациенты были разделены по группам в зависимости от давности ИМ: 1-я группа — умершие в течение первых суток ИМ; 2-я — умершие в течение 24–72 часов; 3-я группа — умершие на 4–10-е сутки; и 4-я группа — на 11–21-е сутки. Группу контроля составили 9 человек, погибших от травм, несовместимых с жизнью и не имевших заболеваний сердечно-сосудистой системы.
Помимо гистопатологического исследования, проводилась иммуногистохимическая оценка макрофагальной инфильтрации. В качестве основного маркера макрофагов был использован CD68, в качестве классических маркеров М2 макрофагов — CD163 и CD206, а в качестве дополнительного маркера М2 макрофагов — ста-билин-1. Мы применяли систему визуализации HRP-DAB (horseradishperoxidase-3,3’-diamnobenzidine). Количественный анализ проводился двумя независимыми исследователями. Количество CD68+, CD163+, CD206+ и ста-билин-1+ макрофагов было подсчитано в зоне инфаркта, периинфарктной зоне и зоне, отдаленной от ИМ. Каждая область оценивалась в 20 случайных полях зрения (микрофотографии x630).
Обработка данных выполнялась с использованием пакета программ Statistica 10.0. Данные представлены в виде медианы и межквартильного размаха. Для статистического анализа использовался метод Крускала — Уоллиса, корреляционный анализ по Спирмену. Обсуждались результаты со статистической значимостью различий при р <0,05.
Результаты и обсуждение
Результаты иммуногистохимического анализа представлены в таблице.
В инфарктной зоне интенсивность CD68+, стабилин-1+, CD163+, CD206+ макрофагальной инфильтрации в течение воспалительной фазы была ниже, чем в фазе регенерации (рис. 1). Количество CD68+ ( p 1–3 =0,003; p 2–3 =0,01) и стаби-лин-1+ ( p 1–3 =0,009; p 2–3 =0,001) макрофагов в зоне инфаркта значительно возрастало и достигало пика в регенераторную фазу (с 4-го по 10-й день ИМ). Количество CD163+ ( p 1–3 =0,01; p 2–3 =0,007) и CD206+ ( p 1–4 =0,003; p 2–4 =0,003) макрофагов в зоне инфаркта возрастало в регенераторную фазу и продолжало увеличиваться на 11–21-е сутки. Таким образом, на более поздних сроках ИМ содержание CD68+,
Таблица
Иммуногистохимический анализ сердечных макрофагов у пациентов с ИМ
|
Показатели |
1-я группа n =13 |
2-я группа n =11 |
3-я группа n =9 |
4-я группа n =8 |
Группа контроля n =9 |
|
CD68+ макрофаги в зоне инфаркта |
54,0 (50,0; 109,0) |
65,5 (59,0; 175,0) |
441 (111; 761,0)† ‖ |
409,0 (334,5; 579,5)§¶ |
17,0 (14,0; 24,0)** |
|
Стабилин-1+макрофаги в зоне инфаркта |
0,0 (0,0; 2,0) |
0,0 (0,0; 1,0) |
174,0 (42,0; 233,0)† ‖ |
186,5 (82,0; 267,5)§¶ |
18,0 (8,0; 30,0)** |
|
CD163+макрофаги в зоне инфаркта |
85,0 (34,0; 285,0) |
49,5 (23,5; 145,0) |
846 (545,0; 1282,0)† ‖ |
916,0 (572,0; 1504,0)§¶ |
32,0 (21,0; 36,0)** |
|
CD206+ макрофаги в зоне инфаркта |
21,0 (14,0; 43,0) |
9,0 (8,0; 18,0) |
45,0 (12; 108,0) |
249 (240,0; 505,0) §¶ |
24,0 (17,0; 21,0) |
|
CD68+ макрофаги в периинфарктной зоне |
44,0 (31,0; 71,0) |
87,0 (48,0;109)* |
176 (85,0; 256,0)† ‖ |
144,5 (83,5; 207,0) |
17,0 (14,0; 24,0) ** |
|
Стабилин-1+ макрофаги в периинфарктной зоне |
0,0 (0,0; 2,0) |
0,0 (0,0; 1,0)* |
39,0 (1,0; 78,0)† |
40,5 (1,0; 71,0)§¶ |
18,0 (8,0; 30,0)** |
|
CD163+ макрофаги в периинфарктной зоне |
51,0 (47,0; 66,0) |
73,0 (44,5; 135,5) |
135,0 (82,0; 204,0)† |
163,0 (72,0; 265,0)§ |
32,0 (21,0; 36,0)** |
|
CD206+-макрофаги в периинфарктной зоне |
12,0 (10,5; 29,0) |
19,0 (3,0; 51,0) |
46,0 (45,0; 55,0)† |
36 (16,0; 37,0) |
24,0 (17,0; 21,0) |
|
CD68+-макрофаги в отдаленной от инфаркта зоне |
37,0 (31,0; 62,0) |
51,0 (39,0; 85,0) |
118,0 (61,0: 169,0)† |
92,5 (57,0; 107;0) |
17,0 (14,0; 24,0)** |
|
Стабилин-1+ макрофаги в отдаленной от инфаркта зоне |
0,0 (0,0; 3,0) |
0,0 (0,0; 0,04) |
10,0 (0,0; 21,0) ‖ |
0,5 (0,0; 13,0) |
18,0 (8,0; 30,0)** |
|
CD163+-макрофаги в отдаленной от инфаркта зоне |
60,0 (42,5; 85,5) |
52,0 (31,0; 87,0) |
73,0 (59,0; 142,0) |
77,5 (46,0; 107,0) |
32,0 (21,0; 36,0)** |
|
CD206+-макрофаги в отдаленной от инфаркта зоне |
15,0 (5,0; 36,0) |
14,0 (4,0; 27,0) |
7,0 (4,0; 13,0) |
16 (14,0; 16,0) |
24,0 (17,0; 21,0) |
Примечание: * p <0,05 — различие между 1-й и 2-й группой; † p <0,05 — различие между 1-й и 3-й группой; § p <0,05 — различие между 1-й и 4-й группой; ‖ p <0,05 — различие между 2-й и 3-й группой; ¶ p <0,05 — различие между 2-й и 4-й группой; ** p <0,05 — различие между группой контроля и остальными группами. Для проведения попарных сравнений использовались множественные сравнения в критерии Крускала — Уоллиса.
стабилин-1+, CD206+ и CD163+ макрофагов по-прежнему оставалось высоким. В группе контроля количество CD68+ (p<0,001) и CD163+ (p<0,001) макрофагов было ниже, чем в инфарктной зоне, в том числе и на ранних сроках заболевания. При этом в течение фазы воспаления количе- ство стабилин-1+ клеток в зоне инфаркта было ниже, чем в группе контроля (p1–5=0,01; p2–5=0,007). В ранние сроки инфаркта содержание CD206+ макрофагов не отличалось от такового в группе контроля и становилось выше на поздних сроках (p4-5=0,003).
В периинфарктной зоне количество CD68+ макро- фагов начинало увеличиваться в воспалительную фазу (24–72 часа от начала ИМ; p1–2=0,024), достигало пика с 4-го по 10-й день ИМ (p1–3=0,009). В то время как содержание стабилин-1+, CD206+ и CD163+ макрофагов в периинфарктной области оставалось неизменным в течение фазы воспаления и увеличивалось в регенераторную фазу (стабилин-1: p1–3=0,02; p2–3=0,02; CD206: p1–3=0,04; CD163: p1–3=0,03). Как и в зоне инфаркта, на более поздних сроках ИМ, содержание CD68+, стаби-лин-1+ и CD163+ макрофагов значительно не изменялось. В группе контроля содержание CD68+ (p<0,001) и CD163+ (p=0,0004) макрофагов было ниже, чем в периинфаркт-ной зоне, в том числе и на ранних сроках заболевания.
Аналогично с инфарктной зоной, в течение фазы воспаления количество стабилин-1+ клеток в периинфарктной области было ниже, чем в группе контроля ( p 1–5 =0,003; p 2–5 =0,001). Содержание CD206+ макрофагов в данной области не отличалось от группы контроля.
Помимо изменений в зоне инфаркта и периинфаркт- ной зоне, в участках, отдаленных от инфаркта, также наблюдалось увеличение количества CD68+ (p1–3=0,04) Исследование по моделированию ИМ у мышей про-и стабилин-1+ (p2–5=0,038) макрофагов на 4–10-й день те- демонстрировало наличие двухфазной реакции в мио-
чения заболевания. В зоне, отдаленной от инфаркта, количество CD68+ ( p 1–5 =0,004) и CD163+ ( p 1–5 =0,04) клеток было выше, чем в группе контроля, в то время как число стабилин-1+ макрофагов ( p 1–5 =0,005) было меньшим, чем в контрольной группе.
Анализ интенсивности макрофагальной инфиль- трации показал (рис. 2), что в зоне инфаркта в течение первых суток (p<0,001), а также в фазе регенерации (p<0,001) преобладающей субпопуляцией являлись CD163+ макрофаги. Различия в интенсивности макрофагальной инфильтрации сохранялись и в периинфаркт- ной зоне (p<0,0010 до p=0,005), однако здесь преобладание CD68+ и CD163+ макрофагов варьировало в разные сроки инфаркта. В зонах, отдаленных от инфаркта, начиная с четвертых суток (p=0,004), превалировало количество CD68+ клеток. Стабилин-1+ клетки отсутствовали на ранних сроках ИМ и представляли наиболее малочисленную субпопуляцию макрофагов.
Выявлена взаимосвязь количества CD68+, стаби-лин-1+, CD206+, CD163+ макрофагов и давности ИМ. Количество CD68+ макрофагов коррелировало со сроками ИМ следующим образом. Сильная положительная связь обнаружена в зоне инфаркта ( R =0,67; p =0,001) и умеренная положительная связь — в периинфарктной области
(R=0,55; p<0,001). Похожая взаимосвязь наблюдалась и в динамике стабилин-1+ и CD163+ макрофагов (стаби-лин-1: для зоны инфаркта R=0,6, p<0,001, для периин-фарктной зоны R=0,42, p=0,007; CD163: для зоны инфаркта R=0,58, p=0,0003, для периинфарктной зоны R=0,58, p=0,0004). Количество CD206+ макрофагов коррелирова- ло со сроками ИМ лишь в зоне инфаркта (R=0,4, p=0,02).
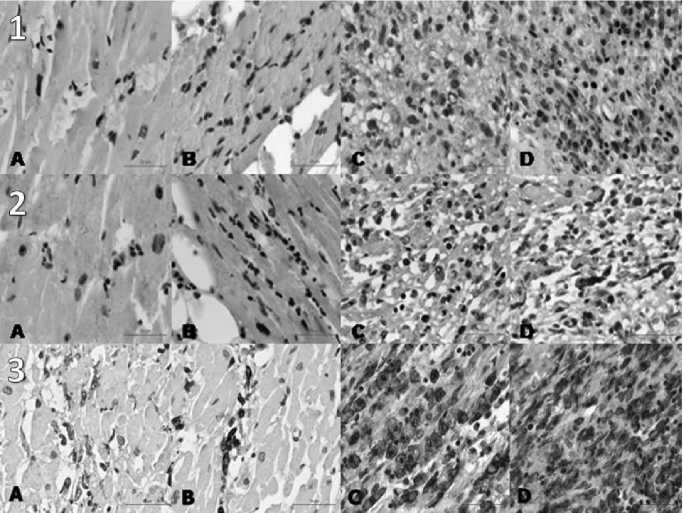
Рис. 1. Динамика сердечных CD68+, стабилин-1+ и CD163+ макрофагов в зоне инфаркта миокарда, иммуногистохимия, scale-bar 50µm. 1 — CD68+ макрофаги; 2 — стабилин-1+ макрофаги; 3 — CD163+ макрофаги. A — 1-я группа ( n =13), B — 2-я группа ( n =11), C — 3-я группа ( n =9), D — 4-я группа ( n =8)
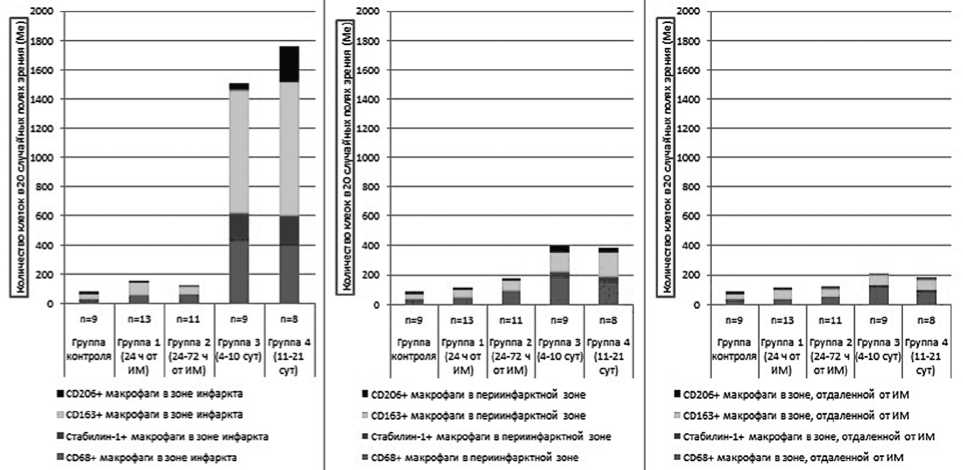
Рис. 2. Интенсивность макрофагальной инфильтрации в зоне инфаркта, периинфарктной зоне и зоне, отдаленной от инфаркта
карде в ответ на ишемию [3]. В результате нашей работы мы подтвердили бифазный ответ сердечных макрофагов в ответ на острую ишемию миокарда. Эта реакция напоминала таковую у мышей, однако не была идентичной. Различие заключалось в выраженной и продолжительной CD68+, CD163+, CD206+ и стабилин-1+ макрофагальной инфильтрации на протяжении позднего срока ИМ. Данный факт может быть результатом различий между экспериментальной моделью, полученной на животных, и исследованием, проведенным на клиническом материале. Однако нельзя исключить возможность того, что подобный ответ был вызван другими факторами, такими как продолжающаяся ишемия, обширное повреждение миокарда, сопутствующая патология.
Известно, что М2 макрофаги выполняют противовоспалительные функции и создают условия для процессов заживления повреждений и регенерации [9]. С другой стороны, длительное воздействие повреждающего фактора может приводить к неконтролируемой активации М2 макрофагов и трансформировать их в антагонистов тканевого заживления. Возможно, в нашем исследовании мы наблюдали неблагоприятный «сценарий» чрезмерной активации М2 макрофагов на поздних сроках ИМ. Кроме того, количество CD68+, CD163+ и стабилин-1+ макрофагов увеличивалось не только в инфарктной и периин-фарктной зоне, но в участках, отдаленных от инфаркта, что свидетельствует о вовлечении всего миокарда в ответ на острую ишемию.
В настоящем исследовании мы наблюдали схожую динамику стабилин-1+, CD163+ и СD206+ макрофагов — увеличение их содержания в регенераторную фазу, что говорит об их принадлежности к макрофагам М2 типа [9]. Однако при этом во всех группах и зонах в количественном плане преобладали CD163+ клетки, что позволяет нам сделать вывод о гетерогенности М2 макрофагов — наличии их различных субпопуляций. Наличие стаби- лин-1+ макрофагов в группе контроля, их отсутствие в первые сутки инфаркта и появление на более поздних сроках, вероятно, отражает различия в функциях, механизмах активации и поляризации М2 клеток.
В ходе нашего исследования мы использовали антитела к стабилину-1, который является одним из широко изучаемых маркеров М2 макрофагов [10–13]. Однако исследования, посвященные роли стабилин-1+ клеток в сердечно-сосудистой патологии, немногочисленны [14–16]. В настоящей работе мы впервые изучили экспрессию стабилина-1 в процессе постинфарктной регенерации миокарда. Мы показали наличие положительной связи между количеством стабилин-1+ макрофагов в зоне инфаркта и гистологической характеристикой сроков ИМ, а именно, появлением и формированием грануляционной ткани, что является морфологической основой постинфарктного ремоделирования сердца [17]. Возможно, полученные результаты отражают данные клинических исследований, в которых развитие прогрессирующей дилатации камер сердца и систолической дисфункции наблюдалось в течение первых трех дней ИМ, в то время как улучшение функции левого желудочка наступало на поздних сроках инфаркта [18].
Заключение
Мы впервые оценили динамику сердечных макрофагов в постинфарктной регенерации миокарда, транслируя экспериментальные данные в клинические. Нами выявлен бифазный ответ сердечных макрофагов в ответ на острую ишемию миокарда и продемонстрирована их фенотипическая гетерогенность. Результаты нашей работы подтверждают перспективность дальнейшего изучения макрофагов, их фенотипов и механизмов активации для последующей разработки и внедрения технологий, основанных на свойствах и функциях данных клеток, в клиническую практику.
Список литературы Фенотипическая гетерогенность сердечных макрофагов в постинфарктной регенерации миокарда: перспективы клинических исследований
- Snyder R. J., Lantis J., Kirsner R. S., Shah V., Molyneaux M., Carter M. J. Macrophages: a review of their role in wound healing and their therapeutic use. Wound Repair Regen. 2016; 24(4): 613-629. DOI: 10.1111/wrr.12444
- Gombozhapova A., Rogovskaya Yu., Shurupov V., Rebenkova M., Kzhyshkowska J., Popov S. V., Karpov R. S., Ryabov V. Macrophage activation and polarization in post-infarction cardiac remodeling. J. Biomed. Sci. 2017; 24(1): 13. DOI: 10.1186/s12929-017-0322-3
- Nahrendorf M., Swirski F. K., Aikawa E., Stangenberg L., Wurdinger T., Figueiredo J. L., Libby P., Weissleder R., Pittet M. J. The healing myocardium sequentially mobilizes two monocyte subsets with divergent and complementary functions. J. Exp. Med. 2007; 204(12): 3037-3047. DOI: 10.1084/jem.20070885
- Рябов В. В., Гомбожапова А. Э., Роговская Ю. В., Иванюк Е. Э., Кжышковская Ю. Г., Карпов Р. С. Функциональная пластичность моноцитов/макрофагов в процессах восстановительной регенерации и постинфарктного ремоделирования сердца. Иммунология. 2016; 37: 305-312. DOI: 10.18821/0206-4952-2016-37-6-305-311
- Troidl C., Mollmann H., Nef H., Masseli F., Voss S., Szardien S., Willmer M., Rolf A., Rixe J., Troidl K., Kostin S., Hamm C., Elsasser A. Classically and alternatively activated macrophages contribute to tissue remodelling after myocardial infarction. J. Cell. Mol. Med. 2009; 13: 3485-3496. x. DOI: 10.1111/j.15824934.2009.00707
- Xue J., Schmidt S. V., Sander J., Draffehn A., Krebs W., Quester I., De Nardo D., Gohel T. D., Emde M., Schmidleithner L., Ganesan H., Nino-Castro A., Mallmann M. R., Labzin L., Theis H., Kraut M., Beyer M., Latz E., Freeman T. C., Ulas T., Schultze J. L. Transcriptome-based network analysis reveals a spectrum model of human macrophage activation. Immunity. 2014; 40(2): 274-288.
- DOI: 10.1016/j.immuni.2014.01.006
- Ginhoux F., Schultze J. L., Murray P. J., Ochando J., Biswas S. K. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nat. Immunol. 2016; 17: 34-40.
- DOI: 10.1038/ni.3324
- Gratchev A., Sobenin I., Orekhov A., Kzhyshkowska J. Monocytes as a diagnostic marker of cardiovascular diseases. Immunobiology. 2012; 217: 476-482.
- DOI: 10.1016/j.imbio.2012.01.008
- Nahrendorf M., Swirski F. K. Monocyte and macrophage heterogeneity in the heart. Circ Res. 2013; 112(12): 1624-1633.
- DOI: 10.1161/CIRCRESAHA.113.300890
- Kzhyshkowska J., Gratchev A., Goerdt S. Stabilin-1, a homeostatic scavenger receptor with multiple functions. J. Cell. Mol. Med. 2006; 10: 635-649.
- Mitrofanova I., Zavyalova M., Telegina N., Buldakov M., Riabov V., Cherdyntseva N., Kzhyshkowska J. Tumor-associated macrophages in human breast cancer parenchyma negatively correlate with lymphatic metastasis after neoadjuvant chemotherapy. Immunobiology. 2017; 222: 101-109.
- DOI: 10.1016/j.imbio.2016.08.001
- McCurdy S. M., Dai Q., Zhang J., Zamilpa R., Ramirez T. A., Dayah T., Nguyen N., Jin Y. F., Bradshaw A. D., Lindsey M. L. SPARC mediates early extracellular matrix remodeling following myocardial infarction. Am. J. Physiol. Heart Circ. Physiol. 2011; 301: 497-505.
- DOI: 10.1152/ajpheart.01070.2010
- Riabov V., Yin S., Song B., Avdic A., Schledzewski K., Ovsiy I., Gratchev A., Llopis Verdiell M., Sticht C., Schmuttermaier C., Schonhaber H., Weiss C., Fields A. P., Simon-Keller K., Pfister F., Berlit S., Marx A., Arnold B., Goerdt S., Kzhyshkowska J. Stabilin-is expressed in human breast cancer and supports tumor growth in mammary adenocarcinoma mouse model. Oncotarget. 2016; 7: 31097-31110.
- DOI: 10.18632/oncotarget.8857
- Kzhyshkowska J. Multifunctional receptor stabilin-1 in homeostasis and disease. Scientific World Journal. 2010; 10: 2039-2053.
- DOI: 10.1100/tsw.2010.189
- Gratchev A., Ovsiy I., Manousaridis I., Riabov V., Orekhov A., Kzhyshkowska J. Novel monocyte biomarkers of atherogenic conditions. Curr. Pharm. Des. 2013; 19: 5859-5864.
- Гомбожапова А. Э., Роговская Ю. В., Ребенкова М. С., Шурупов В. С., Кжышковская Ю. Г., Рябов В. В. Стабилин-1позитивные макрофаги в миокарде пациентов с фатальным исходом инфаркта миокарда. Сибирский медицинский журнал. 2016; 31(2): 100-103.
- Potapov E., Wassilew K., Krabatsch T., Dandel M., Song B., Mickley A., Schmuttermaier C., Gratchev A., Hetzer R., Kzhyshkowska J. Association of alternatively activated macrophages with unbalanced immune reactions and fibrosis in myocardium of dilatative cardiomyopathy patients with left ventricular assist device implantation. Eur. Heart J. 2013, abstract: p4198.
- DOI: 10.1093/eurheartj/eht309.P4198
- Керчева М. А., Рябова Т. Р., Рябов В. В., Карпов Р. С. Динамика показателей стандартной и 2D speckle tracking эхокардиографии у пациентов с острым первичным передним инфарктом миокарда с подъемом сегмента ST. Сибирский медицинский журнал. 2016; 31(2): 43-47.


