Фенотипическая пластичность метастатической меланомы
Автор: Михайлова Ирина Николаевна, Анурова Ольга Александровна, Лушникова Анна Александровна, Цыганова Ирина Викторовна, Сендерович Анастасия Ильинична, Кондратьева Татьяна Тихоновна, Демидов Лев Вадимович, Мазуренко Наталия Николаевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 1 т.18, 2019 года.
Бесплатный доступ
Актуальность. Метастатическая меланома отличается клинико-морфологической гетерогенностью и пластичностью. Встречаются редкие случаи метастатической меланомы, которые практически не экспрессируют меланоцитарных маркеров. Гиcтологически такие меланомы требуют дифференциаль-ной диагностики от морфологически сходных немеланоцитарных опухолей, саркомы или лимфомы. Цель исследования - исследование неординарных случаев метастатической меланомы с низкой экспрессией дифференцировочных маркеров. материал и методы. Описаны 15 случаев меланомы с необычными клинико-морфологическими характеристиками. Опухоли подверглись морфологиче-скому, цитологическому исследованию, иммуногистохимическому и FISH-анализу, были определены мутации в генах BRAF, NRAS и KIT. Результаты. Первичные меланомы часто не содержали пигмен-та, что затрудняло дифференциальную диагностику опухоли. Опухоли располагались чаще всего на спине, голени или голове, у 4 пациентов первичные очаги не выявлены. Метастатические поражения представляли собой крупные узловые новообразования в мягких тканях в области спины либо нижней конечности. Большинство опухолей относились к смешанному или веретеноклеточному гистологическим типам. Веретенообразные клетки отмечены и при цитологических исследованиях. При генетическом анализе мутации в гене BRAF выявлены в 27 % меланом, мутации в генах NRAS и KIT не обнаруже-ны. В 4 случаях с помощью FISH проведен анализ на наличие реаранжировки гена EWSR1, при этом диагноз саркомы не подтвердился. Полученные результаты указывают на гистологическую и молеку-лярную неоднородность и фенотипическую пластичность исследованных меланом. Ряд выявленных молекулярно-генетических особенностей сближает эти опухоли с саркомами.
Меланома кожи, цитологические и гистологические особенности, мутационный статус опухоли, гетерогенность, генетическое исследование, иммуногистохимические маркеры
Короткий адрес: https://sciup.org/140254246
IDR: 140254246 | УДК: 616-006.81-033.2-091.811:577.21 | DOI: 10.21294/1814-4861-2019-18-1-86-94
Текст научной статьи Фенотипическая пластичность метастатической меланомы
Меланома – одно из наиболее опасных злокаче‑ ственных новообразований кожи с высоким риском метастазирования и рецидивов. Метастатическая меланома прогностически крайне неблагоприятна и резистентна к традиционной химиотерапии, однако улучшение результатов лечения стало воз‑ можным благодаря совершенствованию таргетной и иммунотерапии [1, 2].
Меланома отличается клинико‑морфологи‑ ческой гетерогенностью и пластичностью [3, 4]. Диагноз, поставленный при дермоскопии, под‑ тверждают с помощью гистологических и ИГХ (иммуногистохимических) исследований. Для меланомы кожи характерно позитивное окраши‑ вание S100, Melan‑A или HMB‑4 (маркер MITF менее специфичен) и негативное окрашивание на цитокератины, p63 и гладкомышечный актин [5]. Клинико‑морфологическая гетерогенность мела‑ номы проявляется в различной локализации опу‑ холей, в фазе опухолевой прогрессии и сопряжена с определенными молекулярно‑генетическими нарушениями. Наиболее часто в меланоме кожи выявляют мутации генов BRAF (50 %) или NRAS (20 %), реже обнаруживают мутации генов NF1, RAC1 , KIT и др. [1, 2].
В России частота выявления меланомы на поздних стадиях заболевания остается высокой. Метастазы меланомы обнаруживают в коже, в регионарных лимфоузлах, легких, печени, голов‑ ном мозге и костях. В ряде случаев клиническая картина заболевания обусловлена метастазами без выявленного первичного очага (БВПО). Иногда локализацию первичной меланомы невозможно установить из‑за регрессии опухоли, вплоть до ее полного исчезновения.
В отличие от слабо пигментированных мета‑ стазов, первичная беспигментная или малопиг‑ ментная меланома является редким вариантом, для диагностики которого используют иммуногистохи‑ мические маркеры. В большинстве случаев метаста‑ тической меланомы выявляют фокальную ядерную или цитоплазматическую экспрессию S100. Однако экспрессия вторичных меланоцитарных маркеров, таких как Melan‑A/MART‑1, HMB45, тирозиназа и MITF, высоко вариабельна. Метастатические опухоли, особенно веретеноклеточная меланома, не экспрессируют данные маркеры [3–7]. В связи с этим говорят о низкодифференцированной и де‑ дифференцированной злокачественной меланоме как первичной, так и метастатической [7].
Различают несколько типов дивергентной дифференцировки злокачественной меланомы [4, 7]. Фибробластная/миофибробластная дифферен‑ цировка наблюдается исключительно в веретено‑ клеточной десмопластической злокачественной меланоме с саркоматоидной дедифференцировкой [3–4, 7–9]. Шванновская дифференцировка встре‑ чается в доброкачественных внутридермальных невусах и в злокачественной меланоме, впервые описанной как нейросаркоматоидная трансформа‑ ция [10]. Также описана меланома с эпителиальной (аденокарциноматозной) [11], рабдомиобластной [7] и нейроэндокринной дифференцировкой [4].
Патогистологические особенности таких опу‑ холей, как правило, недостаточно убедительны для дифференциальной диагностики меланомы, по‑ скольку экспрессия дифференцировочных марке‑ ров в них низкая или отсутствует. Такие меланомы могут представлять неожиданные или необычные фенотипы, гистологически сходные с различными опухолями. Это создает диагностические труд‑ ности и требует углубленной дифференциальной диагностики от морфологически похожих неме‑ ланоцитарных опухолей, например саркомы или карциномы [4, 7, 12].
Среди неэпителиальных опухолей особо вы‑ деляется так называемая меланома мягких тканей, или светлоклеточная саркома [6, 12–14]. Подобно меланоме, в ней экспрессируются S100, SOX10 и вторичные меланоцитарные маркеры. Однако светлоклеточная саркома характеризуется более интенсивным диффузным окрашиванием HMB‑45 по сравнению с S100, что не характерно для меланомы. Поскольку гистологические и имму‑ ногистохимические характеристики меланомы и светлоклеточной саркомы перекрываются, для уточнения диагноза и исключения меланомы не‑ обходим FISH‑анализ на наличие реаранжировки гена EWSR1 . В светлоклеточной саркоме обнару‑ живают транслокации с образованием слитного гена и химерного белка EWSR1‑ATF1 (12;22, q13;q12) или с образованием EWSR1‑CREB1(2;22, q34;q12). Эти химерные онкобелки индуцируют экспрессию транскрипционного фактора MITF, что ведет к пролиферации и дифференцировке опухолевых клеток [12–14].
Целью исследования явилась характеристика редких образцов меланомы, которые привлекли наше внимание необычной клинической картиной и морфологическими особенностями.
Материал и методы
Исследовали 15 случаев меланомы с необычной клинико‑морфологической картиной из выборки более 250 пациентов с первичной или метастати‑ ческой меланомой, обратившихся в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» МЗ РФ в 2013–15 гг.
Цитологические исследования. Три опухо‑ левых образца исследовали с помощью свето‑ оптической микроскопии. Высушенные мазки фиксировали с использованием красителя Лейш‑ мана и контрастировали азур‑эозином.
ИГХ исследования . Шесть опухолевых образ‑ цов, полученных от пациентов с первоначальным диагнозом саркома/лимфома, исследовали иммуно‑ гистохимически с использованием антител к Ki‑67 (фирма CellMarque); S100 (фирма CellMarque); MelanA (фирма BioGenex); HMB 45 (фирма Dako); MiTF (фирма CellMarque); тирозиназе (фирма CellMarque); Н‑кальдесмину (фирма Dako); CD99 (фирма CellMarque); виментину (фирма BioGenex); PanCKAE1/AE3 (фирма CellMarque); СK5/6(фирма CellMarque); P63(фирма Epitomics ); EMA(фирма CellMarque); хромогранину А (фирма BioGenex); синаптофизину (фирма BioGenex); MuM1 (фирма CellMarque).
FISH-анализ проведен для 4 опухолей с подо‑ зрением на саркому. FISH‑реакция проводилась по стандартному протоколу, предложенному фирмой‑ производителем флуоресцентного зонда, Kreatech (Нидерланды) с использованием зонда ONEWSR1 (22q12) Break. Оценка результатов производилась с помощью флуоресцентного микроскопа Axioscop 2Plus (Zeiss).
Генетическое исследование опухолей прове‑ дено на 15 образцах ДНК, полученных из опухо‑ левых клеток, собранных с парафиновых срезов с последующей обработкой протеиназой К (Novagen, USA) либо выделенных из свежих операционных биопсий с использованием набора «Ампли Прайм ДНК‑сорб‑В» (производитель ООО «НекстБио», Россия). Мутации генов BRAF ( 15 экзон), NRAS ( 2, 3 экзоны), KIT (11, 13 и 17 экзоны) анализиро‑ вали в ПЦР с последующим секвенированием на ABI PRISM 3100‑Avant с помощью реактивов ABI PRISM® BigDye™ Terminator Vol.3.1 [15, 16].
Результаты
В исследование включены 15 случаев меланомы с необычной клинико‑морфологической картиной (табл. 1). Биопсийный материал получен от 8 жен‑ щин и 7 мужчин в возрасте от 27 до 78 лет (средний возраст – 42,4 года), причем 11 пациентов были моложе 50 лет.
В одном случае была исследована первич‑ ная беспигментная веретеноклеточная опухоль спины (пациент № 12), в 14 – поступивший ма‑ териал представлял собой метастазы меланомы. Первичная опухоль располагалась на спине у 6 пациентов, на голени – у 2, в височной области головы или на шее – у 3 больных. У 4 пациентов имелись метастазы без выявленного первичного очага. Метастатические поражения представляли собой крупные узловые новообразования в мягких тканях в области спины либо нижней конечности, также метастазы поражали лимфоузлы, легкие, кожу, кости, печень. Большинство метастазов были лишены пигмента, но 6 метастатических опухолей были пигментосодержащими (табл. 1).
Диагностика опухолей практически во всех случаях вызывала сложности, чаще всего было не‑ обходимо дифференцировать меланому и саркому, в 1 случае предполагали лимфому. В частности, фи‑ гурировали следующие диагнозы: лимфома (№ 1), плейоморфная рабдомиосаркома (№ 3), меланоци‑ тарная шваннома (№ 6), меланоцитарный фенотип круглоклеточной саркомы (№ 9), саркомоподобная меланома (№ 14), светлоклеточная недифференци‑ рованная плейоморфная саркома (№ 15).
При цитологическом исследовании препарата опухоли пациентки № 1 (рис. 1 г , д ) обнаружены клетки преимущественно округлой формы с нежной структурой хроматина, которые ошибочно могут быть интерпретированы как клетки злокачествен‑ ной лимфомы. При детальном изучении в отдельных клетках отмечалось наличие темных гранул пигмен‑ та (рис. 1 а , б ). При исследовании клеток узловой изъязвленной беспигментной поверхностно рас‑ пространенной меланомы пациентки № 13 клетки, типичные для меланомы, были немногочисленны, преимущественно выявлялись веретенообразные клетки и клетки с палочковидными ядрами, сарко‑ моподобные, бедные пигментом (рис. 1 в–д ).
таблица 1
Фенотипы исследованных опухолей
|
Паци‑ ент |
Пол |
Воз‑ раст |
Первичная локализа‑ ция |
Первичный гистологи‑ ческий диагноз |
Пигмента‑ ция |
Гистологический тип |
Мутационный статус метастаза |
|
1 |
Ж |
47 |
БВПО |
Лимфома / Рак молоч‑ ной железы |
Нет |
Смешанный |
BRAF/NRAS/KITWT |
|
2 |
Ж |
38 |
БВПО |
Саркома / Меланома яичника с врастанием в |
Нет |
Эпителиоидно‑ клеточный |
BRAF/NRAS/KIT WT |
|
серозу тела матки Плеоморфная рабдо‑ |
|||||||
|
3 |
Ж |
27 |
БВПО |
миосаркома или злока‑ чественная фиброзная |
Нет |
Смешанный |
BRAF/NRAS/KIT WT |
|
гистиоцитома |
|||||||
|
4 |
Ж |
37 |
Голень |
Меланома |
Пигмента‑ ция |
Эпителиоидно‑ клеточный |
BRAF/NRAS/KIT WT |
|
5 |
Ж |
78 |
Cпина |
Саркома |
Пигмента‑ ция |
Веретеноклеточный / Узловая |
BRAF/NRAS/KIT WT |
|
6 |
М |
34 |
Спина |
Меланоцитарная шваннома / Саркома / |
Пигмента‑ ция |
Смешанный / Узло‑ вая |
BRAF/NRAS/KIT WT |
|
Меланома |
|||||||
|
7 |
Ж |
30 |
БВПО |
Саркома |
Нет |
Смешанный |
Ex-15 V600E NRAS/KIT WT |
|
8 |
М |
49 |
Спина |
Лимфома |
Нет |
Эпителиоидно‑ клеточный |
Ex-15 V600E NRAS/KIT WT |
|
9 |
М |
40 |
Спина |
Саркома |
Пигм |
Веретеноклеточный / Узловая |
BRAF/NRAS/KIT WT |
|
10 |
М |
30 |
Спина |
Саркома |
Нет |
Эпителиоидно‑ клеточный |
BRAF/NRAS/KIT WT |
|
11 |
М |
44 |
Височная область |
Саркома |
Пигмента‑ ция |
Веретеноклеточный |
BRAF/NRAS/KIT WT |
|
12 |
Ж |
72 |
Спина |
Саркома |
Нет |
Веретеноклеточный |
Ex-15 V600E NRAS/KIT WT |
|
13 |
Ж |
68 |
Голень |
Меланома |
Нет |
Эпителиоидно‑ клеточный / Узловая |
BRAF/NRAS/ KIT WT |
|
14 |
М |
62 |
Височная область |
Саркомоподобная меланома |
Пигмента‑ ция |
Эпителиоидно‑ клеточный |
BRAF/NRAS/ KITWT |
|
Задняя по‑ |
Недифференциро‑ |
||||||
|
15 |
М |
30 |
верхность |
ванная плеоморфная |
Нет |
Смешанный |
Ex-15 V600E NRAS/KIT WT |
|
шеи |
саркома / Меланома |
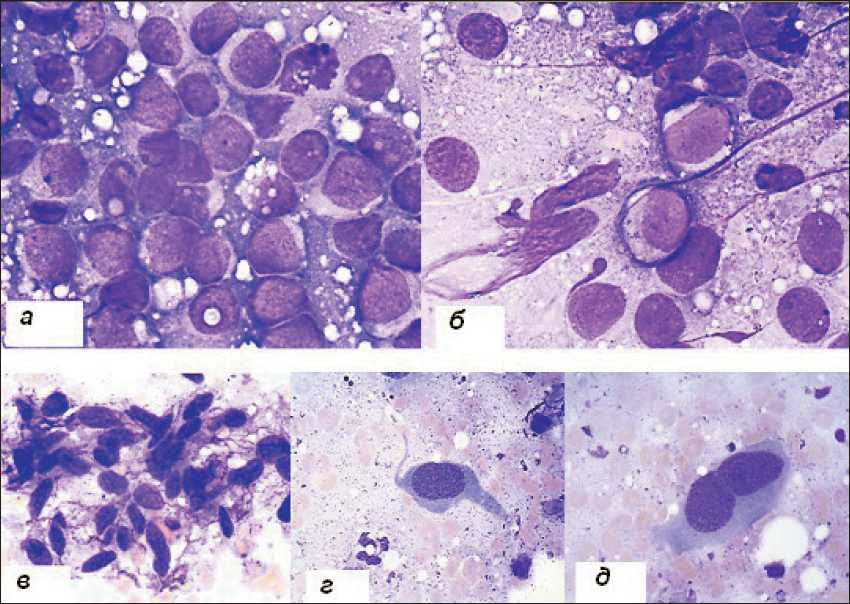
Рис. 1. Микрофото. Цитологические препараты опухолей пациенток № 1 ( а, б ) и 13 ( в–д ). ×400 ( а, б, г, д ), ×200 ( в )
таблица 2
Иммуногистохимическая характеристика опухолевых клеток пациентов

|
Отриц. BCL2,MuM1, CD3, |
|||||||||||||||||
|
1 |
3040 % |
+/‑ |
+/‑ |
+/‑ |
н/д |
+Яд |
н/д |
н/д |
н/д |
н/д |
н/д |
н/д |
н/д |
+/‑ |
+/‑ |
н/д |
CD5, CD10, CD20, CD23, CD30, CD39, |
|
синаптофизин |
|||||||||||||||||
|
2 |
6070 % |
+/‑ |
+/‑ |
+ |
н/д |
н/д |
+ |
н/д |
н/д |
н/д |
‑ |
‑ |
н/д |
н/д |
н/д |
+ |
|
|
3 |
67 50 % |
+/‑ |
+/‑ |
+/‑ |
+/‑ |
+Яд. |
+ |
‑ |
‑ |
‑ |
н/д |
‑ |
‑ |
н/д |
н/д |
+ |
|
|
5 |
75 % |
+/‑ |
+/‑ |
‑ |
н/д |
‑ |
+ |
‑ |
н/д |
‑ |
н/д |
н/д |
+/‑ |
‑ |
‑ |
н/д |
Отриц.синапто‑ физин |
|
6 |
+ |
+ |
+ |
н/д |
н/д |
н/д |
н/д |
‑ |
н/д |
н/д |
н/д |
+ |
н/д |
н/д |
н/д |
||
|
7 |
50 % |
+ |
н/д |
+ |
н/д |
‑ |
н/д |
н/д |
н/д |
н/д |
н/д |
н/д |
+ |
н/д |
н/д |
н/д |
|
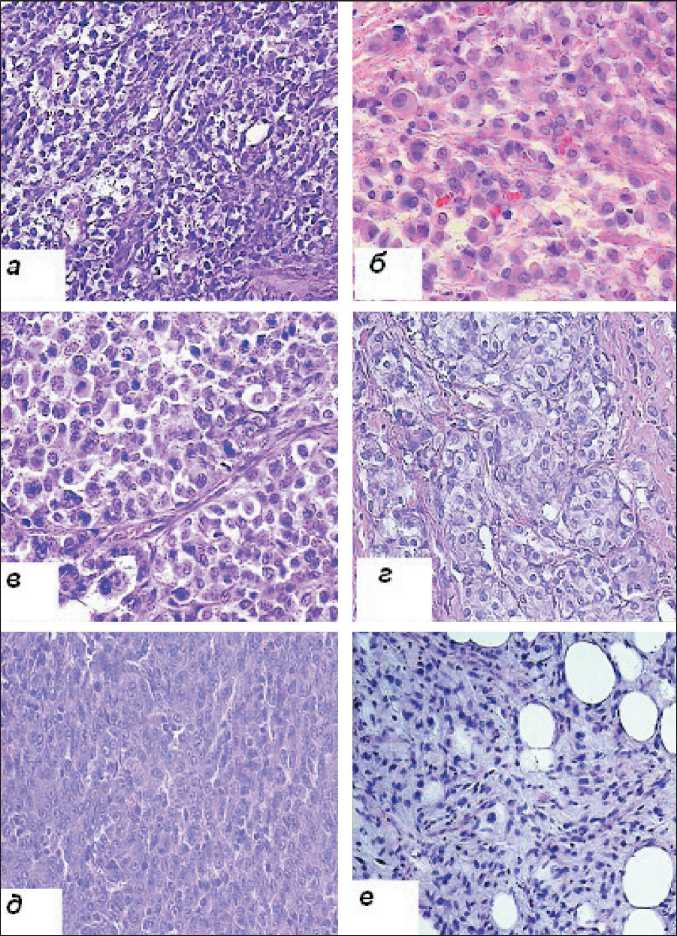
Рис. 2. Микрофото. Гистологические препараты опухолей пациентов № 1 ( а ), № 4 ( б ), № 13 ( в ), № 6 ( г, д ), № 14 ( е ). ×200
Гистологическое исследование показало раз‑ нородность опухолевых клеток, метастатические опухоли чаще имели смешанный фенотип, но встречались также эпителиоидные и веретенокле‑ точные опухоли (табл. 1). В гистологическом пре‑ парате опухоли пациентки № 1 c множественными метастазами в легких, мягких тканях туловища и конечностей без выявленного первичного очага обнаружена атипия 1‑го типа, присутствовали бес‑ пигментные округлые мелкие клетки смешанного гистогенеза (рис. 1 а ). Эпителиоидный тип клеток был выявлен в метастатической полиморфнокле‑ точной меланоме с атипией 3‑го типа у пациентки № 4 (рис. 1 б ) и в метастазе опухоли у пациентки № 13 (рис. 1 в ) с изъязвленной поверхностно распространенной меланомой голени, хотя в ци‑ тологическом препарате у нее обнаруживали и веретенообразные клетки (рис. 1 в–д ). У пациента № 6 в метастазе опухоли с первичным диагнозом меланоцитарная шваннома спины выявлены клет‑ ки смешанного гистотипа (рис. 2 г, д ).
При иммуногистохимическом исследовании метастатических опухолей, диагностированных как саркома или лимфома, выявлены слабополо‑ жительные реакции на S100, HMB 45, Melan A, MITF, тирозиназу, однако отсутствие экспрессии цитокератинов, p63 и гладкомышечного актина подтверждает диагноз меланомы (табл. 2).
С целью дифференциации саркомы от мелано‑ мы был проведен FISH‑анализ 4 опухолей (№ 2, 6, 10, 11) для выявления возможной реаранжировки гена EWSR1, однако транслокация хромосомы 22q не обнаружена, что подтверждает диагноз меланомы.
Генетический анализ в ДНК 4 из 15 (27 %) опухолей выявил мутацию BRAF (p.V600E), мута‑ ции в генах NRAS и KIT не обнаружены (табл. 1) . Любопытно, что все 4 опухоли (№ 7, 8, 12, 15) с мутацией BRAF были беспигментными. Выявление мутации BRAF в метастазах указывает, что первич‑ ной опухолью является меланома.
У 30‑летней пациентки (№ 7) с метастатической опухолью в брюшной полости без выявленного первичного очага наличие мутации BRAF сви‑ детельствует, что первичной опухолью является меланома. Мутация BRAF обнаружена также в первичной беспигментной веретеноклеточной опу‑ холи спины с саркомоподобной дифференцировкой у 72‑летней пациентки (№ 12). Мутация BRAF обнаружена также в метастазе на коже головы у 30‑летнего пациента № 15, возникшем через год после появления опухоли шеи. Это указывает на то, что первичная опухоль представляла собой светлоклеточную меланому, а не плеоморфную не‑ дифференцированную саркому, как предполагали ранее. У пациента № 8 с подозрением на лимфо‑ му мутация BRAF выявлена в лимфоузле через 6 лет после первичной опухоли, что указывает на метастазирование меланомы. Во всех случаях об‑ наружение мутации BRAF подтверждает диагноз меланомы, поскольку мутации BRAF и NRAS, пред‑ ставленные в первичной опухоли, сохраняются и в последующих метастазах [14, 17].
Обсуждение
В данном исследовании охарактеризованы необычные случаи меланомы. Фенотипическая пластичность как первичной меланомы, так и ме‑ тастазов хорошо известна. Некоторые меланомы утрачивают иммуногистохимические маркеры меланоцитарной дифференцировки [3, 4, 7], и это требует дифференциальной диагностики от морфо‑ логически сходных немеланоцитарных опухолей.
С другой стороны, известны случаи непол‑ ной дифференцировки или дедифференцировки злокачественной меланомы, как первичной, так и метастатической. При первичном диагнозе из‑ мененный фенотип такой опухоли принимают за рабдомиосаркому, миофибросаркому, аденокарци‑ ному или лейомиосаркому [3, 7]. А. Agaimy et al. описывают случаи, когда у пациентов с первичным диагнозом меланома через некоторое время (3 мес – 9 лет) возникала метастатическая опухоль с фенотипом саркомы , так как в ней выявили дедифференцированные метастазы, в которых экспрессия маркеров меланомы иммуногистохи‑ мически не определялась [7]. При этом в 10/14 (71 %) случаев в первичной опухоли и метастазе выявлены мутации BRAF (35 %) или NRAS (35 %). Метаанализ 24 недифференцированных меланом выявил мутации BRAF и NRAS в 33 % и 29 % опу‑ холей соответственно [7] .
В нашей работе мутации BRAF выявлены в 27 % случаев атипичной меланомы, мутации NRAS не обнаружены. Однако при исследовании более 200 образцов дифференцированной меланомы кожи мутации BRAF обнаружены в 60 %, а NRAS – в 14 % случаев [15, 16].
Важно отметить, что наличие мутаций BRAF или NRAS является доказательством меланоцитар‑ ной дифференцировки опухолей, фенотипически сходных с саркомами [18]. Известно, что в истин‑ ных саркомах такие мутации не встречаются. Более того, плейоморфизм и потеря дифференцировоч‑ ных маркеров не характерны для светлоклеточных сарком.
В литературе довольно часто встречаются описания сложных случаев, когда необходимо дифференцировать беспигментную меланому от светлоклеточной саркомы мягких тканей. По морфологии злокачественная беспигментная ме‑ ланома кожи может напоминать светлоклеточную саркому, причем эти опухоли существенно не раз‑ личаются по профилю экспрессии молекулярных маркеров. C. Liu et al. [19] описали два случая светлоклеточной саркомы, локализованной на коже большого пальца левой руки и в тощей кишке, при диагностике которых возникли значительные трудности. В обеих опухолях иммуногистохими‑ чески выявлялась диффузная экспрессия S100, виментина, белка NSE, и фокальная экспрессия антигенов CD56, MelanA. Использование чипов MassARRAY и панели OncoCarta 1.0 позволило авторам проанализировать 238 известных мутаций, локализованных в горячих точках 19 онкогенов, однако ни одной мутации выявлено не было. До‑ казательством светлоклеточной саркомы явились результаты ПЦР с обратной транскрипцией, под‑ твердившие транслокацию EWS/ATF1 типа 1 в двух опухолях [19].
B.P. Wagner et al. также описали случай диагно‑ стической дилеммы: светлоклеточной саркомы или беспигментной BRAF ‑негативной меланомы [20]. Положительное окрашивание на меланоцитарные маркеры S‑100, HMB‑45, MART‑1, MITF вместе с результатами кариотипирования и FISH‑анализа – отсутствием реаранжировки гена EWS – подтвер‑ дило диагноз беспигментной меланомы [20].
В настоящем исследовании мы попытались проанализировать нетипичные случаи меланомы со свойствами, характерными для сарком, что при‑ водило к проблемам при первоначальной диффе‑ ренциальной диагностике опухоли. У 6 пациентов описаны метастазы в мягких тканях или первич‑ ных опухолях в виде мягкотканого образования. У 4 пациентов первичный очаг меланомы не выявлен, и среди мягкотканных опухолей (первичных и ме‑ тастазов) встречались беспигментные, что затруд‑ няло дифференциальную диагностику меланомы или саркомы. Лишь у 4/15 пациентов выявлена мутация BRAF V600E, подтверждающая диагноз меланомы. С помощью иммуногистохимического окрашивания обнаружена слабоположительная ре‑ акция на S100 и меланоцитарные маркеры Melan A, тирозиназу и частично HMB 45 и MITF, однако такая реакция возможна и при светлоклеточных саркомах. В четырех случаях (№ 2; № 6; № 10; № 11) с подозрением на саркому методом FISH
Список литературы Фенотипическая пластичность метастатической меланомы
- Мазуренко Н.Н. Молекулярно-генетические факторы и маркеры меланомы. Молекулярно-генетические маркеры опухолей. М., 2016. 85-128. [Mazurenko N.N. Molecular-genetic factors and markers of melanoma. Molecular-Genetic Tumor Markers. Moscow, 2016. 85-128. (in Russian)].
- Leonardi G.C., Falzone L., Salemi R., Zanghì A., Spandidos D.A., Mccubrey J.A., Candido S., Libra M. Cutaneous melanoma: From pathogenesis to therapy (Review). Int J Oncol. 2018 Apr; 52 (4): 1071-80. DOI: 10.3892/ijo.2018.4287
- Magro С.M., Crowson A.N., Mihm M.C.Jr3. Unusual variants of malignant melanoma. Mod Pathol. 2006 Feb; 19 Suppl 2: S41-70. DOI: 10.1038/modpathol.3800516
- Banerjee S.S., Eyden B. Divergent differentiation in malignant melanomas: a review. Histopathology. 2008 Jan; 52 (2): 119-29. DOI: 10.1111/j.1365-2559.2007.02823.x
- Ordóñez N.G. Value of melanocytic-associated immunohistochemical markers in the diagnosis of malignant melanoma: a review and update. Hum Pathol. 2014 Feb; 45 (2): 191-205. DOI: 10.1016/j.humpath.2013.02.007


