Фенотипическая вариабельность реакции нейронов головного мозга. Хроническое действие токсинов при высокой и низкой чувствительности к ним
Автор: Волков Александр Владимирович
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 4 (18), 2016 года.
Бесплатный доступ
В экспериментальном исследовании в двух сериях была оценено влияние хронической интоксикации этанолом и бактериальным липополисахаридом на фенотип нейронов и их окружения у крыс с различной исходной чувствительностью к данным токсинам. Были исследованы области фронтальной коры, стриатума, переднего гипоталамуса, коры мозжечка и продолговатого мозга. Для оценки использовали такие морфометрические показатели, как средняя степень повреждения нейронов, коэффициент глия/нейрон, экспрессия нейрональной и эндотелиальной нитроксидсинтаз, а также проапоптотического лиганда TRAIL. Экспериментальная хроническая интоксикация вызывала в нейронах изученных областей головного мозга во многом однотипные изменения, максимально выраженные во фронтальной коре и ядрах переднего гипоталамуса. Исходно высокая чувствительность к токсинам предопределяла в этих же областях более интенсивные изменения нейронов, реакции глиальных клеток и эндотелия сосудов при сравнении между подгруппами. Для животных с высокой чувствительностью к токсинам был характерен относительно высокий уровень экспрессии эндотелиально нитроксидсинтазы и TRAIL. Полученные данные свидетельствуют о наличии молекулярных предикторов повышенной чувствительности нейронов к хроническому токсическому воздействию, в том числе связанных с механизмами нейроглиальных отношений, балансом нитроксидсинтаз и управлением апоптозом нейронов. Они, безусловно, определяют итоговую чувствительность к нейротропным экзогенным токсическим воздействиям, конкретная величина которой определяется также спецификой действующего токсического агента и видом животного.
Нервная система, головной мозг, нейроны, морфология, хронические интоксикации, этанол, липополисахарид
Короткий адрес: https://sciup.org/149131411
IDR: 149131411 | УДК: 611.811.018: | DOI: 10.15688/jvolsu11.2016.4.1
Текст научной статьи Фенотипическая вариабельность реакции нейронов головного мозга. Хроническое действие токсинов при высокой и низкой чувствительности к ним
DOI:
Прогресс в области нейроморфологии в последние десятилетия привел к тому, что в головном мозге (ГМ) детально изучено свыше 200 структурных образований, для них установлены (как у лабораторных животных, так и у человека) множество структурных, ульт-раструктурных, гистохимических и иммуногистохимических особенностей, имеющих генетическую детерминированность [11; 15; 23].
Это предопределяет фенотипическую гетерогеность популяций в отношении чувствительности к различным нейротропным воздействиям [4; 6]. На морфологическом уровне показан ряд специфических признаков повышенной чувствительности к таким токсинам в виде особенностей строения коры головного мозга, ядер гипоталамуса, продолговатого мозга, вегетативных ганглиев внутренних органов [7; 8; 14].
Молекулярные маркеры различий такой чувствительности кроются в особенностях экспрессии в нервной ткани ферментов, отвечающих за обмен ключевых нейромедиаторов [1; 3; 22], функциональную активность нейроглиальных клеток и сосудистного эндотелия [13; 16; 26], а также связанных с регуляцией и реализацией апоптоза клеток [12; 20; 21].
Мы поставили своей задачей сопоставить степень повреждения нейронов, нейроглиальных соотношений и экспрессии ряда молекулярных маркеров в ключевых структурах головного мозга, чувствительных к интоксикации.
Методика исследования
Эксперименты проводили с использованием 25 белых крыс-самцов линии Wistar массой 240–290 г, руководствуясь этическими нормами, изложенными в «Правилах проведения работ с использованием экспериментальных животных» и Директиве 2010/63/EU Европейского Парламента и Совета Европейского Союза по охране животных, используемых в научных целях. Для выведения животных из эксперимента использовали передозировку «Золетила» (150 мг/кг массы).
Для первой группы были предварительно отобраны по времени этанолового сна по 5 животных с максимально быстрым (Б) и максимально медленным (М) метаболизмом этанола. Животные каждой подгруппы были подвергнуты 30-суточной принудительной пероральной алкоголизации в дозе 1 мл/кг этанола в сутки. Во второй группе на основании результатов измерения 30-минутного градиента температуры при действии 0,1 мг/кг липополисахарида (ЛПС) S. Thyphimurium внутрибрюшинно [5] выделили две подгруппы по 5 животных с высокой (В) и низкой (Н) чувствительностью к этому токсину. Их подвергали хронической интоксикации бактериальным ЛПС в той же дозе каждые 48 ч в течение 30 суток. Пять интактных животных составили группу контроля (рис. 1).
Непосредственно после эвтаназии ГМ животных извлекали щадящим образом из черепа, помещали в 10 %-ный раствор нейтрального забуференного формалина (рН = 7,4)
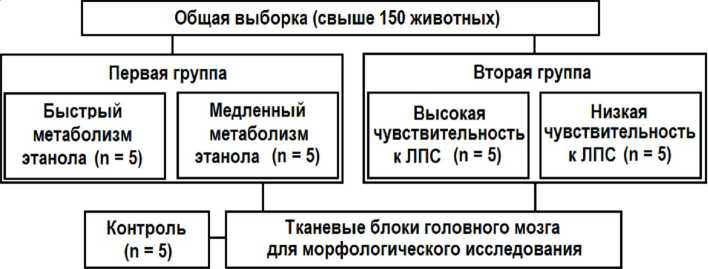
Рис. 1. Общий дизайн эксперимента
на 30 мин. После этого разделяли на 3 блока (А, В и С) фронтальной секцией через точку P0 в координатах Хорслей – Кларка и тангенциальной – от борозды, разделяющей полушария большого мозга и мозжечка до границы между стволом и промежуточным мозгом на вентральной его поверхности. Материал до-фиксировали в том же растворе в течение 24 ч. С фронтальной (А, В) и вентро-фрональ-ной (С) поверхностей каждого блока делали серийные срезы толщиной 5–7 мкм. Использовали окраски гематоксилином и эозином и тионином по Нисслю. Иммуногистохимическое исследование проводили с использованием моноклональных антител производства Dako (Дания) к нейрональной (NOS-1) и эндотелиальной (NOS-3) нитроксидсинтазам, маркеру ФНО-зависимого апоптоза (TRAIL). В результате удавалось идентифицировать на срезах и дать качественную и полуколиче-ственную оценку фенотипа нейронов следующих локализаций: передней фронтальной области коры больших полушарий ГМ, стриатума, переднего гипоталамуса, коры мозжечка, а также продолговатого мозга [25]. Эти локализации были выбраны, поскольку с ними, по данным литературы, связываются наиболее типичные изменения в головном мозге, вызванные хронической интоксикацией [4; 9; 19].
Фотосъемку препаратов проводили на микроскопе БИМАМ Р-13 («Ломо», Россия) с фотокамерой TK-C620E JVC (Japan), после чего осуществляли количественное морфологическое исследование с использованием программы свободного доступа Image Tool (Union B, США). Рассчитывали относительную степень повреждения нейронов (в отн. ед.), нейроглиальное соотношение, а также интенсивность экспрессии молекулярных маркеров («–» – негативная, «+» – слабо выраженная, «++» – умеренно выраженная, «+++» – гиперэкспрессия).
Обработку количественных данных проводили с помощью программы Statistica 10 (StatSoft Inc., США) с учетом отсутствия нормального характера распределения в выборках. Распределение в группах выражали в виде медианы и интервала между первым и третьим квартилем (Ме [Q1; Q3], на графиках – в виде вертикальных отрезков у столбиков). При сравнении результатов проведен дисперсион- ный анализ с использованием непараметрического критерия Фридмана для множественных групп (p < 0,01), для анализа различий внутри каждой подгруппы – непараметрический критерий Манна – Уитни (p < 0,01).
Результаты и их обсуждение
В нейронах всех изученных областей головного мозга на фоне хронической интоксикации выявлялись классические признаки повреждения нейронов в виде пикноза и латерализации ядра, уплотнения и гомогенизации рисунка цитоплазмы перикариона, перицеллюлярного отека и признаков их необратимой гибели вплоть до формирования клеток-теней. Повреждение и гибель нейронов сопровождались сосудистой и глиальной реакцией с увеличением соотношения глия/ нейрон.
В результате сопоставления изменений в различных отделах головного мозга животных опытных групп было выявлено, что максимальные изменения при хронической интоксикации (в виде увеличения нейроглиального соотношения, повышения доли нейронов с признаками обратимого и необратимого повреждения) были характерны для третьего и пятого слоев фронтальной коры, крупноклеточных ядер переднего гипоталамуса и вегетативных ядер продолговатого мозга (см. табл. 1, 2).
Сравнение между подгруппами (М и Б в первой группе; Н и В – во второй группе) выявило, что максимальные различия, связанные с высокой и низкой чувствительностью к токсинам, также характерны для фронтальной коры и переднего гипоталамуса.
Иммуногистохимическое исследование выявило, что повреждение нейронов сопровождалось изменением экспрессии нейрональной и эндотелиальной нитроксидсинтаз, а также лиганда ФНО-зависимого апоптоза TRAIL с общей тенденцией к увеличению экспрессии от умеренно выраженной до ги-перэкспресии.
В большинстве случаев иммунопозитив-ный материал был распределен неравномерно в цитоплазме, образуя скопления по периферии перикарионов, а для NOS-3 – в эндотелии сосудов (см. рис. 2).
Таблица 1
Относительная степень повреждения нейронов в различных отделах головного мозга крыс при хронической интоксикации в течение 30 суток
|
Локализация |
Первая группа (этанол) |
Вторая группа (ЛПС) |
||
|
Подгруппа М |
Подгруппа Б |
Подгруппа Н |
Подгруппа В |
|
|
Кора ГМ |
15,6 [13,3÷18,4] |
42,7 [33,8÷44,9] * |
14,1 [12,5÷16,6] |
35,0 [32,4÷42,7] * |
|
Стриатум |
9,3 [7,7÷10,5] |
12,5 [9,8÷15,0] |
7,5 [6,2÷9,1] |
15,8 [12,6÷18,2] * |
|
Гипоталамус |
17,3 [14,6÷20,1] |
39,6 [33,8÷44,9] * |
14,1 [12,5÷16,6] |
35,0 [32,4÷42,7] * |
|
Мозжечок |
10,1 [8,1÷11,9] |
13,2 [10,1÷15,9] |
8,8 [6,7÷9,8] |
14,6 [12,9÷17,0] * |
|
Продолговатый мозг |
15,5 [13,3÷18,6] |
30,5 [25,6÷34,7] * |
15,2 [13,5÷18,4] |
32,8 [27,9÷37,0] * |
Примечание. * – достоверные различия между подгруппами.
Таблица 2
Изменение нейроглиального соотношения в различных отделах головного мозга крыс при хронической интоксикации в течение 30 суток
|
Локализация |
Первая группа (этанол) |
Вторая группа (ЛПС) |
||
|
Подгруппа М |
Подгруппа Б |
Подгруппа Н |
Подгруппа В |
|
|
Кора ГМ |
14,2 [11,0÷17,2] |
19,9 [15,6÷23,2] * |
13,6 [11,4÷17,5] |
20,8 [16,1÷26,2] * |
|
Стриатум |
6,8 [5,9÷8,1] |
8,0 [6,2÷9,7] |
6,6 [5,7÷7,9] |
7,7 [5,9÷9,5] |
|
Гипоталамус |
7,6 [6,7÷7,5] |
5,2 [4,8÷5,9] * |
7,9 [6,8÷8,7] |
5,4 [4,8÷6,4] * |
|
Мозжечок |
6,0 [5,3÷6,9] |
6,6 [5,6÷7,5] |
6,1 [5,5÷7,2] |
6,9 [6,0÷7,3] |
|
Продолговатый мозг |
12,5 [9,9÷14,7] |
16,2 [12,4÷17,6] |
11,8 [9,6÷13,3] |
15,6 [12,0÷19,2] |
Примечание. * – достоверные различия между подгруппами.
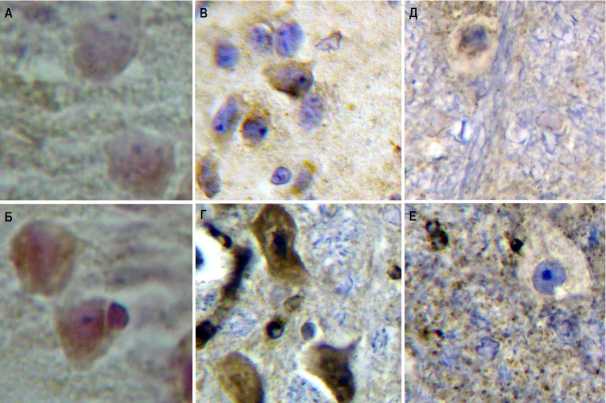
Рис. 2. Варианты экспрессии изученных маркеров в ткани головного мозга крыс при хронической интоксикации:
А – умеренная экспрессия TRAIL; Б – высокая экспрессия TRAIL; В – умеренная экспрессия NOS-1; Г – гиперэкспрессия NOS-1; Д – умеренная экспрессия NOS-3; Е – гиперэкспрессия NOS-3.
Окраска: моноклональные антитела к маркерам, пероксидазный метод. х 300
Наиболее интенсивные изменения экспрессии касались эндотелиальной нитроксид-синтазы и TRAIL, локализация наиболее ярких изменений соответствовала ранее описанным областям с наиболее выраженными изменениями нейронов и глиальной реакции (табл. 3).
Проведенное исследование выявило, как минимум, три момента, требующих обсуждения. Во-первых, фронтальная кора и передний гипоталамус оказались наиболее поражаемыми из изученных областей ГМ при хронической интоксикации. Далее, у животных, более чувствительных к воздействию токсинов, изменения в этих областях ГМ развивались более интенсивно. Наконец, при общем сходстве интоксикации этанолом и ЛПС картина повреждения нейронов, а также реакции нейроглии и сосудов на нее представляется достаточно вариабельной.
При анализе выявленных особенностей необходимо принимать во внимание такие важнейшие моменты, как исходно различная функциональная нагрузка, сложность нейроглиальных отношений и сосудистых реакций в конкретной области ГМ, а также ее вовлеченность в процессы управления детоксикацией организма [7; 8; 10; 18]. Кроме того, важным мо- ментом при анализе динамики хронического процесса в нервной системе является способность нейронов к внутриклеточной регенерации [2; 23].
Несмотря на достаточно ограниченное количество общепатологических механизмов повреждения нейронов при интоксикациях (прежде всего – активация свободно-радикальных процессов, дефицит энергетических субстратов и дисбаланс регуляторных молекул) [5; 10; 17; 24], специфические механизмы, присущие конкретному токсину, могут существенно моделировать интенсивность неспецифических и влиять на фенотип нейронного повреждения. При прочих равных, относительно более сложная организация нейронного окружения, высокое глиальное представительство, исходно высокая активность эндотелиальной нитроксидсинтазы и низкая экспрессия TRAIL могут считаться фенотипом, соответствующим более высокой резистентности данной области ГМ к хроническому токсическому повреждению.
Заключение
Экспериментальная хроническая интоксикация этанолом или бактериальным ЛПС
Таблица 3
Экспрессия иммуногистохимических маркеров в различных отделах головного мозга крыс при хронической интоксикации в течение 30 суток
Список литературы Фенотипическая вариабельность реакции нейронов головного мозга. Хроническое действие токсинов при высокой и низкой чувствительности к ним
- Зиматкин, С. М. Ультраструктурные изменения в гистаминергических нейронах мозга при воздействиях алкоголя / С. М. Зиматкин, Е. М. Федина // Морфология. - 2014. - Т. 146, № 5. - С. 19-23.
- Комиссарова, С. В. Регенерация нейронов / С. В. Комиссарова, И. П. Дубровин, А. А. Пальцын // Патологическая физиология и эксперементальная терапия. - 2014. - № 3. - С. 76-87.
- Недостающее доказательство кооперативного синтеза дофамина недофаминергическими нейронами / А. Ю. Курина, Т. С. Пронина, В. С. Кудрин, М. В. Угрюмов // Доклады Академии наук. - 2016. - Т. 468, № 3. - С. 336-338. - DOI: 10.7868/S086956521615024X
- Писарев, В. Б. Современные подходы к оценке конституциональной морфологии продолговатого мозга в норме и при хронической патологии / В. Б. Писарев, В. И. Фролов, В. В. Новочадов // Волгоградский научно-медицинский журнал. - 2004. - № 1. - С. 12-14.
- Пономарев, Э. А. Морфологические параметры нейропротекции при ишемии-реперфузии головного мозга у крыс / Э. А. Пономарев, В. В. Новочадов, Н. Н. Стрепетов // Вестник Волгоградского государственного медицинского университета. - 2010. - № 1. - С. 103-106.


