Фенотипические особенности гранулоцитов низкой плотности при физиологической беременности
Автор: Орлова Е.Г., Логинова О.А., Горбунова О.Л., Ширшев С.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
При физиологической беременности в периферической крови увеличивается количество нейтрофилов низкой плотности, однако их фенотипические и функциональные особенности практически не изучены. Поэтому цель данной работы - изучение экспрессии молекул, характеризующих цитотоксичность (CD16, CD107a), транспорт глюкозы (GLUT-1) и состояние митохондрий (по включению красителя MitoSpy™ Green FM) гранулоцитами низкой плотности и в общем пуле гранулоцитов при физиологически протекающей беременности. Объектом исследования была периферическая кровь условно здоровых женщин в I и III триместрах физиологически протекающей беременности. Группу сравнения составили условно здоровые небеременные женщины в фолликулярной фазе менструального цикла. Гра-нулоциты низкой плотности анализировали как процент CD3-CD16+ клеток в мононуклеарных лейкоцитах, выделенных на градиенте плотности фиколла-урографина (1.077 г/мл). Общий пул гранулоцитов исследовали как процент CD3-CD16+ клеток в гейте гранулоцитов периферической крови после удаления эритроцитов. Среди гранулоцитов выделяли субпопуляции с высокой экспрессией CD16 (CD16hi) и сниженной (CD16mt). Установлено, что у небеременных CD16hl гранулоциты доминируют как в общем пуле, так и среди гранулоцитов низкой плотности. В динамике беременности количество гранулоцитов низкой плотности увеличивается, а CD16mt гранулоциты становятся доминирующей субпопуляцией как в общем пуле гранулоцитов, так и среди гранулоцитов низкой плотности. У небеременных и беременных в I триместре CD16hi- и CD16mt-гранулоциты низкой плотности и общего пула сравнимы по экспрессии GLUT-1, CD107a, массе и объему митохондрий. В III триместре экспрессия CD107a на CD16lnt-гранулоцитах низкой плотности и в общем пуле снижается по сравнению с небеременными, а масса и объем митохондрий увеличиваются и в CD16hi, и CD16mt-гранулоцитах только общего пула по сравнению с I триместром. Полученные результаты расширяют наше понимание механизмов регуляции функций гранулоцитов при физиологической беременности.
Гранулоциты низкой плотности, cd107a, glut-1, митохондрии, беременность
Короткий адрес: https://sciup.org/147247250
IDR: 147247250 | УДК: 571.27:618.2:612.112.91 | DOI: 10.17072/1994-9952-2024-4-451-460
Текст научной статьи Фенотипические особенности гранулоцитов низкой плотности при физиологической беременности
Физиологическая беременность характеризуется глубокими изменениями функций клеток как адаптивного, так и врожденного иммунитета, что необходимо для выживания полуаллогенного плода и сохранения защитных свойств организма матери [Ширшев, 2009]. Нейтрофилы преобладают среди гранулоцитов периферической крови и являются ведущими эффекторами врожденного иммунитета. Их функции не ограничиваются обеспечением противомикробной защиты. Нейтрофилы активно инфильтруют ткани матки, стимулируют ангиогенез, выполняют регуляторные функции, участвуют в репарации, а стимуляция их фагоцитарной и цитотоксической активности ассоциирована со спонтанными абортами [Циркин и др., 2015; Потапнев, Гущина, Мороз, 2019]. При физиологической беременности происходит увеличение относительного и абсолютного содержания нейтрофилов в периферической крови, их фагоцитарная и цитотоксическая активность снижается, что является частью системного гормон-зависимого угнетения цитотоксических реакций при беременности и необходимо для сохранения плода [Ширшев, Куклина, Баженова, 2008; Патурова и др., 2018].
Физиологическая беременность характеризуется увеличением количества нейтрофилов низкой плотности [Denny et al., 2010; Ssemaganda et al., 2014; Ye et al., 2023]. Нейтрофилы низкой плотности выделяются вместе с фракцией мононуклеарных клеток периферической крови при разделении методом седиментации на градиенте плотности фиколл-урографина (1.077 г/см3) [Denny et al., 2010; Ye et al., 2023]. Подобные клетки присутствуют и у здоровых доноров вне беременности, но не превышают 1–2% [Denny et al., 2010; Ye et al., 2023]. Количество нейтрофилов низкой плотности значительно повышается при воспалении, аутоиммунных процессах, онкологических заболеваниях [Denny et al., 2010; Carmona-Rivera, Kaplan, 2013; Yang et al., 2019; Ning, Wang, Jin, 2022]. При подобных патологических состояниях нейтрофилы низкой плотности характеризуются как преимущественно незрелые, избыточно экспрессирующие маркеры активации, способные к спонтанному формированию нейтрофильных ловушек, активной продукции провоспалительных цитокинов и цитотоксичности в отношении эндотелиальных клеток [Denny et al., 2010; Carmona-Rivera, Kaplan, 2013; Yang et al., 2019; Ning, Wang, Jin, 2022]. При физиологической беременности нейтрофилы низкой плотности не отличаются по маркерам зрело- сти/дифференцировки, активационного статуса, бактерицидности от нейтрофилов нормальной плотности [Ssemaganda et al., 2014; Deniset, Kubes, 2018], но имеют сниженную фагоцитарную активность [Denny et al., 2010; Ye et al., 2023]. Предполагается, что эти клетки способны к индукции формирования Т-регуляторных лимфоцитов в зоне фето-плацентарного контакта [Ssemaganda et al., 2014; Deniset, Kubes, 2018]. Однако их функциональные особенности, как и динамика их численности при физиологической беременности, остаются малоизученными.
Нейтрофилы периферической крови отличаются по экспрессии молекулы CD16 – рецептора к Fc-фрагментам IgG, необходимого для фагоцитоза IgG-опсонизированных патогенов [Asakura et al., 2002]. Гранулоциты с высокой экспрессией CD16 (CD16hi) и средней экспрессией CD16 (CD16int) дифференцированы по степени зрелости и характеризуются разной адгезионной способностью к активированному эндотелию и экстравазации, что определяет их разную активность при воспалении, дополнительно предполагая участие в изменении иммунореактивности при беременности [Boron et al., 2022]. В немногочисленных исследованиях показано, что нарушение субпопуляционного состава CD16hi- и CD16int-нейтрофилов и их функций ассоциировано со спонтанными абортами в ранние сроки беременности [Рапопорт, Курмышкина, Бовин, 2008]. В наших предыдущих исследованиях показано, что при физиологической беременности нарастает доля (CD16int) нейтрофилов в общем пуле гранулоцитов периферической крови, а количество CD16hi гранулоцитов снижается, метаболическая активность CD16hi- и CD16int-нейтрофилов увеличивается к концу беременности [Орлова и др., 2024]. Однако особенности экспрессии CD16 на гранулоцитах низкой плотности и их метаболический статус при физиологической беременности не изучены.
В большинстве работ гранулоциты низкой плотности описываются как избыточно активированные клетки, что предполагает их высокую метаболическую активность [Denny et al., 2010; Carmona-Rivera, Kaplan, 2013; Yang et al., 2019; Ning, Wang, Jin, 2022]. Для большинства клеток иммунной системы глюкоза является основным энергетическим субстратом и поступает в клетку при помощи белков-транспортеров (GLUT-1), а количество и состояние митохондрий отражают активность основных метаболических путей [Stojkov et al., 2022]. Поэтому целью данной работы является изучение экспрессии молекул, характеризующих цитотоксичность (CD16, CD107a), транспорт глюкозы (GLUT-1) и состояние митохондрий (MitoSpyT M Green FM) нейтрофилов низкой плотности и общей фракции гранулоцитов в разные триместры физиологической беременности.
Материалы и методы исследования
Объектом исследования являлась венозная кровь женщин в I и в III триместрах физиологической беременности (табл. 1). Группу сравнения составили условно-здоровые небеременные женщины в фолликулярной фазе менструального цикла, сравнимые по возрасту с исследуемыми группами. Использовались следующие критерии включения: добровольное информированное согласие на использование биологического материала, наличие одной и более успешных беременностей; отсутствие патологий беременности в прошлом и настоящем; отсутствие острых и хронических заболеваний; отрицание диет, приема контрацептивных, гормональных, противовоспалительных или антибактериальных препаратов. Исследование выполнено в соответствии с этическими стандартами национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. с ее последующими изменениями или сопоставимым нормам этики и одобрено локальным этическим комитетом ИЭГМ УрО РАН (протокол № 16 от 05.06.2022).
Таблица 1
Характеристика участников исследования [Characteristics of study participants]
|
Исследуемые группы |
Количество |
Возраст |
Срок беременности, недель |
|
Небеременные женщины |
6 |
20.5 (20–27) |
- |
|
Беременные, I триместр |
7 |
31 (25–32) |
12 (10–12) |
|
Беременные, III триместр |
6 |
29 (25–32) |
31 (30–32) |
Примечание. Возраст и срок беременности представлены в виде медианы, верхнего и нижнего квартилей Me(Q1-Q3).
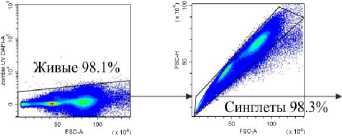
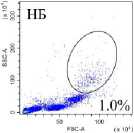
Венозную кровь получали из локтевой вены утром натощак в вакуумные пробирки с этилендиамин-тетрауксусной кислотой в качестве антикоагулянта после 8 ч. голодания. Собранную кровь делили на две равные части. Для анализа нейтрофилов низкой плотности выделяли фракцию мононуклеарных лейкоцитов периферической крови (МНПК). Для этого одну часть крови разводили средой RPMI 1640 в соотношении 1:1, наслаивали на фиколл (1.077 г/см3) и центрифугировали 40 мин про 400 g. МНПК собирали пипетированием с границы раздела фаз, затем ресуспендировали в фосфатно-солевом буфере (ФСБ), содержащим 2мМ ЭДТА и 0.1% бычьего сывороточного альбумина (БСА), дважды отмывали центрифугированием по 5 мин. при 300 g. Для исследования общего пула гранулоцитов из второй части крови уда- ляли эритроциты с помощью лизирующего буфера (BioLegend, USA). Окрашивание моноклональными антителами проводили согласно инструкции производителя. Характеристика использованных антител представлена в табл. 2. Фенотип клеток анализировали на проточном цитометре «CytoFlex S» (BeckmanCoulter, США) с использованием программы «CytExpert 2.0» (Beckman Coulter, США). Анализировали не менее 100 000 событий в каждой пробе. Для уменьшения неспецифического связывания и адгезии клеток окрашивание проводили в ФСБ, содержащем 2мМ ЭДТА и 0.1% БСА, без использования консервантов. Для контроля неспецифического связывания и выделения негативного по флюоресценции окна использовали соответствующие изотипические и негативные контроли. Стратегия гейтирования представлена на рис. 1.
Таблица 2
Характеристика антител [Antibodies characteristic]
общая фракция гранулоцитов после лигирования эритроцтов цельной крови
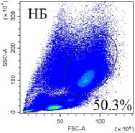
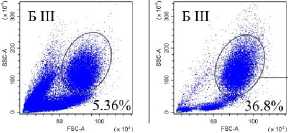
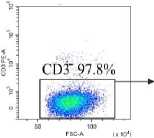
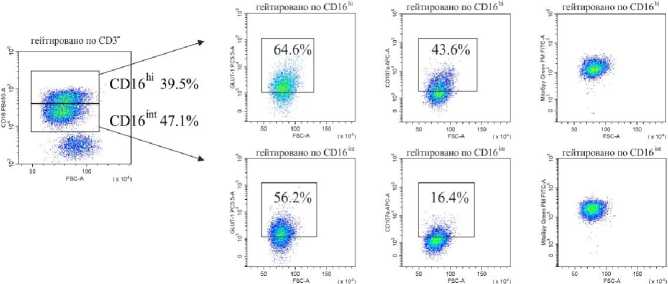
Рис. 1. Стратегия гейтирования гранулоцитов
[Granulocyte gating strategy]
Последовательно: определение региона живых клеток с использованием красителя Zombie UV ™ ; определение одиночных неслипшихся клеток (синглетов) по параметрам площади и высоты прямого светорассеивания (FSC-A/ FSC-H); выделение гранулоцитарного гейта по параметрам площади прямого (FSC-A) и высоты бокового (SSC-H) светорассеивания в периферической крови во фракции мононуклеарных клеток после выделения на градиенты фиколла (нейтрофилы низкой плотности у НБ и в III триместре (Б III) или в общей фракции гранулоцитов периферической крови после лизирования эритроцитов (общая фракция гранулоцитов у НБ и в III триместре (Б III)); определение CD3- клеток в гейте гранулоцитов; выделение CD16hi и CD16int субпопуляций среди CD3-CD16+ гранулоцитов; оценка экспрессии GLUT-1, CD107a среди CD16hi- и CD16int-клеток; определение включения флюоресцентного красителя MitoSpy ™ Green FM в CD16 hi - и CD16int-клетки.
Представлены гистограммы одного репрезентативного эксперимента
Статистический анализ проводили с помощью программы Prism v.8.0.1 (Graphpad, США). Для проверки нормальности распределения использовали критерий Колмогорова-Смирнова. Данные представлены в виде медианы (Me), нижних (LQ) и верхних квартилей (UQ). Достоверность различий между группами: небеременные – НБ (группа сравнения); беременные в I триместре (Б I); беременные в III триместре (Б III) определяли с использованием критерия Крускала-Уоллиса для множественных сравнений независимых переменных. Различия считали достоверными при p<0,05 .
Результаты и обсуждение
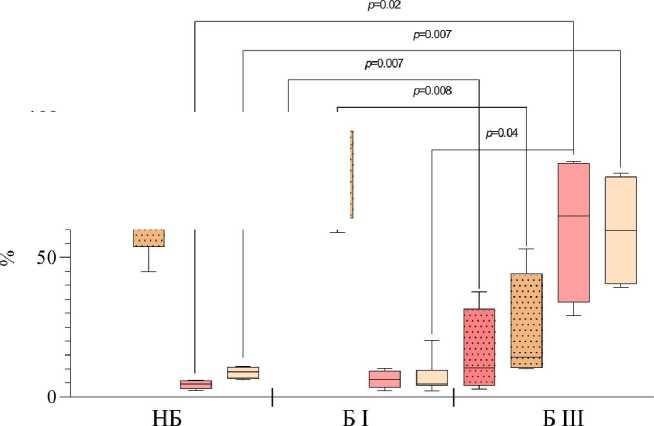
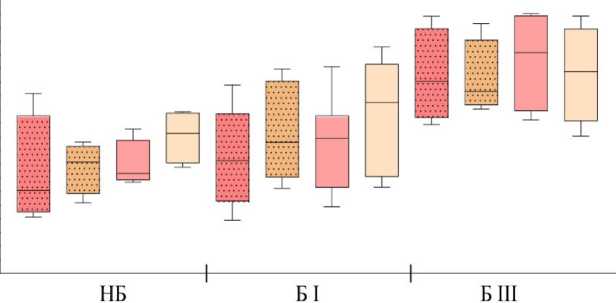
Среди гранулоцитов периферической крови доминирующей популяцией являются нейтрофилы (более 93%) [Кишкун, 2013]. При изучении гранулоцитов низкой плотности во фракции МНПК также показано, что эти клетки относятся к нейтрофильным гранулоцитам [Torell et al., 2023]. В проведенном исследовании показано, что у здоровых небеременных женщин репродуктивного возраста процент гранулоцитов низкой плотности от фракции МНПК составляет 1.37% (0.96–3.72), а при беременности увеличивается: в I триместре – 5.83% (3.77–21.54; p<0,05 к НБ ), в III триместре – 3.21% (0.64–6.99) (рис. 1), что согласуется с работами других авторов [Torell et al., 2023]. У небеременных CD16hi-нейтрофилы являются преобладающей субпопуляцией как в общем пуле гранулоцитов, так и среди клеток низкой плотности (рис. 2). Ранее подобные результаты для общей фракции нейтрофилов описаны и другими авторами для доноров обоих полов [Kamp et al., 2012; Medara et al., 2021; Martin et al., 2022]. Считается, что CD16hi-нейтрофилы являются более зрелыми и проявляют бо́льшую цитотоксичность по сравнению с CD16int-нейтрофилами [Kamp et al., 2012]. В динамике беременности соотношение CD16hi/CD16int-клеток меняется аналогичным образом как среди общей фракции нейтрофилов, так и среди нейтрофилов низкой плотности: количество CD16hi – снижается, а CD16int-клеток увеличивается пропорционально сроку беременности (рис. 2). Нарастание пропорции CD16int-клеток в периферической крови на фоне развития нейтрофильного лейкоцитоза, по-видимому, объясняется стимулирующим влиянием гормонов плаценты на миелопоэз и выходом менее зрелых форм нейтрофилов в периферическую кровь. Можно полагать, что системное угнетение цитотоксических реакций клеток адаптивного иммунитета, участвующих в антимикробной защите, при беременности компенсируется увеличением количества нейтрофилов, тогда как вопрос о причинах увеличения количества нейтрофилов низкой плотности при физиологической беременности остается открытым [Hassani et al., 2020]. Согласно данным литературы, нейтрофилы низкой плотности включают как незрелые формы, так и зрелые, которые приобретают характеристики данной популяции под влиянием активационных факторов [Hassani et al., 2020]. По-видимому, при беременности увеличение количества нейтрофилов низкой плотности в периферической крови обусловлено стимуляцией миелопоэза гормонами плаценты.
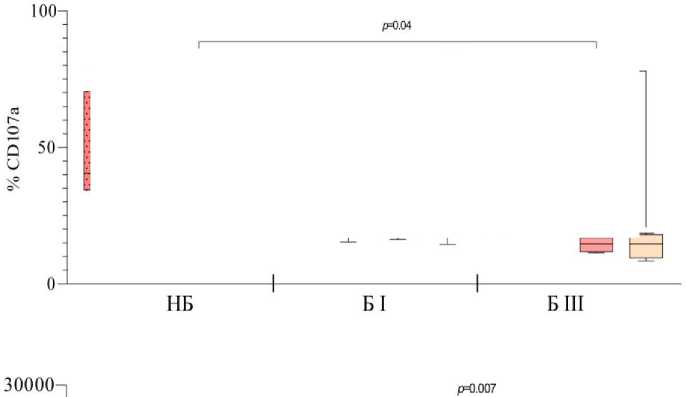
Цитотоксическую активность нейтрофилов оценивали по экспрессии молекулы CD107a (белок мембраны гранул), появление которой на поверхности клетки свидетельствует о ее дегрануляции и выбросе содержимого гранул во внеклеточное пространство. Анализ присутствия CD107a показал, что у небеременных женщин и в I триместре беременности количество CD107a-позитивных клеток не отличалось в субпопуляциях CD16hi- и CD16int-нейтрофилов как в общей фракции, так и среди нейтрофилов низкой плотности (рис. 3). В III триместре беременности процент CD16int-нейтрофилов, экспрессирующих CD107a, достоверно снижался по сравнению с небеременными как в общей фракции, так и среди нейтрофилов низкой плотности. Учитывая преобладание CD16int-нейтрофилов к концу беременности, можно сделать вывод о снижении цитотоксичности как общего пула нейтрофилов периферической крови, так и нейтрофилов низкой плотности в III триместре физиологической беременности. Таким образом, полученные результаты дополняют наше понимание механизмов снижения антимикробной резистентности организма матери, характерное для физиологической беременности.
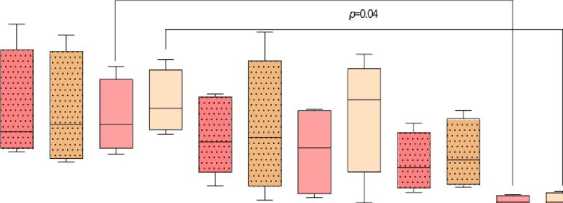
Известно, что увеличение экспрессии GLUT-1 отражает усиление потребления глюкозы и активации метаболических процессов в клетке [Martin et al., 2022]. Краситель MitoSpy Green может избирательно накапливаться в матриксе митохондрий, где связывается белками [Cottet-Rousselle et al., 2011]. Накопление MitoSpy Green в клетке прямо пропорционально массе и объему митохондриального компартмента, что свидетельствует об усилении биогенеза энергетических органелл [Cottet-Rousselle et al., 2011]. Установлено, что у небеременных CD16hi- и CD16int-нейтрофилы как в общем пуле, так и среди клеток низкой плотности, не отличались по экспрессии GLUT-1 и способности накапливать MitoSpy Green, что свидетельствует об их сходной метаболической активности. В I триместре беременности экспрессия GLUT-1, масса и объем митохондрий достоверно не менялись в сравнении с небеременными женщинами. В III триместре масса и объем митохондрий достоверно увеличивались в CD16hi- и CD16int-нейтрофилах общего пула, тогда как среди гранулоцитов низкой плотности присутствовала подобная тенденция, но она не являлась достоверной (рис. 3В). Таким образом, можно заключить, что метаболическая активность нейтрофилов увеличивается к концу беременности, что, по-видимому, сопряжено с активацией в них синтетических процессов.
A
I 哀一济 а^т
ВИР
ОО
E CD16hi
О CD16mt общей фракции гранулоцитов
司 CD 16 hi
I I CD 16 mt гранулоциты низкой плотности
Б
соотношение
員 CD16hi □ CD16int общей фракции гранулоцитов
員 CD16hi □ CD16int гранулоциты низкой плотности

Рис. 2. Процентное содержание (А) и соотношение (Б) CD16hi- и CD16int-нейтрофилов в общей фракции гранулоцитов и среди гранулоцитов низкой плотности у небеременных (НБ), беременных в I (Б I) и III триместрах (Б III).
Данные (А) представлены в виде медианы и межквартильного размаха, Me (Q1-Q3); процентное соотношение CD16hi/CD16int-клеток; значения «p» представлены по критерию Крускала-Уоллиса с апостериорным тестом Данна
[Percentage (A) and ratio (Б) of CD16hi- and CD16int-neutrophils in the total fraction of granulocytes and among low-density granulocytes in non-pregnant (НБ), pregnant women in I (Б I) and III trimesters (Б III).
Data (A) are presented in the form of median and interquartile range, Me (Q1-Q3); percentage ratio of CD16hi/CD16int cells; values of "p" are presented according to the Kruskal-Wallis criterion with the posteriori Dunn test]
Согласно данным литературы и нашим ранее проведенным исследованиям, гормоны, продуцируемые плацентой при беременности, оказывают мощные модулирующие эффекты на функциональную активность нейтрофилов периферической крови [Некрасова, Ширшев, 2013; Патурова и др., 2018]. Можно полагать, что выявленные нами функциональные особенности нейтрофилов при беременности также объясняются влиянием гормонов плаценты, поскольку нейтрофилы экспрессируют специфические рецепторы к гормонам беременности [Revelli, Mascobrio, Tesarik, 1998]. Учитывая способность нейтрофилов к инфильтрации тканей матки и участию в иммунном отторжении, модуляция их цитотоксической активности важна не только для обеспечения антимикробной резистентности, но и благополучного течения беременности. Полученные результаты раскрывают новые механизмы регуляции функциональной активности нейтрофилов при беременности.
А
ОО
Б
В
Es с=н UU 巴9Щ£
тьво^
20000-
10000-
一 ^и
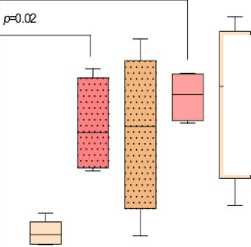
EB CD1611'
О CD16int общей фракции ц>анулоцитов
ЕЗ CDi6hi
I I CDi6 mt гранулоциты низкой плотности

Рис. 3. Процент CD16hi- и CD16int-гранулоцитов, позитивных по экспрессии GLUT-1 (А), CD107a (Б), включению митохондриального зонда MitoSpy Green (В) в общей фракции гранулоцитов и среди гранулоцитов низкой плотности у небеременных (НБ), беременных в I (Б I) и III триместрах (Б III).
Данные представлены в виде медианы и межквартильного размаха, Me (Q1-Q3); (В) по оси ординат представлена медиана интенсивности флуоресценции (MFI, Median Fluorescence Intensity) в клетках, содержащих MitoSpy Green FM; значения «p» представлены по критерию Крускала-Уоллиса
[The percentage of CD16hi- and CD16int-granulocytes positive for the expression of GLUT-1 (A), CD107a (Б), the inclusion of MitoSpy Green mitochondrial probe (В) in the total fraction of granulocytes and among low-density granulocytes in non-pregnant (НБ), pregnant women in the I (Б I) and III trimesters (Б III)
Заключение
Таким образом, при физиологически протекающей беременности в периферической крови увеличивается количество гранулоцитов низкой плотности. В динамике беременности количество CD16int-нейтрофилов нарастает, а CD16hi-нейтрофилов снижается как в общей фракции гранулоцитов, так и среди клеток низкой плотности. Различия между нейтрофилами низкой плотности и общей фракции гранулоцитов выявлены по показателям метаболической активности в III триместре беременности. Также в III триместре беременности CD16int-нейтрофилы характеризуются меньшей цитотоксичностью как в общей фракции гранулоцитов, так и среди клеток низкой плотности по сравнению с CD16hi -нейтрофилами. Полученные результаты важны для понимания механизмов регуляции функций нейтрофилов при беременности и перспективны для направленной модуляции функций нейтрофилов периферической крови.
Список литературы Фенотипические особенности гранулоцитов низкой плотности при физиологической беременности
- Кишкун А.А. Клиническая лабораторная диагностика: учеб. пособие. М.: ГЭОТАР-Медиа, 2013. 976 с.
- Некрасова И.В., Ширшев С.В. Женские половые стероидные гормоны в регуляции ферментативной активности нейтрофилов // Доклады Академии наук. 2013. Т. 453, № 6. С. 690.
- Орлова Е.Г. и др. Метаболические особенности гранулоцитов периферической крови при физиологической беременности // Вестник уральской медицинской академической науки. 2024. Т. 21, № 3. С. 233-241.
- Патурова И.Г. и др. Негеномное влияние прогестерона на радикальную активность нейтрофилов женщин при беременности, в родах и с угрозой преждевременных родов // Российский физиологический журнал им. И.М. Сеченова. 2018. № 4. С. 506-514.
- Потапнев М.П., Гущина Л.М., Мороз Л.А. Фенотипическая и функциональная гетерогенность субпопуляций нейтрофилов в норме и при патологии // Иммунология. 2019. № 5. С. 84-96. DOI: 10.24411/0206-4952-2019-15009.
- Рапопорт Е.М., Курмышкина О.В., Бовин Н.В. Галектины млекопитающих: структура, углеводная специфичность и функции // Биохимия. 2008. Т. 73, № 4. с. 483-497.
- Циркин В.И. и др. Роль нейтрофилов в физиологическом течении беременности и родов и некоторых акушерских осложнениях // Вестник Уральской академической науки. 2015. № 4. С. 75-86.
- Ширшев С.В. Иммунология материнско-фетальных взаимодействий. Екатеринбург, 2009. 582 с.
- Ширшев С.В., Куклина Е.М., Баженова А.В. Влияние прогестерона на фагоцитарную и окислительную активность моноцитов и нейтрофилов // Вестник Пермского университета. 2008. Вып. 9(25) Биология. С. 87-90.
- Asakura H. et al. Selective eosinophil adhesion to fibroblast via IFN-gamma-induced galectin-9 // J. Immunol. 2002. Vol. 169. P. 5912-5918.
- Boron D.G. et al. Galectin-1 and galectin-9 concentration in maternal serum: implications in pregnancies complicated with preterm prelabor rupture of membranes // J. of clin. Med. 2022. Vol. 11, № 21. Art. 6330.
- Carmona-Rivera C., Kaplan M.J. Low density granulocytes: a distinct class of neutrophils in systemic autoimmunity // Semin. Immunopathol. 2013. Vol. 35, № 4. P. 455-463. DOI: 10.1007/s00281-013-0375-7.
- Cottet-Rousselle C. et al. Cytometric assessment of mitochondria using fluorescent probes // Cytometry Part A. 2011. Vol. 79, № 6. Р. 405-425. DOI: 10.1002/cyto.a.21061.
- Deniset J.F., Kubes P. Neutrophil heterogeneity: bona fi de subsets or polarization states? // J. Leuk. Biol. 2018. Vol. 103, № 5. P. 829-838. DOI: 10.1002/JLB.3R10917-361R.
- Denny M.F. et al. A distinct subset of proinflammatory neutrophils isolated from patients with systemic lupus erythematosus induces vascular damage and synthesizes type I IFNs // J. Immunol. 2010. Vol. 184, № 6. P. 3284-3297. DOI: 10.4049/jimmunol. 0902199.
- Hassani M. et al. On the origin of low-density neutrophils // J. Leukoc. Biol. 2020. Vol. 107, № 5. Р. 809-818.
- Kamp V.M. et al. Human suppressive neutrophils CD16bright/CD62Ldim exhibit decreased adhesion // J. Leukoc. Biol. 2012. Vol. 92, № 5. Р. 1011-1020. DOI: 10.1189/jlb.0612273.
- Martin C. et al. Specific circulating neutrophils subsets are present in clinically stable adults with cystic fibrosis and are further modulated by pulmonary exacerbations // Front. Immunol. 2022. № 13. Art. 1012310. DOI: 10.3389/fimmu.2022.1012310.
- Medara N. et al. Peripheral neutrophil phenotypes during management of periodontitis // J. Periodontal Res. 2021. Vol. 56, № 1. P. 58-68. DOI: 10.1111/jre.12793.
- Ning X., Wang W.M., Jin H.Z. Low-density granulocytes in immune-mediated inflammatory diseases // J. Immunol. Res. 2022. Art. e1622160. DOI: 10.1155/2022/1622160.
- Revelli A., Mascobrio M., Tesarik J. Monogenetic actions of steroid hormones in reproductive tissues // Endocr. Rev. 1998. Vol. 19, № 3. P. 3-17.
- Ssemaganda A. et al. Characterization of neutrophil subsets in healthy human pregnancies // PLoS One. 2014. Vol. 9, № 2. Art. e85696. DOI: 10.1371/journal.pone.0085696.
- Stojkov D. et al. Physiological and pathophysiological roles of metabolic pathways for NET formation and other neutrophil functions // Front. Immunol. 2022. № 13. Art. e826515. DOI: 10.3389/fimmu.2022.826515.
- Torell A. et al. Low-density granulocytes are related to shorter pregnancy duration but not to interferon alpha protein blood levels in systemic lupus erythematosus // Arthritis Res. Ther. 2023. Vol. 25, № 1. Art. 107. DOI: 10.1186/s13075-023-03092-w.
- Yang P. et al. Different faces for different places: heterogeneity of neutrophil phenotype and function // J. Immunol. Res. 2019. Art. e8016254. DOI: 10.1155/2019/8016254.
- Ye H. et al. Dysregulated low-density granulocyte contributes to early spontaneous abortion // Front. Immunol. 2023. № 14. Art. e1119756. DOI: 10.3389/fimmu.2023.1119756.


