Фенотипические признаки растений арабидопсиса, дефицитные в РНК-полимеразе rpotmp
Автор: Тарасенко В.И., Гарник Е.Ю., Кулинченко М.В., Константинов Ю.М.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
В Arabidopsis три транскрипции органелларных генов участвуют в трех ядерно-кодированных РНК-полимеразах. RpoTmp представляет собой РНК-полимеразу, которая локализуется как в митохондриях, так и в хлоропластах, но участвует преимущественно в контроле экспрессии генов в митохондриях. Вставной мутант rpotmp характеризуется рядом фенотипических и молекулярно-биологических особенностей, включая снижение активности митохондриальных дыхательных комплексов I и IV. В настоящем исследовании мы сравнили ростовые характеристики мутанта rpotmp и мурата fro1, который характеризуется отсутствием функционального комплекса I. Мы показали, что, несмотря на сходные молекулярные дефекты и фенотипический внешний вид, исследованные мутанты можно отличить по скорости роста при разных фотопериодах, а также в возрасте начала старения листьев. Более того, скорость роста культуры суспензионных клеток линии rpotmp чрезвычайно замедлена, что четко отличает ее от культуры клеток суспензии fro1. Мы предлагаем, чтобы уникальные свойства мутанта rpotmp были связаны с уменьшением уровня активности IV дыхательного комплекса.
Короткий адрес: https://sciup.org/14323976
IDR: 14323976
Текст научной статьи Фенотипические признаки растений арабидопсиса, дефицитные в РНК-полимеразе rpotmp
Митохондрии и пластиды обладают собственными геномами, очень малыми по сравнению с геномами их бактериальных предков. Экспрессия ограниченного количества генов, кодируемого ими (до 60 (Gualberto et al ., 2014) и 100 (Wicke et al ., 2011) в митохондриях и хлоропластах высших растений, соответственно), осуществляется транскрипционными механизмами, которые отличаются, тем не менее, большой сложностью (см. обзор Liere et al ., 2011). В хлоропластных геномах водорослей и высших растений присутствуют гены rpoA , rроВ , rpoC1 и rpoC2 , кодирующие основные субъединицы РНК-полимеразы цианобактериального типа, называемой сокращенно PEP (от plastid encoded polymerase; Lysenko and Kuznetsov, 2005). В митохондриях почти всех эукариот РНК-полимераза бактериального типа в ходе эволюции была заменена на фермент, гомологичный РНК-полимеразам бактериофагов типа T3/T7. РНК-полимеразы фагового типа состоят из одной субъединицы и кодируются ядерными генами (их называют NEP-полимеразами, от nuclear encoded polymerase, и обычно обозначают RpoT).
Зеленые водоросли, такие как Chlamydomonas reinhardtii, Ostreococcus tauri, Thalassiosira pseudonana, обладают только одним ядерным геном RpoT, кодирующим митохондриальную РНК-полимеразу (RpoTm) (Liere et al., 2011). Ядерные геномы злаковых содержат два гена RpoT (Chang et al., 2009), один из которых кодирует митохондриальную РНК-полимеразу (RpoTm), другой РНК-полимеразу, функционирующую в пластидах (RpoTp). До настоящего времени РНК-полимеразы двойной адресации, RpoTmp, были идентифицированы помимо мха Physcomitrella patens в настоящих двудольных растениях, например, в Arabidopsis thaliana (Hedtke et al., 2000) и Nicotiana tabacum (Hedtke et al., 2002). РНК-полимеразы RpoTm и RpoTp осуществляют транскрипцию исключительно митохондриальных и хлоропластных генов, тогда как RpoTmp, транспортируемая как в митохондрии, так и в хлоропласты, предположительно участвует в транскрипции генов обеих органелл (Hedtke et al., 2000; Baba et al., 2004; Kühn et al., 2009).
Ранее было показано (Baba et al., 2004, Kühn et al., 2009), что инсерционный мутант арабидопсиса по гену, кодирующему RpoTmp, характеризуется рядом отличных от растений дикого типа фенотипических и молекулярно-биологических признаков. Мутантная линия арабидопсиса, в которой отсутствует функциональная полимераза RpoTmp, проявляет признаки нарушения развития растений: замедленный рост, укорочение корней, изменение формы и размеров листьев, а также снижение уровня транскриптов ряда митохондриальных генов - matR, nad1, nad2, nad6, cox1, rps4 и др. (Kühn et al., 2009). Различия в профилях митохондриальных транскриптов между мутантом rpotmp и растениями дикого типа остаются стабильными на всех этапах развития растений (Kühn et al., 2009). Показано, что снижение транскрипции определенных митохондриальных генов в растениях rpotmp не связано с изменениями в частоте использования конкретных промоторов, что подтверждает установленное in vitro (Kühn et al., 2007) отсутствие промоторной специфичности для активности этой РНК-полимеразы в митохондриях. Анализ промоторов генов, которые менее активно транскрибировались в rpotmp, и сопоставление их с промоторами других митохондриальных генов не выявили в промоторных последовательностях каких-либо специфических для RpoTmp мотивов (Kühn et al., 2009). Исходя из этого, авторы высказали предположение, что функции RpoTmp, по крайней мере, в митохондриях, являются специфичными не в отношении промоторов, а в отношении генов. Снижение количества ряда митохондриальных транскриптов приводит к снижению активности комплексов дыхательной цепи I и IV в мутанте rpotmp, при этом синтез белка в митохондриях мутанта остается ненарушенным (Kühn et al., 2009).
Отмечено (Kühn et al ., 2009), что фенотип растений линии rpotmp во многом напоминает фенотип мутантов с нарушениями функционирования митохондриальной электрон-транспортной цепи, в частности растений с инактивированным дыхательным комплексом I. Нами была поставлена задача провести сравнение ростовых характеристик растений и суспензионных культур клеток мутантной линии fro1 , в которой инактивирован ген, кодирующий Fe-S-содержащую субъединицу комплекса I, и линии rpotmp . В результате показано, что линия rpotmp проявляет фенотипические особенности, отличающие ее как от линии дикого типа, так и от линии fro1 .
MATERIALS AND METHODS
Растительный материал и условия культивирования. Семена Arabidopsis thaliana (L.) Heynh. экотип Columbia (далее Col-0 ) и линии Sail596_E11 (далее fro1 ) были получены из Arabidopsis Biological Resource Center (The Ohio State University, USA). Генотипирование, получение гомозигот и характеристика мутантных растений линии fro1 описаны ранее (Tarasenko et al ., 2010). Семена линии GABI_286Е07 (далее rpotmp ) были получены из коллекции инсерционных мутантов GABI-Kat (Rosso et al ., 2003). Растения выращивали на грунте, как описано ранее (Tarasenko et al ., 2012), либо стерильно в чашках Петри на средах, содержавших: минеральные соли MS – половинный состав, фитогель («Sigma-Aldrich», США) – 0,8%.
Суспензионную культуру клеток выращивали в 50-мл колбах в темноте при 26 0С на среде MS с добавлением тиамина (1 мг/л), пиридоксина (0,5
мг/л), никотиновой кислоты (0,5 мг/л), инозитола (100 мг/л), 2,4 дихлорфеноксиуксусной кислоты (0,3 мг/л) и сахарозы (30 г/л), объем среды в каждой колбе составлял 15 мл. Для построения кривых роста немедленно после пересадки культуры в свежую среду определяли средний начальный вес клеток в колбе, отфильтровав от среды и взвесив клетки в 3-5 случайно выбранных колбах. Далее аналогичным образом определяли средний вес клеток на 5-ый, 10-ый и 14-ый день после пересадки и выражали его в % от среднего начального веса.
Выделение митохондрий из листьев арабидопсиса. Выделение митохондрий из 3недельных розеток арабидопсиса проводили согласно модифицированному методу, описанному в (Sweetlove et al ., 2007). Растительный материал (в количестве 15-25 г) гомогенизировали в буфере, содержащем 0,3 М сахарозы, 25 мМ Na 4 P 2 O 7 , 10 мМ KH 2 PO 4 , 2 мМ ЭДТА, 1 % PVP-40, 1 % БСА, 20 мМ аскорбата натрия, 20 мМ цистеина, pH 7.5 (в соотношении 1:5). После фильтрации через слой капроновой ткани (50 мкм) и слой ткани Miracloth, гомогенат дважды подвергали дифференциальному центрифугированию при 2450 g (5 мин) и 17400 g (20 мин), с последовательным отбором сначала супернатанта, затем митохондриального осадка и промежуточным ресуспендированием осадка в среде промывания (СП), содержащей 0,3 М сахарозы, 20 мМ MOPS, 1 мМ ЭДТА, 0,2 % БСА, pH 7.2. Митохондриальную фракцию далее подвергали очистке центрифугированием в градиенте плотности PVP-40 (0 % - 4,4 %) в СП, содержащей 28 % Percoll, при 40000 g в течение 40 мин. Отобранные митохондрии дважды промывали в СП с последующим центрифугированием при 31000 g в течение 15 мин.
Определение активности дыхательных комплексов методом BN-PAGE. Для солюбилизации митохондриальных мембран использовали буфер, содержащий тритон Х-100 (состав буфера: 5 мМ NaCl, 2 мМ аминокапроновая кислота, 1 мМ ЭДТА, 50 мМ имидазол-HCl, 5 мМ фенилметилсульфонилфторид), соотношение количества белка и детергента cоставляло 1:1. В супернатант, обогащенный митохондриальными мембранными комплексами, полученный после центрифугирования при 16000 g (30 мин), добавляли 5% раствор красителя Coomassie brilliant blue G-250 (СBB). Электрофорез митохондриальных белковых комплексов проводили согласно протоколу (Heinemeyer et al., 2007). В качестве разделяющего геля использовали линейный градиент, 5-13 % (в/о) акриламида, концентрирующий гель содержал 4 % акриламида. Состав катодного буфера в электрофоретической камере - 50 мМ трицин; 15 мМ бис-трис; 0,02 % Coomassie G-250; рН 7,0, анодного - 50 мМ бис-трис, рН 7,0. Проба, которую наносили на гель, содержала по 100 мкг белка. По окончанию электрофореза гель помещали в раствор, содержащий 5 % CBB в 10 %-ной уксусной кислоте. Для определения активности комплекса I использовали раствор, содержащий 0,1 M трис-HCl, pH 7,4, 0,225 мМ NADH, 157 мкг/мл нитросинего тетразолия (Sabar et al., 2005). Время инкубации геля в растворе составляло 10 минут. RESULTS AND DISCUSSION
На первом этапе работы мы сравнили активность дыхательного комплекса I в мембранах митохондрий, выделенных из растений линии дикого типа (Col-0), линии fro1 с инактивированным геном, кодирующим Fe-S-содержащую субъединицу комплекса I митохондриальной дыхательной цепи, и линии rpotmp с инактивированным геном, кодирующим РНК-полимеразу RpoTmp (рис. 1). Активность комплекса I (представленная преимущественно суперкомплексом, состоящим из комплексов I и III) легко детектировалась в растениях дикого типа. При этом его активность полностью отсутствовала в растениях линии fro1, а в растениях линии rpotmp обнаруживались только следовые количества комплекса I. Таким образом, мы подтвердили, что линии rpotmp и fro1 проявляют сходный молекулярный дефект в отношении содержания и активности комплекса I.
Далее нами было проведено исследование фенотипических характеристик растений арабидопсиса линии rpotmp . Выращивание растений на грунте показало замедленный рост и более позднее образование цветоносного побега. Для листьев мутантных растений была характерна темно-зеленая окраска и складчатая поверхность листовой пластинки, что соответствует имеющимся в литературе данным (Kühn et al ., 2009). Следует отметить, что фенотипические характеристики растений rpotmp , такие как замедленное прорастание семян, позднее цветение, складчатость и темно-зеленая окраска листьев, характерны для мутантов с нарушенными митохондриальными функциями, и в особенности для растений с инактивированными компонентами дыхательного комплекса I (de Longevialle et al ., 2007; Kühn et al ., 2011). Действительно, все эти признаки проявляли и растения линии fro1 . Это позволяет предположить, что на молекулярном уровне основной дефект, приводящий к фенотипическим отличиям мутанта rpotmp , состоит в сниженном уровне активности комплексов дыхательной цепи (или, возможно, только комплекса I).
Однако дальнейшее более детальное сравнение растений линии rpotmp с растениями линии fro1 показало, что линия rpotmp обладает рядом специфических свойств. В частности, показана различная зависимость роста растений этих линий от продолжительности фотопериода. В то время как в условиях длинного светового дня растения линий rpotmp и fro1 обладали сходной скоростью роста (16 ч света и 8 ч темноты), при коротком световом дне (10 ч света и 14 ч темноты) растения линии rpotmp росли существенно быстрее, чем растения линии fro1 (рис. 2).
Следует отметить, что для растений линии fro1 (и других мутантов по комплексу I) ранее было показано, что отсутствие функционального комплекса I приводит к подавлению программ клеточной гибели листа и отсрочке увядания зеленых частей растения (Meyer et al ., 2009, Tarasenko et al ., 2010). Однако в настоящей работе мы показали, что листья растений линии rpotmp , выращиваемых в условиях короткого светового дня, напротив, проявляют признаки раннего увядания, образуя зоны некроза раньше, чем листья растений линии fro1 и листья растений дикого типа
(рис. 3). Хотя предполагается, что отсутствие РНК-полимеразы rpotmp отражается главным образом на митохондриальных, но не хлоропластных функциях (Kühn et al ., 2009), нельзя исключать и участие этого белка в функционировании хлоропластов. Можно предположить, что выявленные нами фенотипические различия между линиями rpotmp и fro1 связаны либо с последствиями сниженной активности комплекса IV, либо с гипотетическими изменениями в хлоропластах в растениях rpotmp . Однако, последняя возможность представляется нам маловероятной, поскольку у растений rpotmp не отмечены такие характерные для подавляющего большинства хлоропластных мутантов, включая мутанты по основной хлоропластной NEP-полимеразе арабидопсиса RpoTp, признаки, как светлая окраска листьев, ассоциированная со сниженным содержанием хлорофилла.

Figure 1. Активность дыхательного комплекса I в митохондриях растений дикого типа ( Col-0 ) и мутантных линий rpotmp и fro1 . После выделения митохондрий из листьев растений полученные фракции белков внутренней мембраны были разделены в полиакриламидном геле. CI – комплекс I, CI+III – суперкомплекс, состоящий из комплексов I и IV.
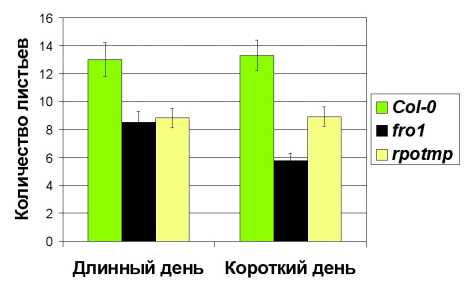
Figure 2. Зависимость числа листьев у растений линии дикого типа ( Col-0 ) и мутантных линий rpotmp и fro1 от продолжительности светового дня. Измерения проводили на 30-е сутки при выращивании в условиях длинного светового дня (16 ч света и 8 ч темноты) и на 40-е сутки при выращивании в условиях короткого светового дня (10 ч света и 14 ч темноты).

Figure 3. Листья растений линии rpotmp образуют зоны некроза раньше, чем листья растений линии fro1. Возраст растений составлял 45 сут, выращивание производилось в условиях короткого светового дня.
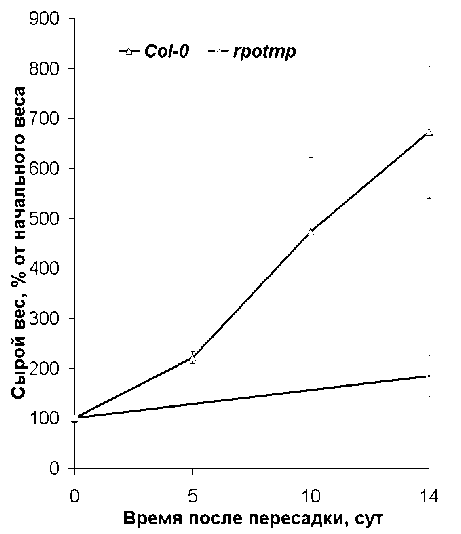
Figure 4. Динамика роста суспензионных культур клеток, полученных из растений дикого типа ( Col-0 ) и мутантной линии rpotmp.
На следующем этапе работы нами была получена суспензионная культура клеток линии rpotmp. Отмечена существенно (в 4-5 раз) меньшая скорость нарастания массы клеток в суспензионной культуре мутантной линии по сравнению с культурой клеток, полученной из растений дикого типа. Ранее нами было показано, что рост суспензионной культуры клеток линии fro1 был замедлен по сравнению с ростом клеток дикого типа не более чем на 20% (Тарасенко и др., 2014). Таким образом, несмотря на сходные проявления на уровне целых растений, отсутствие РНК-полимеразы RpoTmp (приводящее в первую очередь к снижению активности дыхательных комплексов I и IV в митохондриях) в культуре клеток вызывает существенно более серьезные дефекты роста сравнительно с отсутствием дыхательного комплекса I. Причины данного различия пока неясны. Поскольку гетеротрофная суспензионная культура клеток лишена функциональных хлоропластов, представляется маловероятным, чтобы отличия в скорости роста объяснялись ролью, которую РНК-полимераза могла бы играть в хлоропластах. Можно предположить, что в проявлении этого признака играет роль существенное снижение содержания комплекса IV. Это позволяет высказать гипотезу о том, что полноценный уровень активности комплекса IV является особенно важным для роста гетеротрофных культур клеток, и пониженное содержание этого комплекса приводит к гораздо более выраженному эффекту, нежели полное отсутствие комплекса I в линии fro1.
Несмотря на косвенный характер полученных данных о возможных фенотипических проявлениях сниженного уровня дыхательного комплекса IV, эти данные имеют определенную ценность по причине отсутствия жизнеспособных мутантов арабидопсиса по генам, кодирующим компоненты этого комплекса. По-видимому, подавляющее большинство мутаций по коровым субъединицам комплекса IV в высших растениях являются летальными. Единственными охарактеризованными на сегодняшний день мутантами по комплексу IV являются линии кукурузы NCS5 и NCS6 , несущие делеции в участке митохондриальной ДНК, кодирующей субъединицу COX2 (Lauer et al ., 1990). Растения этих линий проявляют гетероплазмию и содержат клетки как с мутантными, так и с нормальными митохондриями. Таким образом, с помощью мутантов по РНК-полимеразе RpoTmp нами впервые получены данные, указывающие на возможные фенотипические последствия сниженного уровня дыхательного комплекса IV для растений. Кроме того, продемонстрированные нами дефекты роста суспензионной культуры клеток линии rpotmp свидетельствуют о перспективности ее использования в качестве системы для селекции клеток, митохондрии которых трансформированы генетической конструкцией, несущей кодирующий RpoTmp ген.
ACKNOWLEDGMENT
Работа выполнена при финансовой поддержке РФФИ в рамках научного проекта № 15-04-05046, а также РФФИ и Правительства Иркутской области (постановление № 545-пп от 29 октября 2015) в рамках научного проекта 14-44-04001 р_сибирь_а. В работе использовано оборудование Байкальского аналитического центра (ЦКП) СО
РАН при Президиуме ИНЦ СО РАН, а также оборудование ЦКП Фитотрон СИФИБР СО РАН.
Список литературы Фенотипические признаки растений арабидопсиса, дефицитные в РНК-полимеразе rpotmp
- Baba K., Schmidt J., Espinosa-Ruiz A., Villarejo A., Shiina T., Gardestrom P., Sane A.P., Bhalerao R.P. (2004) Organellar gene transcription and early seedling development are affected in the RpoT;2 mutant of Arabidopsis. Plant J, 38, 38-48
- Chang C-C., Sheen J., Bligny M., Niwa Y., Lerbs-Mache S., Stern D.B. (1999) Functional analysis of two maize cDNAs encoding T7-like RNA polymerases. Plant Cell, 11, 911-926
- Gualberto J.M., Mileshina D., Wallet C., Niazi A.K., Weber-Lotfi F., Dietrich A. (2014) The plant mitochondrial genome: dynamics and maintenance. Biochimie, 100, 107-120
- Hedtke B., Borner T., Weihe A. (2000) One RNA polymerase serving two genomes. EMBO reports, 11(54), 435-440
- Hedtke B., Legen J., WeiheA., Herrmann R.G., Börner T. (2002) Six active phage-type RNA polymerase genes in Nicotiana tabacum. The Plant Journal, 30(5), 625-637
- Heinemeyer J., Lewejohann D., Braun H.P. (2007) Blue-native gel electrophoresis for the characterization of protein complexes in plants. Methods Mol. Biol., 355, 343-352
- Kühn K., Bohne A.V., Liere K., Weihe A., Börner T. (2007) Arabidopsis phage-type RNA polymerases: Accurate in vitro transcription of organellar genes. Plant Cell, 19, 959-971
- Kühn K., Richter U., Meyer E., Delannoy E., de Longevialle A.F., O’Toole N., Börner T., Millar A., Small I., Whelan J. (2009) Phage-type RNA polymerase RPOTmp performs gene-specific transcription in mitochondria of Arabidopsis thaliana. Plant Cell, 21, 2762-2779
- Kühn K., Carrie C., Giraud E., Wang Y., Meyer E.H., Narsai R., des Francs-Small C.C., Zhang B., Murcha M.W., Whelan J. (2011) The RCC1 family protein RUG3 is required for splicing of nad2 and complex I biogenesis in mitochondria of Arabidopsis thaliana. Plant J., 67, 1067-1080
- Lauer M., Knudsen C., Newton K.J., Gabay-Laughnan S., Laughnan J.R. (1990) A partially deleted mitochondrial cytochrome oxidase gene in the NCS6 abnormal growth mutant of maize. New Biol., 2, 179-186
- Liere K., Weihe A., Börner T. (2011) The transcription machineries of plant mitochondria and chloroplasts: Composition, function, and regulation. Journal of Plant Physiology, 168, 1345-1360
- de Longevialle A.F., Meyer E.H., Andres C., Taylor N.L., Lurin C., Millar A.H., Small I.D. (2007) The pentatricopeptide repeat gene OTP43 is required for trans-splicing of the mitochondrial nad1 intron 1 in Arabidopsis thaliana. Plant Cell, 19, 3256-3265
- Lysenko E.A., Kuznetsov V.V. (2005) Plastid RNA polymerases. Mol Biol., 39, 661-674
- Meyer E.H., Tomaz T., Carroll A.J., Estavillo G., Delannoy E., Tanz S.K., Small I.D., Pogson B.J., Millar A.H. (2009) Remodeled respiration in ndufs4 with low phosphorylation efficiency suppresses Arabidopsis germination and growth and alters control of metabolism at night. Plant Physiol., 151, 603-619
- Rosso M.G., Li Y., Strizhov N., Reiss B., Dekker K., Weisshaar B. (2003) An Arabidopsis thaliana T-DNA mutagenized population (GABI-Kat) for flanking sequence tag-based reverse genetics. Plant Mol. Biol., 53, 247-259
- Sabar M., Balk J., Leaver C.J. (2005) Histochemical staining and quantification of plant mitochondrial respiratory chain complexes using blue-native polyacrylamide gel electrophoresis. The Plant Journal, 44, 893-901
- Sweetlove L.J., Taylor N.L., Leaver C.J. (2007) Isolation of intact, functional mitochondria from the model plant Arabidopsis thaliana. Methods Mol Biol., 372, 125-136
- Tarasenko V.I., Garnik E.Y., Shmakov V.N., Konstantinov Y.M. (2012) Modified alternative oxidase expression results in different reactive oxygen species contents in Arabidopsis cell culture but not in whole plants. Biologia Plantarum, 56, 635-640
- Tarasenko V.I., Garnik E.Y., Konstantinov Y.M. (2010) Characterization of Arabidopsis mutant with inactivated gene coding for Fe-S subunit of mitochondrial respiratory chain complex I. Russ. J. Plant Physiol., 57, 392-400
- Tarasenko V.I., Garnik E.Y., Shmakov V.N., Konstantinov Y.M. (2009) Induction of Arabidopsis gdh2 gene expression during changes in redox state of the mitochondrial respiratory chain. Biochemistry (Moscow), 74, 47-53
- Wicke S., Schneeweiss G.M., de Pamphilis C.W., Müller K.F., Quandt D. (2011) The evolution of the plastid chromosome in land plants: gene content, gene order, gene function. Plant Mol. Biol., 76, 273-297
- Тарасенко В.И., Гарник Е.Ю., Кулинченко М.В., Потапова Т.В., Константинов Ю.М. (2014) Характеристика растений арабидопсиса, мутантных по различным компонентам дыхательной цепи митохондрий. Механизмы регуляции функций растительных органелл: материалы Всероссийской научной конференции. Иркутск: Издательство РИО НЦРВХ СО РАМН. С. 88-91


