Фентанил-индуцированный цереброкардиальный синдром
Автор: Ахматханова Л.Х.Б., Ковалева Э.А., Алиев И.С., Коригова Х.В., Шевченко Е.В., Симонова А.Ю., Рамазанов Г.Р.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 2 т.14, 2024 года.
Бесплатный доступ
Клинический случай представлен для демонстрации важности дифференциального диагноза нарушений мозгового кровообращения у пациентов с острым или хроническим токсическим действием психоактивных веществ. В представленном наблюдении пациент 50 лет доставлен в НИИ СП им. Н.В. Склифосовского с угнетением уровня бодрствования до глубокого оглушения, при сборе анамнеза факт употребления психоактивных веществ отрицает, двусторонний миоз, диффузное снижение тонуса во всех конечностях. Выполнена компьютерная ангиотомография головного мозга, транскраниальная допплерография, магнитно-резонансная томография головного мозга, электроэнцефалография - без явных диагностических находок. При проведенном детальном обследовании в неврологической клинике данных за нарушение мозгового кровообращения не получено, выполнено химико-токсикологическое исследование мочи и крови, в биологических средах обнаружен фентанил. Исходя из литературных данных, однако повреждение нервной системы, как правило, возникает вследствие хронической интоксикации и не всегда возможно обнаружение психоактивных веществ в биологических средах. В связи с угнетением дыхания пациент был интубирован и в течение 72 часов находился на искусственной вентиляции до спонтанного восстановления дыхания. После повторного расспроса пациент признал факт употребления фентанила якобы для купирования болевого синдрома, после чего от дальнейшего лечения отказался. Выводом является необходимость химико-токсикологического исследование биологических сред при нарушении сознания неясного генеза, однако повреждение нервной системы, как правило, возникает вследствие хронической интоксикации и не всегда возможно обнаружение психоактивных веществ в биологических средах.
Цереброкардиальный синдром, ишемический инсульт, фентанил, кардиомиопатия
Короткий адрес: https://sciup.org/143182965
IDR: 143182965 | УДК: 616.12, | DOI: 10.20340/vmi-rvz.2024.2.CLIN.6
Текст научной статьи Фентанил-индуцированный цереброкардиальный синдром
Инсультоподобное состояние (ИПС) можно определить как заболевание или состояние, клинические проявления которого схожи с острым нарушением мозгового кровообращения (ОНМК), но при этом не сопровождаются формированием инфаркта мозга или внутричерепного кровоизлияния [0] . Дифференциальный диагноз ишемического инсульта (ИИ) с ИПС ограничен временными рамками концепции «время-мозг», т.к. в случае острой церебральной ишемии пациенту могут быть показаны системная тромболитическая терапия (сТЛТ) и/или тромбэктомия (ТЭ). Выполнение реперфузионной терапии ассоциировано с таким жизнеугрожающим осложнением, как внутричерепное кровотечение, частота развития которого составляет 4,5–45,3 % [2] . По причине смещения приоритета в сторону такого показателя, как «время от двери до иглы», значительное количество пациентов с ИПС могут быть неверно идентифицированы как больные с истинным ИИ. У данной группы пациентов при сохранении рисков развития кровотечения отсутствует польза от реперфузионной терапии. Тонкая грань между возможностью своевременного начала лечения ИИ и его гипердиагностикой у пациентов с ИПС, между значительным клиническим улучшением на фоне реперфузионной терапии у пациента с ИИ и тяжёлым геморрагическим осложнением сТЛТ у пациента с ИПС накладывают на невролога дополнительную ответственность. В свете всего вышеизложенного необходимо отметить, что частота ИПС достигает 50 % от числа всех пациентов, поступающих в стационар с диагнозом «инсульт» [0] . Основную массу пациентов с ИПС составляют лица с гипогликемией, гипокалиемией, эпилептическими приступами и постиктальным параличом Тодда, внутричерепными объёмными образованиями, гемиплегической мигренью, отравлениями наркотическими средствами [0, 3] .
Ниже приводим клиническое наблюдение инсультоподобного состояния у пациента с фентанил-индуцированным повреждением головного мозга.
Клинический случай
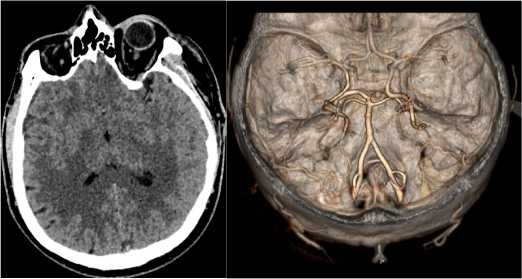
Пациент, 50 лет, доставлен в НИИ СП им. Н.В. Склифосовского с угнетением уровня бодрствования до глубокого оглушения (12 баллов по шкале комы Глазго (ШКГ)). Из анамнеза известно, что последний контакт с пациентом был за сутки до госпитализации. При поступлении в неврологическом статусе отмечены двусторонний миоз, диффузное снижение тонуса во всех конечностях. В связи с подозрением на ОНМК с целью исключения тромбоза базилярной артерии (ТБА) пациенту выполнена компьютерная томография (КТ) головного мозга и КТ-панангиография церебральных артерий, признаков паренхиматозного повреждения и окклюзии не выявлено (рис. 1). Пациент госпитализирован в реанимацию неврологического отделения.
При поступлении артериальное давление – 100/60 мм рт. ст., частота дыхательных движений – 16 в минуту. В биохимическом анализе крови повышение уровня креатинина и мочевины до 169 мкмоль/л и 8 ммоль/л соответственно, в клиническом анализе крови умеренный лейкоцитоз – до 10×109/л. Исследование системы гемостаза выявило повышение уровня D-димера в плазме крови до 2,09 мкг/мл. При оценке кислотно-щелочного состояния артериальной крови установлены признаки респираторного ацидоза в виде снижения рН до 7,2 на фоне рСО 2 57,1. Учитывая угнетение уровня бодрствования до глубокого оглушения и результаты лабораторных исследований, пациенту выполнена интубация трахеи и начата искусственная вентиляция легких (ИВЛ). Компьютерная томография органов грудной клетки визуализировала инфильтративные изменения в базальных отделах лёгких (рис. 2).
А Б
Рисунок 1. Компьютерная томография головного мозга (A) и КТ-ангиография интракраниальных артерий (Б). Данных за патологические изменения и тромбоз базилярной артерии не выявлено
Figure 1. Computed tomography of the brain (A) and CT angiography of the intracranial arteries (Б). No data were found for pathological changes and thrombosis of the basilar artery
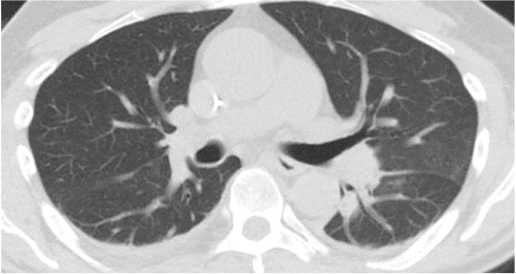
Рисунок 2. Компьютерная томография легких, стрелкой указаны участки инфильтративных изменений
Figure 2. Computed tomography of the lungs, the arrow indicates the areas of infiltrative changes
Однако клинических признаков пневмонии у пациента не наблюдали, уровень С-реактивного белка не превышал референсных значений, ввиду чего принято решение воздержаться от назначения системной антибактериальной терапии.В связи с выявленным при помощи дуплексного сканирования окклюзионного тромбоза вен нижних конечностей назначена антикоагулянтная терапия раствором гепарина натрия. По результатам ультразвукового исследования брахиоцефальных артерий признаков атеросклероза не выявлено, исключён церебральный вазоспазм при помощи транскраниальной допплерографии.
По данным ЭКГ ритм синусовый, частота сердечных сокращений – 79 ударов в минуту. Трансторакальная эхокардиография (Эхо-КГ) выявила диффузный гипокинез со снижением фракции выброса левого желудочка (ЛЖ) до 25 %, систолическое давление лёгочной артерии составило 15 мм рт. ст. В связи с этим осуществлён забор крови для определения концентрации высокочувствительного тропонина I с интервалом 6 часов. Исходное значение тропонина I составило 0,07 нг/мл со снижением показателя в динамике до 0,037 и 0,02 нг/мл. Отмечено повышение уровня мозгового натрийуретического пептида до 1768 пг/мл. Клинических и лабораторных признаков острого инфаркта миокарда не получено. Для оценки перфузии миокарда пациенту выполнена сцинтиграфия, очаговых изменений не выявлено. В связи с артериальной гипотензией пациенту начата терапия норадреналином в дозе 0,05 мг/кг/мин внутривенно.
При помощи магнитно-резонансной томографии (МРТ) головного мозга верифицировано билатеральное повышение интенсивности сигнала в режимах Т2-взвешенное изображение (ВИ) и Т2-FLAIR от бледного шара (рис. 3). При внутривенном контрастировании очагов накопления контрастного вещества не выявлено.
Учитывая двусторонний характер повреждения головного мозга, ограниченные данные анамнеза, предположен токсический генез энцефалопатии. В связи с этим выполнено химико-токсикологическое исследование мочи и крови, в биологических средах обнаружен фентанил.
С целью исключения бессудорожного эпилептического статуса выполнена электроэнцефалография, выявлены диффузные неспецифические изменения биоэлектрической активности головного мозга. Через 72 часа отмечено восстановление уровня бодрствования до ясного, прекращены ИВЛ и вазопрессорная терапия, восстановлено самостоятельное дыхание, пациент экстубирован. Кроме того, в динамике выполнена Эхо-КГ, зафиксировано восстановление фракции выброса ЛЖ до 55 %.
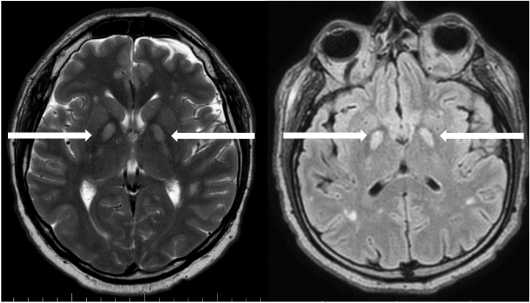
Рисунок 3. Магнитно-резонансная томография головного мозга с контрастным усилением: А – режим Т2-ВИ, аксиальный срез; Б – режим Т2-FLAIR, аксиальный срез. Стрелками указаны зоны токсического повреждения головного мозга
Figure 3. Magnetic resonance imaging of the brain with contrast enhancement: A – T2-VI mode, axial section; B – T2-FLAIR mode, axial section. The arrows indicate the areas of toxic brain damage
В неврологическом статусе моторного дефицита не выявлено, отмечена брадилалия. Выполнена замена инъекционного гепарина натрия на пероральный антикоагулянт (ривароксабан в дозе 20 мг в сутки). Пациенту сообщено о результатах нейровизуализации и лабораторных исследований, и при повторном сборе анамнеза подтверждён факт длительного употребления фентанила в связи с болевым синдромом. Однако от дальнейшего стационарного лечения пациент отказался.
Обсуждение
Снижение уровня бодрствования требует исключения ТБА, который наблюдают у 1–4 % пациентов с ИИ, а летальность при этом состоянии достигает 95 % [4] . Жизнеспасающей процедурой при ТБА является механическая тромбэктомия, которая должна быть выполнена у пациентов даже со снижением уровня бодрствования до комы в дебюте заболевания [4 –7] .
Одномоментное повреждение головного мозга и явления кардиальной дисфункции возникают вследствие кардиоцеребрального или цереброкардиаль-ного синдромов, а также при действии токсического агента. Кардиоцеребральный синдром (КЦС) подразумевает сочетанное развитие цереброваскулярных событий и острого инфаркта миокарда. Как правило, в основе патогенеза КЦС лежат такие состояния как фибрилляция предсердий, расслоение аорты I типа, тромбоз правого предсердия у пациентов с открытым овальным окном и дисфункция левого желудочка со снижением его фракции выброса [8]. В случае развития кардиологических осложнений у пациентов с ИИ принято говорить о цереброкардиальном синдроме (ЦКС). Чаще всего у пациентов после ИИ впервые верифицируют такие нарушения ритма сердца как фибрилляция предсердий, атриовентрикулярная блокада и пароксизмы наджелудочковой тахикардии [9]. В 93,9 % указанные аритмии возникают в первые сутки ИИ [10]. Кроме того, в остром периоде инсульта возможно повышение уровня высокочувствительного тропонина (20,6 %) и креатинфосфокиназы-МВ (34,4 %), отмечают инверсию зубца Т (17,8 %), удлинение интервала QT (26–36 %) и элевацию или депрессию сегмента ST (24,5–50 %) [11–13]. Частота инфаркта миокарда после ИИ у пациентов без предшествующего анамнеза ишемической болезни сердца составляет 3,5 % [13]. Результаты аутопсии продемонстрировали, что частота очагов трансмурального повреждения миокарда у пациентов с ИИ по сравнению с группой больных без церебрального повреждения составляет 62 % против 26 % (р < 0,01) [14]. Предполагаемой причиной кардиомиопатии у данных пациентов является повышение уровня катехоламинов на фоне остро возникшей внутричерепной гипертензии [14]. Одновременное повреждение головного мозга и сердца необходимо дифференцировать с токсической энцефало- и кардиомиопатией. Наиболее распространёнными токсическими агентами являются этанол и его производные, опиоидные наркотические средства и некоторые лекарственные препараты (антрациклины, иматиниб, антиретровирусные препараты) [15–18].
Длительное употребление психоактивных веществ (ПАВ) приводит к повреждению головного мозга с развитием токсической энцефалопатии [19] . В тяжёлых случаях токсическая энцефалопатия сопровождается морфологическими изменениями в виде билатерального повреждения базальных ядер, что подтверждается данными МРТ [20 –22] . Клиническая картина токсической энцефалопатии достаточно вариабельна и может проявляться нарушением зрения и/или высших мозговых функций, изменением поведения, афазией, а также угнетением уровня сознания вплоть до комы [20, 23 –26] . Как правило, первые симптомы появляются спустя 3 недели от употребления ПАВ и могут сохраняться в течение года. Наиболее распространёнными агентами токсической энцефалопатии являются толуол, этанол, метадон, морфин, героин, фентанил [27] .
Фентанил – селективный агонист µ-рецепторов и синтетический опиоид с выраженным анальгетическим действием [28]. Противоболевой эффект фентанила в 100 раз превосходит таковой морфина, а смертельная доза первого составляет 2 мг [28]. Фентанил синтезирован в 1960 году и разрешён к использованию в медицине в 1968 году [29]. Широкое применение препарат нашёл не только в анестезиологии, но и в онкологии, где у пациентов с хроническим болевым синдромом используют трансдермальные системы с непрерывной абсорбцией фентанила [30]. Исследования на популяционном уровне о распространённости токсического дей- ствия фентанила и частоте неврологических осложнений отсутствуют. В основе патогенеза повреждения нервной системы при употреблении фентанила лежат демиелинизация и хроническая церебральная гипоксия, приводящие к так называемой отсроченной постгипоксической энцефалопатии [27].
В представленном клиническом случае хроническое употребление фентанила привело к билатеральному повреждению головного мозга и угнетению уровня бодрствования. Клиническая картина требовала в первую очередь исключения ОНМК, а именно ТБА. С этой целью пациенту была выполнена КТ-ангиография интракраниальных артерий, позволившая исключить такое жизнеугрожающее состояние как ТБА и неоправданное применение реперфузионной терапии. Компьютерная томография является простым и быстрым скрининговым методом визуализации головного мозга, однако значительно уступает МРТ и не позволяет проводить в полной мере дифференциальную диагностику. Билатеральное повреждение бледного шара чаще всего наблюдают при токсическом действии опиатов, в частности героина и метадона, а также при митохондриальной энцефалопатии, болезни Крейтцфельда – Якоба и осмотическом демиелинизирующем синдроме [31] . Именно при помощи МРТ в нашем клиническом наблюдении была заподозрена токсическая энцефалопатия, в последующем подтверждённая результатами химикотоксикологического исследования. Такие радиологические проявления, как билатеральное повышение интенсивности сигнала от бледного шара в режимах Т2-FLAIR и Т2 ВИ, свидетельствуют о токсическом повреждении головного мозга. Кроме того, у пациента было выявлено снижение фракции выброса левого желудочка, обусловленное, по всей видимости, фен-танил-индуцированной кардиомиопатией. Одномоментное развитие острой церебральной недостаточности и кардиальной дисфункции в представленном клиническом случае в первую очередь требовало исключения кардиоцеребрального и цереброкар-диального синдромов. Однако данные нейровизуализации не верифицировали ИИ, а снижение уровня тропонина I в динамике и отсутствие электрокардиографических признаков ишемии, локальных зон гипо-и акинеза снизили вероятность инфаркта миокарда. Кроме того, восстановление фракции выброса ЛЖ в течение суток свидетельствовало об обратимом характере повреждения миокарда.
Таким образом, снижение уровня бодрствования в сочетании с кардиальной дисфункцией необходимо дифференцировать с ОНМК, КЦС или ЦКС, а также отравлением ПАВ. В настоящее время специфическая терапия токсической энцефалопатии отсутствует, лечение носит симптоматический характер и направлено на элиминацию токсического агента.
Заключение
У половины пациентов, поступающих с остро возникшим неврологическим дефицитом, верифицируют ИПС, в том числе энцефалопатии токсического генеза. В связи с отсутствием патогномоничных симптомов ведущая роль в установлении диагноза принадлежит МРТ головного мозга и определению токсического агента в биологических средах. Нейрорадиологические признаки билатерального повреждения белого вещества головного мозга у пациентов с угнетением уровня бодрствования, когнитивными нарушениями и изменениями поведения требуют исключения токсической энцефалопатии. При подозрении на употребление ПАВ следует помнить об их системном действии и в обязательном порядке выполнять эхокардиографию. Для подтверждения диагноза необходимо химикотоксикологическое исследование биологических сред, однако повреждение нервной системы, как правило, возникает вследствие хронической интоксикации, и не всегда возможно обнаружение ПАВ в биологических средах.
Список литературы Фентанил-индуцированный цереброкардиальный синдром
- Buck BH, Akhtar N, Alrohimi A, Khan K, Shuaib A. Stroke mimics: incidence, aetiology, clinical features and treatment. Ann Med. 2021;53(1):420-436. PMID: 33678099 https://doi.org/10.1080/07853890.2021.1890205
- Khatri P, Wechsler LR, Broderick JP. Intracranial hemorrhage associated with revascularization therapies. Stroke. 2007;38(2):431-440. PMID: 17234988 https://doi.org/10.1161/01.STR.0000254524.23708.c9
- McClelland G, Rodgers H, Flynn D, Price CI. The frequency, characteristics and aetiology of stroke mimic presentations: a narrative review. Eur J Emerg Med. 2019;26(1):2-8. PMID: 29727304 https://doi.org/10.1097/MEJ.0000000000000550
- Lohse A, Preul C, Witte OW, Isenmann S. Clinical Diagnostics,Therapy and Outcome After Basilar Artery Thrombosis. Open Crit Care Med J. 2011 ;4(1):28-34. https://doi.org/10.2174/1874828701104010028
- Demel SL, Broderick JP. Basilar Occlusion Syndromes: An Update. Neurohospitalist. 2015;5(3):142-150. PMID: 26288672 https://doi.org/10.1177/1941874415583847
- Рамазанов Г.Р., Ковалева Э.А., Клычникова Е.В., Коков Л.С., Коригова Х.В., Муслимов Р.Ш., Пархоменко М.В., Петриков С.С., Степанов В.Н. Тромбэктомия у пациентов с тромбозом базилярной артерии. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». 2021 ;10(3):484-492. https://doi.org/10.23934/2223-9022-2021-10-3-484-492
- Рамазанов Г.Р., Коков Л.С., Ковалева Э.А., Коригова Х.В., Пархоменко М.В., Петриков С.С. Тромбэктомия у пациентов с тромбозом базилярной артерии и сниженным уровнем бодрствования (Клиническое наблюдение). Журнал Диагностическая и интервенционная радиология. 2021; 15(2); 55-64. Ramazanov G.R., Kokov L.S., Kovaleva E.A., Korigova H.V., Parkhomenko M.V., Petrikov S.S. Thrombectomy in patients with basilar artery thrombosis and decreased wakefulness (Clinical observation). Journal of Diagnostic and Interventional Radiology. 2021 ;15(2);55-64. (In Russ). https://doi.org/10.25512/DIR.2021.15.2.06
- Habib M. Cardio-Cerebral Infarction Syndrome: An Overview. International J Clinical Case Reports and Reviews. 2021;8(1):140. https://doi.org/10.31579/2690-4861/140
- Ruthirago D, Julayanont P, Tantrachoti P, Kim J, Nugent K. Cardiac Arrhythmias and Abnormal Electrocardiograms After Acute Stroke. Am J Med Sci. 2016;351(1):112-118. PMID: 26802767 https://doi.org/10.1016/j.amjms.2015.10.020
- Seifert F, Kallmunzer B, Gutjahr I, Breuer L, Winder K, Kaschka I, et al. Neuroanatomical Correlates of Severe Cardiac Arrhythmias in Acute Ischemic Stroke. J Neurol. 2015;262(5):1182-1190. PMID: 25736554 https://doi.org/10.1007/s00415-015-7684-9
- Fure B, Bruun Wyller T, Thommessen B. Electrocardiographic and Troponin T Changes in Acute Ischaemic Stroke. J Intern Med. 2006;259(6):592-597. PMID: 16704560 https://doi.org/10.1111/j.1365-2796.2006.01639.x
- He L, Wang J, Dong W. The Clinical Prognostic Significance of Hs-Ctnt Elevation in Patients With Acute Ischemic Stroke. BMC Neurol. 2018; 18(1):118. PMID: 30124165 https://doi.org/10.1186/s12883-018-1 121-5
- Boulanger M, Li L, Lyons S, Lovett NG, Kubiak MM, Silver L, et al. Essen Risk Score in Prediction of Myocardial Infarction After Transient Ischemic Attack or Ischemic Stroke Without Prior Coronary Artery Disease. Stroke. 2019;50(12):3393-3399. PMID: 31637970 https://doi.org/10.1161/STROKEAHA.119.025831
- Kolin A, Norris JW. Myocardial damage from acute cerebral lesions. Stroke. 1984;15(6): 990-993. https://doi.org/10.1161/01 .str.15.6.990
- Krantz MJ, Palmer RB, Haigney MC. Cardiovascular complications of opioid use: JACC state-of-the-art review. J Am Coll Cardiol. 2021 ;77(2):205-223. PMID: 33446314 https://doi.org/10.1016/j.jacc.2020.11.002
- Omran SS, Chatterjee A, Chen ML, Lerario MP, Merkler AE, Kamel H. National trends in hospitalizations for stroke associated with infective endocarditis and opioid use between 1993 and 2015. Stroke. 2019;50(3):577-582. PMID: 30699043 https://doi.org/10.1161/STROKEAHA.118.024436
- Kerkelä R, Grazette L, Yacobi R, Iliescu C, Patten R, Beahm C, et al. Cardiotoxicity of the cancer therapeutic agent imatinib mesylate. Nat Med. 2006;12(8):908-916. PMID: 16862153 https://doi.org/10.1038/nm1446
- Рамазанов Г.Р., Ковалева Э.А., Новиков Р.А., Кузьмина И.М., Клычникова Е.В., Хамидова Л.Т., Рыбалко Н.В., Измайлова А.М. Ишемический инсульт как первое проявление антрациклиновой кардиомиопатии. Вестник медицинского института «РЕАВИЗ». 2022; 12(6); 127-133. https://doi.org/10.20340/vmi-rvz.2022.6.CASE.2
- Sboto-Frankenstein U, Citton K, Young W, Moore A, Hasselback P. Acquired Brain Injury and Opioid Overdose Community Dialogue. Public Engagement Session Summary Report. 2020.
- Buxton JA, Sebastian R, Clearsky L, Angus N, Shah L, Lem M, et al. Chasing the dragon - characterizing cases of leukoencephalopathy associated with heroin inhalation in British Columbia. Harm Reduct J. 2011;8:3. PMID: 21255414 https://doi.org/10.1186/1477-7517-8-3
- Odia YM, Jinka M, Ziai WC. Severe leukoencephalopathy following acute oxycodone intoxication. Neurocrit Care. 2010;13(1):93-97. PMID: 20440598 https://doi.org/10.1007/s12028-010-9373-y
- Achamallah N, Wright RS, Fried J. Chasing the wrong dragon: a new presentation of heroin-induced toxic leukoencephalopathy mimicking anoxic brain injury. J Intensive Care Soc. 2019;20(1):80-85. PMID: 30792768 https://doi.org/10.1177/1751143718774714
- Beeskow AB, Oberstadt M, Saur D, Hoffmann KT, Lobsien D. Delayed post-hypoxic Leukoencephalopathy (DPHL)-An uncommon variant of hypoxic brain damage in adults. Front Neurol. 2018;9:708. PMID: 30210433 https://doi.org/10.3389/fneur.2018.00708
- Barash JA, Ganetsky M, Boyle KL, Raman V, Toce MS, Kaplan S, et al. Acute Amnestic Syndrome Associated with Fentanyl Overdose. N Engl J Med. 2018;378(12):1157-1158. PMID: 29562161 https://doi.org/10.1056/NEJMc1716355
- Benoilid A, Collongues N, de Seze J, Blanc F. Heroin inhalation-induced unilateral complete hippocampal stroke. Neurocase. 2013;19(4):313-315. PMID: 22624985 https://doi.org/10.1080/13554794.2012.667125
- Switzer AR, Beland B, Sarna JR, Walzak A, Pfeffer G. Fentanyl Overdose Causing Hippocampal Ischaemia Followed by Delayed Leukoencephalopathy. Can J Neurol Sci. 2020;47(3):398-399. PMID: 32063243 https://doi.org/10.1017/cjn.2020.33
- Filley CM, Kleinschmidt-DeMasters B. Toxic leukoencephalopathy. N Engl J Med. 2001;345(6):425-432. PMID: 11496854 https://doi.org/10.1056/NEJM200108093450606
- Ramos-Matos CF, Karlyle GB, Lopez-Ojeda W. Fentanyl. Treasure Island (FL): StatPearls Publishing; 2023 Jan. PMID: 29083586 Bookshelf ID: NBK459275
- Stanley TH. The history and development of the fentanyl series. J Pain Symptom Manage. 1992;7(3 Suppl):S3-7. PMID: 1517629 https://doi.org/10.1016/0885-3924(92)90047-l
- Taylor KP, Singh K, Goyal A. Fentanyl Transdermal. Treasure Island (FL): StatPearls Publishing; 2023 Jan. PMID: 32310428 Bookshelf ID: NBK555968
- Ramirez-Zamora, A, Ramani, H, Pastena G. Neurological picture. Bilateral pallidal and medial temporal lobe ischaemic lesions after opioid overdose. J Neurol Neurosurg Psychiatry. 2015;86(12):1383-1384. PMID: 25240058 https://doi.org/10.1136/jnnp-2014-308730


