Филогенетическая структура сообщества прокариот дерново-подзолистой почвы под озимой рожью не зависит от агротехнических приемов
Автор: Филиппова В.А., Круглов Ю.В., Андронов Е.Е.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Агросистемы будущего растение и почва
Статья в выпуске: 5 т.53, 2018 года.
Бесплатный доступ
Микробные сообщества почв - это сложные многокомпонентные системы, формирующиеся под влиянием широкого круга факторов, в том числе типа почвы, вида растения, климата, агротехники. До сих пор ведется дискуссия о специфическом характере действия различных растений на микробиом почвы, что важно для понимания механизма взаимодействия микроорганизмов и растений, построения оптимальных севооборотов, а также организации мероприятий по защите сельскохозяйственных культур от фитопатогенных микроорганизмов и вредителей. Озимая рожь - одна из немногих сельскохозяйственных культур, которая может выращиваться бессменно на протяжении десятилетий. Она имеет мощную корневую систему, которая по биомассе сопоставима с наземной частью растения. В настоящей работе представлены результаты анализа филотипической структуры и разнообразия прокариотических микроорганизмов в посевах ржи, выращиваемой в бессменной культуре и шестипольном севообороте на протяжении почти 100 лет. Нашей целью было выявление влияния различных агротехник (севооборот и известкование) на филогенетическую структуру прокариотических микроорганизмов в посевах ржи в условиях длительного полевого опыта...
Филогенетическая структура, биоразнообразие прокариот, дерново-подзолистая почва, озимая рожь
Короткий адрес: https://sciup.org/142216605
IDR: 142216605 | УДК: 633.14:631.58:631.461:577.2 | DOI: 10.15389/agrobiology.2018.5.994rus
Текст научной статьи Филогенетическая структура сообщества прокариот дерново-подзолистой почвы под озимой рожью не зависит от агротехнических приемов
Почва — это сложная экологическая система, где ключевую роль играют микробные сообщества, обеспечивающие нормальное функционирование биосферы (1, 2). Для сельского хозяйства особый интерес представляет таксономическая и функциональная структура микробного сообщества, которое формируется в разнообразных физико-химических условиях среды, под покровом разных видов растений. Большинство исследователей считают, что основным фактором формирования микробиоты ризосферы, и особенно ризопланы, служат растения, но, учитывая сложность взаимодействия в системе почва—микроорганизмы—растения, многие признают значительное влияние на структуру и разнообразие ризосферных микроорганизмов типа почвы, агротехнических мероприятий и климата (3-5).
* Работа выполнена в рамках государственных заданий ¹ 0664-2018-0023 и ¹ 0664-2017-0050.
До сих пор ведется дискуссия о специфическом характере действия различных растений на микробиом почвы, что очень важно для понимания механизма взаимодействия микроорганизмов и растений, построения оптимальных севооборотов, организации мероприятий по защите сельскохозяйственных культур от фитопатогенных микроорганизмов и вредителей. В связи с этим особая роль отводится исследованиям микрофлоры почвы в длительных полевых опытах, в которых одна и та же культура возделывается в поле на протяжении многих лет. Такие опыты проводятся в России, Германии, Великобритании, США, Канаде, Франции (6). Тотальные исследования филогенетической структуры микробиома почвы в многофакторном долголетнем (более 100 лет) полевом опыте (МСХА им. К.А. Тимирязева, г. Москва) показали (7), что ключевым фактором филогенетического разнообразия микробиома служит вид возделываемого растения, вторым по значимости — известкование. Систематическое применение минеральных удобрений не имело заметного влияния на филогенетическую структуру микробиома почвы. При этом микробиомы почв, засеянных различными растениями, неодинаково реагируют на известкование (7).
Особый интерес представляет структура почвенного микробиома под озимой рожью. Это одна из немногих сельскохозяйственных культур, которую можно выращивать бессменно на протяжении десятилетий. Она имеет мощную корневую систему, сопоставимую с биомассой наземной части растений и достигающую 6 т/га (8). Общая площадь корней составляет около 6 тыс. м2, а их поверхность превышает поверхность наземной части в 130 раз (9). Корневые выделения достигают, по оценке некоторых авторов, 21 % от синтезируемой массы растений (10). Корневые выделения озимой ржи и ткани растений включают органические кислоты, сахара, глюкозиды циклических производных гидроксамовой кислоты, а также продукты их вторичной трансформации аглюканы и производные бензокси-золинона (11-13). Производные гидроксамовой кислоты и продукты их трансформации обладают гербицидными, фунгицидными и инсектицидными свойствами, обеспечивая защиту культуры от фитопатогенных грибов и ее высокую конкурентоспособность с сорняками (14-16). Это предполагает значительное влияние озимой ржи на почвенный микробиом.
E. Kurek с соавт. (17) показали, что численность прокариот в ризосфере озимой ржи выше, чем в почве. По их данным, в почве и в ризосфере растений преобладают грамположительные бактерии. Другие исследователи отмечают, что практически у всех полевых культур в ризосфере расие-ний, особенно в раннем возрасте, доминируют грамотрицательные бактерии (2, 9). По данным А.О. Зверева с соавт. (18), филогенетическая структура прокариот и их разнообразие в ризосфере озимой ржи в возрасте 42 сут и в парующей почве практически не различаются. И.Г. Широких с соавт. (19) обнаружили в ризосфере ржи значительное количество актиномицетов, видовая структура и численность которых изменялась в течение онтогенеза растений. Доминирующее положение занимали стрептомицеты. Данные о длительном влиянии культуры ржи на почвенную микрофлору отсутствуют.
В настоящей работе впервые представлены данные о филотипиче-ской структуре и разнообразия прокариотических микроорганизмов в почве при выращивании ржи в бессменной культуре в шестипольном севообороте на протяжении почти 100 лет (долголетний многофакторный полевой опыт, МСХА им. К.А. Тимирязева). Полученные результаты свидетельствуют, что растение служит основным фактором формирования почвенного прокариотического сообщества.
Нашей целью была оценка влияния разных агротехник (севообо- рот, известкование) в условиях длительного полевого опыта на филогенетическую структуру микроорганизмов в посевах ржи.
Методика . Образцы почвы отбирали в 2010 году на участке многолетнего опыта РГАУ—МСХА им. К.А. Тимирязева, который был расположен на территории площадью около 1,5 га с уклоном 1 ° на северо-запад на моренной равнине в южной части Клинско-Дмитровской возвышенности. Высота над уровнем моря — 162 м, среднее количество осадков — около 600 мм в год, из них примерно половина приходилась на май—август, среднегодовая температура — 4,1 ° С. Почва дерново-подзолистая, песчаный крупно-пылеватый суглинок, старопахотная (более 200 лет под пашней) (20). Для филогенетического анализа комплекса прокариотических микроорганизмов в почве использовали делянки, засеянные озимой рожью ( Secale cereale L.), которая выращивалась в бессменной культуре и шестипольном севообороте с 1912 года. Севооборот включал чистый пар, озимую рожь, картофель, ячмень с подсевом клевера, клевер первого года пользования, лен. На опытные делянки ежегодно вносили минеральные удобрения, общий объем которых за годы исследований (1912-2009) составлял по азоту — 5820 кг, фосфору — 7990 кг, калию — 6716 кг/га. (20).
Почвенные пробы отбирали в фазу колошения озимой ржи на глубину пахотного горизонта А1 (0-20 см) в 5 повторностях, из которых составляли средний образец, который тщательно перемешивали
При выделении ДНК из образца почвы навеску (0,2 г) помещали в эппендорф объемом 2 мл, добавляли равный объем стеклянных шариков диаметром 0,1 мм («Innomed», Венгрия), 350 мкл раствора А (20 мM натрий-фосфатный буфер, 240 мM изотиоцианат гуанидина, рН 7,0), 350 мкл раствора Б (500 мM Трис-НCl, 1 % SDS, pH 7,0) и 400 мкл смеси фенола с хлороформом. Пробирку помещали в гомогенизатор FastPrep-24 («MP Biomedicals», США) и разрушали пробу в течение 10-15 мин. Затем центрифугировали при 10000-15000 g в течение 5 мин, отбирали водную фазу. После гомогенизации к образцу приливали 400 мкл хлороформа, интенсивно встряхивали на вортексе в течение 1 мин, центрифугировали при тех же условиях, что и на предыдущей стадии, отбирали водную фазу. К неочищенному экстракту ДНК добавляли равный объем изопропилового спирта, вортексировали, центрифугировали, дважды промывали 70 % этанолом, сушили на воздухе. Осадок растворяли в 100 мкл воды при 65 ° С в течение 15 мин.
ДНК очищали от примесей электрофорезом в 1 % агарозном геле. Вырезанный блок агарозы, содержащий ДНК, помещали в эппендорф (1,5 мл), добавляли 2 объема раствора В (3 М изотиоцианат гуанидина, 20 мM Трис-HCl , 20 мг/мл Тритона X-100, рН 7,0) и инкубировали при температуре 65 ° С до полного растворения блока. К раствору добавляли 20 мкл раствора Г (раствор В с добавлением окиси кремния, 40 мг/мл), перемешивали и инкубировали 5 мин при комнатной температуре, периодически встряхивая. Затем центрифугировали при 10000-15000 g в течение 1 мин, полностью убирали супернатант, осадок суспендировали в 200 мкл раствора Д (25 % этанола, 25 % изопропанола, 100 мM NaCl, 10 мM Трис-HCl, рН 7,0), центрифугировали при 10000-15000 g в течение 1 мин, удаляли супернатант, осадок ресуспендировали в этаноле, снова центрифугировали в течение 1 мин и удаляли супернатант. Осадок подсушивали на воздухе в течение 15 мин, добавляли 50 мкл элюирующего буфера (10 мM Трис-HCl, 1 мM EDTA, рН 8,0) и встряхивали на вортексе в течение 30 мин. После этого образцы центрифугировали и отбирали супернатант, избегая попадания окиси кремния в очищенный препарат ДНК.
Выделенная тотальная почвенная ДНК служила матрицей для секвенирования нуклеотидных последовательностей. Использовали универсальные праймеры к вариабельному участку V4 гена 16S рРНК (F515 — 5´-GTGCCAGCMGCCGCGGTAA-3´, R806 — 5´-GGATACVSGGGTAT-CTAAT-3´) с добавлением олигонуклеотидных идентификаторов для каждой пробы и служебных последовательностей, необходимых для высокопроизводительного секвенирования по протоколу «Roche» (Швейцария). Подготовку проб и секвенирование проводили на приборе GS Junior («Roche», Швейцария) согласно рекомендации производителя. Таксономическую идентификацию последовательностей ДНК и сравнительный анализ микробных сообществ выполняли с использованием VAMPS (Visualization and Analysis of Microbial Population Structure) . Дополнительно для расширенной филогенетической характеристики последовательностей также пользовались базой данных RDP (Ribosomal Database Project, .
Результаты . Агрохимическая характеристика почвы на дату отбора почвенных образцов представлена в таблице.
Агрохимическая характеристика дерново-подзолистой почвы на участках многолетнего опыта под посевами озимой ржи (опытное поле РГАУ—МСХА им. К.А. Тимирязева, г. Москва, 2010 год)
|
Вариант опыта |
N общ. , % |
P 2 O 5 , мг/100г |
K 2 O, мг/100г |
С общ. , % |
рН сол. |
Сумма обменных оснований, мг-экв/100г |
|
Рожь севооборот |
0,090 |
31,45 |
4,25 |
0,79 |
4,2 |
8,00 |
|
Рожь севооборот + известь |
0,098 |
31,85 |
4,63 |
0,93 |
5,7 |
7,75 |
|
Рожь бессменно |
0,112 |
53,80 |
24,70 |
1,28 |
4,6 |
8,63 |
|
Рожь бессменно + известь |
0,095 |
53,70 |
21,51 |
0,98 |
6,1 |
8,25 |
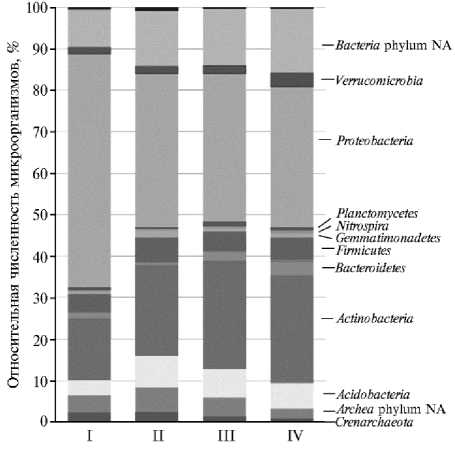
Рис. 1. Таксономическое разнообразие прокариотических микроорганизмов дерново-подзолистой почвы (на уровне фил) на участках многолетнего опыта под посевами озимой ржи в зависимости от технологии выращивания: I — в севообороте с известкованием почвы, II — в севообороте без известкования почвы, III — бессменная культура с известкованием почвы, IV — бессменная культура без известкования почвы (опытное поле РГАУ—МСХА им. К.А. Тимирязева, г. Москва, 2010 год).
При высокопроизводительном пиросеквенировании амплифицированной ДНК из почвенных образцов в составе микробного сообщества дерново-подзолистой почвы под посевами озимой ржи выявили 16 фил бактерий и 2 филы архей. Доминирующее положение занимали две бактериальные филы — Proteobacteria (от 34 до 56 %) и Actinobacteria (от 15 до 26 %). Филы Acidobacteria и Firmicutes составляли от 3,5 до 7,5 %, а археи — от 3,0 до 8,5 % от общего числа прокариотических микроорганизмов (рис. 1).
В составе почвенного прокариотического сообщества было выявлено около 300 родов микроорганизмов. Из них всего у 41 (что не превышало 13 % от общего числа таксонов) ча- стота была более 1 % (рис. 2). Во всех вариантах опыта встречались 12 родов, независимо от технологии выращивания озимой ржи (севоборот, бессменная культура, известкование). По-видимому, они составляли коровый комплекс прокариот, характерный для исследованного типа почвы под посевами озимой ржи. В этом комплексе доминировали бактерии, относящиеся к филам Protobacteria и Actinobacteria, а также неидентифицируе-мая бактерия (см. рис. 2). Доминирующее развитие этих таксонов в ризосфере озимой ржи наблюдали другие авторы (2, 18), с чем согласуются результаты наших исследований.
Во всех вариантах опыта доминирующее положение среди про-теобактерий занимал род Rhizobium . Филогенетически Rhizobium очень близок к родам Agrobacterium и Allorhizobim , входящим в семейство Rhizobiaceae , которые в настоящее время объединены в филогенетическую группу Rhizo-bium—Agrobacterium . Более того, J.M. Young с соавт. (21) на основании филогенетического сходства предложили объединить эти бактерии в один род — Rhizobium . Полученные нами результаты о доминирующем положении
Ранг
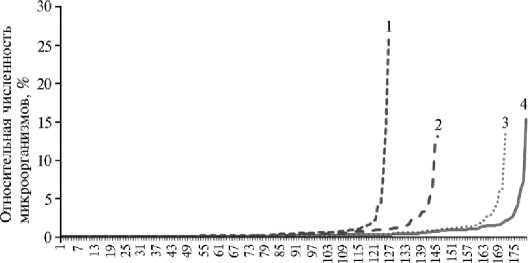
Рис. 3. Кривые доминирования (разнообразия) прокариотного комплекса в дерново-подзолистой почве на участках многолетнего опыта под посевами озимой ржи в зависимости от технологии выращивания: 1 — в севообороте с известкованием почвы, 2 — в севообороте без известкования почвы, 3 — бессменная культура с известкованием почвы, 4 — бессменная культура без известкования почвы
(опытное поле РГАУ—МСХА им. К.А. Тимирязева, г. Москва, 2010 год).
бактерий рода Rhizobium в почве под покровом озимой ржи следует рассматривать, по меньшей мере, как доминирующее положение бактерий группы Rhizobium—Agrobacterium , учитывая степень их родства и разрешающую способность используемого нами метода.
Значительное количество микроорганизмов из этой группы в почве и ризосфере растений отмечали многие авторы. По мнению М. Садовски с соавт. (22), клубеньковые бактерии ( Rhizobium sp. и Bradirhizobium sp.) достаточно широко распространены и составляют до 8,0 % от общего количества бактерий в почве. О наличии представителей Rhizobiaceae , в том числе клубеньковых бактерий, в ризосфере и корнях злаковых культур сообщалось в ряде работ (18, 23, 24). Некоторые исследователи называют клубеньковые бактерии эндофитами злаковых культур (25-27). А.О. Зверев с соавт. (18) на основе филогенетического анализа обнаружили в ризосфере 42-суточной культуры озимой ржи клубеньковые бактерии рода Mezo-rhizobium , относящиеся к этому семейству. Ни в одном случае не был вы-влен патогенез озимой ржи, вызванный Agrobacterium tumifaciens (28).
Наличие семейства Rhizobiaceae в почве под посевами озимой ржи в длительных опытах, по нашему мнению, объясняется тем, что в условиях шестипольного севооборота два поля были заняты клевером. Клубеньковые бактерии, присутствующие в посевах клевера, пережили период, когда почва была занята предшественниками озимой ржи (лен, чистый пар), и нашли благоприятные условия для своего развития под покровом этой культуры. Последнее с биологической точки зрения представляет интерес для оценки адаптации и выживаемости клубеньковых бактерий в агроценозах.
Что касается бессменной культуры ржи, то следует отметить, что перед закладкой опыта 100 лет назад это поле было несколько лет занято клевером (20). Кроме того, бактерии рода Rhizobium могут существовать в почве, не фиксируя атмосферный азот. Возможно, клубеньковые бактерии адаптировались и прижились в ризосфере растений как ассоциативные эндосимбионты. Наличие такой ассоциации с зерновыми колосовыми культурами клубеньковых бактерий Bradirhizobium sp., Agrobacterium sp., Rhizobium sp. отмечено в других работах (25, 27). Нельзя исключить и то, что в бессменной культуре ржи за 100 лет сформировалась своя микрофлора, важным компонентом которой стали бактерии семейства Rhizobiaceae . Отсюда вытекает интерес для глубокого анализа эволюции взаимоотношений Rhizo-biaceae с зерновыми культурами, в частности с озимой рожью, и прикладное значение этих исследований. Так, на основе непатогенной Agrobacterium radiobacter уже созданы биопрепараты, которые успешно используются на посевах злаковых культур (29).
Известкование практически не оказывало влияния на видовое богатство в посевах бессменной ржи, но резко снижало его в севообороте (см. рис. 3). Мы не обнаружили прямой зависимости биоразнообразия прокариот от величины рН. Крупные таксоны на уровне фил присутствовали во всех вариантах опыта. Изменение филогенетической структуры прокариот наблюдались на уровне рода, вида и штамма микроорганизмов. Так, при известковании снижалась относительная численность одних видов ацидобактерий, но увеличивалось количество других, что свидетельствует о перегруппировке таксономического состава прокариот. Это несколько противоречит традиционной точке зрения о безусловном положительном влиянии известкования кислых почв на микрофлору (30, 31). Однако следует отметить, что в последние годы накоплен материал, который дает противоречивую оценку действия известкования на сообщество почвенных микроорганизмов. Если по данным одних авторов (32, 33) известкование повышало биомассу микроорганизмов и интенсивность дыхания почвы, то другие исследователи (34) показали, что изменения рН красноземов как в кислую, так и в щелочную сторону приводило к снижению биомассы микроорганизмов. В работе N. Kennedy с соавт. (35) наряду с увеличением микробиологической активности при известковании наблюдалось изменение филогенетической структуры и снижение разнообразия бактериального сообщества почвы. Неодинаковое действие известкования на филогенетическое разнообразие прокариот под покровом разных растений отмечали И.О. Корвиго с соавт. (7). В частности, в звене севооборота картофеля и льна (предшественников озимой ржи) известкование приводило к снижению разнообразия прокариот, что соответствует результатам наших исследований.
Таким образом, анализ филогенетической структуры и разнообразия прокариотических микроорганизмов дерново-подзолистой почвы в условиях многолетней культуры ржи показал, что растение служит основным фактором формирования прокариотического сообщества. Независимо от агротехнических приемов, под покровом озимой ржи в фазу колошения складывается одинаковый по структуре коровый комплекс прокариот, включающий небольшое число видов протеобактерий и актинобактерий. Доминирующее положение среди них занимают бактерии семейства Rhizo-biaceae , в частности род Rhizobium , входящий в филогенетическую группу Rhizobium—Agrobacterium , что в определенной степени связано с историей опытного поля. По-видимому, бактерии этого семейства, прежде всего клубеньковые, находят в ризосфере ржи благоприятные условия для развития. Влияние известкования на структуру сообщества прокариот кислых почв может быть разным. Существенное значение, по-видимому, имеет конкретный вид растений, а также история поля (севооборот, бессменная культура, система удобрений и т.д.). Дальнейшие исследования жизнеспособности Rhizobiaceae в посевах озимой ржи и их эволюции в сторону ассоциативных эндосимбиотических взаимоотношений с растениями ржи в процессе длительного совместного существования представляют несомненный научный интерес.
Авторы выражают глубокую благодарность заведующему кафедрой земледелия и опытного дела РГАУ—МСХА им. К.А. Тимирязева профессору М.А. Мазирову и профессору Н.Ф. Хохлову за помощь и предоставленную возможность отбора почвенных образов на поле длительного многофакторного опыта, заложенного А.Г. Дояренко в 1912 году.
Список литературы Филогенетическая структура сообщества прокариот дерново-подзолистой почвы под озимой рожью не зависит от агротехнических приемов
- Добровольский Г.В., Никитин Е.Д. Экология почв. Учение об экологических функциях почв. М., 2012.
- Prashar P., Kapoor N., Sachdeva S. Rhizosphere: its structure, bacterial diversity and significance. Reviews in Environmental Science and Bio/Technology, 2014, 13(1): 63-77 ( ) DOI: 10.1007/s11157-013-9317-z
- Minz D., Ofek M., Hadar Y. Plant rhizosphere microbial communities. In: The prokaryotes: prokaryotic communities and ecophysiology/E. Rosenberg, E.F. DeLong, S. Lory, E. Stacke-brandt, F. Thompson (eds.). Springer, Berlin, Heidelberg, 2013: 57-84.
- Bulgarelli D., Schlaeppi K., Spaepen S., Ver Loren van Themaat E., Schulze-Lefert P. Structure and function of bacterial microbiota of plants. Annu. Rev. Plant Biol., 2013, 64: 807-838 ( ) DOI: 10.1146/annurev-arplant-050312-120106
- Garbeva P., van Veen J.A., van Elsas J.B. Microbial diversity in soil: selection of microbial populations by plant and soil type and implications for disease suppressiveness. Annu. Rev. Phytopathol., 2004, 42: 243-270 ( ) DOI: 10.1146/annurev.phyto.42.012604.135455
- Мазиров М.А., Арефьева В.А. Краткий обзор результатов научных исследований в мировых длительных полевых опытах. В cб.: Длительный полевой опыт 1912-2012 г. Теоретические и технологические основы воспроизводства плодородия почв и урожайность сельскохозяйственных структур. М., 2012: 23-31.
- Корвиго И.О., Першина Е.В., Иванова Е.А., Матюк Н.С., Савоськина О.А., Чирак Е.Л., Проворов Н.А., Андронов Е.Е. Оценка длительного воздействия агротехнических приемов и сельскохозяйственных культур на почвенные микробные сообщества. Микробиология, 2016, 85(2): 199-210.
- Стихин М.Ф., Денисов П.В. Озимая рожь и пшеница в Нечерноземной полосе. Л., 1977.
- Красильников Н.А. Микроорганизмы почвы и высшие растения. М., 1958.
- Marschner H. Mineral nutrition of higher plants. Academic Press, London, 1995.
- Niemeyer H.M., Perez F. J. Potential of hydroxamic acids in the control of cereal pests, diseases and weeds. In: Allelopathy: organisms, processes and applications (American Chemical Society Symposium Series No. 582)/K.M.M.D. Inderjit, F.A. Einhelling (eds.). American Chemical Society, Washington DC, 1995: 261-270.
- Li X.F., Ma J.F., Matsumoto H. Pattern of aluminum-induced secretion of organic acids differs between rye and wheat. Plant Physiol., 2000, 123(4): 1537-1544 ( ) DOI: 10.1104/pp.123.4.1537
- Niemeyer H.M. Hydroxamic acids derived from 2-hydroxy-2h-1,4-benzoxazin-3(4h)-one: key defense chemicals of cereals. J. Agr. Food Chem., 2009, 57(5): 1677-1696 ( ) DOI: 10.1021/jf8034034
- Pérez FJ, Ormenoñuñez J. Difference in hydroxamic acid content in roots and root exudates of wheat (Triticum aestivum L.) and rye (Secale cereale L.): possible role in allelopathy. J. Chem. Ecol., 1991, 17(6): 1037-1043 ( ) DOI: 10.1007/BF01402932
- Rice C.P., Park Y.B., Adam F., Abdul-Baki A.A., Teasdale J.R. Hydroxamic acid content and toxicity of rye at selected growth stages. J. Chem. Ecol., 2005, 31(8): 1887-1905 ( ) DOI: 10.1007/s10886-005-5933-6
- Мельников Н.Н. Пестициды. Химия, технология применения. М., 1987.
- Kurek E., Machowicicz Z., Kulpa D., Slomka A. The microorganisms of rye (Secale cereale L.) rhizosphere. Acta Microbiologica Polonica, 1994, 43(2): 251-255.
- Зверев А.О., Першина Е.В., Проворов Н.А., Андронов Е.Е., Серикова Е.Н. Метагеномная характеристика ризосферного эффекта при выращивании злаковых в черноземной и дерново-подзолистой почве. Сельскохозяйственная биология, 2016, 51(5): 654-663 ( ) DOI: 10.15389/agrobiology.2016.5.654rus
- Широких И.Г., Мерзаева О.В. Комплекс актиномицетов в ризосфере озимой ржи на дерново-подзолистой почве. Микробиология, 2005, 74(2): 271-275.
- Мазиров М.А., Сафонов А.Ф. Длительный полевой опыт РГАУ-МСХА: сущность и этапы развития. Известия МСХА, 2010, 2: 68-75.
- Young J.M., Kuykendall L.D., Martínez-Romero E., Kerr A. A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allorhizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R. rhizogenes, R. rubi, R. undicola and R. vitis. Int. J. Syst. Evol. Micr., 2001, 51: 89-103 ( ) DOI: 10.1099/00207713-51-1-89
- Садовски М., Грэм П. Почвенная биология Rhizobiaceae. В кн.: Rhizobiaceae: молекулярная биология бактерий, взаимодействующих с растением/Пер. под ред. И.А. Тихоновича, Н.А. Проворова. СПб, 2002: 101-117.
- Höflich G., Tauschke M., Kühn G., Werner K., Frielinghaus M., Höhn W. Influence of long-term conservation tillage on soil and rhizosphere microorganisms. Biol. Fert. Soils, 1999, 29(1): 81-86 ( ) DOI: 10.1007/s003740050528
- Mia M., Shamsuddin Z. Rhizobium as a crop enhancer and biofertilizer for increased cereal production. Afr. J. Biotechnol., 2010, 9(37): 6001-6009.
- Cocking E.C. Endophytic colonization of plant roots by nitrogen-fixing bacteria. Plant Soil, 2003, 252(1): 169-175 ( ) DOI: 10.1023/A:1024106605806
- Yanni Y.G., Rizk R.Y., Corich V., Squartini A., Ninke K., Philip-Hollingsworth S., Orgambide G., de Bruijn F., Stoltzfus J., Buckley D., Schmidt T.M., Mateos P.F., Ladha J.K., Dazzo F.B. Natural endophytic association between Rhizobium leguminosarum bv. trifolii and rice roots and assessment of potential to promote rice growth. Plant Soil, 1997, 194(1-2): 99-114 ( ) DOI: 10.1023/A:1004269902246
- Robinson R., Fraaije B., Clark I., Jackson R., Hirsch P. Mauchline T. Endophytic bacterial community composition in wheat (Triticum aestivum) is determined by plant tissue type, developmental stage and soil nutrient availability. Plant and Soil, 2015, 405(1-2): 381-396 ( ) DOI: 10.1007/s11104-015-2495-4
- Schroth M.N., Thomson S.V., Weinhold A.R Behavior of plant pathogenic in rhizosphere and non rhizosphere soils. In: Ecology of root pathogens/S.V. Krupa, Y.R. Domergues (eds.). Elsevier Scientific Publishing Company, Amsterdam, Oxford, NY, 1979: 105-138.
- Биопрепараты в сельском хозяйстве: методология и практика применения микроорганизмов в растениеводстве и кормопроизводстве/Под ред. И.А. Тихоновича, Ю.В. Круглова. М., 2005.
- Мишустин Е.Н. Микроорганизмы и плодородие почвы. М., 1956.
- Пошон Ж., Де Баржак Г. Почвенная микробиология. М., 1960.
- Небольсин А.Н., Небольсина З.П. Известкование почв. СПб, 2010.
- Mühlbachová G., Tlustoš P. Effects of liming on the microbial biomass and its activities in soils long-term contaminated by toxic elements. Plant Soil Environ., 2006, 52(8): 345-352.
- Chen G.C., He Z. Effects of pH on microbial biomass -C and -P in red soils. In: The red soils of China/M.J. Wilson, Z. He, X. Yang (eds.). Springer, Dordrecht, 2004: 307-314.
- Kennedy N., Brodie E., Connolly J., Clipson N. Impact of lime, nitrogen and plant species on bacterial community structure in grassland microcosms. Environ. Microbiol., 2005, 7(6): 780-788 ( ) DOI: 10.1111/j.1462-2920.2005.00748.x


