Филогенетический анализ цистатинов — потенциальных иммунорегуляторов из секретомов (экскреторно-секреторных продуктов) и транскриптомов паразитов семейства Diphyllobothriidae
Автор: Васина В.М., Кутырев И.А., Дугаров Ж.Н., Мазур О.Е.
Журнал: Природа Внутренней Азии @nature-inner-asia
Рубрика: Биология
Статья в выпуске: 3 (32), 2025 года.
Бесплатный доступ
В настоящее время усилился интерес к использованию иммунорегуляторов паразитов для лечения аутоиммунных заболеваний. В статье отдельно рассматриваются цистатины как потенциальные иммунорегуляторы цестод лентеца чаечного Dibothriocephalus dendriticus (плероцеркоид и половозрелая стадия), лентеца широкого D. latus, ремнеца Ligula interrupta. В результате исследования были идентифицированы цистатины в транскриптомах и секретомах цестод семейства Diphyllobothriidae. В ходе исследования проводится поиск гомологов в секретомах и транскриптомах, построение филогенетического дерева. Ожидается, что цистатины дифиллоботриид будут образовывать отдельные клады, демонстрируя видоспецифичные особенности, и сохранять ключевые аминокислотные остатки, ответственные за ингибирование цистеиновых протеиназ хозяина. Результаты позволят оценить эволюционную адаптацию этих молекул и их потенциал в качестве мишеней для терапии или средств иммунорегуляции.
Потенциальные иммунорегуляторы, цестоды, цистатин
Короткий адрес: https://sciup.org/148332425
IDR: 148332425 | УДК: 595.121:577.112 | DOI: 10.18101/2542-0623-2025-3-6-22
Текст научной статьи Филогенетический анализ цистатинов — потенциальных иммунорегуляторов из секретомов (экскреторно-секреторных продуктов) и транскриптомов паразитов семейства Diphyllobothriidae
Изучение цестод играет важную роль для медицины и ветеринарии, так как они способны вызывать тяжелые заболевания у человека и животных. Понимание их жизненных циклов и механизмов передачи инфекции является важным для разработки эффективных мер профилактики, а также идентификация паразитарных иммунорегуляторных молекул имеет большую значимость для медицины. Изучение механизмов действия этих молекул может способствовать разработке инновационных терапевтических стратегий для лечения болезней. Цестоды, или ленточные черви, — это организмы, которые претерпели глубочайшие эволюционные изменения, способствующие адаптации к паразитическому образу жизни. Особенностью цестод является полное отсутствие пищеварительной системы и наличие высокой плодовитости. Тело в основном беловатого цвета, узкое, лентовидное, плоской формы. Длина цестод варьируется от 0,6 мм до 30 м. В теле цестод в основном дифференцируют сколекс, который несет разные типы органов прикрепления, зону роста (шейка) и стробилу, которая состоит из члеников — проглоттид [Гаевская, 2017].
Цестоды (ленточные черви) обладают сложноорганизованным покровом — тегументом, который играет ключевую роль в адаптации к паразитизму. Этот метаболически активный орган выполняет множество функций (барьерно-защитная, пищеварительно-абсорбционная, опорная, секреторная, экскреторная и осмо-регуляторная) и обеспечивает обмен веществами с хозяином [Kutyrev et al., 2020].
На примере двух семейств плероцеркоидов показаны особенности их тегумента:
-
1) Diphyllobothriidae: содержимое наружного синцитиального слоя тегумента плероцеркоидов представлено вакуолями, гранулами, дисковидными, пластинчатыми (ламеллярными) телами и митохондриями. Вакуоли бывают электронно-прозрачными или могут содержать электронно-плотное вещество, частично заполняющее их;
-
2) Ligulidae: присутствие на их поверхности плероцеркоидов регулярно повторяющихся пальцеобразных выростов наружной цитоплазмы тегумента. Длина всех исследованных видов достигает 2 мкм, на поперечных срезах эти виды имеют округлую или продолговатую форму. Выросты сужены у основания и покрыты наружной плазматической мембраной тегумента. Пальцеобразные выросты и поверхность тегумента между ними несут многочисленные микротрихии с трубчатой базальной и сильно вытянутой апикальной частями. Слой наружного синцития лигулид весьма развит и заполнен плотными гранулами в виде коротких палочек, вакуолями и мелкими митохондриями [Kutyrev et al., 2020].
Железистые аппараты цестод присутствуют на всех стадиях онтогенеза и играют ключевую роль во взаимоотношениях паразита и хозяина. Разделяют два основных типа экзокринных желез: фронтальные (железы проникновения с самостоятельными протоками) и тегументальные (одно- или многоядерные, чей секрет поступает в наружную цитоплазму тегумента).
Фронтальные железы — специализированные образования, которые имеют самостоятельные секреторные протоки. По своей функции они играют роль желез проникновения. Тегументальные железы могут состоять из одной клетки или иметь синцитиальное строение. Данные железы образуются из покровных клеток и входят в их состав; их секрет поступает по отросткам клеток в слой наружной цитоплазмы тегумента сколекса [Kutyrev et al., 2020].
Существуют разные механизмы выведения секреторного материала из тела цестод:
-
1. Макроапокриновый способ связан с накоплением секрета в крупных выростах дистальной цитоплазмы тегумента. Секреция происходит путем частичного или полного разрушения этих выростов, что приводит к единовременному выбросу значительного объема материала в окружающую среду.
-
2. Микроапокриновый способ характеризуется тем, что секрет равномерно заполняет дистальную цитоплазму. Выход осуществляется путем образования многочисленных мелких выпячиваний наружной мембраны, включающих фрагмент цитоплазмы и несколько секреторных гранул. Затем выпячивания отшнуровываются.
-
3. Мерокриновый способ характерен для фронтальных желез. Секреторные протоки желез пронизывают тегумент и выделяют секрет в окружающую среду без разрушения клетки или ее мембраны.
У семейства Diphyllobothriidae (например, Dibothriocephalus dendriticum) секрет выводится по мерокриновому и микроапокриновому типам. В некоторых случаях эти механизмы могут сочетаться, выведение секрета из тела червей в окружающую среду значительно ускоряется и облегчается. У плероцеркоидов Dibothriocephalus dendriticum фронтальные железы локализуются, главным образом, в области сколекса, реже в передней трети тела. У Dibothriocephalus dendriticum выявлены «зеленые» (фронтальные) и «золотистые» (связанные с нейросекрецией) железы. У представителей семейства Ligulidae (Ligula intestinalis, Schistocephalus solidus) железы расположены вдоль всего тела; у L. interrupta они не изучены [Kutyrev et al., 2020].
Секрет желез обладает многофункциональными свойствами, обеспечивающими проникновение и защиту от иммунитета хозяина. При химическом анализе было выявлено, что секрет тегументальных желез — это нейтральный гликопро-теидовый комплекс, не связанный с пищеварением [Давыдов, 1979, 1981; Пронина и др., 1985]. Тегумент также обладает защитными свойствами: адсорбирует антитела [Befus, 1977], участвует в антигенной мимикрии [Damian, 1964; Robinson et al., 2011] и супрессии Th1-иммунного ответа [Terrazas et al., 1998; Spolski et al., 2000; Siracusano et al., 2008].
Исследования показали, что воздействие иммунной сыворотки хозяина усиливает активность секреции желез у Eubothrium rugosum (Batsch, 1786) и Bothriocephalus acheilognathi Yamaguti, 1934 [Давыдов, 1981], а имплантация в полость тела рыб у E. rugosum и B. acheilognathi [Давыдов и др., 1988]. Это может быть связано со стадией зрелости и обитанием в агрессивной среде кишечника.
У разных видов цестод по-разному выражена способность к самостоятельному пищеварению. Изучение протеиназ показало, что различия определяются интенсивностью обменных процессов хозяина. Наиболее выраженной протеолитической активностью обладают цестоды, которые обитают в птицах, наименьшей — паразиты рыб [Добровольский и др., 1978]
Ленточные черви — облигатные эндопаразиты, обеспечивающие подходящие условия в организме хозяина для своего развития. При обитании в облигатных хозяевах паразиты лучше приспособлены и отличаются повышенной плодовитостью. Цестоды способны выживать в кишечниках различных хозяев, включая человека и животных1.
В некоторых эндемичных регионах по своему эпидемиологическому и эпизоотическому значению цестодозы выходят на первый план среди остальных гельмин-тозов. На территории России ежегодно дифиллоботриозом заболевает более 6 тыс. человек [Информационный сборник, 2001, 2010, 2014]. В ряде северных районов Сибири и в Прибайкалье, включая Республику Бурятия, основным возбудителем дифиллоботриоза человека и животных является лентец чаечный Dibothriocephalus dendriticus Nitzsch, 1824 [Сердюков, 1979; Пронин и др., 2009].
Паразиты являются мощными регуляторами иммунной системы своих хозяев. Чтобы выжить и размножаться, им необходимо уклоняться от иммунного ответа организма хозяина. Для этого паразиты используют следующие механизмы:
-
1. Ингибирование активности иммунных клеток: паразиты способны выделять молекулы, подавляющие активацию Т-лимфоцитов и других клеток иммунной системы.
-
2. Модуляция воспалительного ответа: некоторые паразиты могут изменять уровень провоспалительных цитокинов, что в результате приводит к снижению воспалительной реакции.
-
3. Изменение экспрессии молекул адгезии: этот механизм позволяет паразитам избежать захвата фагоцитами.
Эти механизмы помогают паразитам эффективно уклоняться от иммунного ответа хозяев и обеспечивать свою выживаемость.
Изучение экскреторно-секреторных продуктов (E/S) и транскриптомов этих организмов помогает получить необходимую информацию о механизмах их взаимодействия с хозяином и вероятных путях модуляции иммунного ответа.
Цистатин — это ингибитор цистеиновых протеаз, который наиболее изучен с точки зрения его иммуномодулирующей функции в организме хозяина [Khatri et al., 2020]. Встречающиеся в природе цистатины являются внутриклеточными ингибиторами цистеиновых протеаз, распространенными во всех живых организмах — от простейших до млекопитающих. Цистатины часто локализуются в эндосомах и лизосомах [Bird et al., 2009], а также можно найти в ядре, цитозоле, клеточной мембране или вне клеток [Prunk et al., 2016].
Цистатины принимают участие в важных физиологических процессах, а также влияют на иммунные процессы (обработку и презентацию антигенов, миграцию иммунных клеток, активацию toll-подобных рецепторов и секрецию цитокинов), заживление ран, ремоделирование костной ткани, остеогенез и резорбцию, процессинг протеинов и развитие заболеваний [Lenarcic et al., 1988]. На основании экспрессии, локализации, структурных вариаций и физиологических функций цистатины делят на три основных семейства: цистатины 1-го типа, или стефины (цистатины A и B), цистатины 2-го типа (цистатины C, E и S) и цистатины 3-го типа, или кининогены [Prunk et al., 2016].
Кроме того, цистатины могут участвовать в регуляции лизосомальных катепсинов и в защитных механизмах против микробных и паразитарных инфекций. Цистатины паразитов, как и другие иммуномодулирующие молекулы, играют важнейшую роль в установлении активного паразитизма у хозяев. Они вырабатываются паразитами для подавления иммунного ответа хозяина, чтобы паразит мог выжить в организме хозяина. Механизм, при участии которого цистатины паразитов могут подавлять иммунный ответ хозяина, включает в себя ингибирование процессинга и презентации антигенов в антигенпрезентирующих клетках, подавление пролиферации Т-клеток, регуляцию рецепторов распознавания образов и опосредованную рецепторами модуляцию макрофагов и дендритных клеток путем высвобождения супрессивных цитокинов [Khatri et al., 2020].
Цистатины других цестод были испытаны как противовоспалительные средства на разных лабораторных животных и культурах клеток. Цистатины паразитов были использованы в экспериментах на мышиных моделях для проверки терапевтического эффекта при хроническом колите [Togre et al., 2018], артрите [Liu et al., 2016], диабете [Yan et al., 2020], астме [Schnoeller et al., 2008], аллергии на пыльцу трав [Danilowicz-Luebert et al., 2013]; на культуре дендритных клеток для проверки противовоспалительных свойств при аллергическом воспалении дыхательных путей у мышей [Coronado et al., 2019].
Целью исследования является изучение цистатинов — белков, способных ингибировать сериновые протеазы, в роли потенциальных иммунорегуляторов у паразитов семейства Diphyllobothriidae. Информация о данном белке и его роли в иммунорегуляции у паразитических червей широко доступна в научной литературе и является одной из важных тем в изучении механизмов иммунного уклонения паразитов. Однако по цистатинам цестод информация отсутствует. В отличие от предыдущих исследований внимание акцентировано на сравнительный анализ цистатинов разных видов с использованием актуальных методов биоинформатики и молекулярной биологии. Это позволяет выявить уникальные молекулы, которые, вероятно, могут быть использованы в разработке инновационных лечебных стратегий против инфекций, спровоцированных ленточными червями.
Материалы и методы
Омуль Coregonus migratorius Georgi, 1775 был отловлен в оз. Байкал в Кабан-ском районе Республики Бурятия; карась серебряный Carassius auratus gibelio Bloch, 1783 — в оз. Никиткино в Кабанском районе, щука Esox lucius Linnaeus, 1758 — в оз. Гусиное в Селенгинском районе; чайка серебристая Larus argentatus Pontoppidan, 1763 была добыта в Кабанском районе на основании разрешений на добычу (вылов) биологических ресурсов.
Плероцеркоидов Dibothriocephalus latus (Linnaeus, 1758) извлекали из полости тела щуки, плероцеркоидов D. dendriticus (Nitzsch, 1824) из полости тела омуля, половозрелых D. dendriticus из кишечника чайки, плероцеркоидов Ligula interrupta (Rudolphi, 1810) из полости тела карася, затем их промывали в 0,65 %-ном растворе хлорида натрия. Плероцеркоидов Dibothriocephalus dendriticus и Ligula interrupta помещали в инкубационную среду. Средняя масса анализируемых плероцеркоидов Dibothriocephalus dendriticus составляет 50 мг, Ligula interrupta — 4,9 г. Инкубационная среда включала в себя раствор Хенкса (Биолот, Россия) и сыворотку крови омуля в соотношении 1 : 1 (пенициллин 105 МЕ/л), линкомицин (100 мг/л) [Давыдов и др., 1988; Kutyrev et al., 2014]. Инкубация паразитов проводилась в чашках Петри. При комнатной температуре время инкубации составляло 6 часов. Соотношение массы плероцеркоидов и объема инкубационной среды составляло 150 мг / 2 мл. Каждый эксперимент был проведен в трехкратной повторности. По окончании среда, в которой инкубировались плероцеркоиды, фиксировалась жидким азотом для протеомных исследований [Яременко и др., 1999]. Для транс-криптомных исследований плероцеркоидов Dibothriocephalus dendriticus, D. latus, Ligula interrupta и половозрелых D. dendriticus после извлечения из полости тела немедленно фиксировали жидким азотом [Kutyrev et al., 2020].
Поиск цистатинов проводился в транскриптомах и секретомах цестод семейства Diphyllobothriidae:
-
1) в транскриптоме и секретоме лентеца чаечного Dibothriocephalus dendriticus на личиночной стадии развития и в транскриптоме половозрелой стадии;
-
2) в транскриптоме плероцеркоидов лентеца широкого D. latus ;
-
3) в транскриптоме и секретоме плероцеркоидов лигулы Ligula interrupta .
Общую РНК из 0,5–1,0 г ткани выделяли с помощью реагента TRIzol (Ambion) и очищали с одновременной обработкой ДНКазой I на колонках PureLink RNA Mini (Invitrogen). Качество РНК определяли на биоанализаторе BA2100 с использованием набора RNA Nano Kit. Все полученные образцы секвенировались на платформе Illumina NextSeq550 с использованием набора NextSeq® 550 High Output Kit v2 (300 циклов) в режиме парно-концевого чтения по 150 b.p.
Полученные в результате секвенирования мРНК последовательности формата fastq были предварительно обработаны с помощью программы Scythe v0.9944 BETA (2016) для удаления адапторных последовательностей и Sickle v1.210 [Joshi NA, Fass JN, 2011] для удаления низкокачественных последовательностей (оценка качества Phred>30). Предварительно обработанные последовательности были подвергнуты процедуре сборки de novo с помощью Trinity v.2.8.5 [Grabherr et al., 2011] с параметрами по умолчанию. Сборка выполнялась на 36-ядерном сервере с 256 ГБ оперативной памяти [Sidorova et al., 2022].
Проводилось измерение концентрации общего белка методом с бицинхониновой кислотой. Для измерения концентрации общего белка в качестве стандарта использовали водный раствор бычьего сывороточного альбумина (БСА) в концентрации 0,5, 1, 2, 5, 10, 25, 50 мкг/мкл. К 30 мкл стандартных растворов БСА и экспериментальных образцов добавляли 1 мл реагента, содержащего 1 %-ный водный раствор натриевой соли бицинхониновой кислоты, 2 % Na2CO3, 0,16 % тартрата натрия, 0,4 % NaOH и 0,95 % NaHCO3, рН =11,25, 20 мкл 4 %-ного водного раствора CuSO4. Далее растворы перемешивали и инкубировали при 56°С в течение 20 минут на термошейкере Termomixer comfort (Eppendorf, Germany). Построение калибровочной кривой по стандартным растворам альбумина и измерение концентрации общего белка в экспериментальных образцах проводили при помощи бес-кюветного спектрофотометра NanoDrop ND-1000 (Thermo Fisher Scientific, USA) при длине волны 562 нм в трехкратной повторности.
Концентрирование и отмывка образца: 7 пробирок объединяли в концентрирующую пробирку (5К) объемом 10,2 мл. Образец промывали три раза по 200 мкл буфера 50 мМ ТЭАБ (pH = 8,5) и концентрировали 10 раз до объема 1 мл. После концентрирования образца проводили повторное измерение концентрации белка, как описано выше.
Для идентификации отдельных белков, содержащихся в секреторно-экскреторных продуктах (СЭП), было произведено разделение белков СЭП при помощи высокоэффективной жидкостной хроматографии. Масс-спектрометрический анализ проводили на гибридном орбитальном масс-спектрометре. Обработку масс-спектров и идентификацию белков по полученным масс-спектрам проводили при помощи программы Mascot или SearchGUI v.3.3.7 с использованием поискового алгоритма X!Tandem по базе данных Uniprot с ограничением по виду искомого организма. Для функциональной аннотации идентифицированных белков использовали сервис InterPro v.70.0 (European Bioinformatics Institute), в котором доступна информация о доменах, GO-терминах и принадлежности к семействам белков на основе первичной структуры изученных белков. Помимо этого функциональная аннотация белков выполнялась с помощью встроенных биоинформатических алгоритмов программ FunctionAnnotator, Blast2GO, QuickGO.
Проведен сравнительный анализ найденных нами цистатинов с гомологами близких видов, других паразитов. Для поиска гомологов использовались базы данных NCBI и UniProt. Для филогенетического анализа были собраны последовательности цистатина из различных организмов, включая представителей Diphyllobothriidae и других таксонов (табл. 1). Множественное выравнивание последовательностей было проведено с помощью программы MEGA5. В этой же
В. М. Васина, И. А. Кутырев, Ж. Н. Дугаров, О. Е. Мазур. Филогенетический анализ цистатинов — потенциальных иммунорегуляторов из секретомов и транскриптомов паразитов семейства Diphyllobothriidae программе было построено филогенетическое дерево с использованием метода максимального правдоподобия (Maximum Likelihood), позволяющего интерпретировать филогенетические связи. MEGA5 перебирает возможные деревья и находит топологию, способную дать максимальную вероятность объяснения данных, используя поисковые алгоритмы. Поддержка бутстрэппинга была получена в результате 1 000 повторений [Bouzid et al., 2013]. Для последующего построения и редакции филогенетического дерева была использована программа FigTree.
Виды паразитов для филогенетического анализа цистатина
Таблица 1
|
№ |
Название паразита |
Промежуточные хозяева |
Конечные хозяева |
База данных |
География организма |
|
1 |
Opisthorchis viverrini |
моллюски, рыбы |
человек и другие млекопитающие |
NCBI |
Юго-Восточная Азия |
|
2 |
Trichobilharzia genti |
моллюски |
птицы |
NCBI |
Европа |
|
3 |
Dicrocoelium dendriticum |
моллюски / наземные мухи |
человек / домашние животные (коровы, овцы, козы, свиньи) / дикие животные |
NCBI |
Европа |
|
4 |
Calicophoron daubneyi |
моллюски |
крупный рогатый скот / овцы / козы, реже другие парнокопытные |
NCBI |
Европа |
|
5 |
Clonorchis sinensis |
моллюски |
человек / рыбы и водные животные |
UniProt |
Китай |
|
6 |
Schistosoma mekongi |
моллюски |
человек |
NCBI |
Некоторые регионы ЮгоВосточной Азии |
|
7 |
Schistosoma haematobium |
моллюски |
человек |
NCBI |
Африка и некоторые регионы Ближнего Востока |
|
8 |
Fasciolopsis buski |
моллюски |
человек / реже свиньи и другие млекопитающие |
NCBI |
Азия |
|
9 |
Paragonimus westermani |
моллюски / морские ракообразные |
человек / реже дикие и домашние млекопитающие |
UniProt |
Китай, Япония, Корея и Филиппины |
|
10 |
Spirometra erinaceieuropaei |
водные ракообразные / мелкие позвоночные |
человек / реже другие млекопитающие |
NCBI |
Азия, Европа |
Продолжение табл. 1
|
№ |
Название паразита |
Промежуточные хозяева |
Конечные хозяева |
База данных |
География организма |
|
11 |
Rodentolepis nana |
– |
человек |
UniProt |
Европа |
|
12 |
Hydatigena taeniaeformis |
грызуны |
кошки / другие хищные животные |
UniProt |
По всему миру |
|
13 |
Schistocephalus solidus |
конусообразные ракообразные / маленькие пресноводные рыбы |
птицы / реже млекопитающие / человек |
NCBI |
Европа |
|
14 |
Hymenolepis diminuta |
клещи / грызуны |
человек / грызуны / другие млекопитающие |
NCBI |
Индия |
|
15 |
Mesocestoides corti |
мухи |
кошки / собаки / другие хищные млекопитающие / редко человек |
UniProt |
Европа |
|
16 |
Taenia asiatica |
свиньи |
человек / дикие или домашние свиньи, реже другие млекопитающие |
NCBI |
Китай, Корея и Вьетнам |
|
17 |
Taenia solium |
свиньи |
человек |
UniProt |
По всему миру |
|
18 |
Taenia saginata |
крупный рогатый скот (быки) |
человек |
NCBI |
По всему миру |
|
19 |
Echinococcus multilocularis |
мелкие грызуны |
лисы / собаки / кошки / реже человек |
NCBI |
Северная Америка, Европа, Азия |
|
20 |
Echinococcus granulosus |
овцы / крупный рогатый скот / свиньи / козы / лошади |
кошки / собаки / волки / шакалы / реже человек |
NCBI |
По всему миру |
|
21 |
Diphyllobothrium dendriticum |
пресноводные ракообразные / рыбы |
чайки / человек |
UniProt |
По всему миру |
|
22 |
Dibothriocephalus latus |
пресноводные ракообразные / рыбы |
чайки / человек |
Скандинавия, Россия, Северная Америка, Прибалтика |
|
|
23 |
Ligula interrupta |
планктонные ракообразные / рыбы |
чайки / человек |
Россия |
Результаты и обсуждение
Нами начата комплексная работа по идентификации паразитарных имму-норегуляторных белков. Одно из первых семейств белков, с которых был начат поиск, — это цистатины. По литературным данным, они являются иммунорегуляторами и, как свидетельствуют экспериментальные данные, способны совершать ингибирующие действия по отношению к цистеиновым протеазам. Цистатин играет важную роль во взаимодействии паразитов с иммунной системой хозяев. Он помогает паразитам избежать иммунного ответа и подавить активацию и функционирование иммунных клеток, что помогает паразитам выживать и размножаться в организме хозяев, а это, в свою очередь, может привести к хроническим заболеваниям и другим патологиям.
Нами были идентифицированы цистатины:
-
1) в транскриптомах лентеца чаечного Dibothriocephalus dendriticus на личиночной (плероцеркоиды из полости тела байкальского омуля, оз. Байкал) и половозрелой (из кишечника серебристой чайки, оз. Байкал) стадиях развития. В секре-томе цистатины не обнаружены;
-
2) транскриптоме плероцеркоида лентеца широкого Dibothriocephalus latus (из полости тела щуки, оз. Гусиное).
-
3) транскриптоме и секретоме плероцеркоида лигулы Ligula interrupta (из полости тела карася серебряного, Кабанский район).
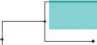
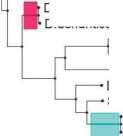
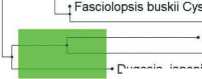
Далее было проведено множественное выравнивание полученных последовательностей. На основе выравниваний построено филогенетическое дерево методом максимального правдоподобия (Maximum Likelihood) (рис. 1).
При анализе филогенетического дерева было выявлено, что белковые последовательности цистатинов группируются в несколько отдельных клад. Последовательности цистатинов, выявленные нами в транскриптомах и секретомах цестод, расположены в кладах 1 и 2 вместе с цистатинами других цестод. Следует отметить, что некоторые цистатины цестод сгруппировались с цистатинами свобод-ноживущих плоских червей (клада 4). Это может свидетельствовать о древности данных белков, о том, что они существовали еще у последнего общего предка паразитических плоских червей и современных свободноживущих. В то же время цистатины трематод сгруппированы в отдельную кладу 3, что свидетельствует о том, что дивергенция этих классов плоских червей произошла достаточно давно и накоплено достаточно большое количество мутаций в генах — ортологах, кодирующих эти белки.
Стоит отметить, что цистатины цестод разделились на три отдельные клады (1, 2, и 4). Это говорит о достаточно большом различии между данными группами белков. Кроме того, часто цистатины от одного вида цестод попадают в разные клады. Это говорит о том, что в одном организме может синтезироваться несколько видов цистатинов. Наличие разных классов цистатинов подтверждается Khatri et al. (2020). Исследования показали, что выявлены три типа цистатинов. Цистатины 1-го типа, известные как стефины, являются преимущественно внутриклеточными белками, которые ненадолго появляются в жидкостях организма [Zavasnik-Bergant, 2008]. Цистатины 2-го типа секретируются в виде одноцепочечных белков длиной около 120 аминокислот, содержат два консервативных дисульфидных мостика и N-концевую сигнальную последовательность [Turk et al., 2012]. Цистатины
3-го типа (кининогены) — это наиболее сложные цистатины, состоящие из трех доменов 2-го типа [Prunk et al., 2016].
-------•Taenia_asiatica_Cystatin_domain-containing_protein_tr|A0A0R3W7W1|
R Echinococcus_multilocularis_Proteinase_inhibitor_l25_cystatin_tr|A0A068Y8P6|
Echinococcus_granulosus_Proteinase_inhibitor_l25_cystatin_tr|U6IWA4| enia_asiatica_Cystatin_tr|A0A0R3VU33|
—• D.dendriticus_pler_TRINITY_DN3488_cO_g3J1 ,p1
D.dendriticus_pler_TRINITY_DN583_cO_g1_i2.p1
_ - Dibothriocephalus_latus_unnamed_protein_product_VDK34788.1
D.dendriticus_pler_TRINITY_DN583_cO_g1_i3.p1
Dibothriocephalus_latus_unnamed_protein_partial_product_VDN40052.1
Mesocestoides_corti_Cystatin_domain-containing_protein_tr|A0A5K3FGM9|
Clade 1
D.dendriticus_pler_TRINITY_DN3488_cO_g1_i1.p1
D.dendriticus_pler_TRINITY_DN856_cO_g1_i1.p1
D.dendriticus_pler_TRINITY_DN856_cO_g1_i2.p1
I—• Hymenolepis_diminuta_Cystatin_domain-containing_protein_tr|A0A0R3S7S0|
*-----• Rodentolepis_nana_Cystatin_domain-containing_protein_tr|A0A0R3T3G3|
-----•Schistocephalus_solidus_Cystatin_domain-containing_protein_tr|A0A183TN85|
Dibothriocephalus_latus_unnamed_protein_product_VDN09860.1
Schistocephalus_solidus_Cystatin_domain-containing_protein_tr|A0A183TPG4|
Dibothriocephalus_latus_Uncharacterized_protein_tr|A0A3P7LTB4| Dibothriocephalus_latus_unnamed_protein_product_VDN14203.1
r Taen ia_asiatica_Stefin_tr|A0A088FW30|
J------------• Mesocestoides_corti_Cystatin_tr|A0A5K3G3E11
|* Hydatigena_taeniaeformis_Cystati_domain-containing_protein_tr|A0A0R3X0L9|
T aenia_solium_Stefin_tr|A0A088FZ58|
4 I-------------------• Echinococcus_granulosus_Uncharacterized_protein_tr|W6UF12|
-
■ Ech i nococcus_m u Iti locu la ris_Cystati n_B_Stefi n_B_tr| A0A087VZV0|
-
■ Echinococcus_granulosus_Cystatin_B_Stefin_B_tr|U6JAU0|
-
— ^ Taenia_saginata_Stefin_tr|A0A088FUU7|
__— Rodentolepis_nana_Cystatin_domain-containing_protein_tr|A0A0R3TRZ9|
^ Hymenolepis_diminuta_Cystatin_domain-containing_protein_tr|A0A564YUG3|
{ Spirometra_erinaceieuropaei_Cysteine_protease_inhibitor_tr|A0A067XIP6|
Schistocephalus_solidus_Cystatin-B_tr|A0A0X3NVK11
D.dendriticus_adult_TRINITY_DN5863
_t Protein_1_ligula_interrupta
-
• L.interrupta_pler_TRINITY_DN22508
Dibothriocephalus_latus_unnamed_protein_product_VDN13077.1
D.dendriticus_pler_TRINITY_DN4214_cO_g1_i1.p1
D.latus_pler_TRINITY_DN2679
D.latus_pler_TRINITY_DN6610
Clade 2
------------------------------------• Rodentolepis_nana_Cystatin_domain-containing_protein_tr|A0A0R3T8P0|
-
— Opisthorchis viverrini hypothetical protein T265 02376 XP 009164873.1:52-164
-
’ Clonorchis sinensis Chain A Cystatin-1 5ZC1 A:39-136
Paragonimus westermani hypothetical protein P879 09965 KAF8568187.1:7-122
-
• Dicrocoelium dendriticum unnamed protein product CAH8636706.1:1-99
-----• Calicophoron daubneyi unnamed protein product CAL5132209.1:28-126
-
• Schistosoma mekongi hypothetical protein MN116 008182 KAK4468002.1:5-113
j---• Trichobilharzia regenti unnamed protein product CAH8860489.1:3-100
— Schistosoma haematobium hypothetical protein MS3 00009291 XP051065064.1:5-101
tin-BKAA0196976.1:1-99
----------- Hydatigena_taeniaeformis_Cystatin_domain-containing_protein_tr|A0A0R3WWB0|
Clade 3
Schistocephalus_solidus_Cystatin_domain-containing_protein_tr|A0A183SMR11 -------• Schmidtea_mediterranea_Cysteine_protease_tr|A0A1 W6I183|
DugesiaJaponica_Cysteine_protease_tr|A0A1Q0XEW5|
Clade 4
Рис. 1. Филогенетическое дерево по цистатину
В целях доказательства наличия различных цистатинов в одном организме мы проанализировали соответствующие аминокислотные последовательности циста-тинов. Множественное выравнивание белковых последовательностей одного вида паразитов показало, что в организме одного паразита может синтезироваться несколько различных цистатинов. Из рисунка 2 видно, что у паразита Taenia asia-tica выявлено четыре разных цистатина. Далее из рисунка 3 можно наблюдать, что у паразита Echinococcus granulosus выявлено три разных белка. А у Echinococcus multilocularis выявлено два разных цистатина (рис. 4).
Taenia_asiatica_Stefin_tr|A0A088FW30|
Taenia_asiatica_Cystatin_domain-containing_protein_tr|A0A0R3W7W1I
Taenia_asiatica_Cystatin_tr|A0A0R3VU33|
Taenia_asiatica_Cystatin_domain-containing_protein_trIA0A0R3WFI6I
Taenia_asiatica_Stefin_tr|A0A088FW3O|
Taen ia_asiatica_Cystatin_domain-containing_protein_tr|A0A0R3W7W11
Taenia_asiatica_Cystatin_tr|A0A0R3VU33I
Taenia_asiatica_Cystatin_domain-containing_protein_tr|A0A0R3WFI6|
Taenia_asiatica_Stefin_trIA0A088FW30|
Taenia_asiatica_Cystatin_domain-containing_protein_trIA0A0R3W7W1|
Taenia_asiatica_Cystatin_tr|A0A0R3VU33|
Taenia_asiatica_Cystatin_domain-containing_protein_tr|A0A0R3WFI6|
Taenia_asiatica_Stefin_trIA0AO88FW3OI
Taenia_asiatica_Cystatin_domain-containing_protein_tr|A0A0R3W7W1|
Taen ia_asiatica_Cystatin_t r|A0A0R3VU331
Taenia_asiatica_Cystatin_domain-containing_protein_tr|A0A0R3WFI61
Taen ia_asiatica_Stef in_tr|A0AO88FW3O|
Taenia_asiatica_Cystatin_domain-containing_protein_tr|A0A0R3W7W1|
Taen ia_asiatica_Cystatin_t rIA0A0R3VU331
Taenia_asiatica_Cystatin_domain-containing_protein_tr|A0A0R3WFI6|
Taenia_asiatica_Stefin_trIA0A088FW301
Taenia_asiatica_Cystatin_domain-containing_protein_tr|A0A0R3W7W1|
Taenia_asiatica_Cystatin_tr|A0A0R3VU33|
Taenia_asiatica_Cystatin_domain-containing_protein_trIA0A0R3V/FI6|
------------------------------MPMCGGLSASVQPSDEDKQRLTP 23
----------------------------------------MSEEEE 6
MNWSVLLLLSYLTAISLACTSCKSQERRVIPPPSKGLVGGITPITEEDMNEIMFQDALTE 60
....................................MRSSIAHSDSAQLTQRFFHGVENA24
V-- - -VKDYITQQTGQEPSEVKIAEVSRQLVNGINHFLKVEHGGSVWHIR-VHEALPCYG78
...........................................................E7
V-- --MKNLDEANECHSFRLVRVIEATKQVVAGMKYWKLEVTPIYSNENDEECLKPCYL116
VLIAASKYVEARNEKA------------------TFLVELEVS 49
SKIEVHSH-------------------KVAA----------AGDPLTY 97
GLSEEQEEDIFTKLQPHRSKG------EVAEGGRGFSGEIKNGGPYTVNLGAPAVDIMNR61
GLSGNKEATATILLQPWREPKHHITFNPNSDGS----ADFSKGGRLVSSCDLPEWTILSP17:
---ST-RRLLLVFSPLWVQPML 67
------- 97
MVITFLDCQQHLDSEEEWRAWCDSNGCPTMAENYELFVLEMCERSSRHNLFQAVRMRYNI122
EEIKSGRFQQA................................................V18г
------------------------------------------------------------
----------------F-------------------------- 98
DVNISEKPNAENMHFYYNVTLTGDTKDSLVAAVNYLVSFAPKEFKIHLCTPCDYRMNDSL 183
QSSIESLNENADRCFRYEFKDVIEGRRHMSSSLNYEW-----------------TMKVNR 227
------------------------------------------------------------ 67
--------------------------------------------------- 98
IPESAIEQYIGAGLDEECEEEECEEEEE------NDN-------------- 212
IYDESMPNCVGACAD-ECSGIEIYRASAFVSPPQSGTPKILNIEYKGPAAL 277
................................................... 67
Рис. 2. Множественное выравнивание аминокислотных последовательностей цистатинов цестоды Taenia asiatica
Echinococcus_granulosus_Proteinase_inhibitor_I25_cystatin_trIU6IWA4|
Echinococcus_gianulosus_Uncharactexized_protein_tr|W6UF12|
Echinococcus_granulosus_Cystatin_B_Stefin_B_tr|U6JAU0|
Echinococcus_granulosus_Proteinase_inh ibitor_I25_cystatin_tr|U6IWA41 Echinococcus_granulosus_Uncharacterized_protein_tr|W6UF12|
Echinococcus_granulosus_Cystatin_B_Stefin_B_tr|U6JAU0|
Echinococcus_granulosus_Proteinase_inhibitor_I25_cystatin_tr|U6IWA4| Echinococcus_granulosus_Uncharacterized_protein_tr|W6UF12|
Echinococcus_gxanulosus_Cystatin_B_Stefin_B_trIU6JAU0I
Echinococcus_gianulosus_Pioteinase_inh ibitor_I25_cystatin_tr|U6IWA41
Echinococcus_granulosus_Uncharacterized_protein_tr|W6UF12|
Echinococcus_granulosus_Cystatin_B_Stefin_B_trIU63AU0I
Echinococcus_granulosus_Proteinase_inhibitor_I25_cystatin_tr|U6IWA4| Echinococcus_granulosus_Uncharacterized_protein_tr|W6UF12|
Echinococcus_gxanulosus_Cystatin_B_Stefin_B_tr|U6JAU0|
Echinococcus_granulosus_Proteinase_inhibitor_I25_cystatin_tr|U6IWA4|
Echinococcus_granulosus_Uncharacteiized_protein_tr|W6UF12|
Echinococcus_granulosus_Cystatin_B_Stefin_B_trIU6JAU0|
MNRFVLLFLSFLVAISLACRQQERSVAVPSSRGIVGGITPITKEDMNEMMFQDALTEVMK 60 ---------------------------MPVCSGLSASVQPSDEDK-------QHLTPWK 26 - - - ------------------------MPMCGGLTTSVRPSDEDK-------QLLTPVIK26
:*.*: .:* ::. :***:*
NLDEVNECHSFRLVKVIEATQQVVAGMKYWKLEVTP......-IYSSDNGEECSKPCYH 113
DYLTKQLGQEPSVVKITEVSRQIVNGTNHFLKTMIIFGMFEFMWLYL-AMESIATGPTIG 85 DYIAQQLGQEPSEVKITEVSRQIVNGTNHFLKVEHDGN----CWHVR-VHEAL---PCYG 78 : ::. **:*.::*:**::.:**
GLSG.....................NKQAIAAIVYQPWRDPKHHITFKPNNEGSADFSKN152
SVDQLGHFHSTRTVRRSRVMQSIPGHGTTSNCFTVDPLRDSGGQTTAQAQT----TPTPN 141
GKVE---VHSHK----------VASVGDPLTYF 98
GKLITSCEL - - - PEGTILSPKEMTSE--------QFQEWRSGIERL......DRNASRC 195
AGLRVLCILMQLPLSRAVGQADIRAYVRLHVNPALVRHLRGANLSRVKSDIAGDSHGGTC 201 98
FRYELMD-----VI----------EGKRMMTSNLKYEW.....---RMKVKRIYDESMLG 232
ILGPLVNSRVMYLLHPSPTPPTEEEKKRLLPPVEEYMQSVLGQVPGDIELLELVSEMDRG 261 98
CIGACADDCSGIEIYRASAFASPFHGGTPEILSI--EYQDPTAL---274
CFYGVKV-KFGEQLWHMQLYHSPIIYGIDIIALKHHAAQEDERLHPY307
............................................... 98
Рис. 3. Множественное выравнивание аминокислотных последовательностей цистатинов цестоды Echinococcus granulosus
Echinococcus_multiloculaxis_Cystat in_B_Stefin_B_tr|A0A087VZV01 Echinococcus_multilocularis_Proteinase_inhibitor_I25_cystatin_tr|A0A068Y8P6|
Echinococcus_multiloculaxis_Cystatin_B_Stefin_B_tr|A0A087VZV0|
Echinococcus_multiloculaxis_Pxoteinase_inhibitor_I25_cystatin_tx|A0A068Y8P6|
Echinococcus_multiloculaxis_Cystatin_B_Stefin_B_trIAOA087VZV0|
Echinococc us_mult iloculaxis_Prot einase_inh ibitor_I25_cystatin_trIA0A068Y8P61
Echinococcus_multiloculaxis_Cystatin_B_Stefin_B_txIA0A087VZV0I
Echinococcus_multiloculaiis_Pioteinase_inhibitoi_I25_cystatin_ti|A0A068Y8P6|
Echinococcus_multilocularis_Cystatin_B_Stefin_B_tr|A0A087VZV0|
Echinococcus_multiloculaiis_Pioteinase_inhibitoi_I25_cystatin_tx|A0A068Y8P6|
-------------------------------MPMCGGLTTSVRPSNEDKQ---LLTPWK 26
MNRFVLLFLSFLVAVSIACRQQERSVAVSSPRGIVGGITPITKEDMNEMMFQDALTEVMK 60 : **:* .: . :: ** *:*
DYIAQQLGREPSEVKITEVSRQIVNGTNHFLKVE--------HDGNCWHVRVHEALPCYG 78
GKVEVHSHKVASVGDPL-------TYF--........-...................... 98
NLSGNKQAIAAWYQPWRNPKHHITFKPNNEGSADFSKNGKLITSCELREGTILSSKEMT 173
............................................................ 98
SKQFQEMVRSGIERLDRNASRCFRYELMDVIEGKRMMTSNLKYEWRMKVKRIYDESMPGC 233
......................................... 98
IGACADDCSGIEIYRASALASMFHGGAPEILSIEYQDPTAL 274
Рис. 4. Множественное выравнивание аминокислотных последовательностей цистатинов цестоды Echinococcus multilocularis
Синтез нескольких видов цистатинов для паразита, возможно, необходим для более высокого уровня выживаемости в условиях хозяина. Так как паразит способен синтезировать несколько видов цистатинов, это может способствовать увеличению шансов на более эффективное подавление ответа иммунной системы хозяина. Данный подход, возможно, помогает паразиту более гибко и надежно обходить механизмы защиты организма хозяина, что в результате способствует его выживанию и размножению. Эксперименты по этому вопросу еще не проводились, но логически можно предполагать, что наличие нескольких видов цистати-нов приводит к повышению вероятности успешной иммуносупрессии и помогает паразиту избегать ответа иммунной системы хозяина.
Далее проводилось выравнивание последовательностей разных видов паразитов, которые оказались в одной кладке в филогенетическом дереве (рис. 5, 6).
|
Echinococcus_multiloculaiis_Cystatin_B_Stefin_B.tr1AOA087VZV01 Echinococcus.granulosus_Cystatin_B_Stefin_B_tr|U6JAU0| |
MPMCGGLTTSVRPSNEDKQLLTPWKDYIAQQLGREPSEVKITEVSRQIVNGTNHFLKVE MPMCGGLTTSVRPSDEDKQLLTPVIKDYIAQQLGQEPSEVKITEVSRQIVNGTNHFLKVE **************:*********:*********:************************* |
60 60 |
|
|
Echinococcus_multiloculaiis_Cystatin_B_Stefin_B_tr|A0A087VZV0| |
HDGNCWHVRVHEALPCYGGKVEVHSHKVASVGDPLTYF |
98 |
|
|
Echinococcus_granulosus_Cystatin_B_Stefin_B_tr|U63AU0I |
HDGNCWHVRVHEALPCYGGKVEVHSHKVASVGDPLTYF |
98 |
|
Рис. 5. Множественное выравнивание аминокислотных последовательностей цистатинов у цестод Echinococcus granulosus и E. multilocularis
Оказалось, что у разных видов паразитов могут синтезироваться гомологичные цистатины.
Заключение
Таким образом, результаты показали, что один вид паразитов может синтезировать разные типы цистатина. Предположительно это способствует лучшему уклонению от иммунной системы хозяина. Также было выявлено, что разные виды паразитов могут синтезировать гомологичный цистатин, что может свидетельствовать о наличии консервативных последовательностей у цестод.
|
Echinococcus_multiloculaiis_Pioteinase_inhibitoi_I25_cystatin_tiIA0A068Y8P6I |
MNRFVLLFLSFLVAVSIACRQQERSVAVSSPRGIVGGITPITKEDMNEMMFQDALTEVNK |
60 |
|
Echinococcus_granulosus_Proteinase_inhibitor_I25_cystatin_tr|U6IWA4| |
MNRFVLLFLSFLVAISLACRQQERSVAVPSSRGIVGGITPITKEDMNEMMFQDALTEVNK **************:*:*********** * ***************************** |
60 |
|
Echinococcus_multiloculaiis_Proteinase_inhibitor_I25_cystatin_tr|A0AO68Y8P6| |
NLDEVNECHSFRLVEVIEATQQVVAGMKYWKLEVTPIYSSDNDEECLKPCYLNLSGNKQ |
120 |
|
Echinococcus_granulosus_Proteinase_inhibitor_I25_cystatin_tr|U6IWA4| |
NLDEVNECHSFRLVKVIEATQQVVAGMKYWKLEVTPIYSSDNGEECSKPCYHGLSGNKQ **************:****************************.*** **** .****** |
120 |
|
Echinococcus_multilocularis_Proteinase_inhibitor_I25_cystatin_trIA0A068Y8P6I |
AIAAWYQPWRNPKHHITFKPNNEGSADFSKNGKLITSCELREGTILSSKEMTSKQFQEM |
180 |
|
Echinococcus_granulosus_Proteinase_inhibitor_I25_cystatin_tr|U6lWA4| |
AIAAIVYQPWRDPKHHITFKPNNEGSADFSKNGKLITSCELPEGTILSPKEMTSEQFQEV ****:******:***************************** ****** *****:****: |
180 |
|
Echinococcus_multiloculaiis_Proteinase_inhibitor_I25_cystatin_trIA0AO68Y8P6I |
VRSGIERLDRNASRCFRYELMDVIEGKRMMTSNLKYEWRMKVKRIYDESMPGCIGACADD |
240 |
|
Echinococcus_granulosus_Proteinase_inhibitor_I25_cystatin_tr|U6IWA4| Echinococcus_multilocularis_Proteinase_inhibitor_I25_cystatin_tr|A0A068Y8P6| Echinococcus_granulosus_Proteinase_inhibitor_I25_cystatin_tr|U6IWA4| |
VRSGIERLDRNASRCFRYELMDVIEGKRMMTSNLKYEWRMKVKRIYDESMLGCIGACADD ************************************************** ********* CSGIEIYRASALASMFHGGAPEILSIEYQDPTAL 274 CSGIEIYRASAFASPFHGGTPEILSIEYQDPTAL 274 ***********:** ****:************** |
240 |
Рис. 6. Множественное выравнивание аминокислотных последовательностей цистатинов у цестод Echinococcus granulosus и E. multilocularis
Полученные результаты можно использовать для дальнейших исследований в области получения инновационных терапевтических стратегий для лечения болезней. Так как информации об иммунорегуляторных белках в классе Cestoda крайне мало, то результаты настоящего исследования имеют фундаментальное значение и могут служить основой для более глубокого изучения тонких механизмов регуляции плероцеркоидами иммунной системы хозяина.


