Филогенетическое разнообразие нитрилутилизирующих бактерий содового шламохранилища и их некоторые физиолого-биохимические особенности
Автор: Сыровацкая Г.А., Максимов А.Ю., Максимова Ю.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2025 года.
Бесплатный доступ
Исследовано филогенетическое разнообразие нитрилутилизирующих бактерий содового шламохранилища. Галоалкалотолерантные изоляты, полученные при использовании ацетамида и ацетонитрила в качестве единственных источников углерода, идентифицированы методом секвенирования 16S рДНК. Определено, что изоляты принадлежат к филумам Actinomycetota (родам Arthrobacter, Microbacterium, Rhodococcus) и Pseudomonadota (родам Acinetobacter, Ensifer, Pseudomonas, Rhizobium). Установлено, что изоляты обладают нитрилгидратазной и амидазной активностью и содержат гены амидаз двух типов, а также Fe-содержащей нитрилгидратазы. Не обнаружено нитрилазной активности и генов нитрилаз, Co-содержащих нитрилгидратаз и энантиоселективных амидаз. Изоляты способны формировать биопленки. Показано, что биомасса биопленок увеличивается при снижении температуры роста.
Гидролиз нитрилов, нитрилутилизирующие бактерии, содовое шламохранилище, биопленки, алкалофилы, галофилы, галоалкалотолерантные бактерии, нитрилгидратаза, амидаза
Короткий адрес: https://sciup.org/147252078
IDR: 147252078 | УДК: 579.22 : 579.26 | DOI: 10.17072/1994-9952-2025-3-279-288
Текст научной статьи Филогенетическое разнообразие нитрилутилизирующих бактерий содового шламохранилища и их некоторые физиолого-биохимические особенности
Изучение микробного разнообразия экстремальных биотопов как естественного, так и антропогенного происхождения имеет большую перспективу для развития фундаментальной науки и биотехнологий. К щелочным и/или высокоминерализованным искусственным средам относятся щелочные сточные воды, солеот-валы, хранилища содового шлама. Содовые шламохранилища – это складированные на открытых полигонах отходы производства кальцинированной соды. Содовый шлам имеет щелочную реакцию (рН 11), содержит главным образом хлорид кальция, в нем практически отсутствуют питательные вещества, необходимые микроорганизмам, при этом он нестерилен. Методом метагеномного секвенирования было показано, что в содовом шламе обитают представители филумов Firmicutes, Proteobacteria, Bacteroidetes, Actinobacteria, Acidobac-teria, Verrucomicrobia и некоторых других [Шилова, Максимов, Максимова, 2020].
Способность микроорганизмов к гидролизу нитрилов активно изучается на протяжении последних нескольких десятилетий. Это связано с использованием нитрилгидролизующих микроорганизмов в биотехнологиях, в частности как биокатализаторов синтеза акриламида из акрилонитрила, никотинамида из 3-цианопиридина, и с перспективой получения различных производных амидов и карбоновых кислот в фарминдустрии и химической промышленности [Debabov, Yanenko, 2011]. При этом появление нитрилутилизирующих прокариотов в биотопах естественного происхождения может не быть связано с загрязнением синтетическими нитрилами. Цианогликозиды, синтезируемые растениями, обусловливают распространение нитрилутилизирующих бактерий в природе [Egelkamp, 2019].
Утилизация нитрилов микроорганизмами может происходить двумя метаболическими путями: одностадийным, при гидролизе нитрилазой (КФ 3.5.5.1) до соответствующих карбоновых кислот, и двустадийным, гидратацией нитрилов до амидов нитрилгидратазой (КФ 4.2.1.84) с последующим гидролизом до карбоновой кислоты амидазой (КФ 3.5.1.4). Биокатализатором этого процесса может быть как фермент, так и целая микробная клетка. Биокатализаторы, используемые в промышленности, в основном нейтрофильны, хотя возникает интерес к нитрилутилизирующим бактериям, выделенным из экстремальных биотопов, т. к. они могут быть полезны при осуществлении цельноклеточного катализа в жестких условиях: при повышенной температуре, крайних значениях рН, в присутствии органических растворителей.
Есть немногочисленные примеры выделения нитрилгидролизующих прокариотов из экстремальных сред. Natronocella acetinitrilica gen. nov. sp., способный к утилизации ацетонитрила как источника углерода и азота при экстремально высоком рН и среднем уровне минерализации, был выделен из осадка содового озера [Sorokin et al., 2007a]. Консорциум, состоящий из нового представителя актинобактерий и гаммапротеобактерий рода Marinospirillum , осуществлял утилизацию изобутиронитрила при рН 10 [Sorokin et al., 2007b]. Представитель рода Halomonas, выделенный из засоленных содовых почв, утилизировал 2-фенилпропионитрил в качестве источника азота при рН 10 [Chmura et al., 2008]. Облигатно алкало-фильный галотолерантный штамм Bacillus alkalinitrilicus sp. nov., растущий в присутствии изобутиронитрила, был выделен из солончаковой почвы [Sorokin, Van Pelt, Tourova, 2008]. Алкалотолерантный штамм R. pyridinivorans NIT-36, продуцирующий нитрилгидратазу, был выделен из горячего источника [Singh et al., 2017]. Выделены не только прокариотические, но и эукариотические микроорганизмы, способные к трансформации нитрилов в экстремальных условиях. «Черные дрожжи» Exophiala oligosperma R1 растут при pH 4, используя фенилацетонитрил в качестве единственного источника углерода, азота и энергии [Rustler et al., 2008]. Cолеустойчивый штамм дрожжей Meyerozyma guilliermondii LM2, способный конвертировать бензонитрил в среде, содержащей до 1.5 М NaCl, был выделен из подводных отложений [Serra et al., 2019]. Галофильные и галотолерантные микроорганизмы, утилизирующие нитрилы, могут функционировать как биокатализаторы в присутствии органических растворителей при низкой активности воды. Внутриклеточные ферменты алкалофилов часто проявляют наибольшую активность в нейтральном диапазоне рН, однако алкало- и галотолерантные нитрилутилизирующие бактерии могут служить цельноклеточным биокатализатором в условиях, отличающихся от физиологических.
Загрязненные среды антропогенного происхождения могут быть источником выделения штаммов, устойчивых как к высоким концентрациям токсикантов, так и к экстремальным воздействиям окружающей среды. Кроме этого, такие микроорганизмы обычно обладают механизмами неспецифической устойчивости, которые позволяют им приспосабливаться к воздействию самых разных неблагоприятных факторов. В связи с этим изучение филогенетического разнообразия нитрилутилизирующих бактерий в таком биотопе, как содовое шламохранилище, представляется достаточно важным. Целью настоящей работы явилось выделение и идентификация нитрилутилизирующих бактерий, изучение их биохимических свойств и способности к биопленкообразованию под воздействием неблагоприятных факторов окружающей среды.
Материалы и методы исследования
Объекты исследования и условия культивирования
Бактериальные изоляты выделяли из проб содового шлама и грунта старой карты содового шламо-хранилища АО «Березниковский содовый завод» (г. Березники, Пермский край) на агаризованной минеральной среде (0.05% NaCl, рН 7.2) c 10 мМ ацетамидом (ацд) или 0.25% ацетонитрилом (ацн) в качестве единственных источников углерода и азота. Грунт отбирали с поверхности, на глубине 5 и 10 см, также для выделения использовали объединенную пробу. Сочетание высокой концентрации соли, щелочной среды и ацетамида/ацетонитрила как единственных источников энергии не позволило получить изоляты на агаризованной среде.
Идентификация полученных изолятов
Видовая идентификация бактериальных изолятов была проведена путем ПЦР-анализа с праймерами к генам 16S рРНК, сконструированными на основе последовательностей, представленных в базе данных GenBank, и синтезированными ООО «Евроген» (г. Москва). Препараты хромосомной ДНК получали методом щелочного лизиса. Амплификацию ДНК проводили с применением термостабильной Taq-полимеразы производства ООО «СибЭнзим» (г. Новосибирск) на термоциклере Т3 («Biometra», Германия). Электрофоретическое разделение продуктов ПЦР-реакции проводили в 1.2–1.5% агарозном геле в трисборатном буфере при напряженности поля 5 В/см. Для оценки молекулярной массы фрагментов ДНК использовали молекулярные маркеры 1 kb и 100 b (ООО «СибЭнзим» и Axigen®). Визуализацию полос и документирование данных осуществляли после окрашивания геля бромистым этидием с использованием системы гельдокументации BioDocAnalyze («Biometra», Германия). Очистку ПЦР-продукта перед секвенированием осуществляли двумя способами: с помощью смеси ферментов ExoSAPMix (Fermentas Life Sciences) и аппарата E--Gel («Invitrogen», США) согласно инструкции фирмы-производителя. Секвенирование проводили на приборе Genetic Analyzer 3500xl («Applied Biosystems», США), следуя инструкциям фирмы-производителя. Гомологию полученных нуклеотидных последовательностей генов 16S рРНК с известными генами микроорганизмов анализировали с использованием программного пакета BLAST ; программы Chromas lite 2.1. Сравнение нуклеотидных последовательностей проводили с применением программ ClustalW 2.0.9 и YACWGUI 1.2.
Определение нитрилгидратазной и амидазной активности изолятов
Нитрилгидратазную активность определяли по образованию акриламида и акриловой кислоты из акрилонитрила. Изоляты выращивали до стационарной фазы, культуральную жидкость (1 мл) центрифугировали 10 мин при 4500 g, клетки отмывали калий-фосфатным буфером (рН 7.2) и центрифугировали повторно. Клеточный преципитат суспендировали в 1 мл фосфатного буфера и вносили акрилонитрил до конечной концентрации 0.3 М, через 24 ч реакцию останавливали добавлением 50 мкл HCl. Амидазную активность определяли по образованию акриловой кислоты из акриламида. Реакцию проводили 24 ч, субстрат добавляли в концентрации 50 мМ. Концентрацию акриламида и акриловой кислоты в реакционной среде определяли методом ВЭЖХ на хроматографе Infinity II JC 1260 (Agilent, Германия) с колонкой Synergi 4u Hydro–RP 80A (250 × 4.6 мм). В качестве подвижной фазы использовали 25 мМ NaH 2 PO 4 с 5% ацетонитрила, скорость потока составляла 0.500 мл/мин при 25°C, детекцию проводили при длине волны 200 нм.
Детекция генов амидаз, нитрилгидратаз и нитрилаз
Амплификацию ДНК проводили с применением термостабильной Taq-SE ДНК-полимеразы (ООО «СибЭнзим», г. Новосибирск) на термоциклере Т100 («Biometra», Германия). Для анализа генов использованы разработанные ранее олигонуклеотидные праймеры [Демаков и др., 2009a; Демаков и др., 2009б; Павлова, Неустроева, Максимов, 2011]. Режим амплификации включал начальный цикл денатурации –
1 мин при 94°С; денатурацию, 94°С – 20 с; отжиг, 53° – 30 с; элонгацию, 72°С – 60 с; (35 циклов) и завершающий этап – 60 с при 72°С. Электрофоретическое разделение ПЦР-продуктов проводили в 1.2% агарозном геле в трис-боратном буфере при напряженности электрического поля 6 В/см. Праймеры для выявления генов ферментов, участвующих в трансформации нитрилов и амидов, представлены в табл. 1 .
Праймеры для выявления генов амидаз, нитрилгидратаз, нитрилаз
Таблица 1
[Primers for detecting the genes of amidases, nitrile hydratases, and nitrilases]
|
Выявляемые гены |
Праймер |
Последовательность, 5’-3’ |
Длина ПЦР-продукта |
|
Амидаза R. erythropolis (E12517) и R. rhodochrous N-774 (X54074) |
ARh499f ARh1002r |
GAAGCAGGTGGATCATCCGG TCCGTGGCGATCACGTTCCA |
503 |
|
Амидаза R. erythropolis (M88714) |
AReR-1 AReR-2 |
ATGCGACACGGTGACATCTCCTCGA TTACGCTTCGACGGTCTTCTCGAC |
1094 |
|
Амидаза R. rhodochrous J1 (D16207) |
AmiJ1-1 AmiJ1-2 |
ATGTCTTCGTTGACTCCCCCCAATT TTATGTCAGGGTGCCGGCTGCAGC |
1547 |
|
Амидаза Rhodococcus sp. (A19131) |
ARsp-1 ARsp-2 |
ATGGGCTTGCATGAACTGACGCTCG TCAAAGCGGCGCCAGTCGCGGCCA |
1388 |
|
α-субъединица Со-нитрилгидратазы R. rhodochrous J1 (D67027) |
NHCoAF NHCoAR |
GTGATACATATGAGCGAGCACGTCAAT ATGCATCATACGATCACTTCCTG |
611 |
|
β- субъединица Со-нитрилгидратазы R. rhodochrous J1 (D67027) |
NHCoBF NHCoBR |
GTGATACATATGGATGGTATCCACGAC ATGCATCACGCAGAGATCAGGTA |
689 |
|
α- субъединица Fe-нитрилгидратазы R. rhodochrous N-774, (X54074) |
NHFeAF NHFeAR |
СATATGTCAGTAACGATCGAC ATGCATCAGACGGTGGGAACCTG |
623 |
|
β- субъединица Fe-нитрилгидратазы R. rhodochrous N-774 (X54074) |
NHFeBF NHFeBR |
СATATGGATGGAGTACACGAT ATGCATCAGGCCGCAGGCTCGAG |
638 |
|
Нитрилаза R. rhodochrous K22 (D12583) |
NitK22F NitK22R |
ATGTCCAGCAATCCAGAGCTCAAGTACAC CTAGGCCTCCGCCTTGGCCC |
1151 |
|
Нитрилаза R. rhodochrous J1 (D67026) |
NitJ1F NitJ1R |
ATGGTCGAATACACAAACACATTCAAAG TCAGATGGAGGCTGTCGCCC |
1100 |
Определение массивности биопленок
Биопленки выделенных изолятов выращивали в 96-луночном полистироловом планшете (Медполи-мер, Россия) в БТН-бульоне (Биотехновация, Россия), варьируя условия культивирования. Для изучения влияния минерализации в среду добавляли 5, 10, 50 г/л NaCl, рН среды доводили с помощью гидроксида натрия (NaOH), культивирование проводили при температуре 8, 15, 30 и 37°С. Биопленки в среде с различной концентрацией соли и рН выращивали при температуре 30°С. Влияние температуры на образование биопленок изучали на среде БТН с рН 7. После 7‒10 суток инкубации планктонные клетки удаляли из лунок декантацией, дважды отмывали биопленку 200 мкл калий-фосфатным буфером и определяли массивность образованной биопленки. Биопленку окрашивали 0.1% кристаллическим фиолетовым в течение 40 мин в темноте, удаляли краситель, отмывали 1 раз калий-фосфатным буфером и экстрагировали краситель 200 мкл 96% спирта. Формирование биопленок оценивали по оптической плотности раствора красителя при λ 540 нм на планшетном ридере Infinite M1000 pro, «TECAN» (Швейцария).
Статистическую обработку проводили с использованием t-критерия Стьюдента, различия считали значимыми при p < 0.05.
Результаты и их обсуждение
Из содового шлама и восстанавливающихся после эксплуатации грунтов территории содового шла-мохранилища АО «Березниковский содовый завод» на минеральной среде с ацетамидом и ацетонитрилом в качестве единственного источника углерода и энергии были выделены изоляты нитрил- и амиду-тилизирующих бактерий, которые идентифицировали методом секвенирования гена 16S рДНК. Результаты идентификации представлены в табл. 2.
Таблица 2
Идентификация нитрилгидролизующих бактерий, выделенных на территории содового шламохранилища АО «Березниковский содовый завод»
[Identification of nitrile hydrolyzing bacteria isolated on the territory of the soda sludge storage facility of JSC Bereznikovsky Soda Plant]
|
Изолят |
Источник выделения |
Вид |
Типовой штамм |
Сходство, % |
Количество прочт. нукл-ов |
Таксономия |
|
Источник углерода – ацетонитрил |
||||||
|
ССОЗ1 (ацн) |
Грунт, старая карта |
Rhizobium radiobacter |
ATCC 19358(T) |
100.00 |
809 |
Bacteria, Pseudo-monadota, Alphaproteobacteria, Rhizobiales, Rhizobi-aceae, Rhizobium |
|
ССОП 1 (ацн) |
Поверхность грунта, старая карта |
Rhizobium nepotum |
39/7(T) |
99.75 |
807 |
|
|
ССОП (ацн) |
Поверхность грунта, старая карта |
Pseudomonas mandelii |
NBRC 103147(T) |
99.87 |
782 |
Bacteria, Pseudo-monadota, Gammaproteobacteria, Pseudomonadales, Pseudomonadaceae, Pseudomonas |
|
ССОЗ 1.1(ацн) |
Грунт, старая карта |
Microbacterim hatanonis |
JCM 14558(T) |
98.42 |
699 |
Bacteria, Actinomyce-tota, Actinomycetes, Micrococcales, Microbacteriaceae, Microbacterium |
|
ОШ2 / 5Э |
Шлам, новая карта |
Rhodococcus qingshengii |
JCM 15477(Т) |
99.42 |
537 |
Bacteria, Actinomyce-tota, Actinomycetes, Corynebacteriales, Nocardiaceae, Rhodococcus |
|
ССОЗ 5 2 / 6Э |
Грунт, 5 см глубины, старая карта |
Rhodococcus erythropolis |
NBRC 15567(Т) |
99.84 |
651 |
|
|
Источник углерода – ацетамид |
||||||
|
ССОЗ1 (ацд) |
Грунт, старая карта |
Ensifer morelensis |
Lc04(T) |
98.99 |
701 |
Bacteria, Pseudo-monadota, Alphaproteobacteria, Hyphomicrobiales, Rhizobiaceae, Ensifer |
|
CCОЗ 1.3 (ацд) |
Грунт, старая карта |
Ensifer morelensis |
Lc04(T) |
99.87 |
781 |
|
|
ССОЗ 10 4 (ацд) |
Грунт, старая карта, 10 см глубины |
Ensifer morelensis |
Lc04(T) |
100.00 |
847 |
|
|
ССОЗ 1.2 (ацд) |
Грунт, старая карта |
Pseudomonas sp. |
DSM 18928(T) |
99.53 |
853 |
Bacteria, Pseudo-monadota, Gammaproteobacteria, Pseudomonadales, Pseudomonadaceae, Pseudomonas |
|
ССОЗ 3(ацд) |
Грунт, старая карта |
Pseudomonas mandelii |
NBRC 103147(T) |
98.00 |
751 |
|
|
CCОЗ 1.4 (ацд) |
Грунт, старая карта |
Rhodococcus sp. |
JCM 15477(T) |
100 |
666 |
Bacteria, Actinomyce-tota, Actinomycetes, Corynebacteriales, Nocardiaceae, Rhodococcus |
|
ССОЗ 10 3 |
Грунт, старая карта, 10 см глубины |
Rhodococcus erythropolis |
NBRC 15567 (Т) |
99.85 |
701 |
|
Окончание табл. 2
|
Изолят |
Источник выделения |
Вид |
Типовой штамм |
Сходство, % |
Количество прочт. нукл-ов |
Таксономия |
|
ССОЗ 10 1 (ацд) |
Грунт, старая карта, 10 см глубины |
Arthrobacter globiformis |
NBRC 12137(T) |
100.00 |
771 |
Bacteria, Actinomyce-tota, Actinomycetes, Micrococcales, Micrococcaceae, Arthrobacter |
|
ССОП 1 (ацд) |
Грунт, старая карта, поверхность |
Acinetobacter calcoaceticus |
DSM 30006(T) |
99.87 |
876 |
Bacteria, Pseudo-monadota, Gammaproteobacteria, Pseudomonadales, Moraxellaceae, Aci-netobacter |
|
ССОП 1.2 (ацд) |
Грунт, старая карта, поверхность |
Rhizobium nepotum |
39/7(T) |
99.77 |
876 |
Bacteria, Pseudo-monadota, Alphaproteobacteria, Rhizobiales, Rhizobi-aceae, Rhizobium |
Нитрилутилизирующие бактерии были выделены главным образом из грунта старой карты шламо-хранилища, который характеризовался высокой минерализацией и был слабощелочным (рН 8) [Шилова, Максимов, Максимова, 2020]. Ранее из различных сред содового шламохранилища (содового шлама, грунта восстанавливающихся территорий) были выделены бактериальные штаммы, обладающие различной гидролитической активностью [Шилова, Максимов, Максимова, 2021] и устойчивостью к широкому спектру рН и высокой минерализации [Maksimova, Eliseeva, Maksimov, 2024]. На грунте старой карты шламохранилища наблюдалось восстановление растительности. Содовый шлам состоял из ионов кальция, хлора, карбонатов и гидрокарбонатов и имел рН 11, что приводило к значительному снижению микробного разнообразия по сравнению с грунтом старой карты. Из содового шлама на ацетонитриле был изолирован только один штамм галоалкалотолерантных родококков. Выделенные изоляты принадлежали филумам Actinomycetota и Pseudomonadota.
Определена активность выделенных изолятов. Показано, что изоляты обладают как амидазной активностью, которая проявляется при гидролизе акриламида, так и нитрилгидратазной активностью, выявляющейся при трансформации акрилонитрила. Когда субстратом реакции является акрилонитрил, в реакционной смеси обнаруживается как акриламид, так и акриловая кислота, что подтверждает работу нит-рилгидратазно-амидазной ферментативной системы. При гидролизе акриламида в реакционной среде детектировали акриловую кислоту. Ферментативные активности изолятов представлены в табл. 3. Нит-рилгидратазная активность обычно значительно превышает амидазную, особенно у селекционированных продуцентов, однако у большинства изолятов, выделенных с территории содового шламохранилища, амидазная активность была выше нитрилгидратазной.
Известно, что у родококков встречается несколько структурно-различных групп амидаз. Из щелочного высокоминерализованного биотопа были выделены бактериальные изоляты различной филогенетической принадлежности, в том числе изоляты родококков. Методом ПЦР определено наличие в геномах исследованных алкалотолерантных изолятов генов, соответствующих генам амидаз следующих типов: амидаза R. erythropolis (E12517) и R. rhodochrous N-774 (X54074), алифатическая амидаза R. erythropolis (M88614, Genbank), энантиоселективная амидаза R. erythropolis (AY026386, Genbank). Установлено, что в ДНК всех исследованных экстремотолерантных изолятов есть гены амидаз 1-го и 2-го типов (рис. 1), но не обнаруживается энантиоселективная амидаза. У всех штаммов обнаружены гены Fe-cодержащей нит-рилгидратазы (рис. 2) и отсутствует Co-содержащая. Гены нитрилаз не обнаружены.
Образование биопленок является адаптивной реакцией бактерий. Ранее нами было показано, что Rhodococcus qingshengii IEGM 1416 (изолят ОШ2 / 5Э) и R. erythropolis IEGM 1417 (изолят ССОЗ 5 2 / 6Э) формировали более массивные биопленки при увеличении рН и снижении температуры, а R. qingshengii IEGM 1416 – еще и при повышении концентрации соли в среде [Maksimova, Syrovatskaya, Maksimov, 2025]. Изучено биопленкообразование выделенных на ацетамиде и ацетонитриле изолятов нитрилутилизирующих бактерий. Изоляты формировали биопленки, биомасса которых, оцененная по ОП 540 экстрагированного красителя кристаллического фиолетового, составляла от 0.2 до 0.4 единиц. Наибольшую биомассу (ОП 540 = 0.4–0.5) отмечали у биопленок Acinetobacter calcoaceticus , Pseudomonas mandelii и
Rhizobium nepotum. Оценили воздействие 5–50 г/л хлорида натрия, 7–12 рН и 8–37ºС на формирование биопленок у изолятов, проявивших наибольшую способность к биопленкообразованию (рис. 3).
Таблица 3
Нитрилгидратазные и амидазные активности бактериальных изолятов, выделенных на территории содового шламохранилища АО «Березниковский содовый завод»
[Nitrile hydratase and amidase activities of bacterial isolates isolated on the territory of the soda sludge storage facility of JSC Bereznikovsky Soda Plant]
|
Субстрат реакции (фермент) Изолят |
Акрилонитрил (нитрилгидратаза) |
Акриламид (амидаза) |
|
Активность фермента, ммоль/г/ч |
||
|
ССОП (ацн) |
1.63 |
2.84 |
|
ССОП 2 (ацд) |
3.31 |
33.38 |
|
ССОЗ 10 2 (ацд) |
27.19 |
14.21 |
|
ССОЗ 10 4 (ацд) |
15.23 |
42.99 |
|
ССОЗ 10 3 (ацд) |
26.79 |
10.73 |
|
ССОЗ 5 1 (ацн) |
6.50 |
28.19 |
|
ССОЗ 2 (ацн) |
26.14 |
38.03 |
|
ССОЗ 2 (ацд) |
23.67 |
37.61 |
|
ССОЗ 10 (ацн) |
1.89 |
16.18 |
|
ССОЗ 4 (ацд) |
19.09 |
49.05 |
|
ССОЗ 10 1 (ацд) |
0.97 |
0.87 |
|
ССОП 1 (ацд) |
0.42 |
3.39 |
|
ССОЗ 3 (ацд) |
19.76 |
33.23 |
|
ССОЗ 1 (ацн) |
7.77 |
14.49 |
|
ССОЗ 3 (ацн) |
1.60 |
17.41 |
|
ССОЗ 1 (ацд) |
33.24 |
22.80 |
Примечание: независимые эксперименты по культивированию изолятов и определению ферментативной активности их клеток проведены в двухкратной повторности. В таблице приведены результаты единичного эксперимента.
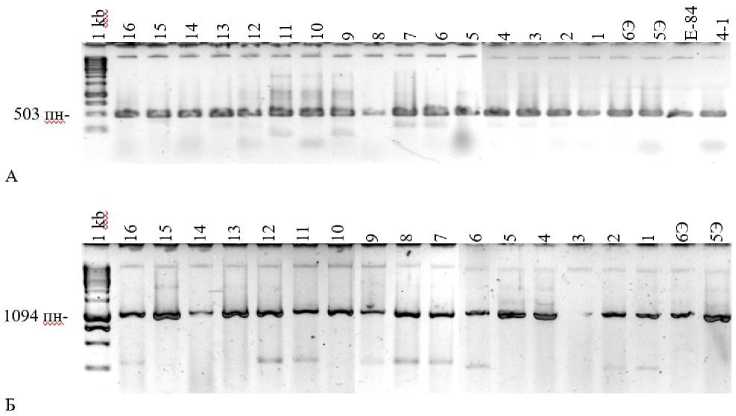
Рис. 1. ПЦР-продукты, соответствующие генам амидаз, гомологичных таковым из R. erythropolis , E12517, R. rhodochrous N-774, X54074 (А) и R. erythropolis , M88714 (Б).
Изоляты: 1 – ССОП (ацн), 2 – ССОП2 (ацд), 3 – ССОЗ 10 2 (ацд), 4 – ССОЗ 10 4 (ацд), 5 – ССОЗ 10 3 (ацд) 6 – ССОЗ 5 1 (ацн), 7 – ССОЗ2 (ацн), 8 – ССОЗ2 (ацд), 9 – ССОЗ 10 (ацн), 10 – ССОЗ4 (ацд), 11 – ССОЗ 10 1 (ацд), 12 – ССОП1 (ацд), 13 – ССОЗ3 (ацд), 14 – ССОЗ1 (ацн), 15 – ССОЗ3 (ацн), 16 – ССОЗ1 (ацд), R. qingshengii IEGM 1416 (5Э), R. erythropolis IEGM 1417 (6Э), R. erythropolis Е-84, R. erythropolis 4-1
[PCR products corresponding to the genes of amidases homologous to those from R. erythropolis , E12517, R. rhodochrous N-774, X54074 (A) and R. erythropolis , m88714 (B).
Isolates: 1 – SSOP (acn), 2 – SSOP2 (acd), 3 – SSOZ102 (acd), 4 – SSOZ104 (adc), 5 – SSOZ103 (adc), 6 – SSOZ51 (adc), 7 – SSOZ2 (adc), 8 – SSOZ2 (adc), 9 – SSOZ10 (adc), 10 – SSOZ4 (adc), 11 – SSOZ101 (adc), 12 – ssop1 (ADC), 13 – ccos3 (ADC), 14 – ccos1 (ADC), 15 – ccos3 (ADC), 16 – ccos1 (ADC), R. qingshengii IEGM 1416 (5E), R. erythropolis IEGM 1417 (6E), R. erythropolis E-84, R. erythropolis 4-1]
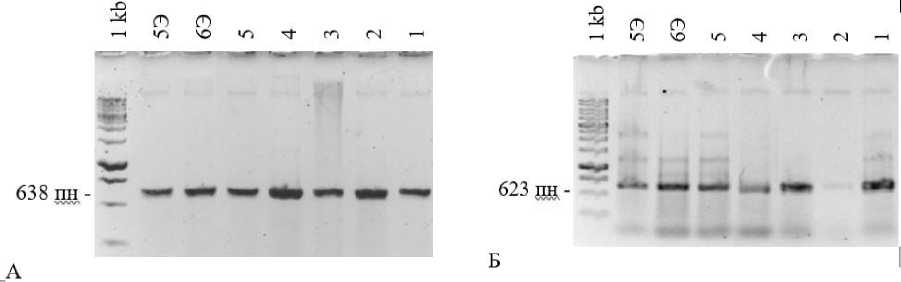
Рис. 2. ПЦР-продукты, соответствующие генам альфа (А) и бета (Б) субъединиц Fe-содержащей нитрилгидратазы, гомологичных таковым из R. rhodochrous N-774, X54074.
Обозначение изолятов как на рис. 1
[PCR products corresponding to the alpha (A) and beta(B) subunit genes of Fe-containing nitrile hydratase, homologous to those of R. rhodochrous N-774, X54074.
Designation of isolates as shown in Fig. 1]
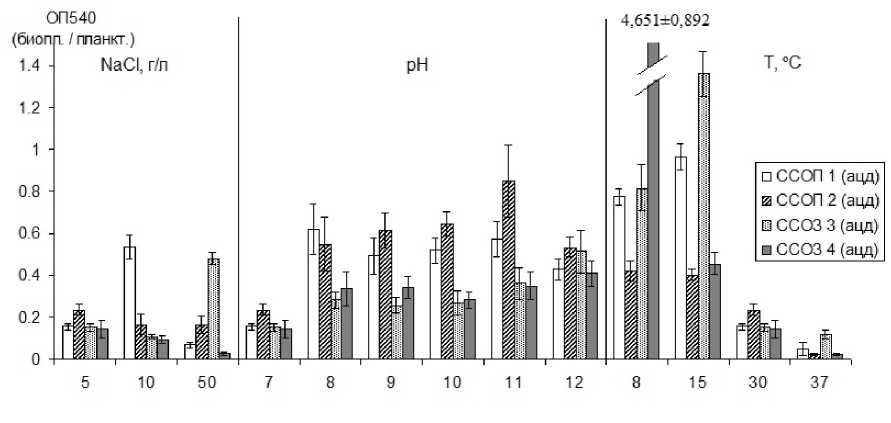
Рис. 3. Влияние концентрации NaCl, рН и температуры на биопленкообразование изолятов нитрилутилизирующих бактерий содового шламохранилища
[Influence of NaCl concentration, pH, and temperature on biofilm formation of isolates of nitrilutylizing bacteria from soda sludge storage]
Высокие концентрации соли подавляли рост изолятов, только у A. calcoaceticus ССОП 1 и P. mandelii значительно увеличивалась биомасса биопленки в среде с 10 и 50 г/л NaCl соответственно. Влияние рН было более выражено для R. nepotum, биомасса биопленок увеличивалась при возрастании рН от 7 до 11, но снижалась при рН 12. У всех изолятов образование биопленок было достоверно выше в щелочной среде (p < 0.05), чем при рН 7. Температурное воздействие на биопленкообразование было сходным у всех изученных изолятов: при температуре 37ºС формирование биопленок подавлялось, тогда как планктонная культура росла достаточно активно (ОП 540 = 0.7–0.8). Снижение температуры до 8–15ºС интенсифицировало процесс образования биопленок.
Заключение
Таким образом, с поверхности, глубины 5–10 см и из объединенной пробы грунта старой карты содового шламохранилища на ацетамиде и ацетонитриле как единственном источнике углерода были выделены изоляты нитрилутилизирующих бактерий, относящиеся к филумам Actinomycetota и Pseudomonadota. Единственный штамм родококков, способный к утилизации нитрилов, был выделен из содового шлама с экстремально высокими рН и минерализацией. Изоляты обладали активностью нит-рилгидратазы и амидазы, причем амидазная активность была выше нитрилгидратазной. Обнаружены гены неэнантиоселективных амидаз двух типов и Fe-cодержащей нитрилгидратазы. Выделенные изоляты формировали биопленки, биомасса которых увеличивалась при снижении температуры роста. Воздействие других изученных факторов (концентрации NaCl и рН) на образование биопленок было штаммоспецифично.


