Фиторегулирующее действие продуктов бактериальной деструкции парацетамола
Автор: Коротаев М.Ю., Вихарева Е.В., Белоногова В.Д., Ившина И.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
Показано, что продукты биодеструкции парацетамола клетками Rhodococcus ruber ИЭГМ 77 име-ют гуминоподобную природу. В составе их молекул присутствуют “симметричные” и “асиммет-ричные” участки, включающие аминофенольные, феноксазиновые, индольные и бензофурановые фрагменты. В основе химической структуры данных фрагментов лежат замещенные ароматиче-ские или хиноидные циклы с пара- (“симметричным”) и мета- (“асимметричным”) положениями эквивалентных заместителей - фенольных гидроксильных или азотсодержащих функциональных групп. Выявлено фиторегулирующее действие продуктов бактериальной деструкции парацетамола на прорастание семян пшеницы мягкой Triticum aestivum L., обусловленное влиянием “симметрич-ных” и “асимметричных” молекулярных участков на функциональную активность пероксидазы. Экспериментально обосновано, что эффект фитостимуляции зависит от стадии роста растения и концентрации веществ, содержащихся в водном извлечении из продуктов бактериальной деструк-ции парацетамола.
Парацетамол, биодеструкция, пероксидазная актив-ность
Короткий адрес: https://sciup.org/147204812
IDR: 147204812 | УДК: 579.695
Текст научной статьи Фиторегулирующее действие продуктов бактериальной деструкции парацетамола
Важной фармакохимической проблемой является поиск эффективных способов переработки лекарственных средств, не пригодных к медицинскому’ использованию. для получения на их основе новых биологически активных соединении, в том числе фитостимулирующего действия. Одним из широко ис пользуемых в медицинской практике лекарственных препаратов является парацетамол (CAS: 103-90-2; Д-(4-гигфоксифснил)ацстамид).
В качестве деструкторов парацетамола и про-дукта его гидролиза п -аминофенола применяют различные микроорганизмы, в том числе актино-бакгерии рода Rhodococcus. выделенные из почвенных и водных экосистем [Warliurst, Fewson.
(С Коротаев М. Ю., Вихарева Е. В., Белоногова В. Д., Ивонна И. Б., 2017
1994; Takenaka et al., 2003;Ившина и др„ 2006; de Gusseme et aL, 2011; Wu, Zhang, Chen, 2012; Zhang et ah, 2013: Arora, 2015], Согласно данным В. de Gusseme et al. [2011], бактериальная деструкция парацетамола может сопровождаться поликонденсацией фенольных интермедиатов. При зтом окислительные пол и конденсационные процессы, протекающие с участием ферментов почвенных бактерий, лежат в основе образования гумусовых кислот (гуминовой и фульвовой) и гуми-ноподобных соединений [Stevenson, 1994; Орлов, 1997], Особый интерес при рассмотрении вопросов, связанных с возможностью превращения фенолов в гуминоподобные соединения, представляет биоконверсия аминофенолов, которые, как и гуминовые кислоты, являются азотсодержащими соединениями [Орлов, 1990].
Гуминовые кислоты представляют собой смесь в ы со ко м олс кул я р н ы х органических аз отсо держа -щих соединений с бензольным ядром и алифатической углеводородной цепочкой, содержащих в качестве заместителей различные функциональные группы (рис. I)* Наибольшее значение среди последних имеют фенольный гидроксил и карбоксил, присутствие которых обусловливает растворимость гуминовых кислот в щелочах, а также хиноидная группа, определяющая их темную окраску, Фенольные и хиноидные группы определяют способность гуминовых кислот к окислительно-восс га нови re j i ь н ы м р еа к ц ия м. негидропизуемая часть гидролизуемая часть
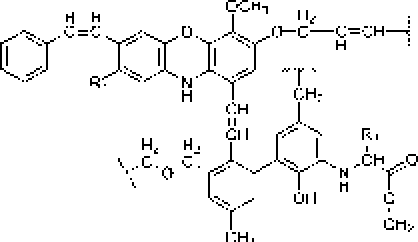
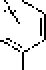
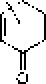
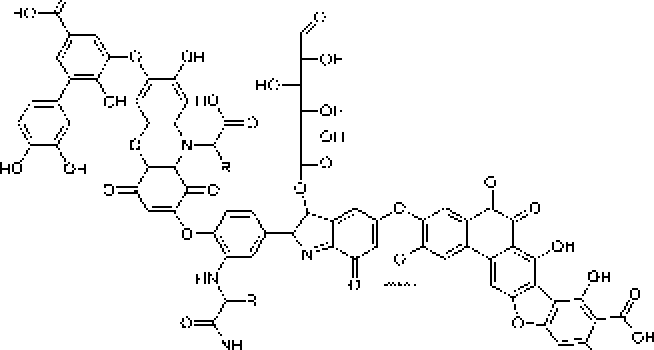
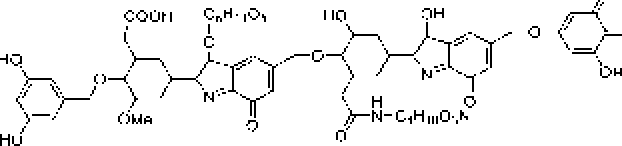
Рис. L Строение структурных ячеек (а, б) и молекулы (в) гуминовой кислоты.
Цит. по: а) Д.С, Орлову [1990]; б) FJ, Stevenson [1994];
в) С. С. Драгу] топу [Орлов, 1990]
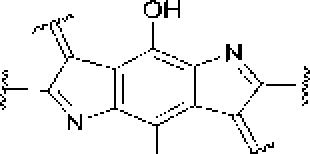
В ранее проведенных нами исследованиях установлено, что актинобактерии рода Rhodoeoccus способны к биодеструкции парацетамола с образованием водорастворимых веществ, окрашивающих культуральную среду в коричневый цвет, и черного аморфного осадка (АО) полимерной природы [Ившина и др_ 2006; Коротаев и др_ 2015]. Сравнение элементных составов АО и поли-ц-аминофенола показало их сходство. Высокая молекулярная масса (- 6 кДа), растворимость в щелочах и осаждение кислотонерастворимой фракции при подкислении щелочного раствора АО, а также наличие фитостимулирующего действия обусловливают сходство АО с гум и неподобным и веществами [Орлов, 1990; Гладков и др., 2006]. Наличие бензофурановых и индольных фрагментов в составе «симметричных» ("Sym’') и «асимметричных» OAsym”) участков молекул АО (рис. 2) подтверждает мелапизацию полиаминофенолов, первоначально образующихся при биотралсформации пара пега мола родококками [Коро гаев, Вихарева, Ившина, 2016; Коро гаев и др., 2016]. При этом под «симметричными» следует понимать участки молекул, включающие ароматические и хиноидные кольца с одинаковыми заместителями в пара- положенищ под «асимметричными» - молекулы с одинаковыми заместителями в .мета- положении [Коротаев, Вихарева, Ившина, 2016].
“Дзут"
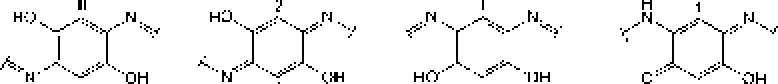
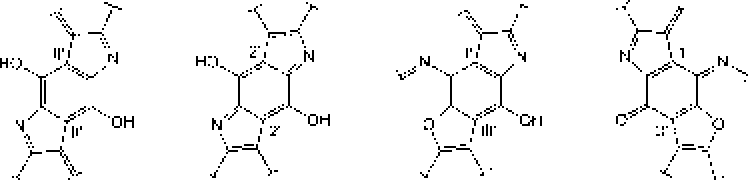
Рис. 2. Структурные фрагменты молекул
АО, представленные остатками:
а - 2,5-диамино-! ,4-фенилендиола: 6-2.5-дигидрокси-1 Л-беизохипондиимина: в - 4.6-диами но-1.3-фен и лен диол а; г - 2-амино5- г идрокси-1.4-бс 11 зох и 11 от т и м и 11 а
Как видно на рис. 2, в составе молекул АО могут присутствовать как аминофенольные, так и индольные фрагменты. В молекулах гуминовых кислот также имеются данные структурные фрагменты (рис. 1), что предопределяет их фитостимулирующую активность.
Известно, что фитостимул и руюшее действие гумусовых кислот и родственных им соединений обусловлено несколькими факторами, в том числе участием фульвовой кислоты как водорастворимой и наиболее подвижной фракции гумусовых кислот в переносе микроэлементов питания из почвы в корни растений [Nardi et al., 2002]. При этом фуль-вовая кислота за счет фенольных гидроксильных, карбонильных и карбоксильных групп (рис. 3) способна образовывать хелатные комплексы с ионами различных металлов.
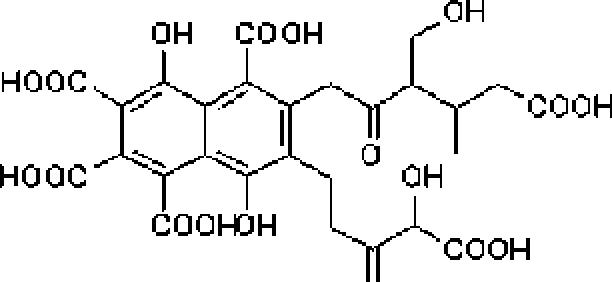
Рис. 3, Химическая формула фульвовой кислоты.
Циг по JAE. ВиШе [1977]
Именно в форме фульватов большинство микроэлементов являются биодосту иным и для корневой системы растений. Кроме того, гумусовые кислоты оказывают влияние на ферментные системы подземных органов растительного организма вследствие фенольно-хиноидной составляющей их химической структуры. Не случайно содержание пероксидазы в корнях значительно больше, чем в надземной части растения [Рогожин, 2004]. В связи с этим исследование фитостимулирующего действия необходимо проводить параллельно с изучением активности ферментов растений, в частности, пероксидазы [Рогожин, 2004].
Пероксидаза - растительный гемсодержащий фермент класса оксидоредуктаз, обладающий двумя «опциями»; собственно пероксидазной* обусловленной способностью фермента переносить кислород пероксида водорода на окисляемый субстрат (аскорбиновую кислоту* в частности), и оксидазной, связанной с переходом кислорода из молекулярной формы на 3-индолилуксусную кислоту7 (ИУК). что сопровождается продукцией перекисных соединений [Газарян и др* 2006]* Последние способны диспропорционировать с образованием атомарного кислорода и его радикальных форм [Kawano, 2003]. Частицы радикалов необходимы при выходе семян из покоя и активизации их прорастания за счет потребления энергии, полученной в результате перекисного (радикального) окисления липидов. Регуляторами пероксидазной и оксидазной функций пероксидазы могут выступать фенольные соединения, которые являются его быстро окисляемыми субстратами и, соответственно, ускоряют или замедляют (в зависимости от концентрации) окисление медленно окисляемых субстратов, аскорбиновой кислоты, в частности [Рогожин, 2004]. Так, установлено регуляторное действие гидрохинона на пероксидазную активность данного фермента и о-дианизидина - на его оксидазную функцию* Отмечено* что обе представленные ^опции v пероксидазы находятся в антагонистическом отношении и не могут включаться одновременно* а лишь последовательно [Рогожин* 2004; Давидянц* 2013]*
Цель настоящей работы - установление зависимости между химическим составом водного извлечения из осадка, образующегося в процессе чения из осадка* образующегося в процессе биодеструкции парацетамола клетками Rhodococcus ruber ИЭГМ 77* и его росторегулирующим действием на процесс прорастания семян пшеницы мягкой Triticum aestivum L** широко используемой в качестве тест-культуры при фитохимических исследованиях.
Материалы и методы исследований
Для биодеструкции парацетамола (Аньцю Лу-ань Фармасьютикал Ко., Лтд, Китай) использовали штамм R. ruber ИЭГМ 77 из Региональной профилированной коллекции алканотрофных микроорганизмов (официальный акроним коллекции ИЭГМ, номер во Всемирной федерации коллекций культур WDCM 768, [Catalogue of Strains, 2016]. Выделение осадка из постферментационной среды культивирования родококков осуществляли в соответствии с условиями, описанными в работе [Ившина и др.. 2006].
Изучение спектральных характеристик продуктов биодеструкции парацетамола
Электронные спектры АО и продуктов его фракционирования регистрировали на спектрофотометре Lambda EZ 201 (Perkon Elmer* USA) в кварцевых кюветах с толщиной слоя 1 см в диапазоне длин волн от 190 до 1000 нм. Анализируемый раствор готовили из 0.1%-ного раствора АО в 0*1 М растворе NaOH путем стократного разведения его аликвотной части дистиллированной водой или 0.1 М раствором NaOH* Растворами сравнения являлись 0.001 М раствор NaOH и 0.1 М раствор NaOH*
Фракционирование АО осуществляли методами дробного осаждения и растворения. В химическом стакане вместимостью 100 см3 смешивали 1.00 см3 0.1%-ного раствора АО с 1.00 см3 0.1 М раствора НС1. Полученную взвесь разбавляли дистиллированной водой и фильтровали через бумажный фильтр в мерную колбу вместимостью 100.00 см3 доводя объем растворителем до метки. Собранный в мерную колбу фильтрат представлял собой водорастворимую фракцию АО в Н^-форме (ВФ-1Т). Для получения спирто-водорастворимой фракции АО в Н^-форме (СВФ-1Т) вышеуказанную взвесь обрабатывали последовательно 50.00 см3 дистиллированной воды и 96%-ного этилового спирта и фильтровали через бумажный фильтр в мерную колбу вместимостью 100.00 см3* доводя объем фильтратом до метки.
Для изучения влияния pH на изменение спектральных характеристик фракций АО готовили растворы последних в 0.1 М NaOH. Предварительно в мерную колбу вместимостью 100*00 см3 вносили 50.00 см3 0.2 М раствора NaOH* Далее взвесь, полученную по вышеприведенной методике* разбавляли дистиллированной водой и фильт- ровали через бумажный фильтр в мерную колбу к доводя объем фильтратом до метки. Полученный раствор представлял собой водорастворимую фракцию АО в Ыа+-форме (ВФ-Ыа+). Дтя получения спирторастворимой фракции АО в Na -форме (CФ-Na+) в мерную колбу вместимостью 100.00 см3 вносили 50.00 ем3 0.2 М раствора NaOH. Данную взвесь обрабатывали в химическом стакане 96%-НЫМ ЭТИЛОВЫМ спиртом и фильтровали через бумажный фильтр в мерную колбу, доводя ее объем фильтратом до метки.
Растворы для заполнения кювет сравнения при регистрации спектров ВФ-ЬГ, СВФ-Н\ ВФ-Па+ и СФ-Na" готовили аналогично исследуемым, но с использованием вместо 2.00 смэ взвеси, полученной по вышеприведенной методике. 2.00 см3 0.05 М раствора NaCl.
Получение водорастворимых продуктов биодестру к*1 иш п ар ai гетамола
Извлечение водорастворимых продуктов (ВП) из АО (0.2500 г) проводили экстракцией дистиллированной водой (100.00 см3) при нагревании на водяной бане с обратным холодильником в течение 3 ч. [Коротаев и др., 2015]. Водное извлечение охлаждали и фильтровали через обеззоленный бумажный фильтр “синяя лента” (Химреактивком-плект. Россия). В фильтрате гравиметрическим методом устанавливали концентрацию ВП. которую рассчитывали по массе остатка, полученного после испарения воды из 10.00 см3 фильтрата. Серию растворов ВП готовили посредством разбавления фильтрата дистиллированной водой. Соотношение объемов фильтрата и полученного разведения находилось в пределах от 1:6.2 до 1:1.2.
Проращивание семян и анализ проростков пшеницы
Предварительно взвешенные семена пшеницы мягкой ТгШсит aestivum L. помещали по 30 штук во флаконы из темного стекла вместимостью 25 см3, заливали растворами ВП (2.50 см3) и выдерживали в темноте в течение 1 сут. при комнатной температуре. Объем вносимого во флаконы раствора подбирался таким образом, чтобы он покрывал слой семян [Христин, Ковальченко. Алкацсва. 2008]. Флаконы на период замачивания семян прикрывали крышкой во избежание значительного испарения растворителя. В контрольном опыте вместо растворов ВП использовали дистиллированную воду.
Через I сут. от начала замачивания семена извлекали из флаконов. промывали дистиллированной водой (1 дм3 на 30 семян), подсушивали и переносили по 30 шт. в чашки Петри. Проращивание семян осуществляли между’ 3 нижними слоями и 1 верхним слоем смоченной фильтровальной бумаги. Первоначальный объем дистиллированной воды. введенный в каждую чашку Петри, составлял
4.00 см3. По мере высыхания слоев фильтровальной бумаги вносили дополнительное количество дистиллированной воды. Общий объем внесенной в одну7 чашку7 Петри дистиллированной воды на 6 сут. составлял 6.50 см3. Отбор проростков для определения их морфометрических показателей и пероксидазной активности осуществляли на 1-, 2-, 4-, 6-е сут.. а также на 1-? 3-, 6-е сут., соответственно. с момента помещения семян в чашки Петри. Для каждого проростка определяли суммарную длину всех корней и длину ростка. С целью определения сухой биомассы 3- и 6-суточных проростков пшеницы закладывали дополнительно 14 чашек Петри.
Статистическую обработку результатов проводили с использованием Е-критерия Фишера и I- критерия Стьюдента при уровне значимости а=0.05. Различия между7 выборками считали статистическими значимыми при /^ > tKV. При статистической обработке морфометрических показателей проростков пшеницы предварительно проводили отсев грубых погрешностей наблюдений (критерий Рошера) и проверку выборок на нормальность (метод моментов) [Бондарчук. 2010].
Пероксидазную активность корней проростков определяли модифицированным методом Бояркина [Воскресенская и др.. 2006]. Выбор корней проростков в качестве объекта анализа связан с большим, в сравнении с ростками, содержанием в них пероксидазы [Рогожин, 2004: Рогожин, Рогожина, 2011; Давидянц. 2013]. Для проростков, отобранных на 1-е сут. эксперимента, для анализа использовали всю сырую биомассу ростков и корней, так как прирост за данный интервал времени был незначительным. Для получения ферментной вытяжки навеску корней проростков пшеницы 0.05-0.10 г гомогенизировали в ступке с дистиллированной водой и переносили в мерную колбу вместимостью 25.00 см3. После доведения объема водой до метки растите липло вытяжку настаивали в течение 10 мин., фильтровали через бумажный фильтр и использовали для определения пероксидазной активности. В одну из кювет с толщиной слоя 1.00 см помещали 1.00 см3 раствора бензидина, 1.00 см3 фильтрата и 1.00 см3 дистиллированной воды (раствор сравнения), в другую - 1.00 cmj раствора бензидина, 1.00 см3 фильтрата и 1.00 см3 0.3%-ного раствора пероксида водорода (анализируемый раствор). С момента падения последней капли 0.3%-него раствора пероксида водорода включали секундомер и регистрировали оптическую ПЛОТНОСТЬ анализируемого раствора на концентрационном фотоэлектрическом фотометре КФК-3-01 (ЗОМЗ, Россия) при длине волны 670 нм. Пероксидазную активность выражали в единицах оптической плотности на грамм сырой массы в секунду (отн. ед. хг"1 хсм"1). Раствор бензидина готовили в среде ацетатного буфера согласно методике. представленной в работе [Воскресенская и др., 2006].
Результаты исследования и их обсуждение
Сравнение электронных спектров АО и его фракции, представленных на рис. 4, подтверждает наличие в молекулах АО системы сопряжения двойных связей, карбонильной и азометиновой функциональных групп. Электронные спектры фракций АО свидетельствуют о гипсохромных и батохромных сдвигах в кислой среде максимумов поглощения при Х=248 нм и Х=329 нм, соответственно (рис, 4).
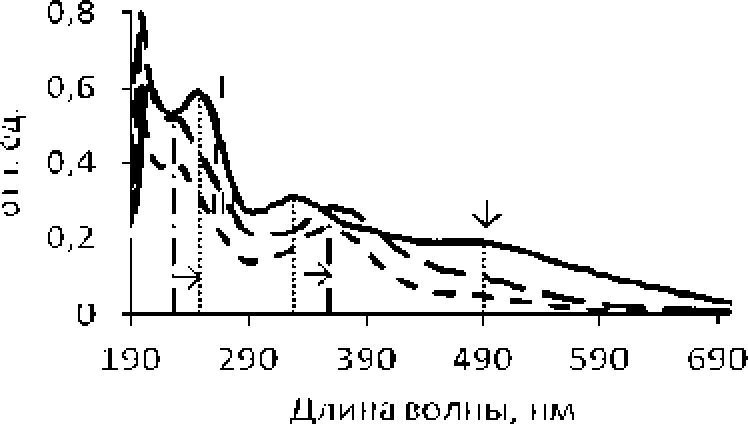
а
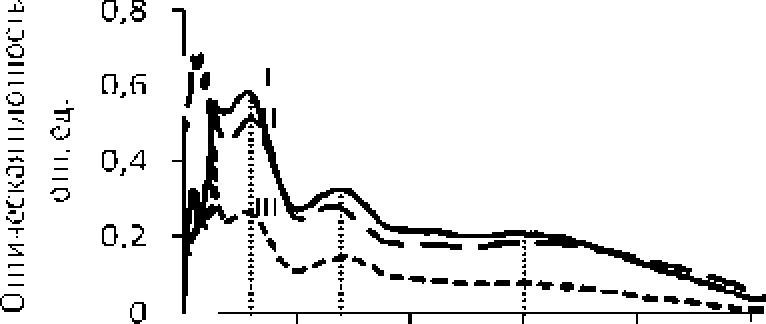
190 290 390 490 S90 699
Дии।ia волны, г гл
Рис. 4* Электронные спектры поглощения АО и его фракций:
-
а) I - 0.001%-иый раствор ЛО в 0.001 М NaOH, П -СЕФ-Н\ Ш - ВФ-ЬГ; 6)1- 0.001%-ный раствор АО в 0.1 М растворе NaOH, П - СФ-Ма+, Ш - ВФ-Ма^
Так. поглощение в области длин волн 230-260 нм обусловлено переходом л-л* в трансоидной форме еноновой системы (рис. 4 a. II. III). а образование енолят-иона в щелочном растворе сдвигает данную полосу’ поглощения в сторону’ длинных волн (рис. 4 б. IL III) [Сильверстейн. Басслер. Моррил, 1977]. Батохромный сдвиг максимума при Х=329 нм (рис. 4 б. II. III) соответствует л-л* переходу находящейся в сопряжении азометиновой группы. При подкислении на атоме азота данной группы создается положительный заряд, обусловливающий смещение максимума в сторону’ длинных волн (рис. 4 а, II, III) [Сильверстейн, Басслер, Моррил, 1977]. Исчезновение полосы поглощения при X = 490 нм при подкислении (рис. 4 а, II, III) связано с протонированием несвязывающей электронной пары гетероатома азота, участвующей в п-л* переходе между HOMO орбиталью ароматического цикла и LUMO орбиталью хиноидного коль- ца [Gopalasamy, 2014].
В эксперименте на проростках пшеницы при прорастании семян выявлена обратная зависимость между длиной ростков (1 сут.) и сухой биомассой корней (3 сут.) от их пероксидазной активности (рис. 5, рис, 6) . На этапе восхождения семян (6 сут ). напротив, отмечается прямо пропорциональная зависимость между7 сухой биомассой корней проростков пшеницы и пероксидазной активностью (рис, 7).
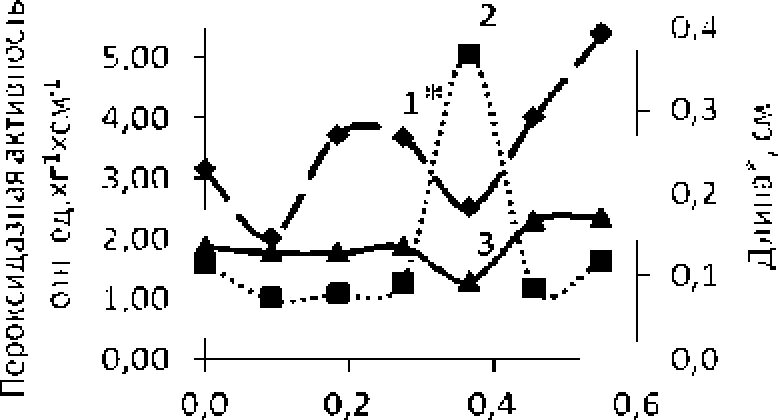
Коп цен । рации ВП. г/д.^Л
Рис. 5, Зависимость средней длины корней (1*), средней длины ростков (3*) и пероксидазной активности (2) от концентрации ВП для проростков пшеницы (1 сут.)
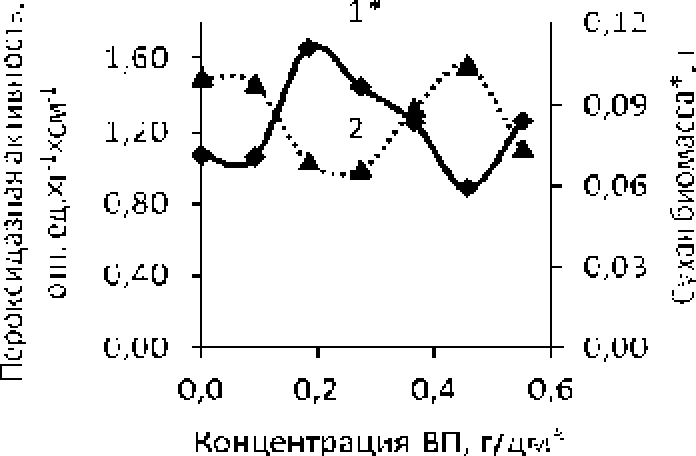
Рис. 6, Зависимость сухой биомассы корней (I *) и пероксидазной активности (2) от концентрации ВП для проростков пшеницы (3 сут.)
5 о
ID
КонцоIIрация ВП, i/цм5
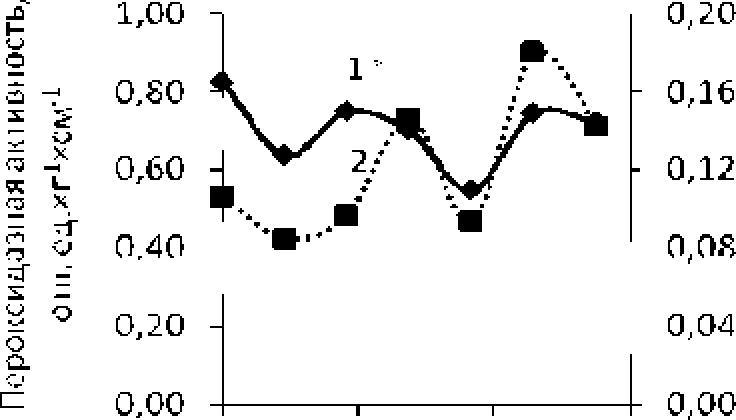
Рис. 7, Зависимость сухой биомассы корней (1*) и пероксидазной активности (2) от концентрации ВП для проростков пшеницы (6 сут.)
0,4 0,6
0,0 0,
Зависимость между длиной корней и пероксидазной активностью в 1-суточных проростках имеет некоторое расхождение с выявленной тенденцией, что объясняется использованием б качестве объекта анализа всей сырой биомассы ростков и корней, где граммовое содержание первых. по всей видимости, в значительной степени превышает в навеске содержание последних (рис. 5).
Средние значения длины побегов (ростков) и корней проростков пшеницы, а также сухой биомассы корней 6-суточных проростков пшеницы, представлены в таблице.
Динамика изменения морфометрических показателем (сухой биомассы) проростков пшеницы
|
Концентрация ВП, г/дм3 |
1 сут. |
2 сут. |
|
Длина ростков, см |
||
|
Контроль |
0.09=Ь0.03 |
0.24*0.05 |
|
0.0913 |
0.08±0.02 |
0.2*0.06 |
|
0.1826 |
0.08±0.02 |
0.31*0.09 |
|
0 2739 |
О.О9±ОО2 |
0,27*0.09 |
|
0 3652 |
0.04^)02 |
0,18*0.06 |
|
0.4565 |
О.12±О.ОЗ |
0.23*0.05 |
|
0.5500 |
0.12±О.ОЗ |
0.21*0.06 |
|
Длина корней, см |
||
|
Контроль |
0.18±0.07 |
0.9*02 |
|
0.0913 |
0Ю±0.04 |
1.2*03 |
|
0.1826 |
0.22±0.06 |
2.3*04 |
|
0.2739 |
0.22^0.12 |
1.5*02 |
|
0.3652 |
0.13^0.07 |
1.3*03 |
|
0.4565 |
0.24±0.09 |
0.8*02 |
|
0.5500 |
0.34±0.09 |
|
|
4 сут. |
6 сут. |
|
|
Длина ростков, см |
||
|
Контроль |
2.1±0.3 |
49*0.4 |
|
0.0913 |
2.4±0.4 |
5.6±0.5* |
|
0.1826 |
1.8±0.4 |
5.1±0.7 |
|
0.2739 |
2.5=ЬО.З |
60*0.6 |
|
0.3652 |
1.4±0.3 |
4.8±0.7 |
|
0.4565 |
1.7±0.3 |
5.0±0.6 |
|
0 5500 |
2.1±О.З |
5.2±0.5 |
|
Длина корней, см |
Сухая биомасса корней, г |
|
|
Контроль |
14.2=Ы.5 |
0.1644 |
|
0.0913 |
15.3*1.8 |
0.1274 |
|
0.1826 |
13.3*1.9 |
0.1499 |
|
0.2739 |
15.3*1.5 |
0.1399 |
|
0.3652 |
11.8*1.5 |
0.1096 |
|
0.4565 |
13.7*1.4 |
0.1492 |
|
0.5500 |
12.4*1.1 |
0 1444 |
|
Статистическое отличие от контрольной выборки |
||
(бк«1 > ^кр)’
Как следует из данных, представленных в таблице и на рис. 4-6. динамика изменения морфометрических показателей и сухой биомассы корней и побегов проростков пшеницы, связанная с активностью содержащейся в них пероксидазы, имеет «маятниковый» характер [Рогожин, 2004].
Спектральными характеристиками гуминовых кислот и родственных им веществ ЯВЛЯЮТСЯ Е- величина (Ej65U’°°1%) И коэффициент цветности (^465 7 Е^ [Орлов, 1990]. Наличие максимума поглощения вблизи Z = 490 нм для АО и его фракций в щелочной среде затрудняет определение данных характеристик. Батохромный сдвиг максимума поглощения азометиновой группы влияет на значения /^-величины и, соответственно, цветного показателя СВФ и ВФ. Тем нс менее, большое значение ^465 / б^и для СВФ-ЕГ (9.74) в сравнении с ВФ-Н” (16.63) является характерной особенностью гуминовых веществ. Так, возрастание цветного показателя наблюдается при выделении фракций гумусовых кислот, имеющих большею растворимость в воде и меньшую среднюю молекулярную массу Среднее значение Е,^5 Е^ для фракций гумусовых кислот со средней молекулярной массой от 5 до 10 кДа равно 6.0 и менее 5 кДа - 9.0. Следовательно, ожидаемое значение цветного показателя АО будет меньше 9.74 и может быть сопоставимо со значением сто средней молекулярной массы, приблизительно равной 6 кДа [Орлов. 1990]. Таким образом h водорастворимые вещества, присутствующие в ВФ-Н- после фракционирования путем изменения pH и содержащиеся в растворе ВП после термической обработки АО на водяной бане, могут быть представлены низкомолекулярными фрагментами АО. при этом также включающими “Sym" и “Jsvw" участки (см. рис. 2). По-видимому, химическая двойственность участков молекул АО и, соответственно, ВП связана с биохимической химерностью пероксидазы, функционирующей в режимах пероксидазного и оксидазного окисления медленно окисляемых субстратов. Так, «симметричность» или «асимметричность» взаимодействующих с пероксидазой молекул циклического строения (аскорбиновая кислота, ИУК), обусловленная числом и положением заместителей в кольцевой системе, вероятно, является причиной их связывания в различных участках активного центра фермента и определяет различный механизм переноса электронов при их окислении [Рогожин, 2004; Газарян и др.. 2006].
В самом деле, «симметричная» молекула гидрохинона в небольших концентрациях активирует, а в больших - ингибирует пероксидазное окисление таких медленно окисляемых субстратов, как аскорбиновая кислота [Рогожин, 2004]. Наличие в химической структуре аскорбиновой кислоты четного числа енольных гидроксильных групп предполагает в реакциях ее пероксидазного окисления «симметричный» перенос электронов на молекулу окислителя (пероксида водорода). Напротив, окси- дазное окисление ИУК в силу ее химического строения сопровождается «асимметричным» переносом электронов, в результате которого образуются свободные радикалы [Savitsky el aL 1999]. Аналогично гидрохинону в реакциях пероксидазного окисления аскорбиновой кислоты о-дианизидин оказывает регуляторное действие на оксидазное окисления ИУК [Рогожин и Рогожина. 2004]. Таким образом, участвующие в биохимическом взаимодействии фенольные регуляторы (в малых концентрациях активаторы) и окисляемые субстраты можно разделить на две группы: те, что имеют отношение к пероксидазной функции, и те. что связаны с оксидазной функцией пероксидазы (рис. 8).

он н

он
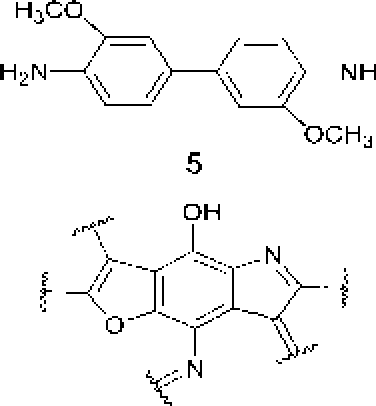
Рис. 8. Субстраты пероксидазного (л) и оксидазного (<5) окисления:
I - аскорбиновая кислота: 2 - гидрохинон: 3 -"симметричные" участки молекул АО иВП:4-ИУК; 5 - о-дианизидин: 6 - "асимметричные" участки молекул АО и ВП
Биохимическое взаимодействие участников окисления упрощенно может быть отражено следующей схемой [Savitsky et al., 1999: Рогожин.
Рогожина. 2004]:
l^.v/??^ lVH/ I ^ | оксидазная функция L пероксидазная функция II
ИУК + Оз + I hO скатол -+- СО2 + 1НЪ + О |syw, ДбУЛ/] —» | пероксидаз г тая функция Т, оксидазная функция II
2Н?О2 + аскорбиновая кислота —> 2Н2О + де г и дроас корб и но в ая ки с; i о i а
Прописные (ЗУЛ/. /15УД/) и строчные буквы ^ут. asym) обозначений фенольных регуляторов на данной схеме соответствуют их большим и малым концентрациям в растительных клетках.
Таким образом, концентрация и природа окисляемых су бс । ра । ов оказ ы в а ют о i1 р ед ej i я ю шее влияние на направление протекания реакций в сторону образования или разрушения пероксида водорода - источника свободных радикалов, необхо димых для активизации процессов прорастания семян.
Так. образная зависимость между сухой биомассой и пероксидазной активностью на этапе «проклевывания» и прорастания семян связана с образованием радикалов, которые оказывают повреждающее действие на мембраны клеток при перекисном окислении содержащихся в них липидов и угнетают рост ращения. Вероя тно, избы i очное накопление радикалов, образованных при оксидазном окислении ИУК. по принципу отрицательной обратной связи выключает оксидазную и включает пероксидазную опцию фермента. По нашим данным, при большем значении пероксидазной активности наблюдается меньший прирос г сухой биомассы корней проростков пшеницы (см. рис. 5. 6).
Прямая зависимость между пероксидазной активностью и сухой биомассой корней 6-су точных проростков пшеницы объясняется расходом энергии. образованной на этане прорастания при перекисном окислении липидов (рис. 7). Так, при более сильном окислительном стрессе, испытанном рас-1 и тельным и клетками на 1—3 су г. с момента помещения семян в чашки Петри, выделяется большее количество энергии. потребляемой р ашен и ем на более поздних этапах его роста. Более интенсивное образование свободных радикалов в начале роста растения по принципу отрицательной обратной связи может стимулировать биосинтез эндогенных антиоксидантов (аскорбиновая кислота, витамин Е). что. в свою очередь, далее вызывает возрастание пероксидазной активности фермент. Постепенное нивелирование различий между значениями сухой биомассы к 6 сут., вероятно, связано с полным израсходованием на рос т запасных пи гаче.чьи ых веществ, изначально содержащихся в семенах.
Т ак им обр аз ом, рос i op е i у j i иру ю шее д ейс гвие продуктов биодесгрукции парацетамола на пшеницу мягкую связано с их влиянием на пероксидазную систему растения. Эффект фитосгимуляции зависит аг стадии роста растения и концентрации веществ, содержащихся в водном извлечении из продуктов биодесгрукции парацетамола.
Заключение
1 1родукты бактериальной деструкции парацетамола клетками Rhodococcus ruber НЭЕМ 77 проявляют выраженное фиторегулирующее действие, обусловленное их влиянием на функциональную активность пероксидазы.
Работа выполнена при частичной поддержке Комплексной программы Уральского отделения РАН (проект 15-12-4-10).
Список литературы Фиторегулирующее действие продуктов бактериальной деструкции парацетамола
- Бондарчук С.С. Основы практической биостатистики./С. С. Бондарчук, И. Г. Годованная, В. П. Перевозкин. -Томск: Изд-во ТГПУ, 2009. -72 c
- Воскресенская О.Л. и др. Большой практикум по биоэкологии. Ч. 1: учеб. пособие. Йошкар-Ола, 2006. 107 с
- Газарян И.Г. и др. Особенности структуры и механизма действия пероксидаз растений//Успехи биологической химии. 2006. Т. 46. С. 303-322
- Гладков О.А. и др. Способ получения солей гуминовых кислот: Евраз. пат. № 006824. Бюл. № 2. 2006. 6 с
- Давидянц Э.С. Влияние обработки семян тритерпеновыми гликозидами на активность пероксидазы, ИУК-оксидазы и полифенолоксидазы в проростках пшеницы//Химия растительного сырья. 2013. № 4. С. 225-231
- Ившина И.Б. и др. Алканотрофные родококки как катализаторы процесса биодеструкции не пригодных к использованию лекарственных средств//Прикладная биохимия и микробиология. 2006. Т. 42, № 4. С. 443-447
- Коротаев М.Ю., Вихарева Е.В., Ившина И.Б. Меланизация полиаминофенолов в процессе биотрансформации парацетамола клетками Rhodococcus ruber ИЭГМ 77//Вестник Пермского университета. Сер. Биология, 2016. Вып. 2. С. 166-170
- Коротаев М.Ю. и др. Определение средней молекулярной массы нерастворимых продуктов биодеструкции парацетамола клетками Rhodococcus ruber ИЭГМ 77//Фундаментальные исследования. 2015. № 2, Ч. 26. С. 5850-5854
- Коротаев М.Ю. и др. Химическая структура осадка, образующегося в процессе биотрансформации парацетамола клетками Rhodococcus ruber ИЭГМ 77//Биофармацевтический журнал. 2016. Т. 8, № 1. С. 13-19
- Коротаев М.Ю., Солодянкина Е.С., Шибанова Е.Н. Определение удельного показателя поглощения водорастворимых продуктов бактериальной деструкции парацетамола//Научный альманах. 2015. № 12-2(14). С. 372-375
- Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. М.: Изд-во МГУ, 1990. 325 с.
- Рогожин В.В. Пероксидаза как компонент антиоксидантной системы живых организмов. СПб.: ГИОРД, 2004. 240 с
- Рогожин В.В., Рогожина Т.В. Роль индолил-3уксусной кислоты в реакциях окисления быстро и медленно окисляемых субстратов пероксидаз//Вестник Московского университета. Сер. 2. Химия. 2004. Т. 45. № 6. С. 423-428
- Рогожин В.В., Рогожина Т.В. Физиолого-биохимические механизмы прорастания зерновок пшеницы//Вестник Алтайского государственного аграрного университета. 2011. № 8 (82). С. 17-21
- Сильверстейн Р., Басслер Г., Моррил Т. Спектрометрическая идентификация органических соединений/под ред. А.А. Мальцева. М.: Мир, 1977. 592 с
- Христин М.С., Ковальченко Ю.М., Алкацева Н.И. Препарат для стимуляции проращивания семян и повышения устойчивости проростков к дефициту влаги и способ его получения: Пат. РФ 2337543. Бюл. № 31. 2008. 13 с
- Arora P.K. Bacterial degradation of monocyclic aromatic amines//Frontiers in Microbiology. 2015. Vol. 6, № 820. URL: http://dx.doi.org/10.3389/fmicb.2015.00820
- Buffle J.A.E. The humic substances in water and their interactions with mineral ions ("Les substances humiques et leurs interactions avec les ions mineraux"). Conference proceedings de la commission d' hydrologie appliquee de A.G.H.T.M. L' Universite d' Orsay, 1977. P. 3-10
- Catalogue of Strains of Regional Specialized Collection of Alkanotrophic Microorganisms. 2016. URL: http://www.iegm.ru/iegmcol/strains/index.html (дата обращения: 26.12.2016)
- de Gusseme B. et al. Degradation of acetaminophen by Delftia tsuruhatensis and Pseudomonas aeruginosa in a membrane bioreactor//Water Research. 2011. Vol. 45. P. 1829-1837
- Gopalasamy T. et al. Poly Meta-Aminophenol: chemical synthesis, characterization and AC impedance study//Journal of Polymers. 2014. Vol. 2014. The mode of access: http://dx.doi.o DOI: rg/10.1155/2014/827043
- Kawano T. Roles of the reactive oxygen speciesgenerating peroxidase reactions in plant defense and growth induction//Plant Cell Reports. 2003. Vol. 21, № 9. P. 829-837
- Nardi S. et al. Physiological effects of humic substances on higher plants//Soil Biology and Biochemistry. 2002. Vol. 34. P. 1527-1536
- Savitsky P.A. et al. Oxidation of indole-3-acetic acid by dioxygen catalysed by plant peroxidases: specificity for the enzyme structure//Biochemical Journal. 1999. Vol. 340, № 3. P. 579-583
- Stevenson F.J. Humus Chemistry: Genesis, Composition, Reactions. N. Y.: John Wiley & Sons, 1994. 512 p
- Takenaka S. et al. The metabolic pathway of 4aminophenol in Burkholderia sp. strain AK-5 differs from that of aniline and aniline with C-4 substituents//Applied and Environmental Microbiology. 2003. Vol. 69, № 9. P. 5410-5413
- Warhurst A.M., Fewson C.A. Biotransformations catalyzed by the genus Rhodococcus//Critical Reviews in Biotechnology. 1994. Vol. 14, № 1. P. 29-73.
- Wu S., Zhang L., Chen J. Paracetamol in the environment and its degradation by microorganisms//Applied Microbiology Biotechnology. 2012. Vol. 96. P. 875-884
- Zhang L. et al. Degradation of paracetamol by pure bacterial cultures and their microbial consortium//Applied Microbiology and Biotechnology. 2013. Vol. 97, № 8. P. 3687-3698
- Орлов Д.С. Гуминовые вещества в биосфере//Соросовский образовательный журнал. 1997. № 2. С. 56-63


