Физический статус вируса папилломы человека в прогнозе рецидивирования цервикальных интраэпителиальных неоплазий различной степени тяжести
Автор: Ибрагимова Марина Константиновна, Чуруксаева Ольга Николаевна, Бычков Вячеслав Алексеевич, Цыганов Матвей Михайлович, Дерюшева Ирина Валерьевна, Шпилева Ольга Владимировна, Коломиец Лариса Александровна, Литвяков Николай Васильевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.17, 2018 года.
Бесплатный доступ
Обследовано 37 пациенток с LSIL (cervical intraepithelial neoplasia grade I), 131 с HSIL (cervical intra-epithelial neoplasia grade II-III) и 150 женщин без патологических изменений слизистой шейки матки. Всем пациенткам проведено комплексное обследование, которое включало гинекологический осмотр, кольпоскопию, цитологическое и гистологическое исследования, молекулярно-генетический анализ - выявление и генотипирование вируса папилломы человека (ВПЧ) высокого канцерогенного риска (ВКР), оценка вирусной нагрузки ДНК ВПЧ и определение физического статуса ДНК ВПЧ-16 (n=208) методом Real-time PCR. Количество ВПЧ-инфицированных среди женщин без морфологических изменений шейки матки составило 50,7 %, среди пациенток с LSIL + НSIL - 78,5 %. При изучении частоты интегрированных форм вируса папилломы человека 16 генотипа при LSIL и НSIL установлено, что частота возникновения рецидивов при цервикальных интраэпителиальных неоплазиях различной степени тяжести определяется физическим статусом ВПЧ-16. При сравнении распределения частот всех трех форм ВПЧ (эписомальной, смешанной и интегрированной) между больными с цервикальными интраэпителиальными неоплазиями различной степени тяжести и без морфологических изменений шейки матки была определена статистическая значимость различий, равная р=0,0002.
Вирус папилломы человека, вирусная нагрузка, интегрированная и эписомальная формы впч, шейка матки, онкогенные вирусы, выживаемость, прогностический фактор, физический статус вируса
Короткий адрес: https://sciup.org/140254229
IDR: 140254229 | УДК: 618.146-006-091.8-037-036.65:578 | DOI: 10.21294/1814-4861-2018-17-6-70-77
Текст научной статьи Физический статус вируса папилломы человека в прогнозе рецидивирования цервикальных интраэпителиальных неоплазий различной степени тяжести
Установлено, что вирус папилломы человека (ВПЧ) высокого канцерогенного риска (ВКР) является важнейшим фактором канцерогенеза шейки матки [1]. Данный вирус является эпите-лиотропным и при проникновении в организм инфицирует базальный слой эпителия. При этом главной мишенью для воздействия онкогенных типов вируса является зона трансформации шейки матки. Как следствие инфицирования ВПЧ ВКР наблюдаются морфологические изменения эпителия шейки матки, что приводит к развитию цервикальных интраэпителиальных неоплазий различной степени тяжести – LSIL (Low grade squamous intraepitelial lesion, низкая степень интраэпителиального повреждения плоского эпителия) и HSIL (High grade squamous intraepitelial lesion, высокая степень интраэпителиального повреждения плоского эпителия) с возможным последующим озлокачествлением [2].
По данным мировой литературы, в качестве стандартного показателя инфицирования вирусом применяется оценка вирусной нагрузки ВПЧ ВКР. Многократно показано, что клинически значимая вирусная нагрузка (>3 lg) статистически чаще наблюдается у больных с высокой степенью интраэпителиального повреждения плоского эпителия, по сравнению с пациентами с LSIL. Более того, подобная закономерность прослеживается и при уже сформировавшейся злокачественной патологии шейки матки: у больных раком шейки матки (РШМ) статистически чаще наблюдается клинически значимая вирусная нагрузка, чем у пациентов с интраэпителиальной неоплазией [3]. Однако, согласно результатам собственных предыдущих исследований, вирусная нагрузка не может выступать в качестве прогностического фактора при раке шейки матки и с ее помощью нельзя прогнозировать безрецидивную выживаемость [4].
Другим показателем вирусной инфекции, который исследуется в настоящее время, является физический статус вируса. Согласно современным литературным данным, ВПЧ после проникновения в клетку может существовать в 3 различных функциональных состояниях: эписомальной (свободной) форме (вне хромосом клетки), интегрированной (встроенной) (встроена в геном клетки) и смешанной форме (одновременное наличие свободного и встроенного в ДНК клетки-хозяина вируса) [5]. Нами было показано, что физический статус является прогностическим фактором при РШМ и с помощью его определения можно прогнозировать исход у больных РШМ [4]. Для формирования групп риска и планирования агрессивности терапии прогноз возникновения рецидивов важен не только при опухолевых заболеваниях шейки матки, но и при интраэпителиальной неоплазии. Мы предположили, что физический статус ВПЧ, так же как и при РШМ, будет иметь прогностическую значимость и при LSIL и HSIL.
Целью исследования явилось изучение частоты инфицирования ВПЧ при предопухолевых патологиях шейки матки и прогностической значимости вирусной нагрузки и физического статуса вируса 16 типа в отношении возникновения рецидивов интраэпителиальных неоплазий.
Материал и методы
В исследовании проанализированы данные 318 жительниц Томской области в возрасте от 19 до 83 лет, проходивших обследование и лечение в НИИ онкологии Томского НИМЦ. В соответствии с Хельсинкской декларацией (1964 г., с поправками, внесенными в 1975 и 1983 гг.) все больные подписывали информированное согласие на исследование. Проведение исследования одобрено этическим комитетом НИИ онкологии Томского НИМЦ.
Материалом для исследования служили соскобы эпителия цервикального канала и наружной части шейки матки. В зависимости от морфологических изменений шейки матки все пациентки были распределены на следующие группы: 150 женщин, не имеющих морфологических изменений шейки матки (средний возраст – 32,8 ± 0,4 года), и 168 пациенток с диспластическими изменениями шейки матки различной степени тяжести (средний возраст – 39,1 ± 0,5 года), в том числе 37 – с LSIL (cervical intraepithelial neoplasia grade I) и 131 больная – с HSIL (cervical intraepithelial neoplasia grade II–III).
Всем пациенткам было проведено комплексное обследование, которое включало гинекологический осмотр, кольпоскопию, проведение цитологического и гистологического исследований для последующей верификации диагноза. Далее было проведено вирусологическое исследование, включающее выявление и типирование ДНК вируса папилломы человека. После генотипирования ДНК ВПЧ была выделена группа с носительством моноинфекции ВПЧ-16 генотипа (n=132), включающая 76 пациенток без морфологических изменений шейки матки, 20 – с LSIL и 112 – с HSIL. Для последней группы больных было проведено определение физического статуса ДНК ВПЧ 16 типа.
Качественное и количественное определение ДНК ВПЧ было проведено при помощи метода Real-Time PCR (RotorGene 6000, «Corbett Research») с использованием комплектов реагентов фирмы «Amplisens®» («АмплиСенс® ВПЧ ВКР скрин-титр-FL», «АмплиСенс® ВПЧ ВКР генотип-FL»). Значение вирусной нагрузки рассчитывалось в геномных эквивалентах ДНК ВПЧ/105 клеток, порог релевантного количества вируса принимался равным 3 lg ДНК ВПЧ/105 клеток в соскобе. Значение <3 lg ДНК ВПЧ/105 клеток считали как клинически малозначимую (низкую) вирусную нагрузку, значение >3 lg ДНК ВПЧ/105 клеток – как клинически значимую (высокую) вирусную нагрузку. Аналогично было проведено определение физического статуса ДНК ВПЧ 16 типа. Определение функционального состояния ВПЧ-16 было проведено следующим образом: выявление области Е6 при отсутствии области E1/Е2 расценивалось как интеграция вируса в ДНК человека, выявление области Е6 при наличии области E1/Е2 интерпретировалось как смешанная форма (частичная интеграция) вируса в ДНК человека, отсутствие области Е6 при наличии области E1/ Е2 – как эписомальная форма вируса.
Статистический анализ полученных результатов проводился с использованием критерия Фишера для оценки статистической значимости различий в распределении частот качественных признаков между группами, калькулятор использован для таблицы 2×3 (тест χ2). Для оценки влияния внутриклеточного статуса ВПЧ-16, вирусной нагрузки и тяжести дисплазии на частоту рецидивирования применяли лог-ранговый критерий, для построения прогностической модели развития рецидивов использовали критерий Кокса.
Результаты
Общая инфицированность ВПЧ ВКР среди пациенток без морфологических изменений шейки матки составила 50,7 % (76/150); в группе пациенток с LSIL и НSIL – 78,5 % ((20 и 112)/168, соответственно), (p=1,4×107, OR (95 CI %) = 3,50 (2,19–5,81) по сравнению с группой обследованных без морфологических изменений шейки матки. Анализ частоты встречаемости различных типов ВПЧ ВКР показал, что в Томской области ВПЧ-16 встречается в 65,8 % (50/76) случаев среди женщин без морфологических изменений шейки матки и в 79,5 % (105/132) среди пациенток с цервикальными интраэпителиальными неоплазиями различной степени тяжести ((p=0,03, OR (95 CI %) = 2,00 (1,07–3,82) по сравнению с пациентками без морфологических изменений шейки матки. Полученные по инфицированности ВПЧ-16 генотипа данные согласуются с мировыми литературными и ранее полученными собственными результатами по распространенности данного типа вируса в Томском регионе [6, 7]. Однако наряду с очевидным превалированием ВПЧ-16 типа в Томской области выявлены некоторые особенности в частоте встречаемости других типов ВПЧ. Так, 2 и 3-е место занимают ВПЧ 33 и 31 типа (11,9 и 10,4 % соответственно) (табл. 1). Согласно литературным данным, в большинстве регионов мира 18 тип исследуемого вируса занимает по распространению вторую позицию, тогда как среди пациенток, живущих в Томской области, данный тип вируса по ча- таблица 1 распределение частот генотипов вПЧ в сравниваемых группах
|
Типы ВПЧ ВКР |
Количество и частота носителей среди ВПЧ+ пациенток без морфологических изменений шейки матки (n=76) |
Количество и частота носителей среди ВПЧ+ пациенток с LSIL и HSIL (CIN I–III) (n=132) |
|
ВПЧ 16 |
50 (65,8 %) |
105 (79,5 %) |
|
ВПЧ 33 |
8 (10,5 %) |
25 (18,9 %) |
|
ВПЧ 31 |
7 (9,2 %) |
9 (6,8 %) |
|
ВПЧ 18 |
9 (11,8 %) |
16 (12,1 %) |
|
ВПЧ 56 |
9 (11,8 %) |
18 (13,6 %) |
|
ВПЧ 52 |
2 (2,6 %) |
11 (8,3 %) |
|
ВПЧ 39 |
5 (6,6 %) |
6 (4,6 %) |
|
ВПЧ 51 |
6 (7,9 %) |
10 (7,6 %) |
|
ВПЧ 35 |
3 (3,9 %) |
6 (4,6 %) |
|
ВПЧ 45 |
3 (3,9 %) |
9 (6,8 %) |
|
ВПЧ 58 |
1 (1,3 %) |
12 (9,1 %) |
|
ВПЧ 59 |
0 (0 %) |
9 (6,8 %) |
Примечание: частота встречаемости каждого типа ВПЧ рассчитывалась от общего количества ВПЧ+ пациенток в группе.
таблица 2
вирусная нагрузка у женщин с различными морфологическими состояниями шейки матки
|
ВПЧ+ пациентки (n=208) |
Низкая вирусная нагрузка (клинически малозначимая) |
Высокая вирусная нагрузка (клинически значимая) |
р-level |
RR (95 % CI) – RiskRatio |
|
Без морфологических изменений шейки матки (n=76) |
60 (78,7 %) |
16 (21,3 %) |
||
|
LSIL (n=20) |
13 (65,0 %) |
7 (35, 0 %) |
р1=0,16 |
1,66 (0,79–3,48) |
|
HSIL (n=112) |
39 (34,8 %) |
73 (65,2 %) |
р1=1,55×10-9 р2=0,01 |
3,1 (1,96–4,88) 1,86 (1,01–3,44) |
|
LSIL + HSIL (CIN I–III) (n=132) |
52 (39,4 %) |
80 (60,6 %) |
р1=2,04×10-8 |
2,88 (1,82–4,55) |
Примечания: р1 – различия статистически значимы по сравнению с группой пациенток без морфологических изменений шейки матки, р2 – с группой LSIL.
стоте встречаемости находится только на 4-м месте [7]. Тем не менее нельзя говорить об уникальности распределения ВПЧ ВКР в исследуемой выборке пациенток, так как опубликованы данные о смене превалирующих типов ВПЧ. Например, в Читинской области при проведении вирусологического исследования по определению наличия ВПЧ ВКР среди 200 пациенток, обратившихся в поликлинику, у 85 (42,5 %) было подтверждено наличие ВПЧ ВКР, однако по частоте встречаемости типы вируса папилломы расположились следующим образом: ВПЧ-16 – 17,7 %, ВПЧ-56 – 16,3 %, ВПЧ-39 – 13,6 %; ВПЧ-31 – 10,9 %, остальные типы ВПЧ встречались менее чем в 8 % случаев [8]. Помимо отчетливого лидирования ВПЧ-16 типа среди всех обследованных пациенток, не было установлено существенных различий по частотам распределения генотипов остальных типов ВПЧ в группах пациенток без морфологических изменений шейки матки и женщин с LSIL и НSIL (табл. 1).
При определении концентрации ДНК вируса в исследуемых образцах (вирусной нагрузки) было выявлено, что количество пациенток с показателем клинически малозначимой вирусной нагрузки, для которой установлена слабая связь с риском развития цервикальной интраэпителиальной неоплазии и рака шейки матки [9, 10], в группе женщин без морфологических изменений шейки матки составило 78,7 %; в группе больных LSIL + HSIL – 32,5 %. При этом показатель клинически значимой вирусной нагрузки, для которого установлен высокий уровень корреляции с риском возникновения CIN и РШМ, у женщин без морфологических изменений шейки матки составил 21,3 %; в группе больных LSIL и HSIL – 67,4 % (p=6,1×10-11 по сравнению с женщинами без морфологических изменений) (табл. 2).
В группе ВПЧ-16-позитивных пациенток по мере изменения морфологической перестройки эпителия шейки матки – от пациенток без морфологических изменений эпителия шейки матки к пациенткам с диагнозом HSIL – увеличивалась частота встречаемости интегрированных и смешанных форм ВПЧ, тогда как частота эписомальных форм ВПЧ снижалась по аналогичному принципу. Сравнение частоты всех трех форм ВПЧ между пациентками без морфологических изменений шейки матки и больными с диагнозом LSIL и HSIL выявило значимость различий по критерию χ2 (р=0,0002) (рис. 1А). При этом анализ распределения частот
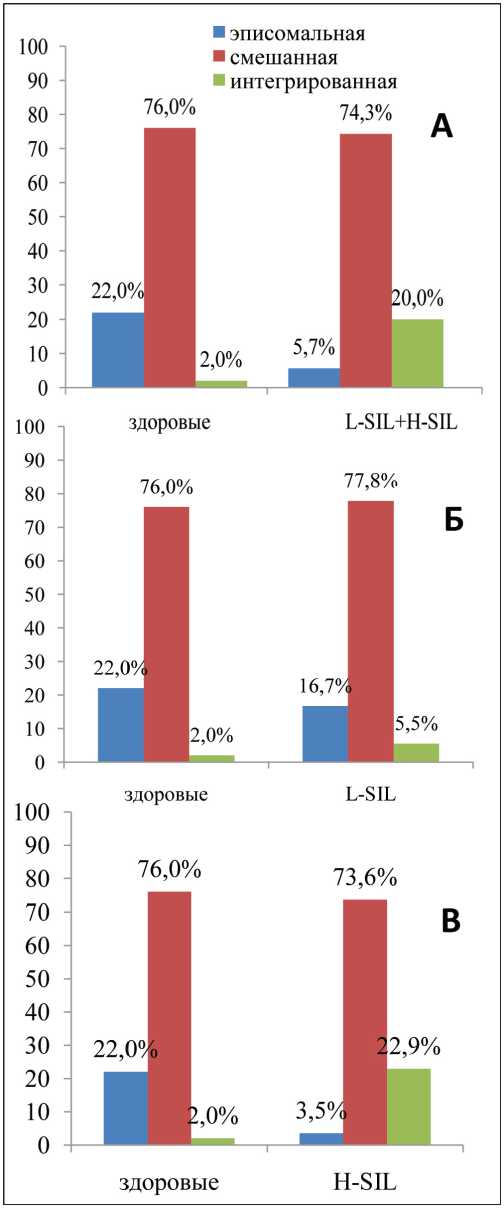
Рис. 1. Распределение частот различных форм ВПЧ-16 в группах наблюдения
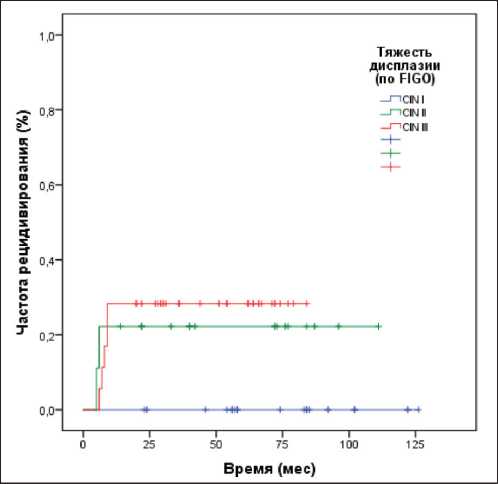
Рис. 2. Частота рецидивирования интраэпителиальной неоплазии в зависимости от степени тяжести неоплазии (p=0,021). Примечание: значимость при парном сравнении: I/II p=0,013, II/III p=0,759, I/III p=0,004
всех трех форм ВПЧ между больными с LSIL и пациентками без морфологических изменений шейки матки не показал значимых различий (рис. 1Б), и, напротив, при сравнении распределения частот всех трех форм ВПЧ между больными с HSIL и пациентками без морфологических изменений шейки матки была выявлена значимость различий на уровне р<0,0001 (рис. 1В). Аналогично, сравнение распределения частот всех трех форм ВПЧ между группой больных LSIL + HSIL и пациентками без морфологических изменений шейки матки показало статистическую значимость различий на уровне р=0,003 (данные не представлены).
Последним этапом работы было проведение анализа риска возникновения рецидивов при цервикальных интраэпителиальных неоплазиях различной степени тяжести в зависимости от степени дисплазии и изученных вирусологических показателей (вирусной нагрузки и физического статуса вируса). Было проанализировано влияние на частоту рецидивирования следующих показателей: степени тяжести дисплазии, внутриклеточного статуса ВПЧ (физический статус) и вирусной нагрузки. Статистический анализ (log rank test) показал, что среди ВПЧ-16-позитивных пациенток частота рецидивирования зависит от степени тяжести дисплазии (p=0,021) (рис. 2) и от формы интеграции вируса (p=0,000) (рис. 3). При этом было установлено отсутствие влияния клинически значимой вирусной нагрузки на частоту возникновения рецидивов в группе пациенток с CIN I–III (р=0,128) (рис. 4). В этой связи было построено уравнение регрессии Кокса, позволяющее создать прогностическую модель возникновения
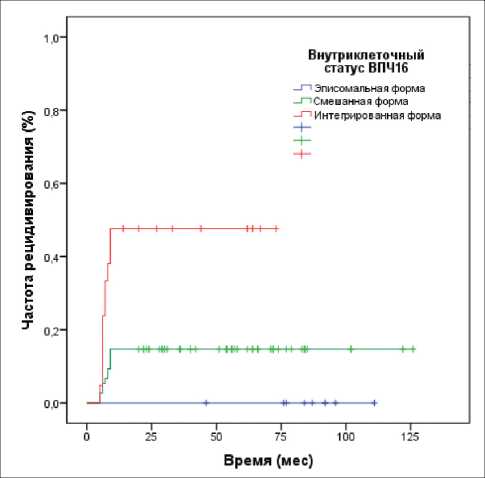
Рис. 3. Частота рецидивирования интраэпителиальной неоплазии в зависимости от внутриклеточного статуса ВПЧ (p=0,000). Примечание: значимость при парном сравнении: Э/С p=0,232, С/И p=0,001, Э/И=0,017
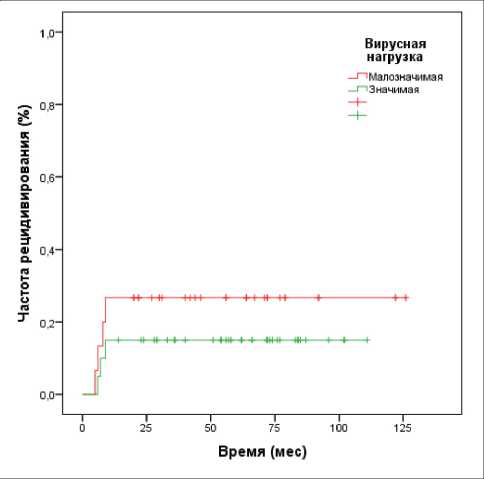
Рис. 4. Частота рецидивирования интраэпителиальной неоплазии в зависимости от вирусной нагрузки ВПЧ (p=0,128)
рецидивов у ВПЧ-позитивных пациенток, которое учитывало оба статистически значимых показателя в качестве переменных. Однако при анализе по критерию Кокса выявлено, что значимый вклад в частоту рецидивирования вносит только статус ВПЧ (p=0,006), в то время как влияние степени дисплазии оказалось незначимым (p=0,126). Таким образом, данные логистической регрессии свидетельствуют о том, что для определения риска реци-дивирования, наряду с тяжестью дисплазии, имеет значение физический статус ВПЧ-16. Вероятность возникновения рецидива определяется логистической функцией по следующей формуле:
f(y)=1/(1+e^(-y)), y=0,594×(а1)+1,196×(а2), где а1 – степень дисплазии; а2 – физический статус ВПЧ.
Обсуждение
Ввиду высокой степени спонтанной элиминации ВПЧ [13] даже подтверждённое инфицирование вирусом высокого онкогенного риска не позволяет прогнозировать вероятность развития и рецидиви-рования предопухолевых патологий, поэтому крайне важно учитывать другие показатели ВПЧ-инфекции, которые коррелируют с тяжестью патологического процесса и позволяют персонализированно оценивать риск злокачественной трансформации. Согласно литературным данным, важным показателем онкогенности вируса является концентрация ДНК вируса. Установлено, что клинически значимая вирусная нагрузка при различных патологиях шейки матки является фактором риска развития дисплазии тяжелой степени и РШМ [11].
Анализ полученных нами результатов позволяет предположить, что вирусная нагрузка может быть использована для оценки риска развития дисплазии тяжелой степени, однако в настоящий момент это доказано только для ВПЧ-16 типа [12]. Нельзя опровергнуть тот факт, что для каждой женщины в течение жизни достаточно высока вероятность оказаться в группе носительниц ВПЧ-инфекции [14]. Инфицирование ВПЧ реализуется в цервикальные неоплазии в течение 6 мес. Трансформация персистирующей инфекции в злокачественное новообразование через ряд промежуточных этапов обычно занимает от 10 до 20 лет, но редко может развиться и за 1–2 года, в данном случае большое значение имеет вероятность быстрой элиминации вируса, и, как правило, в 90 % случаев ВПЧ-инфекция в течение нескольких месяцев может быть самопроизвольно элиминирована из организма носителя [13]. Однако вероятность и скорость элиминации вируса из клетки-хозяина определяется совокупностью многих факторов. Особую роль при этом играет функциональное состояние ВПЧ, т.е. нахождение его в эписомальной, интегрированной или смешанной формах. Встраивание ДНК вируса в ДНК клетки-хозяина является ключевым событием в опухолевой трансформации эпителиальных клеток. Более того, предполагается, что риск рецидива увеличивается за счет пролиферативных процессов, геномной нестабильности и мутаций в инфицированной клетке, вызванных встроенной (интегрированной) в ДНК клетки-хозяина формой ВПЧ [15, 16].
Заключение
Показана значимая связь смешанной и интегрированной форм вируса 16 типа с риском развития рецидивов интраэпителиальной неоплазии. По-видимому, удаление очага CIN в процессе лечения не позволяет полностью элиминировать интегрированные формы вируса из окружающих
Список литературы Физический статус вируса папилломы человека в прогнозе рецидивирования цервикальных интраэпителиальных неоплазий различной степени тяжести
- Bosch F.X. Human papillomavirus: science and technologies for the elimination of cervical cancer. Expert Opin Pharmacother. 2011 Oct; 12 (14): 2189-204. DOI: 10.1517/14656566.2011.596527
- Apgar B.S., Zoschnick L., Wright T.C.Jr. The 2001 Bethesda System terminology. Am Fam Physician. 2003 Nov 15; 68 (10): 1992-8.
- Bruni L., Diaz M., Castellsagué M., Ferrer E., Bosch F.X., de Sanjosé S. Cervical human papillomavirus prevalence in 5 continents: meta-analysis of 1 million women with normal cytological findings. J Infect Dis. 2010 Dec 15; 202 (12): 1789-99. DOI: 10.1086/657321
- Ibragimova M., Tsyganov M., Shpileva O., Churuksaeva O., Bychkov V., Kolomiets L., Litviakov N. HPV status and its genomic integration affect survival of patients with cervical cancer. Neoplasma. 2018 Mar 14; 65 (3): 441-448. DOI: 10.4149/neo_2018_170414N277
- Jiang M., Baseman J.G., Koutsky L.A., Feng Q., Mao C., Kiviat N.B., Xi L.F. Sequence variation of human papillomavirus type 16 and measurement of viral integration by quantitative PCR. J Clin Microbiol. 2009 Mar; 47 (3): 521-6. DOI: 10.1128/JCM.02115-08


