Физико-химическая и биохимическая характеристика смешанной слюны на различных сроках после дентальной имплантации
Автор: Зекий Ангелина Олеговна
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 4 (14), 2015 года.
Бесплатный доступ
В исследовании проведено сравнение физико-химических (pH, буферная емкость, вязкость) и биохимических (концентрации альбумина, кальция, фосфатов, активность a - амилазы и щелочной фосфатазы) показателей в смешанной слюне (ротовой жидкости, РЖ) лиц спустя 2-4 месяца и 5-11 месяцев после установки дентальных имплантатов и лиц с санированной полостью рта и удовлетворительным состоянием гигиены. Значение pH РЖ практически не различалось у лиц группы сравнения, а также на разных сроках после имплантации и при разном числе имплантатов. Буферная емкость РЖ в различные сроки после установки единичных имплантатов варьировала в пределах, характерных для группы сравнения. В сроки 2-4 месяца после установки трех и более имплантатов отмечалось уменьшение буферной емкости РЖ в 2,4 раза, в последующем это снижение восстанавливалось не полностью. Установка единичных имплантатов не сопровождалась изменением вязкости РЖ, в то время как при множественной дентальной имплантации на сроках 2-4 месяца вязкость была в 2,1 раза меньше, чем в группе сравнения. Показано, что изменения ряда биохимических показателей в РЖ, вызванные присутствием дентальных имплантатов в организме, зависят от их числа и сроков с момента начала нагрузки на установленные конструкции. Таким образом, наиболее значимые изменения заключаются в снижении буферной емкости и вязкости РЖ, концентрации ионов кальция, а также активности a - амилазы и сохраняются на сроках 5-11 месяцев с момента имплантации. Эти изменения сопоставлены с возможными функциональными свойствами РЖ, которые могут влиять на адаптацию зубо-челюстной системы к новым условиям функционирования, связанным с установкой дентальных имплантатов.
Дентальная имплантация, слюна, ротовая жидкость, буферная емкость, электролиты, амилаза, щелочная фосфатаза
Короткий адрес: https://sciup.org/14967481
IDR: 14967481 | УДК: 616.314-0 | DOI: 10.15688/jvolsu11.2015.4.3
Текст научной статьи Физико-химическая и биохимическая характеристика смешанной слюны на различных сроках после дентальной имплантации
Успехи ортопедической стоматологии, обусловленные появлением новых диагностических и лечебных технологий, привели к тому,
что дентальная имплантация претендует на роль «золотого стандарта» в восстановлении утраченных зубов. Число операций в крупных стоматологических клиниках исчисляется тысячами в год с эффективностью свыше 95 %, а в отдельных возрастных группах городского населения развитых стран доля людей с дентальными имплантатами приближается к 20 % [1; 12; 13; 24].
На настоящий момент наиболее часто для внутрикостной имплантации используются винтовые внутрикостные титановые имплантаты, прочность их прикрепления к кости (остеоинтеграция) обеспечивается за счет химической и биологической связи оксида титана непосредственно с костным матриксом [6; 17]. Именно с частичной утратой этой связи, бактериальным заселением образовавшихся зазоров и развитием воспаления окружающих тканей связывают основные причины неудач дентальной имплантации [3; 7; 14].
Полноценное функционирование имплантата и установленной на него ортопедической конструкции начинается спустя несколько месяцев с момента имплантации, когда область остеоинтеграции уже полностью закрыта твердыми и мягкими тканями, а между десной и шейкой имплантата сформирован аналог десневой борозды – периимплантаци-онная борозда (peri-implant sulcus), заполненная собственным секретом [8; 10; 15].
Смешанная слюна (РЖ) в настоящее время широко используется в качестве биоматериала для неинвазивного определения различных состояний, как в полости рта, так и в организме в целом [4; 21]. Поскольку наличие дополнительных секретирующих тканей в области имплантации может оказывать влияние на состав и свойства РЖ, нам представилось целесообразным исследовать ее на этот предмет у пациентов с различной длительностью функционирования дентальных имплантатов.
Цель работы
Выявить особенности физико-химических свойств и биохимического состава ротовой жидкости лиц, имеющих функционирующие дентальные имплантаты, в зависимости от их количества и сроков функционирования.
Материал и методы исследования
Основную группу составили 102 пациента (40 мужчин и 62 женщины) в возрасте от 21 до 74 лет, которым были установлены винтовые титановые имплантаты: Touareg (ADIN Dental implant systems Ltd, Израиль) – 21 пациенту (41 имплантат); SPI (Alpha-Bio. Tec. Ltd, Израиль) – 81 пациенту (183 имплантата). Единичные (один-два) имплантаты были установлены 68 пациентам, множественные (три и более) – 34 пациентам. Исследование РЖ у этих лиц проведено в сроки от 2 до 11 месяцев с момента установления абатментов: у 53 пациентов (21 мужчина и 32 женщины) в сроки от двух до четырех месяцев, у 49 (19 мужчин и 30 женщин) – в сроки 5–11 месяцев. В качестве группы сравнения были обследованы образцы РЖ у 37 человек (15 мужчин и 22 женщины возраста 28–63 лет), обратившихся в планово-профилактическом порядке к стоматологу и не имеющих на момент обследования заболеваний твердых тканей и/ или пародонта, состояние гигиены полости рта у которых было удовлетворительным. Половозрастной состав двух клинических групп был достаточно сходным (см. табл. 1).
В качестве биологического материала использовали смешанную слюну, или РЖ. Сбор материала проводили натощак, в состоянии покоя, строго с 8.00 до 9.00, учитывая циркадианные особенности биохимического
Таблица 1
Половозрастная характеристика обследованнных групп
Определение pH проводили сразу после получения РЖ при помощи прибора «Acorn pH5 series pH/oC Meter» (Oakton, США). Перед каждым последующим определением электрод промывался в физиологическом растворе и дважды – в дистиллированной воде. Отдельно 1 мл слюны смешивали с 1мл 0,01н раствора соляной кислоты, после чего также определяли pH. Эффективную буферную емкость при закислении (BA, мг-экв./л) рассчитывали по формуле:
BA = 10 / (pH0– рНA), где 10 – коэффициент пересчета на 1,0 л слюны; pH0– значение pH исходной РЖ; рНA– значение pH при добавлении кислоты.
Вязкость РЖ определяли на ротационном вискозиметре DV-II+ (Brookfield, США) с использованием специального адаптера для образцов малого объема. Значения показателя выражали в Па х с.
Биохимические исследования РЖ проводили на автоматическом анализаторе «SINOWA B-300», с помощью коммерческих наборов реактивов фирмы «DiaSys» (Германия). Определяли концентрации альбумина (г/л), ионов кальция (ммоль/л), фосфатов (ммоль/л), активности a -амилазы (мкКат/л) и щелочной фосфатазы (мкКат/л) в соответствии с инструкциями производителя.
Статистический анализ проводили с помощью программного пакета Statistica 8.0 (StatSoft Inc., США). На основании критериев Колмогорова–Смирнова и Шапиро–Уилка было не подтверждено нормальное распределение в выборке, в связи с чем были использованы непараметрические критерии: распределение в выборках выражали в виде медианы и интервала между первым и третьим квартилем (Ме [Q1 + Q3]), при сравнении выборок использовали критерий Манна–Уитни ( p < 0,01) [2].
Результаты исследования
Данные о величинах отдельных физикохимических показателей в РЖ у лиц исследуемых групп приведены в таблице 2.
Значение pH РЖ оказалось весьма консервативным показателем, и при данных способах получения биоматериала величина показателя практически не различалась у лиц группы сравнения, а также на разных сроках после имплантации и при разном числе имплантатов.
Буферная емкость РЖ в различные сроки после установки единичных имплантатов также варьировала в пределах, характерных для группы сравнения. В то же время в сроки 2–4 месяца после установки трех и более имплантатов отмечалось уменьшение буферной емкости в 2,4 раза ( p < 0,01), на сроке 5–11 месяцев после имплантации это снижение восстанавливалось не полностью. Исследование вязкости РЖ также показало, что установка единичных имплантатов не сопровождается изменением ее значения в РЖ, тогда как при множественной дентальной имплантации на сроках 2–4 месяца регистрируется низкая ве-
Таблица 2
Физико-химическая характеристика РЖ пациентов в различные сроки после дентальной имплантации и лиц группы сравнения (Ме [Q1 ÷ Q3])
|
Показатель |
Группа сравнения ( n = 37) |
Основная группа |
||
|
Количество имплантатов |
2–4 месяца ( n = 53) |
5–11 месяцев ( n = 49) |
||
|
pH |
6,80 [6,63 ÷ 7,01] |
1–2 |
6,69 [6,56 ÷ 6,92] |
6,65 [6,47 ÷ 6,97] |
|
> 2 |
6,55 [6,42 ÷ 6,80] |
6,61 [6,39 ÷ 7,00] |
||
|
B A , мг-экв./л |
7,9 [7,3 ÷ 8,4] |
1–2 |
7,1 [6,6 ÷ 7,8] |
7,6 [6,9 ÷ 8,3] |
|
> 2 |
3,3 [2,9 ÷ 4,7] * |
5,2 [3,7 ÷ 6,8] |
||
|
Вязкость, Па × ?с |
0,15 [0,12 ÷ 0,19] |
1–2 |
0,12 [0,06 ÷ 0,17] |
0,20 [0,11 ÷ 0,27] |
|
> 2 |
0,07 [0,04 ÷ 0,11] * |
0,17 [0,09 ÷ 0,25] |
||
Примечание . «*» – p < 0,01 с группой сравнения по критерию Манна – Уитни.
личина вязкости РЖ – в 2,1 раза меньше, чем в группе сравнения ( p < 0,01).
Данные о динамике отдельных биохимических показателей в РЖ у лиц исследуемых групп приведены в таблице 3.
Концентрация альбуминов в РЖ варьировала в группе сравнения от 0,47 до 0,68 г/л, в подгруппах основной группы – от 0,36 до 0,72 г/л, для периода 2–4 месяца в подгруппе с множественной имплантацией было характерно низкое значение показателя – в 1,4 раза меньше, чем в группе сравнения ( p < 0,01).
Концентрация ионов кальция в РЖ у пациентов основной группы через 2–4 месяца с момента нагрузки на имплантаты была ниже, чем у пациентов группы сравнения, в 1,7– 2,2 раза (p < 0,01), и тем ниже, чем больше имплантатов было установлено. Это снижение нормализовалось на сроках 5–11 месяцев у пациентов с единичными имплантатами, но сохранялось сниженным при множественной дентальной имплантации.
Содержание фосфатов в РЖ снижалось в гораздо меньшей степени, достоверные изменения зарегистрированы лишь в подгруппе с множественной дентальной имплантацией на сроках 2–4 месяца. Активность a -амилазы у большинства пациентов основной группы была значительно ниже, чем у пациентов группы сравнения, достоверные различия выявлялись во всех подгруппах. В противовес этому существенных отклонений от показателей в группе сравнения в отношении активности щелочной фосфатазы не было выявлено.
Анализируя полученные результаты, прежде всего остановимся на происхождении исследованных компонентов РЖ и опосредуемых ими свойств (см. рисунок).
Таблица 3
Отдельные биохимические характеристики РЖ пациентов в различные сроки после дентальной имплантации и лиц группы сравнения (Ме [Q1 ÷ Q3])
|
Показатель |
Группа сравнения ( n = 37) |
Основная группа |
||
|
Количество имплантатов |
2–4 месяца ( n = 53) |
5–11 месяцев ( n = 49) |
||
|
Альбумин, г/л |
0,56 [0,47 ÷ 0,68] |
1–2 |
0,51 [0,42 ÷ 0,64] |
0,59 [0,44 ÷ 0,72] |
|
> 2 |
0,40 [0,30 ÷ 0,48] * |
0,52 [0,39 ÷ 0,68] |
||
|
Кальций, ммоль/л |
1,60 [1,24 ÷ 1,88] |
1–2 |
0,94 [0,62 ÷ 1,03] * |
1,40 [1,17 ÷ 1,72] |
|
> 2 |
0,74 [0,47 ÷ 0,81] * |
1,22 [0,92 ÷ 1,53] * |
||
|
Фосфаты, ммоль/л |
5,85 [4,22 ÷ 7,07] |
1–2 |
4,95 [4,54 ÷ 4,48] |
5,59 [4,77 ÷ 6,14] |
|
> 2 |
4,25 [3,87 ÷ 4,69] * |
5,43 [4,60 ÷ 5,97] |
||
|
α-Амилаза, мкКат/л |
4,82 [4,05 ÷ 5,62] |
1–2 |
2,17 [1,48 ÷ 3,03] * |
2,35 [1,50 ÷ 3,18] * |
|
> 2 |
2,33 [1,57 ÷ 3,24] * |
2,29 [1,39 ÷ 2,95] * |
||
|
Щелочная фосфатаза, мкКат/л |
1,58 [1,14 ÷ 1,85] |
1–2 |
1,42 [0,96 ÷ 1,86] |
1,60 [1,08 ÷ 2,29] |
|
> 2 |
1,75 [1,23 ÷ 2,44] |
1,84 [1,15 ÷ 2,42] |
||
Примечание. «*» – p < 0,01 с группой сравнения по критерию Манна – Уитни.
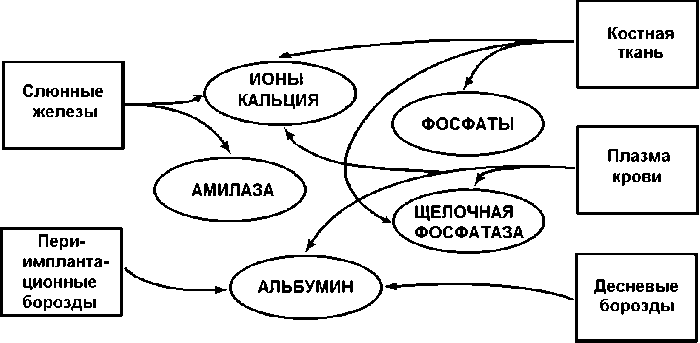
Основные источники изучаемых компонентов ротовой жидкости
Альбумин РЖ имеет комплексное происхождение, поступая в эту жидкость как в составе слюнного секрета, так и в составе большинства других секретов мягких тканей ротовой полости. Считается, что основным источником альбуминов в РЖ являются жидкость десневых борозд и, при их наличии, десневых карманов [19; 23]. Снижение альбуминов может быть результатом активного поглощения микрофлорой [14]. Именно нарушение микробного баланса полости рта после дентальных имплантаций может быть основной причиной уменьшения альбуминов в РЖ, выявленное нами у пациентов основной группы в ранние сроки после множественной дентальной имплантации.
Амилаза РЖ попадает туда практически полностью из слюнных желез, из плазмы крови может вторично поступать только при массивных деструкциях поджелудочной железы [19]. Обнаруженное уменьшение амилолитической активности РЖ у пациентов с дентальными имплантатами имеет практическое значение в плане оценки изменений пищеварительной функции в полости рта у этих лиц. Как минимум эта интересная находка требует дальнейшего изучения. Щелочная фосфатаза в саливодиагностике рассматривается как маркер повышенной остеорезорбции и воспалительных заболеваний пародонта и периимплантитов [9; 11; 22]. В нашем исследовании подтверждено, что в подавляющем числе случаев после проведенной дентальной имплантации эти процессы не активируются, что свидетельствует об успешном течении периода адаптации к новым конструкциям в полости рта.
Что касается ионов кальция и фосфатов, то интерес к их соджержанию в РЖ обусловлен участием в минерализации твердых тканей зубов, а уменьшения трактуются как фактор риска патологии этих тканей. Выявленные снижения содержания кальция в РЖ пациентов спустя 5–11 месяцев после начала нагрузок на имплантаты следует трактовать именно с этих позиций. Механизм снижения требует дальнейшего изучения и объяснения, но, по всей видимости, он косвенно связан с потреблением кальция на процессы остеоинтеграции и ремоделирования кости, окружающей дентальные имплантаты.
Безусловно, взаимоотношения отдельных компонентов зубочелюстной системы в процессе адаптации к дентальным имплантатам могут быть конкретизированы при изучении секреции в РЖ специфических маркеров межклеточных сигнализации, таких как цитокины и факторы роста, а также ферментативных систем, участвующих в остеоинтеграции и ремоделировании кости [20; 22]. Вероятно, более информативными при этом являются исследования материала, максимально приближенного к имплантатам, такого как жидкость периимплантационной борозды, но эти исследования только начинаются [16; 18].
Список литературы Физико-химическая и биохимическая характеристика смешанной слюны на различных сроках после дентальной имплантации
- К вопросу об остеоинтеграции дентальных имплантатов и способах ее стимуляции/С. В. Поройский //Вестник Волгогр. гос. мед. ун-та. -2015. -№ 3 (55). -С. 6-9.
- Новиков, Д. А. Статистические методы в медико-биологическом эксперименте (типовые случаи) /Д.А. Новиков, В.В. Новочадов. -Волгоград: Изд-во ВолгГМУ, 2005. -84 с.
- Оценка изменения качества жизни пациентов с дефектами зубных рядов и заболеваниями пародонта до и после проведения протезирования и имплантации зубов/Е. В. Турусова //Сарат. н.-мед. журн. -2011. -Т. 7, № 3. -С. 689-692.
- Постнова, М. В. Ротовая жидкость как объект оценки функционального состояния организма человека/М. В. Постнова, Ю. А. Мулик, В. В. Новочадов//Вестник Волгоградского государственного университета. Серия 3, Экономика, экология. -2011. -№ 1. -С. 246-253.
- Циркадианная организация физико-химических свойств ротовой жидкости практически здоровых людей / В.И. Шемонаев и др. //Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. -2012. -Т. 17, № 4. -С. 243-249.
- A retrospective study on r elated factors affecting the survival rate of dental implants/H. W. Jang //J. Adv. Prosthodont. -2011. -Vol. 3, № 4. -P. 204-215.
- A review of dental implants and infection/A. D. Pye //J. Hosp. Infect. -2009. -Vol. 72, № 2. -P. 104-110.
- Bhardwaj, S. K. Comparative volumetric and clinical evaluation of peri-implant sulcular fluid and gingival crevicular fluid/S. K. Bhardwaj, M. L Prabhuji//J. Periodontal Implant Sci. -2013. -Vol. 43, № 5. -P. 233-242.
- Biofilm and saliva affect the biomechanical behavior of dental implants/D. Bordin //J. Biomechanics. -2015. -Vol. 48, Iss. 6. -P. 997-1002.
- Clinical outcomes measures for assessment of longevity in the dental implant literature: ORONet approach/F. Bassi //Int. J. Prosthodont. -2013. -Vol. 26, № 4. -P. 323-330.
- Current developments in salivary diagnostics/C. S. Miller //Biomark. Med. -2010. -Vol. 4, № 1. -P. 171-189.
- Harford, J. Population ageing and dental care/J. Harford//Com. Dent. Oral Epidemiol. -2009. -Vol. 37, № 2. -P. 97-103.
- Implant-supported mandibular overdentures in very old adults: a randomized controlled trial/F. Muller //J. Dent. Res. -2013. -Vol. 92, Suppl. 2. -P. 154S-160S.
- Early microbial succession in re-developing dental biofilms in periodontal health and disease/F. R. Teles //J. Periodontal. Res. -2012. -Vol. 47, № 1. -P. 95-104.
- Escoe, R. Saliva and dentures/R. Escoe//J. Am. Dent.Assoc. -2008. -Vol. 139, № 8. -P. 1028-1029.
- Gupta, G. Gingival crevicular fluid as a periodontal diagnostic indicator-I: Host derived enzymes and tissue breakdown products/G. Gupta//J. Med. Life. -2012. -Vol. 5, № 4. -P. 390-397.
- Interaction of titanium, zirconia and lithium disilicate with peri-implant soft tissue: study protocol for a randomized controlled trial/K. Kuhn //Trials. -2015. -Vol. 16. -P. 467.
- Kajale, A. M. Interleukin-1b level in peri-implant crevicular fluid and its correlation with the clinical and radiographic parameters/A. M. Kajale, D. S. Mehta//J. Indian Soc. Periodontol. -2014. -Vol. 18, № 2. -P. 220-225.
- Malamud, D. Saliva as a diagnostic fluid/D. Malamud, I. R. Rodriguez-Chavez//Dent. Clin. North Am. -2011. -Vol. 55, № 1. -P. 159-178.
- Release of bone markers in immediately loaded and nonloaded dental implants: a randomized clinical trial/A. J. Prati //J. Dent. Res. -2013. -Vol. 92 (12 Suppl.). -P. 161S-167S.
- Salivary biomarkers associated with gingivitis and response to therapy/B. Syndergaard //J. Periodontol. -2014. -Vol. 85, № 8. -Р. 295-303.
- Spielmann, N. Saliva: diagnostics and therapeutic perspectives/N. Spielmann, D. T. Wong//Oral Dis. -2011. -Vol. 17, № 4. -P. 345-354.
- Targeted salivar y biomarker s for discrimination of periodontal health and disease(s)/J. L.Ebersole //Front. Cell Infect. Microbiol. -2015. -Vol. 5. -P. 62.
- Tomasi, C. Longevity of teeth and implants: a systematic review/C. Tomasi, J. L. Wennström, T. J. Berglundh//Oral Rehabil. -2008. -Vol. 35, Suppl. 1. -P. 23-32.


