Физико-химические характеристики смешанных гелей кремниевой кислоты и оксигидрата лантана
Автор: Авдин Вячеслав Викторович, Алтынбаева Лилия Шарифулловна, Кривцов Игорь Владимирович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 31 (207), 2010 года.
Бесплатный доступ
Исследованы смешанные гели кремниевой кислоты и оксигидрата лантана, полученные при разных способах смешения реагентов и рН маточного раствора. Установлено, что введение нитрата лантана в раствор метасиликата натрия приводит к образованию смешанных гелей, состоящих из зёрен оксигидрата лантана, «вкрапленных» в матрицу силикагеля. Такие гели имеют низкую сорбционную активность; зёрна оксигидрата лантана склонны к деструкции в сорбате. Введение силиката натрия в раствор нитрата лантана приводит к формированию сополимера, имеющего высокую сорбционную активность. С ростом рН синтеза сорбционная ёмкость сополимерных смешанных гелей возрастает, а зернистых смешанных гелей - снижается.
Силикагелъ, оксигидраты лантана, смешанные гели, неорганические полимеры, термолиз, сорбционные свойства
Короткий адрес: https://sciup.org/147160175
IDR: 147160175 | УДК: 544.77+546.05
Текст обзорной статьи Физико-химические характеристики смешанных гелей кремниевой кислоты и оксигидрата лантана
Силикагели являются известными сорбционными материалами, которые широко применяются как в промышленности, так и в быту для поглощения газов, жидкостей, растворённых в воде веществ. Одним из способов модификации данных сорбентов является получение смешанных гелей кремниевой кислоты с оксигидратами тяжёлых металлов. Вопрос модификации силикагелей изучается как экспериментальными методами, так и при помощи компьютерного моделирования [1-3]. В отличие от индивидуальных силикагелей, особенности получения которых исследованы всесторонне, закономерности формирования смешанных гелей в настоящий момент изучены недостаточно. Их исследование осложняется аморфным характером и многообразием структур, образующихся при совместной полимеризации. Структура и свойства смешанных гелей зависят не только от природы металла, но и от порядка введения реагентов в маточный раствор. В данной работе исследованы сорбционные и термолитические характеристики, а также морфология поверхности смешанных гелей кремниевой кислоты и оксигидрата лантана, полученных при разном порядке введения реагентов в маточный раствор.
Эксперимент
Индивидуальные гели кремниевой кислоты (обозначение на рисунках и в табл. 2 «К») получали введением соляной кислоты (0,2 М) в раствор метасиликата натрия (0,2 М) при pH 4,0 и 5,0. Индивидуальные гели оксигидрата лантана (обозначение «Л») синтезировали введением раствора аммиака (0,2 М) в раствор нитрата лантана (0,2 М) при pH 8,2, 8,5, 9,0, 9,5. Смешанные гели получали при pH 5,0 и 6,0. Мольное соотношение гелеобразующих компонентов Si/La в маточном растворе составляло 1/1. Во всех случаях синтез осуществляли медленным гидролизом (время смешения реагентов - около 0,5 ч) с последующей 8-кратной отмывкой водой до отрицательной реакции на противоионы исходных солей, что проверяли по стандартным методикам [4]. Образцы сушили в эксикаторе над плавленым хлоридом кальция до прекращения изменения массы (« 2 мес. достигали постоянной массы оксигидраты лантана, ® 4 мес. - смешанные гели и » 6 мес. -силикагели). Синтезы, осуществлённые введением нитрата лантана в раствор метасиликата натрия, назвали «прямыми» (обозначение на рисунках и в таблице «КЛ»), введением метасиликата натрия в раствор нитрата лантана - «обратными» (обозначение «ЛК»),
Исследовали морфологию поверхности, сорбционные свойства и термолиз. Морфологию поверхности изучали на сканирующем электронном микроскопе «Jeol» JSM-6460 LV. Сорбционные свойства определяли стандартным методом изомолярных серий. В качестве сорбата использовали нитрат лантана, в который добавляли нитрат калия для постоянства ионной силы. Концентрации растворов нитрата лантана определяли трилонометрическим способом с ксиленоловым оранжевым в качестве индикатора.
Термолиз проводили на дериватографе «МоМ» Paulik-Paulik-Erdey 3434-С со скоростью нагрева 10 °С/мин., атмосфера - собственные пары, интервал температур - от комнатной до 900 °C, масса навески 70-72 мг. Для каждого образца получали не менее 4 термограмм. Кривые термогравиметрического (ТГ) и дифференциального термического анализа (ДТА) нормировали на массу навески 75 мг и усредняли, кривую ТГ численно дифференцировали (дифференциальную кривую обозначили ДТГ). Для анализа данных термолиза применили тот же подход, который изложен в работе [5] - кривые ДТГ и ДТА аппроксимировали кривыми Гаусса для разделения сложных эффектов, имеющих уширения, удвоения, плечи и т. д.
Результаты и их обсуждение
На рис. 1 представлены характерные изотермы сорбции исследованных гелей. Для оксигидратов лантана сорбционные свойства зависят от pH синтеза немонотонно, что соответствует результатам, представленным в работе [6]. Из исследованных образцов наиболее сорбирующими ионы лантана являются гели, синтезированные при pH 8,5, наименее сорбирующими — гели, полученные при pH 8,2. Сорбируемость ионов лантана индивидуальными силикагелями невелика, мало зависит от pH синтеза и близка к сорбируемости этих ионов на индивидуальных оксигидратах лантана.
Г, ммоль/г
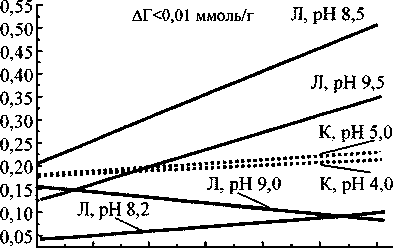
0,00 0,02 0,04 0,06 0,08 0,10 0,12
Ср, моль/л
а)
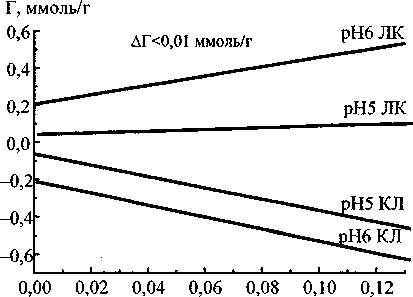
Ср, моль/л
б)
Рис. 1. Изотермы сорбции ионов лантана на индивидуальных оксигидратах лантана и силикагеля (а) и смешанных гелях (б), полученных «прямым» и «обратным» способами
Смешанные гели оксигидрата лантана и кремниевой кислоты, полученные «обратным» способом, сорбируют ионы лантана примерно так же, как индивидуальные оксигидраты лантана. Повышение pH синтеза смешанных гелей приводит к возрастанию сорбционных свойств. Смешенные гели, полученные «прямым» способом, проявляют заметную склонность к деструкции в растворе нитрата лантана, которая возрастает с увеличением pH синтеза образцов. Эта особенность наблюдается для полученных в аналогичных условиях индивидуальных гелей оксигидратов редкоземельных элементов, для которых деструкция в растворе собственной соли является распространённым явлением [6-8].
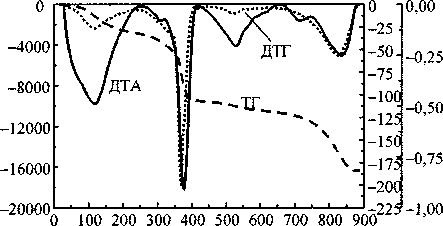
Термограммы исследованных гелей показаны на рис. 2-4. Термолиз оксигидрата лантана и смешанных гелей протекает до 880 °C. Профиль кривых ДТА и ДТГ имеет сложный вид. Аппроксимация позволяет выделить 9-10 стадий для оксигидрата лантана (табл. 1) и 7-8 - для смешанных гелей (табл. 2). Каждому типу связанной воды (адсорбированная влага, концевые ОН-группы, мостиковые Н2О-, ОН-группы) соответствует 2-3 эндоэффекта, что свидетельствует о наличии в геле нескольких областей с различным составом и, вероятно, с различной структурой.
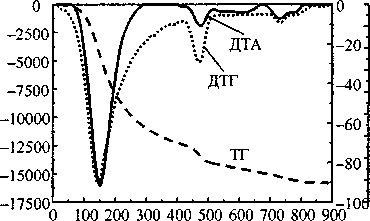
Термолиз силикагеля протекает наиболее просто (рис. 4). Термическая деструкция в основном завершается при температуре 250 °C. Аппроксимация позволяет выделить 2 эндоэффекта, соответствующих дегидратации адсорбированной воды и деструкции концевых (силанольных) ОН-групп. В табл. 2 приведены результаты аппроксимации кривых ДТА и ДТГ индивидуального силикагеля, полученного при pH 5. Анализ образцов, синтезированных при pH 4 и 5, показывает, что в некоторых случаях наблюдается широкий (до 500 °C) эндоэффект дегидратации, заканчи-
Физическая химия
вающийся при температуре 700-800 °C, с небольшой площадью под гауссианом, полученным при аппроксимации кривой ДТГ. Эта вода, вероятно, соответствует влаге, образующейся при дегидратации концевых ОН-групп, находящихся далеко друг от друга.
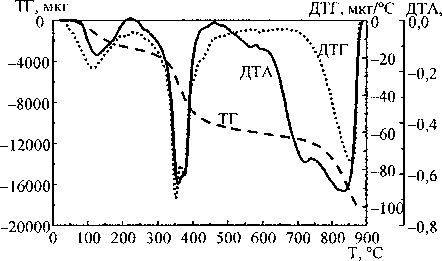
Рис. 2. Термограммы оксигидратов лантана, синтезированных при pH 8,5 (а) и при pH 8,2 (б), обладающие максимальными и минимальными сорбционными способностями
ТГ, мкг
ДТГ. мкгЛС ДТА, °C
б)
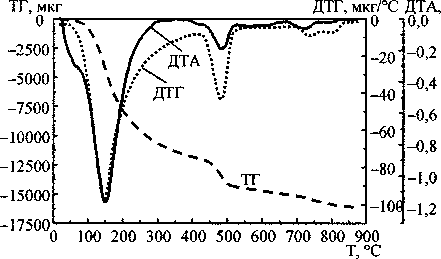
Рис. 3. Термограммы смешанных гелей, полученных «обратным» (а) и «прямым» (б) способами, обладающие максимальными и минимальными сорбционными способностями
ДТГ, мкг/°С ДТА, °C
ТГ, мкг
0,0
-0,1
-0,2
-0,3
-0,4
-0,5
-0,6
-0,7
-0,8
-0,9
Т, °C
б)
ТГ, мкг 0 Г
-40000 -
-15000
-20000
-35000 -
-25000 ■
-30000 ■
-5000
-10000
ДТА
ДТГ
ТГ
-45000.
ДТГ, мкг/°С ДТА, °C
-----п0 10
- -100
-2
; -200 ;-300
■-400
■ -500
■-600
■-700
-6
-8
-10
-12
-800
I ■ ' ■ ......1..... ■ 1 ■ '—900*
0 100 200 300 400 500 600 700 800 900 Т, °C
-14
Рис. 4. Типичная термограмма силикагеля, полученного при pH 4 и 5
Анализ результатов термолитических и сорбционных исследований показывает, что образцы, отличающиеся максимальными сорбциоными свойствами, имеют наибольшее количество химически связанной воды, отщепляющейся в интервале 420-600 °C. Вероятно, эта вода принадлежит сополимерным фрагментам, содержащим связи La-O-Si или La-OH-Si. Возможность образования таких связей подтверждается квантово-химическими расчётами [9].
Микроэлектронный анализ показывает, что полученный и «отмытый» смешанный гель состоит в основном из силикагеля с примесью лантаногеля. Отношение Si/La (в мольных долях) в образцах, полученных «прямым» способом, составляет «8/1, «обратным» - « 5/1. На электронных микрофотографиях, сделанных в режиме упруго рассеянных электронов (рис. 5; светлые точки - зёрна оксигидрата лантана), видно, что в образцах, полученных «обратным» способом, количество зёрен, содержащих оксигидрат лантана невелико; гель в основном представляет собой сополимер. В гелях, полученных «прямым» способом, зёрна оксигидрата лантана внедрены в непрерывную фазу силикагеля. Оксигидраты лантана, полученные в данных условиях, имеют много нестабильных малоупорядоченных участков, которые растворяются в нитрате лантана, что снижает сорбционные свойства геля [10].
Таблица 1 Результаты аппроксимации кривых ДТА и ДТГ индивидуальных оксигидратов лантана
Т, - вершина, S - площадь, \Т- полуширина кривой Гаусса.
|
Кривая |
Параметры |
Значения параметров аппроксимации |
||||||||||||||||||
|
Оксигидрат лантана, полученный при pH 8,5 |
Оксигидрат лантана, полученный при pH 8,2 |
|||||||||||||||||||
|
ДТА |
Т„ °C |
123,8 |
167,4 |
349,0 |
356,6 |
380,6 |
565,6 |
720,6 |
813 |
852,5 |
58,2 |
117,3 |
340,2 |
370,8 |
381,6 |
522,9 |
610,9 |
717,2 |
804,8 |
843,9 |
|
S, °C2 |
7,21 |
3,13 |
19,6 |
13,9 |
8,84 |
10,4 |
72,3 |
40,7 |
14,7 |
4,87 |
53,8 |
10,2 |
11,5 |
15,1 |
18,5 |
1,26 |
4,73 |
13,5 |
7,20 |
|
|
АД °C |
21,4 |
17,3 |
44,4 |
12,4 |
9,70 |
44,2 |
52,3 |
31,0 |
15,0 |
14,2 |
44,4 |
35,1 |
11,7 |
10,9 |
39,0 |
17,2 |
24,4 |
28,4 |
16,5 |
|
|
ДТГ |
Т„ °C |
112,4 |
179,1 |
353,6 |
365,8 |
377,8 |
589,9 |
798,2 |
838,3 |
862,3 |
113,9 |
191,2 |
341,6 |
367,7 |
382,1 |
519,2 |
630,3 |
751,2 |
807,0 |
838,8 |
|
S, мкг |
1,79 |
1,17 |
1,42 |
4,64 |
0,86 |
2,26 |
2,75 |
2,36 |
1,10 |
1,74 |
1,39 |
2,89 |
2,72 |
1,05 |
0,76 |
0,48 |
1,58 |
2,52 |
1,55 |
|
|
ДД°С |
34,0 |
56,1 |
9,85 |
52,7 |
7,65 |
150 |
34,2 |
18,9 |
8,86 |
32,9 |
66,2 |
36,3 |
6,83 |
6,55 |
36,5 |
51,1 |
41,5 |
28,7 |
19,6 |
|
Таблица 2
Результаты аппроксимации кривых ДТА и ДТГ смешанных гелей и индивидуального силикагеля
|
Кривая |
Параметры |
Значения параметров аппроксимации |
||||||||||||||||
|
Смешанный гель ЛК, полученный при pH 6 |
Смешанный гель КЛ, полученный при pH 6 |
Силикагель |
||||||||||||||||
|
ДТА |
Ть °C |
142,0 |
151,5 |
192,5 |
438,0 |
482,4 |
578,1 |
719,3 |
792,8 |
151,3 |
218,4 |
340,7 |
472,6 |
593,0 |
653,4 |
797,7 |
98,6 |
117,5 |
|
S', °C2 |
91,5 |
31,8 |
1,84 |
2,73 |
7,68 |
5,95 |
3,71 |
0,91 |
51,6 |
7,08 |
0,42 |
3,65 |
7,60 |
6,39 |
26,5 |
469,1 |
368,8 |
|
|
ДД °C |
61,9 |
21,8 |
12,2 |
28,7 |
17,8 |
52,0 |
24,9 |
17,5 |
28,9 |
26,9 |
13,7 |
18,5 |
43,2 |
23,8 |
44,1 |
32,4 |
16,8 |
|
|
ДТГ |
Д, °C |
141,0 |
147,6 |
194,1 |
278,4 |
478,8 |
601,3 |
752,5 |
808,2 |
144,4 |
201,7 |
269,3 |
472,8 |
602,6 |
735,6 |
783,6 |
95,5 |
110,4 |
|
S', мкг |
4,75 |
0,28 |
3,27 |
4,48 |
1,88 |
0,51 |
1,04 |
0,07 |
5,27 |
2,91 |
4,10 |
1,07 |
2,00 |
0,21 |
0,16 |
22,2 |
19,3 |
|
|
ДД °C |
30,1 |
10,0 |
50,2 |
132 |
19,2 |
51,1 |
51,9 |
11,2 |
31,1 |
45,7 |
101 |
17,9 |
14,7 |
15,1 |
19,8 |
29,1 |
14,2 |
|
Пояснения см. к табл. 1

а)

б)
Рис. 5. Электронные микрофотографии, сделанные в режиме упруго рассеянных электронов, смешанных гелей оксигидратов лантана и кремниевой кислоты, полученных «обратным» (а) и «прямым способом» (б)
При проведении «прямого» синтеза капли нитрата лантана попадают в среду силиката натрия с высоким pH. Этот pH выше рН0С лантаногеля и ионы лантана гидролизуются и формируют зародыши оксигидрата. Если взаимодействие солей друг с другом невелико, то оксигидрат лантана формируется также, как и при получении индивидуального геля. Зёрна сформированного лантаногеля после смешения всех реагентов, оказываются внедрёнными в фазу силикагеля. При проведении «обратного» синтеза капли силиката натрия, попадая в нитрат лантана с низким pH, не успевают формировать зародыши поликремниевой кислоты в виду низкой скорости этой реакции при данных pH [И]. Вероятно, кремниевая кислота в начале процесса получения смешанного геля сополимеризуется с ионами лантана. При дальнейшем повышении pH маточного раствора скорость полимеризации кремниевой кислоты возрастает, что подавляет процесс сополимеризации. Непрореагировавший с силикатом натрия нитрат лантана начинает образовывать гранулы индивидуального лантаногеля, которые частично остаются в фазе смешанного геля, частично удаляются из образца при его промывке.
Физическая химия
На рис. 6 показана морфология поверхности смешанных гелей. Образцы, полученные «обратным» способом, имеют в составе упорядоченные образования, гели, полученные «прямым» способом в основном состоят их неупорядоченных структур.
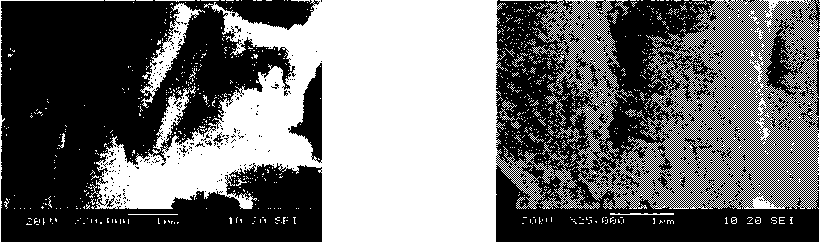
а) б)
Рис. 6. Электронные микрофотографии, сделанные в режиме вторичных электронов, смешанных гелей оксигидратов лантана и кремниевой кислоты, полученных «обратным» (а) и «прямым способом» (б)
Выводы
Введение нитрата лантана в раствор метасиликата натрия приводит к образованию смешанных гелей, состоящих из зёрен оксигидрата лантана, «вкрапленных» в матрицу силикагеля. Такие гели в основном претерпевают деструкцию в растворе нитрата лантана. С ростом pH синтеза образцов склонность данных гелей к деструкции возрастает. Введение силиката натрия в раствор нитрата лантана приводит к формированию сополимера, хорошо сорбирующего ионы лантана. С ростом pH синтеза сополимеров сорбируемость ионов лантана увеличивается. Смешанные гели кремниевой кислоты и оксигидрата лантана содержат не менее 80 мол. % силикагеля.
Работа выполнена при поддержке РФФИ и Правительства Челябинской области (проект № 07-03-96056-р_урала).
Список литературы Физико-химические характеристики смешанных гелей кремниевой кислоты и оксигидрата лантана
- Sheka, E.F. Computer modeling of amorphous silica structures/E.F. Sheka//React. Kinet. Catal. Lett. -1993. -Vol. 50, № 1-2. -P. 389.
- Sheka, E. From molecules to particles: Quantum-chemical view applied to fumed silica/E. Sheka, V. Khavryutchenko, E. Nikitina//J. of Nanoparticle Research. -1999. -Vol. 1. -P. 71-81.
- Матвейчук, Ю.В. Квантово-химическое исследование полимеризации в силикагеле и сопо-лимеризации в гелях ортокремниевой кислоты с гидроксидами иттрия и лантана/Ю.В. Матвейчук, А.А. Лымарь, В.В. Авдин//Вестник ЮУрГУ. Серия «Химия». -2009. -Вып. 1. -№ 12 (145). -С. 42-48.
- Лурье, Ю.Ю. Химический анализ производственных сточных вод/Ю.Ю. Лурье, А.И. Рыбникова. -М.: Химия, 1974. -336 с.
- Формирование оксигидратов иттрия и циркония в присутствии неионогенного ПАВ/В.В. Авдин, Т.В. Сафонова, А.А. Аксёнова, А.А. Лымарь//Вестник ЮУрГУ. Серия «Химия». -2010. -Вып. 3.-№ И (187).-С. 66-71.
- Сухарев, Ю.И. Синтез и периодичность свойств аморфного оксигидрата лантана/Ю.И. Сухарев, В.В. Авдин//Журн. неорган, химии. -1999. -Т. 44, № 7. -С. 1071-1077.
- Авдин, В.В. Сорбционные характеристики оксигидратов иттрия/В.В. Авдин, Ю.И. Сухарев//Известия Челябинского научного центра УрО РАН. -2000. -Вып. 4. -С. 86-90.
- Структурно-морфологические особенности оксигидрата иттербия/Ю.И. Сухарев, В.В. Авдин, М.Ю. Дрязгова, Л.Е. Артюшенко//Известия Челябинского научного центра УрО РАН. -2002. -№3.-С. 93-97.
- Матвейчук, Ю.В. Квантово-химическое исследование полимеризации в силикагеле и сопо-лимеризации в гелях ортокремниевой кислоты с гидроксидами иттрия и лантана/Ю.В. Матвейчук, А.А. Лымарь, В.В. Авдин//Вестник ЮУрГУ. Серия «Химия». -2009. -Вып. 1. -№ 12 (145). -С. 42-48.
- Авдин, В.В. Взаимосвязь оптических, сорбционных и структурно-морфологических характеристик оксигидратов лантана/В.В. Авдин, Ю.И. Сухарев, Н.А. Гришинова//Известия Челябинского научного центра УрО РАН. -2001. -Вып. 2. -С. 79-84.
- Iler, R.K. The Chemistry of Silica/R.K. Her. -New York: Wiley, 1979. -866 p.


