Физико-химические основы алкилирования бензола пропиленом в субкритических условиях
Автор: Востриков С.В., Нестеров И.А., Сосин С.Е., Нестерова Т.Н., Таразанов С.В.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Достижения физики, химии, электроники и нанотехнологий
Статья в выпуске: 4-3 т.12, 2010 года.
Бесплатный доступ
Рассмотрены физико-химические основы алкилирования бензола (Б) пропиленом в субкритических условиях. Выполнен термодинамический анализ процесса. Охарактеризована термическая стабильность изопропилбензолов (ИПБ). Изучена термокаталитическая стабильность моно- и диизопропилбензолов (диИПБ) в присутствии галогенидов алюминия или комплексов на их основе. Показано, что проведение процесса в условиях существования сверхкритического флюида не ухудшает качество целевых продуктов. Даны рекомендации по условиям ведения процесса.
Критические условия, стабильность, равновесие, алкилирование, бензол, изопропилбензолы
Короткий адрес: https://sciup.org/148199451
IDR: 148199451 | УДК: [66.08+66.09.253]:[547.532+547.313.3+54.13]
Текст научной статьи Физико-химические основы алкилирования бензола пропиленом в субкритических условиях
В настоящее время эта энергия не только не используется, но и создает значительные технологические проблемы. В данной работе на примере получения изопропилбензолов в присутствии катализаторного комплекса на основе галогенидов алюминия рассматривается совершенно иной подход к использованию энергетического ресурса процесса. Это сопряжено с переходом от изотермического осуществления его химической стадии к автотермическому режиму с входом в субкритическую область существования системы. Учитывая то, что на данный момент практически отсутствуют сведения по условиям реализации таких технологий, необходимо ответить, прежде всего, на принципиальные вопросы.
Цель данной работы состоит в изучении возможности осуществления процесса алкилирования бензола пропиленом в субкритических условиях.
Первоочередными задачами являлись:
-
• анализ критического (жидкость-пар) состояния системы;
-
• термодинамический анализ процесса;
-
• изучение термической и термокаталитической стабильности изопропилбензолов.
Диапазон критических температур основных компонентов, представляющих систему (табл. 1), широк – от 365 до 703 К. Это существенно расширяет спектр возможностей для реализации процесса в автотермическом режиме с входом в субкритическую область. Вопрос состоит в том, каков предельный уровень температур, обеспечивающий высокую интенсивность химических превращений, теплообмена и массо-передачи при сохранении селективности процесса.
Выполненный нами термодинамический анализ (использованы данные [4]) позволяет заключить, что при низких давлениях (1-5 бар) превышение температуры в 500 К нежелательно, поскольку реакция алкилирования бензола пропиленом становится обратимой (рис. 1).
Таблица 1. Критические температуры и давления индивидуальных соединений
|
Соединение |
Т с , К |
Р с , бар |
Лит. |
|
пропан |
369,9 |
42,5 |
[2] |
|
пропилен |
365,2 |
46 |
[2] |
|
бензол |
562,05±0,07 |
48,9 |
[3] |
|
изопропилбензол |
631,0±0,5 |
32,1 |
[3] |
|
1,2-диИПБ; 1,3-диИПБ; 1,4-диИПБ |
673,3*; 670*; 675 |
-; 24*; 23,3 |
[3] |
|
1,2,4-триИПБ; 1,3,5-триИПБ |
696,6*; 691,6* |
- |
[3] |
|
1,2,4,5-тетраИПБ |
703 |
16,0 |
[3] |
Примечание: * - расчетные значения [3].
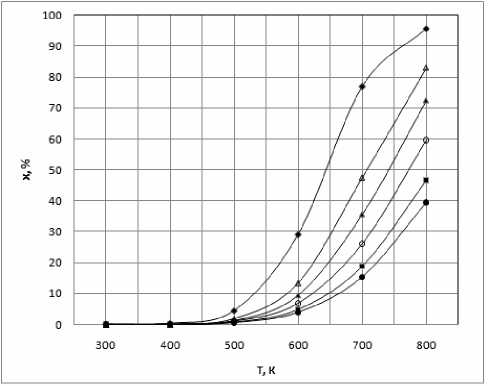
Рис. 1. Равновесная степень конверсии ИПБ при деалкилировании в зависимости от температуры при давлениях в системе, бар: ♦ - 1; .; Δ – 5; ▲ – 10; .; ○ – 20; ■ – 40; • – 60.
Увеличение давления до 60 бар расширяет диапазон температур, разрешенных термодинамикой, вплоть до 600 К. Поскольку критические температуры для всех изопропилбензолов имеют более высокий уровень, переход в субкритическое состояние должно обеспечиваться иным компонентом. В этом качестве не может выступать пропилен хотя бы по той причине, что его избыток в реакционной зоне приведет к интенсификации смолообразования и дезактивации катализатора. По нашим оценкам задача может быть эффективно решена при использовании пропана в качестве «третьего» компонента. Критические свойства его близки к таковым для пропилена, он инертен в условиях процесса и позволяет обеспечить требуемые значения критических свойств реакционной массы. Об этом свидетельствуют экспериментальные данные [5, 6] для критических свойств реакционных смесей, получаемых при алкилировании бензола пропиленом. Важным обстоятельством является и то, что увеличивая концентрацию пропана, мы не только можем снизить критическую температуру смеси вплоть до 450-500 К, но и приобретаем прекрасную возможность существенно (вплоть до 70-80 бар) увеличить ее критическое давление [6]. Это способствует созданию в субкритических условиях среды с высокой плотностью, что важно для интенсификации процесса. Полагаем, что использование пропана в качестве «третьего» компонента позволит значимо упростить общую технологию получения изопропилбензолов.
Оценка возможности автотермического входа в область субкритических температур выполнена нами в приближении достижения системой состояния равновесия. Состав равновесной смеси, представленной бензолом и изопропилбензолами, вычислен на основе данных [7, 8] и для 423 К приведен на рис. 2. Расчетом показано, что адиабатический перепад температур составляет: 91 К при соотношении бензол : пропилен равном 3:1 моль/моль; 195, 288 и 332 К при увеличении соотношения реагентов до 1:1, 1:2 и 1:2,5 моль/моль соответственно. То есть, автотермический вход в субкритическую область возможен.
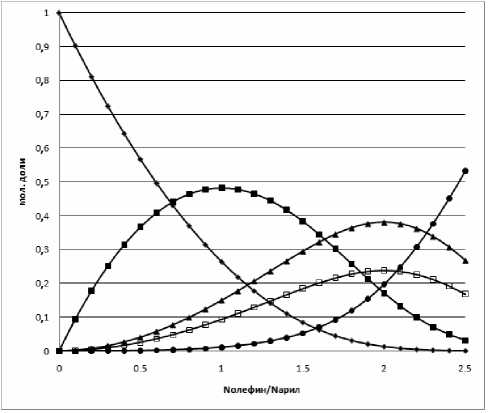
Рис. 2. Состав равновесной смеси, мол. доли: ♦ – бензол; ■ – ИПБ; ▲ – мета -диИПБ; □ – пара -диИПБ; • – 1,3,5-триИПБ
Результаты выполненного анализа показывают, что экспериментальная информация требуется, прежде всего, по двум вопросам – термической и термокаталитической стабильности изопропилбензолов. Сведения, полученные по последнему вопросу, приведены ниже.
Экспериментальная часть. Определение термокаталитической стабильности ИПБ в присутствии катализатора проводилось в герметичных металлических ампулах. Ампулы термостатировались в воздушном термостате, в котором был организован интенсивный теплообмен. Время пребывания ампул в термостате варьировалось от 5 минут до 8 часов, в зависимости от целей эксперимента и объектов исследования. Температура исследования составляла от 403 до 523 К. После извлечения ампулы из термостата её охлаждали в токе холодного воздуха в течение 10 минут. Затем реакционная масса обрабатывалась водой для разложения катализатора. Количественный анализ полученной реакционной массы выполнялся методом ГЖХ на приборе «Кристалл 2000 М» с пламенно-ионизационным детектором и кварцевой капиллярной колонкой 50 м х 0,25 мм с привитой неподвижной фазой SE-30 в условиях: газ-носитель – гелий, давление на входе 1,5 атм., температура испарителя 623 К, детектора – 523 К. Идентификация компонентов смеси проводилась методом ГЖХ – «подколом» чистых соединений. Идентификация орто-, мета- и пара -изомеров выполнена с привлечением химического эксперимента.
В качестве объектов исследования был взят ИПБ, 99,1% масс. по данным ГЖХ, и равновесная смесь, полученная изомеризацией ИПБ на хлориде алюминия. Изомеризацию проводили при комнатной температуре в течение нескольких дней. Работа с ИПБ проводилась следующим образом. ИПБ помещали в металлические ампулы, затем смешивали с катализатором и термостатировали в воздушном термостате при температуре 473 К. Эксперимент проводился двумя сериями. В первой в качестве катализатора брался AlCl 3 в количестве 2% масс. по отношению к ИПБ. Во второй серии катализатором был AlBr3 в количестве 1% масс. по отношению к ИПБ. Взвешивания проводились на аналитических весах с точностью до четвёртого знака. Время пребывания исследуемой смеси при повышенной температуре изменялось от 5 минут до 1 часа. Результаты исследования оценивались по качественному составу реакционной массы, а также по степени приближения системы к химическому равновесию за время эксперимента.
Работа с равновесной смесью проводилась следующим образом. В ампулы загружалось 1-2 грамма реакционной массы, взятой без каталитического комплекса, и термостатировалась в течение 8 часов. Температура исследования варьировалась от 403 до 523 К. Результаты исследования оценивались по качественному и количественному изменению состава реакционной массы относительно её же состава до начала эксперимента.
Обсуждение результатов. Термокаталитические исследования показали, что при количестве катализатора 1% масс. продукты деструкции начинают образовываться на первых мину- тах работы катализатора и с течением времени их количество остаётся практически неизменным (рис. 3,б). Из продуктов деструкции обнаружен этилбензол. За всё время эксперимента реакционная масса не достигла равновесного состояния из-за слабого протекания реакций переалкилиро-вания. При увеличение количества катализатора до 2% масс. в системе образуется помимо этилбензола ещё и толуол. Оба продукта деструкции нарастают с течением времени. Кроме того, при 2% катализатора исследуемая система выходит на равновесие за 45 минут. Равновесие было доказано сопоставлением констант переалкилиро-вания и мета-пара изомеризации диИПБ с литературными данными [8] (рис. 3а; рис. 4).
Эксперимент с участием равновесной смеси показал, что изменения состава реакционной массы не происходит во всём диапазоне температур (рис. 5). Такие результаты позволяют говорить о том, что продукты алкилирования бензола пропиленом термически стабильны в течение времени исследования при 523 К и более низких температурах.
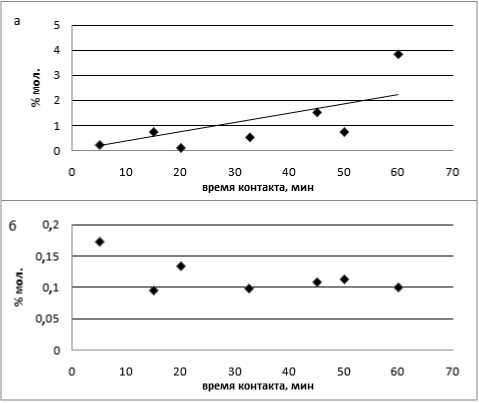
Рис. 3. Образование этилбензола в результате деструктивных превращений изопропилбензола при 473 К. а – 2% AlCl 3 ; б – 1% AlBr 3
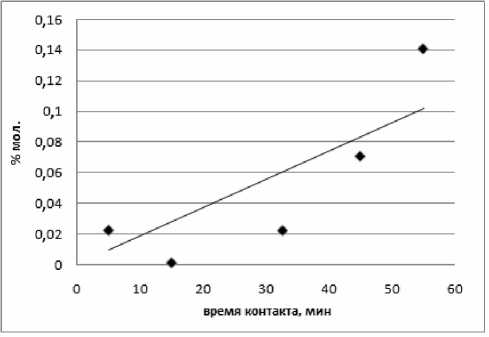
Рис. 4. Образование толуола в результате деструктивных превращений изопропилбензола при 473 К и 2% масс. AlCl 3
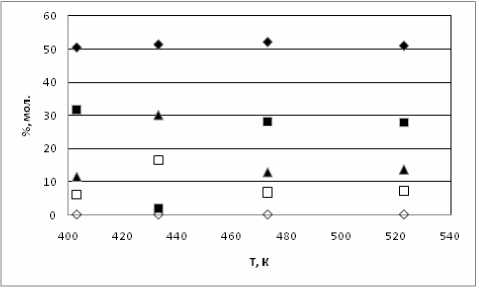
Рис. 5. Термокаталитическая стабильность равновесной смеси, полученной при изомеризации ИПБ: ■ – бензол; ♦ - ИПБ; ▲ – мета -диИПБ; □ – пара -диИПБ; ◊ - этилбензол, % мол.
Таким образом, установлено, что наличие продуктов деструкции при получении ИПБ объясняется в большей степени не влиянием температурного фактора (в рассматриваемом диапазоне температур), а концентрационной составляющей влияния катализатора на кинетику протекающих превращений. Уменьшить это влияние можно, сократив количество катализатора до 1% масс. и менее. При этом в системе будут слабо протекать реакции переалкилирования. Выполненные нами технологические расчеты показали, что при осуществлении процесса в автотермическом режиме стадии алкилирования бензола пропан-пропиленовой фракцией и переалкили-рования в системе бензол-изопропилбензолы целесообразно осуществлять в отдельных реакторах. Это позволит использовать энергетический ресурс процесса алкилирования, оптимально распределить нагрузку между реакторами и существенно уменьшить энергетическую и материальную нагрузку на блок ректификации.
Выводы: исследованием установлено, что осуществление алкилирования в автотермическом режиме позволит интенсифицировать процесс, эффективно использовать выделяющуюся энергию, не повлияет на качество целевых продуктов.
Список литературы Физико-химические основы алкилирования бензола пропиленом в субкритических условиях
- Сверхкритическая флюидная экстракция [электронный ресурс]. www.extract.ru.
- NIST Chemistry WebBook [электронный ресурс]. http://webbook.nist.gov.
- Нестерова, Т.Н. Критические температуры и давления органических соединений. Анализ состояния базы данных и развитие методов прогнозирования/Т.Н. Нестерова, И.А. Нестеров. -Самара: Самарский научный центр Российской академии наук, 2009. 580 с.
- Сталл, Д. Химическая термодинамика органических соединений/Д. Сталл, Э. Вестрам, Г. Зинке. -М.: Мир, 1971. 807 с.
- Jizhi, Guo. Vapor-Liquid Equilibria of Benzene and Propylene under Elevated Temperature and Pressure/Jizhi Guo, Tao Liu, Ying-Chun Dai, Wei-Kang Yuan.//J. Chem. Eng. Data. 2001. V. 46. P. 668-670.
- Guofu, Wang. Critical Properties of the Reacting Mixture in the Alkylation of Benzene with Propene/Guofu Wang, Zhangfeng Qin, Jianguo Liu et al./Ind. Eng. Chem. Res. 2003. V. 42. P. 6531-6535.
- Леванова, С.В. Термодинамический анализ процессов органического синтеза/С.В. Леванова, Т.Н. Нестерова, И.А. Нестеров и др. -Самара: Самар. гос. техн. ун-т. 2003. 100 с.
- Нестеров, И.А. Равновесие взаимных превращений при пара-, мета-изомеризации алкилбензолов/И.А. Нестеров, Т.Н. Нестерова, И.Ю. Рощупкина//Нефтехимия. 2008. Т. 48, № 6. С. 441-449.


