Физико-химические основы синтеза сульфида кобальта (II) в обратной микроэмульсии
Автор: Теслюк Дмитрий Александрович, Васха Михаил Викторович, Селькина Юлия Алексеевна
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Электротехника
Статья в выпуске: 1 т.18, 2015 года.
Бесплатный доступ
В работе приводятся результаты исследования устойчивости обратной микроэмульсии состава: додецилсульфат натрия (ДСН) / n-бутанол - вода - гептан при наличии в водной фазе растворенных сульфата кобальта(II) и сульфида натрия. Представлены результаты кондуктометрического и спектрофотометрического исследования микроэмульсии. Показана зависимость электропроводности и оптической плотности обратной микроэмульсии от соотношения фаз. На основании полученных результатов высказаны предположения о происходящих структурных изменениях в микроэмульсиях. Проведен термодинамический расчет, описывающий границы формирования осадка сульфида кобальта(II) в водном растворе в зависимости от pH, произведена оценка конкурирующих реакций гидролиза.
Обратная микроэмульсия, сульфид кобальта
Короткий адрес: https://sciup.org/14294770
IDR: 14294770 | УДК: 544.722
Текст научной статьи Физико-химические основы синтеза сульфида кобальта (II) в обратной микроэмульсии
Наноразмерный сульфид кобальта(II) является перспективным материалом для производства передовых электронных систем, солнечных батарей, магнитных носителей информации, анодов для литий ионных батарей, температурных сенсоров, ИК-детекторов, а также может использоваться в качестве катализаторов для реакций гидродесульфуризации и дегидродеароматизации ( Ariponnammal, Srinivasan , 2013).
Классический синтез наночастиц заключается в конденсации продукта химической реакции, проводимой в водном растворе. Как правило, таким методом получают слишком крупные и полидисперсные частицы неправильной формы. Одним из способов получения одинаковых по размеру наночастиц неорганических солей является проведение синтеза в обратных микроэмульсиях.
Обратная микроэмульсия (МЭ) представляет собой термодинамически стабильную микрогетерогенную систему, состоящую из обратных мицелл (наноразмерных капель воды, покрытых слоем поверхностно активных веществ (ПАВ) в неполярной жидкости) с диаметром капель 10-100 нм (Сумм, 2000; Мицеллообразование…, 1980). МЭ получают путем смешивания воды и неполярной жидкости в присутствии ПАВ и со-ПАВ (спирты со средней длиной углеводородного радикала).
Первые работы по синтезу в микроэмульсиях относятся к середине 70-х гг. ХХ в. ( Товстун, Разумов , 2011). Идея применения обратных микроэмульсий для синтеза наночастиц сульфидов металлов основана на предположении о том, что их размер ограничен размером водного пула, который можно варьировать путем изменения концентрации воды, ПАВ и со-ПАВ. Радиус водного пула растет с увеличением доли воды к концентрации ПАВ. Имеющиеся обзоры ( Lopez-Quintela , 2003; Eriksson et al. , 2004; Holmberg , 2004; Uskokovic, Drofenik , 2005) по методам получения наночастиц не содержат моделей, описывающих их рост в обратных микроэмульсиях. Нет четкого ответа на вопрос о том, ограничен ли рост неорганической наноструктуры оболочкой обратной мицеллы (размером пула). Закономерности синтеза сульфидов цветных металлов в микроэмульсиях изучены несистемно. Отсутствуют фундаментальные принципы построения микроэмульсий с целью проведения наносинтеза неорганических солей цветных металлов.
Вестник МГТУ, том 18, № 1, 2015 г. стр. 156-163
Описано несколько вариантов синтеза наночастиц в обратных микроэмульсиях. Они отличаются способом введения реагентов. Самый распространенный вариант состоит в сливании двух микроэмульсий, содержащих в водных фазах необходимые для реакции реагенты ( Gobe, Kon-No , 2003).
В работе ( Sato et al. , 2000) выполнено общее моделирование синтеза наночастиц в микроэмульсиях и представлена модель синтеза на примере наночастиц палладия. Что касается синтеза сульфидов металлов, то наибольшее количество публикаций посвящено синтезу сульфида кадмия ( Curri et al. , 2010; Huang et al. , 2004; Khiew et al. , 2003). Единичные публикации описывают синтез в обратных микроэмульсиях сульфидов серебра ( Motte et al ., 1996), свинца ( Khiew et al ., 2003), кобальта ( Tanori et al. , 1995) и меди ( Lianos, Thomas , 1987).
Для проведения реакции в обратной микроэмульсии, с целью получения наночастиц сульфида кобальта, требуется определить область существования обратной микроэмульсии и термодинамические параметры процесса осаждения в водном растворе с учетом области образования гидроксосоединений кобальта.
2. Область существования обратной микроэмульсии (ДСН) / n-бутанол – вода – гептан
В качестве ПАВ использовали додецилсульфат натрия (х.ч.), в качестве со-ПАВ – бутанол (ч.д.а.). Во всех опытах молярное отношение (м.о.) ПАВ/со-ПАВ составляло 0.25. Cпектрофотометрические исследования проводили на приборе "T70 UV/VIS Spectrometer". Кондуктометрические измерения выполнены на кондуктометре "МУЛЬТИТЕСТ КСЛ-101" при температуре 25 °С. Для поддержания температуры ячейки использовали термостат "LOIP-lt100". Источниками ионов Со2+ и S2- являлись сульфат кобальта(II) и сульфид натрия (х.ч.).
На УФ-спектрах (рис. 1), снятых с изучаемой микроэмульсии при изменении содержании ПАВ, наблюдается определенная закономерность. При мольной доле ДСН до 0.9 % на спектре наблюдается один восходящий пик в диапазоне 215-230 нм. Повышение мольной доли ПАВ влечет за собой образование нового восходящего пика при 247-250 нм.
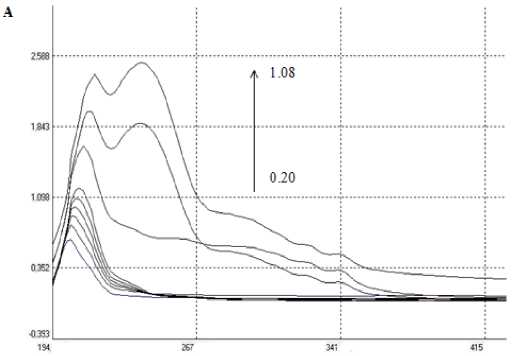
Рис. 1. Спектры поглощения додецилсульфат натрия / n-бутанол – вода – гептан, при различных мольных долях ДСН, % : 0.20; 0.25; 0.37; 0.49; 0.61; 0.73; 0.85; 1.00; 1.08.
Раствор сравнения – n-гептан
Повышение мольной доли ДСН приводит также к увеличению электропроводности микроэмульсионной композиции (рис. 2). При достижении мольной доли ДСН 0.9 % электропроводность резко возрастает.
Изменение физико-химических параметров изучаемой композиции при достижении мольной доли ДСН 0.9 % объясняется структурным преобразованием водной фазы, связыванием глобул полярной жидкости и началом межмицеллярного обмена.
Путем совмещения данных по измерению электропроводности и оптической плотности установлена мольная доля водной фазы 0.232-0.252, при которой наблюдается максимальная агрегативная устойчивость микроэмульсии (рис. 3). Дальнейшее увеличение количества воды приводит к фазовому разделению. При мольной доле воды 0.23 оптическая плотность понижается до минимального значения, а электропроводность еще не выходит на экспоненциальный рост. Это область максимальной агрегативной устойчивости обратной микроэмульсии, при которой она не расслаивается в течение месяца. Резкое повышение электропроводности сопровождается таким же резким снижением агрегативной устойчивости, приводящей к фазовому разделению.
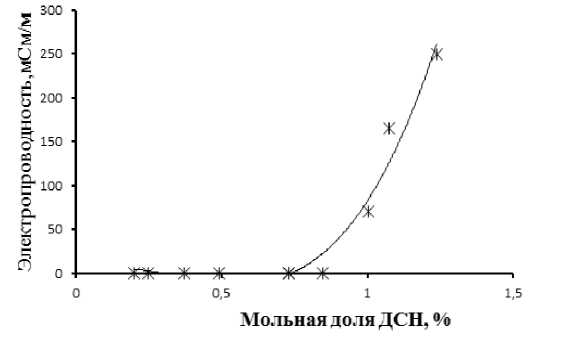
Рис. 2. Изменение электропроводности в зависимости от мольной доли додецилсульфата натрия при 25 °С, м.о. Н 2 О / гептан 0.35 и м.о. ДСН / n-бутанол 0.25
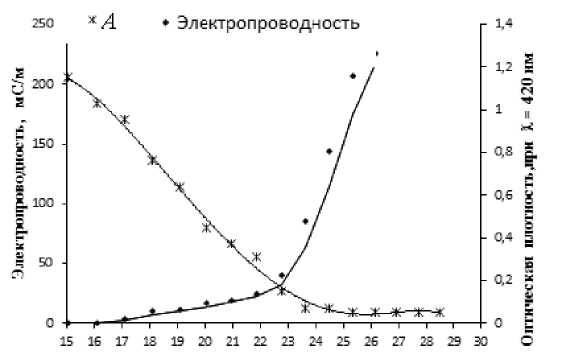
Мольная доля IbO , °о
Рис. 3. Изменение электропроводности и оптической плотности (А) микроэмульсии от мольной доли воды при 25 °Си постоянном м.о. ДСН / n-бутанол 0.25
На рис. 4 представлена графическая зависимость электропроводности от мольной доли воды в системе додецилсульфат натрия / n-бутанол – вода – гептан с учетом содержания в водной фазе растворенных солей СоSO4 и Na2S с концентрацией, отнесенной к водной фазе 0.5 моль/л на область существования обратной микроэмульсии.
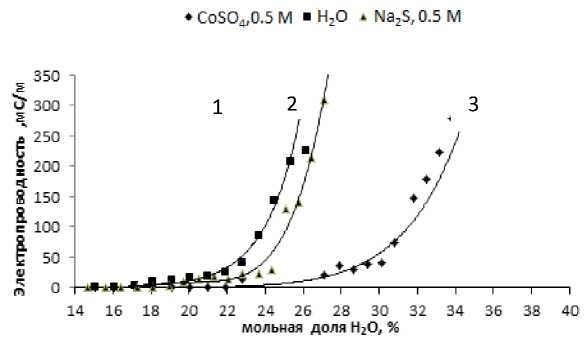
Рис. 4. Изменения электропроводности от мольной доли воды в системе додецилсульфат натрия / n-бутанол – вода – гептан.
1 – водная фаза без добавления ионов; 2 – раствор сульфида натрия, 0.5 М;
3 – раствор сульфата кобальта(II), 0.5 М
Вестник МГТУ, том 18, № 1, 2015 г. стр. 156-163
Из представленных зависимостей можно сделать вывод о том, что солюбилизация водной фазы усиливается в присутствии сульфата кобальта(II) до 0.35. Это объясняется изменением величины электростатического взаимодействия на межфазной границе из-за присутствия в водной фазе противоионов кобальта(II) по отношению к анионам додецилсульфата. Схематически структура водного пула в обратной микроэмульсии, когда наблюдается скачкообразное изменение ее оптических и электрохимических свойств, представлена на рис. 5.

Рис. 5. Схема водного пула в системе додецилсульфат натрия / n-бутанол – вода – гептан в присутствии СоSO4
Из совмещения данных кондуктометрического и спектрофотометрического исследования системы додецилсульфат натрия / n-бутанол – вода – гептан при м.о. ПАВ/бутанол, равном 0.25, выявлены области существования обратной микроэмульси (рис. 6).
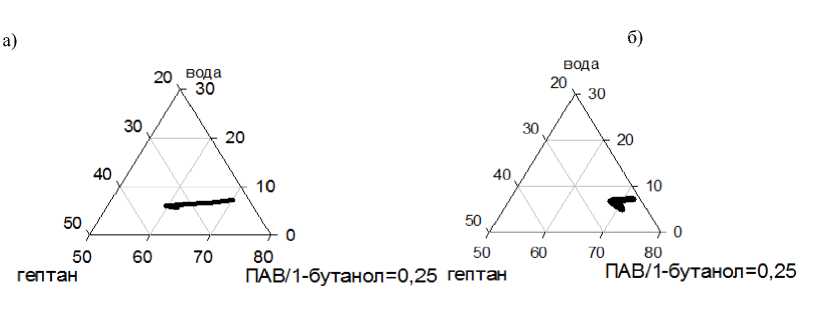
Рис. 6. Область существования обратной микроэмульсии состава: додецилсульфат натрия / n-бутанол – вода – гептан при м.о. ПАВ/бутанол 0.25; а) для водного раствора СоSO 4 ; б) для водного раствора Na 2 S
3. Термодинамические параметры процесса осаждения в водном растворе с учетом области образования гидроксосоединений кобальта
Для определения оптимальных условий синтеза сульфида кобальта(II) предварительно определен диапазон концентраций и рН, при которых отсутствуют конкурирующие реакции в водном растворе. Введение солей в микроэмульсию в виде водного раствора будет осуществляться исходя из условий, при которых отсутствуют конкурирующие процессы.
В момент достижения определенного значения рН кобальт из раствора осаждается в виде Со(OH)2 (синий) и Со(OH)2 (розовый). Определены условия, при которых начинается образование осадка гидроксида кобальта(II). Зависимость рН от концентрации установлена по формуле:
+ Kw'Cc2 +
[ H + ]=------ Co----
J Ks ( Co ( OH )2) . (1)
Подставляя значения ионного произведения воды KW = 10-14 и произведения растворимости гидроксида кобальта(II) Кs (Co(OН)2)роз = 2·10-15 и Кs (Co(OН)2)син = 6.3·10-15 ( Лурье , 1989), строим график зависимости pH = f (pCo2+).
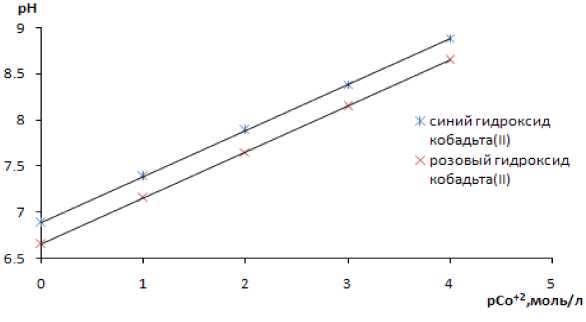
Рис. 7. Влияние концентрации сульфата кобальта на pH начала образования осадка гидроксида кобальта(II)
Из диаграммы (рис. 7) следует, что с увеличением концентрации ионов кобальта(II), рН образования осадка будет смещаться в кислую область.
Кобальт(II) в водном растворе существует в виде различных гидроксокомплексов. Суммарно процесс гидролиза ионов кобальта(II) можно представить уравнением:
pCon + + qH- O = Co n ( OH V + qH +
2 p q .
До момента перехода в осадок кобальт существует в виде различных гидроксоформ в зависимости от рН раствора. Побочные процессы гидролиза являются конкурирующими по отношению к образованию сульфида кобальта(II), поэтому нужно определить условия, при которых конкуренция со стороны гидролитических процессов минимальна.
Равновесие между различными гидроксокомплексами кобальта(II) можно выразить через их константы образования и определить области существования каждого из них. В таблице представлены константы образования гидроксокомплексов.
Таблица. Константы образования гидроксокомплексов кобальта в воде
|
Реакция |
log e ° pq |
|
|
( Plyasunova et al ., 1998) |
( Пестриков и др. , 2005) |
|
|
H 2 O = H++ OH- |
14.00 |
|
|
Co2+ + 2H 2 O = (CoOH) 2(тв) + 2H+ |
14.9 |
— |
|
Co2+ + H 2 O = CoOH+ (тв) + 2H+ |
4.36 |
4.35 |
|
Co2+ + 2H 2 O = (CoOH)0 2 + 2H+ |
9.20 |
9.20 |
|
Co2+ + 3H 2 O = (CoOH)- 3 + 3H+ |
10.5 |
10.50 |
|
Co2+ + 4H 2 O = (CoOH)2- 4 + 4H+ |
9.70 |
9.70 |
|
2Co2+ + H 2 O = CoOH3+ + H+ |
2.80 |
2.80 |
|
4Co2+ + 4H 2 O = CoOH+ (тв) + 4H+ |
25.5 |
25.47 |
Зависимость мольной доли каждого гидроксокомплекса от рН определена по формуле (3) и представлена на рис. 8.
P pq •[ Co 2 + ] p - 1{ OH ] q
.
1 + £ PD ,,•[ Co 2 + ] p - 1{ OH ] q
О РЧ
Вестник МГТУ, том 18, № 1, 2015 г. стр. 156-163
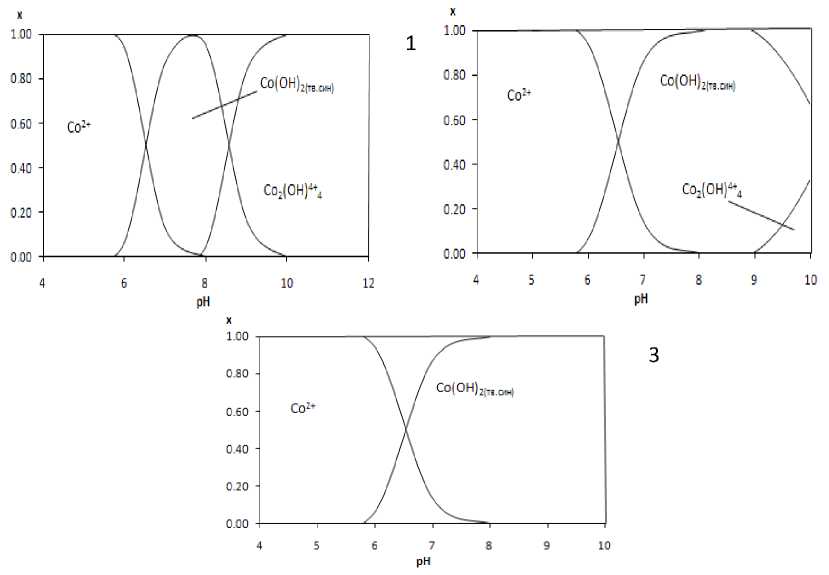
Рис. 8. Распределительная диаграмма для растворов с концентрацией сульфата кобальта(II): 1 – 1 М; 2 – 0.1 М; 3 – 0.01 М
Из анализа распределительных диаграмм (рис. 8) следует, что в микроэмульсию необходимо вводить соль кобальта в такой концентрации и при таком значении рН, при которых минимально
проявляется конкурирующая реакция.
Константу равновесия реакции формирования сульфида кобальта(II) находили по формулам (4, 5):
K =
aCoS' a h+ a • a • a
Co 2 + HS S2
K I • K 2
K = 70—, K s , CoS
где К 1 и К 2 - константы диссоциации сероводорода по первой ступени и второй ступени (640-8 и 1 • 10-14 соответственно); K S 0 Со s - произведение растворимости сульфида кобальта, K 8 0Со8 = 4 ^ 10-21 ( Лурье , 1989).
Поскольку сульфид кобальта твердое вещество, а СоS = 1.
Комбинируем оба уравнения, получаем:
2+ aCo
•K h + s 2-
, CoS
a • a • K • K
HS - S 2 - 1 2
.
После логарифмирования
Принимаем
pH =
-
- lg a 2 ++ lg K 0 s , CoS - lg %v- - lg4.:
Co HS S
-lg K1-lg K2
0.1M , находим численное значение pH = 1.72.
4. Заключение
a ^-o2 += 0.1 M , a^g = 0.1 M , a -^
С увеличением концентрации ионов кобальта в растворе, рН образования осадка будет смещаться в кислую область.
Определена область существования обратной микроэмульсии состава: додецилсульфат натрия / n-бутанол – вода – гептан при м.о. ПАВ/бутанол = 0.25. Показано изменение электропроводности микроэмульсии от мольной доли ПАВ; изменение оптической плотности и электропроводности от мольной доли воды. Определено влияние ионов кобальта на область существования микроэмульсии. Установлено, что наличие в водной фазе сульфата кобальта(II) приводит к повышению доли солюбилизированной воды в составе обратной микроэмульсии. Для максимального осаждения кобальта в виде сульфида, и, во избежание конкурирующих процессов при формировании наночастиц сульфида кобальта, синтез следует проводить в кислой среде в диапазоне pH = 1.7-5.9.
Работа выполнена при финансовой поддержке РФФИ (проект № 15-29-01306 ОФИ_М).
Список литературы Физико-химические основы синтеза сульфида кобальта (II) в обратной микроэмульсии
- Ariponnammal S., Srinivasan T. Growth and characterization of cobalt sulphide nanorods. Research Journal of Recent Sciences. 2013. V. 2. P. 102-105
- Curri M.L., Agostiano A. et al. Synthesis and characterization of CdS nanoclusters in a quaternary microemulsion: The role of the cosurfactant. J. Phys. Chem. B. 2010. V. 104. P. 83-91
- Eriksson S., Nylén U., Rojas S. Preparation of catalysts from microemulsions and their applications in heterogeneous catalysis. Applied Catalysis A. 2004. V. 265, N 2. P. 207-219
- Gobe M., Kon-No K. Preparation and characterization of monodisperse magnetite sols in w/o microemulsion. J. Colloid Interface Sci. 2003. V. 244. P. 125
- Holmberg K. Surfactant-templated nanomaterials synthesis. J. Colloid Interface Sci. 2004. V. 274. P. 355-364
- Huang N.M. et al. Single w/o microemulsion templating of CdS nanoparticles. J. Mater. Sci. 2004. V. 39. P. 2411-2415
- Khiew P., Radiman S., Huan N.M. Studies on the growth and characterization of CdS and PbS nanoparticles using sugar-ester nonionic water-in-oil microemulsion. J. Cryst. Growth. 2003. V. 254. P. 235-243
- Lianos P., Thomas J.K. Small CdS particles in inverted micelles. J. Colloid Interface Sci. 1987. V. 117. P. 505
- López-Quintela M.A. Synthesis of nanomaterials in microemulsions: formation mechanisms and growth control. Curr Opin Colloid Interface Sci. 2003. V. 8. P. 37-144
- Motte L., Billoudet F., Pileni M.P. Synthesized "in situ" in reverse micelles of silver sulfide semiconductors. J. Phys. Chem. 1996. V. 99. P. 164
- Plyasunova N.V., Zhang Yu., Muhammed M. Critical evaluation of thermodynamics of complex formation of metal ions in aqueous solutions. V hydrolysis and hydroxo-complexes of Co2+ at 298.15 K. Hydrometallurgy. 1998. V. 48(2). P. 153-159
- Sato H., Asaji N., Komasawa I. A population balance approach for particle coagulation in reverse micelles. Ind. Eng. Chem. Res. 2000. V. 39. P. 328-334
- Tanori J. et al. Synthesis of nanosize metallic and alloyed particles in ordered phases. Colloid Polym Sci. 1995. V. 273. P. 886-892
- Uskokovic V., Drofenik M. Synthesis of materials within reverse micelles. Surf. Rev. Lett. 2005. V. 12. P. 239-277
- Лурье Ю.Ю. Справочник по аналитической химии. М., Химия, 1989. 448 с
- Мицеллообразование, солюбилизация и микроэмульсии. Под ред. Миттел К., Фриберг С.Е., Боторель П. М., Мир, 1980. 574 с
- Пестриков С.В. и др. Расчетный способ определения условий удаления ионов тяжелых металлов из сточных вод. Успехи современного естествознания. 2005. № 1. С. 27-28
- Сумм Б.Д. Объекты и методы коллоидной химии в нанохимии. Успехи химии. 2000. Т. 69, № 11. С. 995-1007
- Товстун С.А., Разумов В.Ф. Получение наночастиц в обратных микроэмульсиях. Успехи химии. 2011. № 8. С. 996-1012


