Физико-химические процессы рафинирования высокохромистого металлического расплава при производстве нержавеющей стали
Автор: Поволоцкий Д.Я.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 13 (85), 2007 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156554
IDR: 147156554 | УДК: 669.18:
Текст статьи Физико-химические процессы рафинирования высокохромистого металлического расплава при производстве нержавеющей стали
Одной из главных и трудно достигаемых задач производства нержавеющей стали является получение достаточно низкого, часто особонизкого (0,03 %) и даже ультранизкого (0,003 %), содержания углерода при низком угаре хрома. Многочисленные исследования позволили совершенствовать технологию плавки нержавеющей стали, но достигнутое усвоение хрома при плавке монопроцессом в дуговых печах не превышает 85.. .90 %.
С целью изучения возможности выплавки нержавеющей стали с содержанием углерода менее 0,03 % и понижения угара хрома провели серию плавок стали 03X18Н11 и 03Х23Н28МДТ в 100-т дуговых печах. Обезуглероживание расплава производили одновременной продувкой кислородом через сводовую фурму {0,5 м3/(т-мин)} и аргоном {0,10...0,15 м3/(т-мин)}, вводимым стальными трубками через рабочее окно в течение 9... 12 мин. Как показали проведенные ранее исследования [1,2], такая раздельная продувка обеспечивает интенсивное перемешивание ванны и выравнивание концентраций кислорода в металле в подфурменной зоне и в периферийных зонах ванны. Эта технология продувки позволила получать содержание углерода в стали 0,020 % и уменьшить угар хрома примерно на 2 % (абсолютных).
Однако совершенствование плавки нержавеющей стали в дуговых печах монопроцессом было все же паллиативным решением. Кардинально вопрос получения нержавеющей стали с особонизким содержанием углерода при относительно низком угаре хрома был решен с применением процесса AOD (Argon Oxygen Decarburisation), получившиеего у нас название аргонокислородное рафинирование (АКР). Этот процесс, разработанный в 1968 г в США, получил широкое применение, и на его долю приходится более 70 % мирового производства нержавеющей стали. В России один агрегат АКР емкостью 100 т имеется на Челябинском металлургическом комбинате (ОАО «Мечел»).
Интенсивное развитие процесса АКР потребовало изучения физико-химических условий его протекания, в частности, особенностей термодинамики и кинетики окисления углерода. Этому посвящены наши исследования последних более 15 лет, проведенные по результатам обработки нержавеющей стали в агрегате АКР ОАО «Мечел».
Термодинамика взаимодействия. При наличии высокохромистого шлака окисление углерода протекает с участием оксидов хрома, что определяет связь между концентрациями этих элементов. Серия «Металлургия», выпуск 8
Поэтому основное внимание было уделено изучению возможности повышения величины отношения [%Сг]/[%С], которое определяет степень окисления хрома в зависимости от содержания в металле углерода.
Рядом исследователей было установлено образование соединкений Сг2О3 и Сг3О4 при окислении хрома из высокохромистого металлического расплава. В работах [3-5] при написании реакции окисления хрома принят оксид Сг3О4. Например, согласно Хилти [3]
Сг3О4 = 3[Сг] + 4[О];
№r3o4 = lg([%Cr]3M [%O]Zcr/4Zo) =
^ + 5,99. Т
Согласно исследованию Накамуры и соавторов [15] при температуре 1600... 1900 °C образуется Сг2О3> и лишь при температуре более 2000 °C образуются Сг3О4 и другие шпинели. Соответственно, окисление хрома авторы [6] записывают в виде:
Сг2О3 = 2[Сг] + 3 [О];
lg^Cr2o3 = lg([%Cr]2 [%О]3 ) + 2eg [%Cr]+
+3eg [%Cr] + 3eg [%Ni] = - ^^ +19,42, (2) где мною добавлено слагаемое 3(?o'[%Ni], учитывающее влияние никеля на коэффициент активности кислорода в стали.
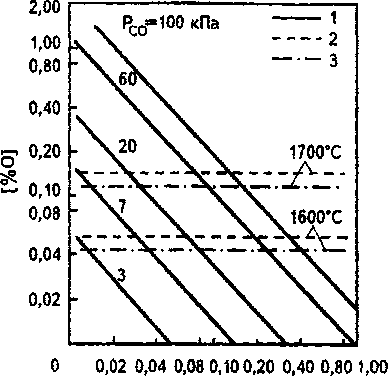
Для сравнения, результаты расчета по уравнениям (1) и (2) при характерных для АКР нержавеющей стали температурах приведены на рис. 1. Видно, что расчет по этим уравнениям, полученным по экспериментальным данным с учетом образования оксидов Сг3О4 или Сг2О3, дает весьма близкие результаты. Это позволяет отметить надежность применения любого из приведенных уравнений.
Для определения возможности получения особонизкого (< 0,03 %) и ультранизкого (< 0,003 %) содержания углерода при минимальном угаре хрома на рис. 1 приведены прямые равновесных концентраций углерода и кислорода при разном парциальном давлении рсо, рассчитанные по уравнению (3) для стали, содержащей 18 % Сг и 10 % №.
lg([%C][%0]) = -l^-2,07 + lg^co -
-eg [%Cr]-eg [%Ni]-eg [%Cr]-eg [%Ni]. (3)
[%q
Рис. 1. Концентрация кислорода в железе, содержащем 18 % Сг и 10 % Ni, в равновесии с углеродом (1) при 1600 °C и разных рсо (цифры у прямых в кПа) и с хромом по уравнению Хилти (2) и Накамуры (3)
На рис. 1 можно выделить три области. При концентрации углерода выше линии, отвечающей равновесию его с кислородом при заданном рСо, равновесную концентрацию кислорода в стали, контролирует углерод, и за счет растворенного в металле кислорода термодинамически возможно окисление углерода. При заданных рсо и температуре в области, лежащей левее линии равновесия С-0 и выше линии равновесия Сг-О, равновесную концентрацию кислорода в стали контролирует хром, и термодинамически возможно окисление растворенным в металле кислородом хрома. В области ниже этих обеих линий окисление углерода и хрома растворенным в стали кислородом невозможно.
Таким образом, в зависимости от термодинамических условий большим химическим сродством к кислороду может обладать либо углерод, либо хром. Вследствие этого хром может ограничивать возможность окисления углерода, что создает большие трудности при производстве нержавеющей стали с особонизкой, тем более с ультра-низкой концентрацией углерода.
Чтобы определить предельное отношение концентраций хрома и углерода, которое может быть достигнуто в условиях равновесия, необходимо просуммировать реакции окисления этих элементов. Суммирование реакций (1) и (3) дает известное [3] уравнение:
[%С] +1 / 4Сг3О4 = 3 / 4[Сг]+СО;
[%Crl3/4 1 11520
1g К = 1g 1........у ' "I.....™- Г = -+ 7,64 . (4)
6 [%С]/с J Т
Сравнение результатов расчета соотношения равновесных концентраций хрома и углерода по уравнению (4) с расчетами, сделанными суммированием уравнений (2) и (3), показало [7], для концентраций хрома 12...20% и углерода до 0,4%, удовлетворительное согласие при 1600 и 1900 °C и некоторое отличие при 1700 и 1800 °C.
При написании константы равновесия реак ции окисления углерода оксидом хрома, как в уравнении (4), так и в других [4-6], принято образование шлака, в котором содержание оксидов хрома выше предела его растворимости. Такой шлак находится в равновесии с взвешенными в нем кристаллами оксида хрома, активность которого в растворе, вследствие этого, равна единице. Это представление получило широкое распространение [8, 9] и не вызывало возражений. Между тем, согласно диаграмме CaO-CrO-Cr2O3-SiO2, построенной по экспериментальным данным [10], при содержании СаО 35...50 % в шлаке этой системы раствор сохраняется жидким с температурой ликвидус 1400... 1500 °C при содержании оксидов хрома (СгО и Сг2О3) до 30 % и более. Эти результаты были подтверждены другими авторами экспериментально [11, 12] и компьютерным моделированием [13].
Поэтому, следует признать ошибочным пред ставление о том, что в процессах выплавки и рафинирования нержавеющей стали шлак всегда насыщен оксидами хрома и активность их равна единице. Следовательно, в уравнении (4) константы равновесия, лежащей в основе теории процес сов окисления углерода и хрома при плавке и рафинировании нержавеющей стали, а также в других подобных уравнениях, необходимо учитывать активность оксидов хрома. Для этого уравнение (4) следует преобразовать в уравнение (5).
lg^ = lg
[%С]/с^04
-у-+ 7,64. (5)
С целью изучения необходимости такого преобразования мы провели исследование. В качестве показателя предельного отношения содержания хрома и углерода, которое может быть достигнуто в условиях равновесия, была принята функция [%Сг]3/4рсо/([%С]/сХ), соответствующая уравнениям (1) и (5). Такой выбор обусловлен тем, что эта функция учитывает влияние на равновесные концентрации парциального давления рсо, изменявшегося на опытных плавках в пределах 35...91 кПа, и температуры - 1651... 1725 °C. Как следует из уравнения константы равновесия, влияние этих параметров весьма велико.
Указанный показатель отношения содержания хрома и углерода в реальных условиях рафинирования нержавеющей стали характеризует степень угара хрома, и возможность получения низкого содержания углерода при высоком содержании хрома в нержавеющей стали. Поэтому, для изучения зави симости этого показателя от активности оксидов хрома в шлаке в промышленных условиях, использовали результаты контроля аргоно-кислородного рафинирования опытных плавок нержавеющей стали. Технологические параметры рафинирования и состав шлаков приведены ранее [14, 15].
Поволоцкий Д.Я.
Результаты контроля опытных плавок, на которых содержание Сг2О3 в шлаке было не более 25 % мае., показаны на рис. 2. Активность Сг3О4 здесь принята равной мольной доле Сг2О3 в шлаке. Как следует из [И], такое допущение в первом приближении вполне допустимо и не может вызвать большой ошибки. При этом учтено, что содержание Сг2О3 в шлаке по данным химического анализа определялось методом пересчета общей концентрации катионов хрома. С таким же успехом можно произвести этот пересчет на Сг3О4, и отличие будет лишь в постоянном коэффициенте.
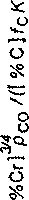
2,1
1,8
1,5
1,2
0,9
0,6
0,07 0,09 0,11 0,13 0,15 йСг2О3
Рис. 2. Влияние активности Сг2О3 на показатель предельного отношения концентраций хрома и углерода в процессе АКР
Как видно из приведенных на рис. 2 данных, активность оксидов хрома оказывает существенное влияние на показатель отношения содержания хрома и углерода в металле. С повышением активности Сг2О3 он увеличивается. Зависимость эта совершенно определенная и значимая. Это подтверждается корреляционным анализом. Коэффициент корреляции ее г = 0,736, а уровень значимости, т.е. вероятность отсутствия выявленной зависимости, равен 0,001, что свидетельствует о большой тесноте связи и ее надежности.
Наличие установленной зависимости позволяет заключить, что при содержании Сг2О3 в шлаке выплавки и аргоно-кислородного рафинирования нержавеющей стали примерно до 25 % оксиды хрома находятся в жидком шлаке в растворе. Следовательно, их активность необходимо учитывать при термодинамических расчетах.
При содержании Сг2О3 более ~25-27 % мае. связь между активностью (содержанием) Сг2О3 в шлаке и величиной [%Сг]3/4рСо/([%С]/сХ) не обнаружена, что можно объяснить выделением части оксидов хрома в шлаке из раствора в виде кристаллической дисперсной фазы.
Проблемы кинетики. Отличительной особенностью взаимодействия высокохромистого металлического расплава со шлаком является большое влияние существенно меняющихся во времени термодинамических параметров, от кото рых в значительной мере зависит кинетика этого взаимодействия.
Лимитирующей стадией взаимодействия металла со шлаком является диффузия [16, 17]. Поэтому скорость перехода элементов между металлом и шлаком можно выразить уравнением dC/dT = - k(F/ V)(C -С*), (6) где С - концентрация элемента в металле; т- время; к - коэффициент скорости массообмена; F и V-поверхность и объем металла; знаком * обозначено состояние равновесия.
Уравнение (6) легко решается интегрированием или упрощением при постоянном значении С . Практически таким оно является для реакции окисления углерода (3). В этом случае уравнение (6) можно, например, упростить до dddr = -кС и, определяя величину т, найти порядок процесса, аналогично порядку химической реакции по данному элементу. Это было использовано рядом исследователей [18-20] для оценки лимитирующего звена процесса окисления углерода. Такой метод, однако, непригоден для процессов, по ходу которых изменяются равновесные концентрации. В этом случае, необходимо интегрирование уравнения (6), которое требует учета изменений С . Это, в частности, относится к реакции окисления углерода оксидами хрома.
Как видно из уравнений (1) и (2), отношение концентраций [%Сг]/[%С] меняется с температурой. Изменение это столь значительно, что оно является одним из главных параметров, используемых при разработке технологии выплавки нержавеющей стали в дуговых печах. Это отношение также значительно меняется с изменением парциального давления рСо, что имеет большое значение при внепечной обработке в вакууме или процессом АКР. Поэтому для изучения кинетики взаимодействия высокохромистого металлического расплава и шлака было предложено решение уравнения (7) методом исчисления конечных разностей [7, 21]. Решая уравнение (6) относительно к и произведя аппроксимацию найденной производной конечными разностями, получили при начальном времени т0= 0 и исходной концентрации элемента Со:
^=(и/^)1п[(со-Со)/(сг-с;)]. (7)
Как видно, уравнение (7) учитывает как исходную равновесную концентрацию заданного элемента во время, принятое за начало отсчета выбранного периода (С*), так и его равновесную концентрацию в конце этого периода ( С* ). Таким образом с его применением можно изучать к при фиксации дискретных изменений значений равновесных концентраций элемента в металле, соответствующих определенным моментам взятия проб металла и шлака, при одновременном измерении температуры.
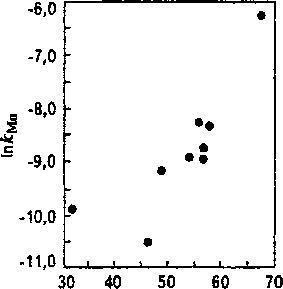
Уравнение (7) было использовано для изучения скорости массообмена между металлом и шлаком в процессе АКР нержавеющей стали. При изучении массообмена марганца, для которого константа равновесия реакции окисления - восстановления достаточно надежно известна [3], получена зависимость коэффициента скорости к от параметров продувки (рис. 3). Установлено, что при обычных для АКР режимах продувки {0,3... 0,7м3 (О2+Аг)/(т-мин)} он изменяется в пределах (0,25...25)-10^* м/с и находится в экспоненциальной зависимости от расхода газа.
О, м3/мин
Рис. 3. Влияние расхода газа в процессе АКР на коэффициент скорости массообмена марганца между металлом и шлаком
Однако результаты аналогичных расчетов для реакции (1) оказались неудовлетворительными. Никакой зависимости коэффициента массоперено-са к от режима продувки не выявлено. Невидимому, это объясняется тем, что при рафинировании высокохромистого металлического расплава окисление углерода и хрома происходит не только по реакции (1). Существенное значение имеет и прямое окисление этих элементов газообразным кислородом, а также образующейся при продувке высокожелезистой газо-шлако-металлической пеной.
Выводы
-
1. Выполнен термодинамический анализ процессов взаимодействия высокохромистого металлического расплава со шлаком. Показана необходимость учета активности (концентрации) оксидов хрома в шлаке.
-
3. Показана возможность исследования скорости массопереноса между металлическим расплавом и шлаком с использованием исчисления конечными разностями.
Список литературы Физико-химические процессы рафинирования высокохромистого металлического расплава при производстве нержавеющей стали
- Поволоцкий Д.Я. Выплавка легированной стали в дуговых печах/Д.Я. Поволоцкий, Ю.А. Гудим -М.: Металлургия, 1987. -136 с.
- Гудим Ю.А./Ю.А. Гудим, Д.Я. Поволоцкий, A.M. Шумаков//Известия вузов. Черная металлургия. -1981. -№ 10. -С. 44-47.
- Эллиот Д.Ф. Термохимия сталеплавильных процессов/Д.Ф. Эллиот, М. Глейзер, В. Рамакришна. -М.: Металлургия, 1969. -252 с.
- Yanke D./D. Yanke, A. Fischer//Arch. Eisenhuttenwesen. -1976. -№ 3. -S. 147-151.
- Ghosh A./A. Ghosh, G.V.R. Murthy//Trans. Iron a. Steel Inst. Japan. -1986. -№ 7. -P. 629-637.
- Nakamura Y./Y. Nakamura, T. Ohno, K. Segawa//Proc. ICSTTIS, Suppl. Trans. ISIJ. -1971. -V. 11. -P. 456-459.
- Поволоцкий Д.Я. Производство нержавеющей стали/Д.Я. Поволоцкий, Ю.А. Гудим. -Челябинск: Изд-во ЮУрГУ, 1998. -236 с.
- Григорян В.А. Теоретические основы электросталеплавильных процессов/В.А. Григорян, Л.Н. Белянчиков, А.Я. Стомахин. -М.: Металлургия, 1987. -271 с.
- Поволоцкий Д.Я. Электрометаллургия стали и ферросплавов/Д.Я. Поволоцкий, В.Е. Рощин, Н.В. Мальков. -М.: Металлургия, 1995. -592 с.
- Villiers J./J. Villiers, A. Muan//Journal of American Ceramic Soc. -1992. -V. 6, № 6, P. 1333-1341.
- Xiao Y./Y. Xiao, L. Hollapa//ISIJ Intern. -1993. -V. 3, № 1. -P. 66-74.
- K. Morita, M. Mori, M. Guo et al.//Steel Research. -1999. -№ 8-9. -P. 319-324.
- Degterov S./S. Degterov, A.D. Pelton//Metallurgical and Materials Trans. -V. 28B. -1997. -№ 2. -P. 235-242.
- Поволоцкий Д.Я./Д.Я. Поволоцкий, С.В. Зырянов//Известия вузов. Черная металлургия. -1995. -№ 7. -С. 16-19.
- Поволоцкий Д.Я./Д.Я. Поволоцкий, С.В. Зырянов//Известия вузов. Черная металлургия. -1995. -№ 9. -С. 17-20.
- Есин О.А.//Физическая химия пирометаллургических процессов/О.А. Есин, П.В. Гельд. -М.: Металлургия, 1966. -Ч. 2. -703 с.
- Явойский В.И. Теория процессов производства стали/В.И. Явойский. -М.: Металлургия, 1967. -792 с.
- Кнюппель Г. Раскисление и вакуумная обработка стали/Г. Кнюппель. -М.: Металлургия, 1973. -312 с.
- Поволоцкий Д.Я./Д.Я. Поволоцкий, O.K. Токовой, И.В. Малков//Известия АН СССР. Металлы. -1989. -№ 5. -С. 96-99.
- Поволоцкий Д.Я./Д.Я. Поволоцкий, Ю.А. Гудим//Металлы. -1993. -№ 5. -С. 23-28.
- Поволоцкий Д.Я./Д.Я. Поволоцкий, С.В. Зырянов//Металлы. -1995. -№ 4. -С. 3-8.


