Физико-химические закономерности создания новых гибридных эпоксиполимерных нанокомпозитов с повышенными прочностными характеристиками
Автор: Ситников П.А., Рябков Ю.И., Белых А.Г., Васенева И.Н., Кучин А.В.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Химические науки
Статья в выпуске: 1 (25), 2016 года.
Бесплатный доступ
Методом рК-спектроскопии исследованы кислотно-основные свойства поверхности оксидов алюминия, железа, кремния. Изучены физико-химические закономерности реакций между эпоксидными олигомерами и модифицирующими наполнителями. Отмечена наивысшая реакционная способность γ-Al2O3 и γ-AlO(OH) за счет наличия наиболее активных поверхностных групп с рК1≈4. Дано обоснование повышения прочностных характеристик гибридных эпоксиполимерных нанокомпозитов.
Кислотно-основные свойства, оксиды алюминия, железа, кремния, наномодификаторы, эпоксидные полимеры, композиты
Короткий адрес: https://sciup.org/14992803
IDR: 14992803 | УДК: 547.912.4.678
Текст научной статьи Физико-химические закономерности создания новых гибридных эпоксиполимерных нанокомпозитов с повышенными прочностными характеристиками
В настоящий момент для новых инфраструктурных проектов, например, морских объектов в Арктике, требуются новые материалы и технологии производства изделий. Эксплуатация ледовых платформ, конструкционных элементов трубопроводов и других изделий в экстремальных природно-климатических условиях, жесткие требования по безопасности и необходимость выдерживать максимальные ледовые нагрузки остро ставят вопрос о постоянном совершенствовании применяемых при их изготовлении и эксплуатации материалов. Композиты на основе эпоксидных олигомеров успешно используются на ледостойких платформах в качестве защитных оболочек металлических конструкций, а также при изготовлении райзерных узлов и компонентов трубопроводов из стеклопластика [1].
На основе эпоксидов активные наполнители способны существенно менять эксплуатационные характеристики полимерных материалов (механическую прочность, тепло- и термостойкость, электропроводность) за счет образования межфазного адсорбционного слоя на границе раздела полимер– наполнитель [2–6]. К сожалению, единого подхода, который позволял бы оценивать взаимодействия на межфазной границе, прогнозировать и регулировать такие взаимодействия, а значит, направленно совершенствовать качество материалов и эффективность технологий производства изделий, до сих пор не разработано.
Анализ литературных данных позволяет утверждать, что систематические исследования по изучению влияния поверхностных реакционных центров (гидроксильные группы, координационноненасыщенные центры и пр.) дисперсных частиц модифицирующего наполнителя на адгезионную способность, физико-механические характеристики полимерной матрицы до настоящего времени не осуществлены, несмотря на то, что даже незначительное варьирование химического состава поверхности вызывает значительное изменение адсорбционной способности [7]. Поэтому предметом исследования авторов является разработка мето- дов направленной модификации поверхности наполнителей с использованием современных методов их синтеза, эффективных способов контроля параметров межфазного взаимодействия, выявление физико-химических закономерностей при получении полимерного композиционного материала. Оксиды металлов нашли широкое применение в качестве наполнителей термо- и реактопластов. В представленной работе изучены оксид кремния (аэросил), а также различные модификации оксидов алюминия (γ-AlO(OH), γ-Al2O3, α-Al2O3) и железа (γ-FeO(OH), γ-Fe2O3, α-Fe2O3), химия поверхности которых хорошо изучена [8–10]. Непосредственной целью работы является исследование влияния кислотно-основных свойств поверхности оксидов на физико-химические процессы, протекающие при их введении в эпоксидные соединения.
Методика исследования
В работе использовался оксид алюминия, полученный методом осаждения из насыщенного раствора нитрата алюминия (ЧДА) водным раствором гидроксида аммония (ω=23 %, ХЧ). Добавление осадителя проводили до рН 7,5. Для получения различных полиморфных модификаций оксида алюминия синтезированный гидроксид алюминия прокаливали при температурах 300 (γ-AlO(OH)), 650 (γ-Al 2 O 3 ), 1200°C (α-Al 2 O 3 ) в течение 1 час, со скоростью нагрева 60°С/час.
Производные гидроксида железа ситезиро-вали золь-гель способом из хлорида железа (III) (ХЧ). Полученные дисперсные системы были охарактеризованы по ряду параметров, таких как: значение pH (1,42 ± 0,02), средний размер частиц (9,3 ± 0,3 нм), содержание дисперсной фазы (0,52 ± 0,05 %), электрокинетический потенциал (+27,3 ± 2,17 мВ). Оксид кремния получен разложением паров хлорида кремния (ХЧ) в атмосфере водяного пара при температуре 1000 °С.
Кислотно-основные свойства оксидов изучали методом рК-спектроскопии. Для анализа проводился отбор образцов суспензий с размером частиц 1–2 мкм. Перед титрованием аликвот суспензий рН доводили до 2–3, и в этих условиях выдерживались в течение 1 сут. Ионную силу в процессе титрования поддерживали равной 0.1 моль/л. Титрование осуществлялось в термостатируемых (±0.2°С) полипропиленовых стаканах в токе аргона. Обычно проводили два параллельных титрования, на основании которых рассчитывали погрешность кривой титрования, учитываемую в дальнейшем при расчете рК-спектров.
Кислотно-основные свойства изучаемого материала удобно охарактеризовать с помощью метода рК-спектроскопии [11, 12]. По оси ординат pK-спектра откладывается доля кислотно-основных центров с соответствующим pK (либо удельное содержание таких центров q, ммоль/г), в зависимости от pK. Расчет рК-спектров проводится по кривым титрования:
0 cc HA V 0 - c B0 H V - [H + ] . (V о + V ) 1 H (PH) = n b ( PH ) + n H = ---------------------------- + n H
m
В этой формуле: n H — количество ионов водорода (ммоль/г), адсорбированных на частицах суспензии в начальной точке титрования pH 0 , n b (pH) – количество ионов водорода (ммоль/г), адсорбированных на частицах суспензии в ходе титрования до текущей величины pH , V 0 - объем суспензии, C HA -концентрация одноосновной сильной кислоты в ней, V – объем добавленной щелочи с концентрацией CBOH , m - масса твердой фазы суспензии в образце.
Кислотно-основные свойства оксидных материалов были интерпретированы на основе 2рК-модели [13]. Исследование процессов, протекающих при термическом воздействии на исследуемые системы, осуществлялось с помощью дифференциального сканирующего калориметра Shimadzu DSC-60 (скорость подъема температуры 2 °С/мин в воздушной атмосфере). ИК-спектры модельных систем на основе фенилглицидилового эфира и оксидов снимали после их предварительной изотермической выдержки при 90 °С в течение 1 ч при помощи спектрометра IR Prestige 21, в тонком слое, между окошками KBr.
В качестве модельного эпоксисодержащего соединения выбран фенилглицидиловый эфир (ТУ 6-08-3321-73, содержание эпоксидных групп 26%). Наличие в его структуре единственного типа функциональных групп упрощает исследование взаимодействия поверхности наполнителя с эпоксидным олигомером.
Результаты и обсуждение
Типичные зависимости n b (pH) , рассчитанные из кривых прямого и обратного потенциометрического титрования суспензии (на примере γ-Al 2 O 3 ), показаны на рис. 1. Из него видно, что последовательно выполненные прямые и обратные титрования дают идентичные результаты, значит, процессы, протекающие при титровании, обратимы.
♦ 1 -е титрование, прямое
■ 2-е титрование, прямое
А 1 -е титрование, обратное
• 2-е титрование, обратное
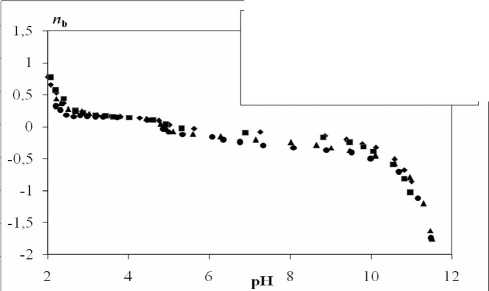
Рис.1. Адсорбция ионов водорода на поверхности Al 2 O 3 как функция рН.
На рис. 2 представлены рК-спектры модификаций оксида алюминия. В соответствии моделью 2рК [10] пики спектров можно отнести к следующим равновесиям:
–Al–OH2+ eS –Al–OH + H+ (рК1 ≈ 4)
–Al–OH Я –Al–O- + H+ (рК 2 ≈ 10-12)
–Al–OH 2 + Cl- ^ –Al–OH+H++ Сl- (рК 3 ≈ 7-8)
–Al–OH + Na+<=* –Al–O-Na++ H+ (рК 4 ≈ 8-10) .
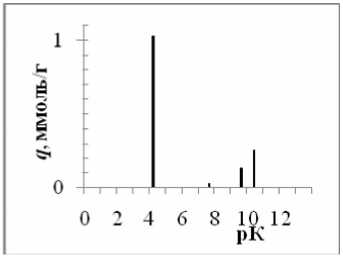
а)
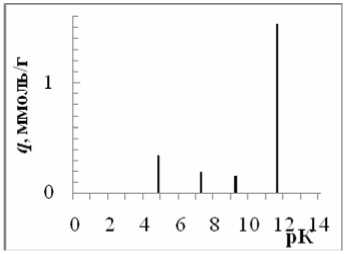
б)
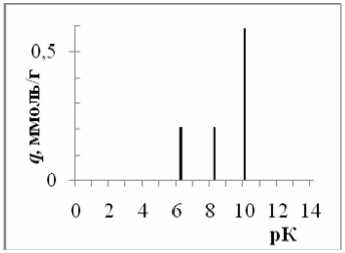
в)
Рис. 2 рК-спектры γ -AlO(ОН) ( а ), γ -Al 2 O 3 ( б ), α -Al 2 O 3 ( в ).
Величина рК 1 в ряду γ-AlO(ОН) – γ-Al 2 O 3 – α-Al 2 O 3 заметно уменьшается вплоть до полного ее исчезновения у корунда, а равновесие, соответствующее рК 2 , практически не зависит от модификации оксида алюминия.
В случае с производными гидроксида железа (III), с увеличением температуры прокаливания происходит удаление воды с образованием в конечном счете поверхностных кислотно-основных центров, поведение которых описывается уравнением: –Fe–OH Ei –Fe–O- + H+ (рК 2 ≈ 11).
При анализе кислотно-основных свойств SiO 2 обычно принимается, что заряд его поверхности изменяется за счет диссоциации поверхностных силанольных групп в соответствии с реакциями:
–Si–OH 2+ # –Si–OH + H+ (рК 1 ≈ 6)
–Si–OH S –Si–O- + H+ (рК 2 ≈ 10).
Известно, что ионы фонового электролита образуют с поверхностными гидроксильными группами оксида кремния комплексы. Весьма вероятно, что между этими слабо сорбирующимися ионами и поверхностью расположен, как минимум, один слой молекул воды, который отделяет эти ионы от атомов кислорода или кремния на поверхности, т.е. они образуют ионные пары или внешнесферные комплексы [14]. Поэтому для описания протолитических свойств оксида кремния, кроме реакции диссоциации, необходимо учитывать реакцию образования внеш-несферных комплексов с катионами электролита:
–Si–OH + Na+ Ei –Si–O-Na++ H+ (рК 4 ≈ 9-10).
Методом дифференциальной сканирующей калориметрии (ДСК) исследованы физико-химические процессы, протекающие при добавлении к фе-нилглицидиловому эфиру (ФГЭ) порошков оксидов. На основании данных ДСК представлены параметры взаимодействия в модельных системах Al 2 O 3 – ФГЭ (см. таблицу).
Температурные параметры и тепловой эффект процесса взаимодействия в модельных системах
ФГЭ – γ -AlO(ОН) и ФГЭ – γ -Al 2 O 3
|
Т start , °C |
T max , °С |
T end , °C |
Q , Дж/г |
|
|
γ-AlO(ОН) |
80 |
105 |
125 |
8.6 |
|
γ-Al 2 O 3 |
76 |
105 |
125 |
6.2 |
В случае γ-AlO(ОН) и γ-Al 2 O 3 имеется экзотермический пик химического взаимодействия эпоксидных групп с поверхностными кислотноосновными центрами, а у α-Al 2 O 3 такого пика не наблюдается. Для оксидов железа и кремния на кривых ДСК, как и в случае α-Al 2 O 3 , процессы химического взаимодействия эпоксидных групп с активными центрами поверхности наполнителя не обнаруживаются.
Так как константы равновесия K 1 и K 2 характеризуют силу кислотно-основных центров, наличие на рК-спектре линии с рК 1 около 4 для γ-AlO(ОН) и γ-Al 2 O 3 свидетельствует о более высокой их реакционной способности по сравнению с остальными изученными оксидами.
Это подтверждается также данными ИК-спектроскопии (IR Prestige 21). При нагревании смеси ФГЭ–γ-AlO(OH) (90°C, 1 час) интенсивность полос поглощения, соответствующих колебаниям эпоксидных групп (750–950 см-1), заметно снижается, что свидетельствует об исчезновении эпоксидных циклов и полимеризации фенилглицидилового эфира на поверхности оксида алюминия.
Появление полосы поглощения в области 1650–1600 см-1, отвечающей валентному колебанию связи С=О, сопряженной с атомом кислорода, позволяет предположить, что раскрытие эпоксидного цикла происходит по схеме:
H
Al OH + H 2 C C C O O H2
где Al – атом алюминия на поверхности наполнителя.
При нагревании системы ФГЭ–γ-Al 2 O 3 заметно уменьшается интенсивность полос поглощения эпоксидных групп. Кроме того, в интервале 1150–1060 см-1 появляются полосы поглощения, отвечающие алифатическим простым эфирным связям –С–О–С–. Эти изменения спектров указывают на то, что при нагревании системы происходит гомополимеризация фенилглицидилового эфира с образованием простого полиэфира, а активные центры на поверхности оксида алюминия выступают как инициаторы полимеризации:
OO
O Al O + H 2 C CH R H 2 C CH R
O Al O
Кроме указанных взаимодействий, в ИК-спек-трах проявляются поверхностные гидроксильные группы, аналогично имеющимся в γ-AlO(OH) (слабый пик в области 1640–1630 см-1). Появление гидроксильных групп связано с гидролизом [7]:
–Al–O–Al– + H 2 O 2–Al–OH.
При нагревании смесей ФГЭ с другими оксидами заметных изменений в ИК-спектрах не наблюдается.
Заключение
Таким образом, в настоящей работе показано, что из изученных модификаций оксидов алюминия, железа и кремния лишь в γ-Al 2 O 3 и γ-AlO(OH) имеются кислотно-основные центры, поведение которых описывается уравнением –Al–OH 2 + –Al– OH + H+ с рК 1 ≈ 4. Эти модификации за счет наличия активных поверхностных групп являются наиболее реакционноспособными наполнителями эпоксидных олигомеров, вступая с ними в химические реакции. При этом происходит как химическое взаимодействие эпоксида с гидроксильными группами на поверхности оксида алюминия, так и гомополимеризация фенилглицидилового эфира, инициированная поверхностно активными центрами наполнителя. Менее активные оксиды железа, кремния и корунд в непосредственное химическое взаимодействие с эпоксидными соединениями не вступают. Модифицирующее действие этих наполнителей может быть связано с образованием водородных связей между эпоксидными группами и поверхностными кислотно-основными центрами оксидов.
Результаты изучения физико-химических закономерностей процессов полимеризации матрицы композиционных материалов, модифицированной субмикро- (оксид алюминия) и нанодисперсными минеральными компонентами (наночастицы и нановолокна оксидов алюминия, железа, кремния), процессов, идущих с участием активных поверхностных групп нанооксидов, использованы для направленного получения образцов композиционных
материалов с повышенной теплостойкостью (до 160 °С), прочностными характеристиками (σ изг = 120 МПа, σ разр = 260 МПа), относительным удлинением для клеевых составов, увеличенным со 100 до 700 %.
Работа выполнена при поддержке программ фундаментальных исследований РФФИ (проект 13-03-00132), УрО РАН (проекты № 12-33-004-АРКТИКА, 12-И-3-2005).
Работа выполнена с использованием оборудования Центра Коллективного Пользования (ЦКП) «Химия» Института химии Коми НЦ УрО РАН.
Список литературы Физико-химические закономерности создания новых гибридных эпоксиполимерных нанокомпозитов с повышенными прочностными характеристиками
- Ягубов Э.З. Композиционно-волокнистые трубы в нефтегазовом комплексе. М.: Изд-во Центр ЛитНефтеГаз, 2008. 271 с.
- Хозин В.Г. Усиление эпоксидных полимеров. Казань: Изд-во ПИК «Дом печати», 2004. 446 с.
- Novak B.M. Hybrid nanocomposite Materials -Between Inorganic Glasses and Organic Polymers//Adv.Mater. Vol.5. 1993. №6. P. 422-433.
- Дебердеев Т.Р., Гарипов Р.М., Гарипова Л.Р. Моделирование процесса отверждения эпоксиаминных композиций, содержащих активные модификаторы//Структура и динамика молекулярных систем. 2003. Вып. X. Ч. 1. С. 59-61.
- Baller J., Thomassey M., Ziehmer M. et al. The catalytic influence of alumina nanoparticles on epoxy curing//Thermochimica Acta. 2011. Vol. 517. № 1-2. P. 34-39.
- Pestov A.V., Kuznetsov V.A., Mekhaev A.V. et al. Designing new adhesive materials based on epoxy oligomers filled with organic compounds//Polymer Science, Series D. Glues and Sealing Materials, 2015. Vol. 8. No. 2. P. 149-152.
- Bekir S., Özkanat Ö., Mol J. et al. Role of Surface Oxide Properties on the Aluminum/Epoxy Interfacial Bonding//J. Phys. Chem. 2013. Vol. 117. P. 4480-4487.
- Yates D. E., Levine S., and Healy T. W. Sitebinding Model of the Electrical Double Layer at the Oxide/Water Interface. J. Chem. Soc. Faraday Trans. 1974. Vol. 70. P. 1807-1818.
- Химия привитых поверхностных соединений/Под ред. Г.В. Лисичкина. М.: Физматлит, 2003. 592 с.
- Hiemstra T., Wit J.C.M.D., Riemsdijk W.H.V. Multisite proton adsorption modeling at the solid/solution interface of (hydr)oxides: A new approach II. Applications to various important (hydr)oxides. J. Colloid. Interface Sci. 1989. Vol. 133. P. 105-117.
- Рязанов М.А. Кислотно-основные свойства поверхности оксидных материалов//Известия Коми научного центра УрО РАН. 2011.Вып. 2(6). С. 25-29.
- Рязанов М.А., Дудкин Б.Н. Использование pК-спектроскопии для изучения кислотноосновных свойств золей гидратированного оксида алюминия//Коллоидный журнал. 2004. Т. 66. № 6. С. 807-810.
- Davis J.A., James R. and Leckie J.O. Surface Ionization and Complexation at the Oxide/Water Interface. I Computation of Electrical Double Layer Properties in Simple Electrolytes. J. Colloid Interf. Sci. 1978. Vol. 63. P. 480-499.
- Власова Н.Н. Сравнение моделей комплексообразования на поверхности для количественного описания кислотных свойств высокодисперсного кремнезема//Химия, физика и технология поверхности. 2008. Вып. 14. С. 6-15.


