Физико-химический анализ фазовых равновесий в системах Со-С-О, Co-Si-O, Co-Al-O и Co-C-Si-0 при температурах существования жидкого металла
Автор: Трофимов Е.А., Михайлов Г.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 10 (65), 2006 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156533
IDR: 147156533 | УДК: 669.25+
Текст обзорной статьи Физико-химический анализ фазовых равновесий в системах Со-С-О, Co-Si-O, Co-Al-O и Co-C-Si-0 при температурах существования жидкого металла
Взаимодействие элементов, растворенных в жидком кобальте с растворенным в нем кислородом, с образованием твердых, жидких и газообразных оксидных фаз, реализуется в частности, в ходе восстановления кобальта при электроплавке кобальтовых руд и штейнов цветной металлургии, а также в ходе окислительного рафинирования и раскисления кобальта [1].
Исследование происходящих при этом взаимодействий (в частности, их термодинамических аспектов) в металле, находящемся в равновесии с различными оксидными фазами, интересно как с практической, так и с теоретической точек зрения.
Имеющиеся в литературе данные о таких исследованиях [2] не позволяют прямо использовать их результаты для достаточно полного моделирования реальных технологических процессов с единых термодинамических позиций.
В связи с вышеизложенным была поставлена задача проведения термодинамического анализа систем Со-С-О, Co-Si-O, Co-Al-O, Co-C-Si-О в области температур 1500...1600 °C при содержании кобальта в системе более 90 % путем построения поверхностей растворимости компонентов в металле (ПРКМ) для этих систем. Термодинамические константы, использованные в ходе работы, сведены в табл. 1 и 2. Большая часть этих значений заимствована из работы [3], другие рассчитаны нами с использованием данных приводимых в этой же работе.
Таблица 1
Температурные зависимости констант равновесия реакций взаимодействия компонентов кобальтового расплава
|
№ |
Процесс |
Константа равновесия, К; a - активность, мае. %; р - давление, атм |
Температурная зависимость, 1g К |
|
1 |
(СоО) = Со + [О] |
К = а[0] / а^СоО) |
-6463/7+3,37 |
|
2 |
|СоО = Со + [О] |
~ Я[О] |
-9090/7+4,56 |
|
3 |
(SiO2) = [Si] + 2[О] |
К = fy^ ^(sio,) |
-36181 /7+ 13,046 |
|
4 |
|SiO2| = [Si] + 2[О] |
К = «[OJ^CSi] |
-36584/ 7+ 13,248 |
|
5 |
|А12О3|=2[А1] + 3[О] |
Л ~ ^О I^All |
-65832/7+21,942 |
|
6 |
|СоА12О4| = Со + 2[А1] + 4[О] |
Л _ а[О]а[А1] |
-76888/7+26,808 |
|
7 |
{СО} = [С] + [О] |
К = а[01<7[С] / рсо |
-4310/7- 1,576 |
|
8 |
{СО2} = [С] + 2[О] |
К = OjOj<2[C] / рСОг |
- 15693/7+3,659 |
Температурные зависимости параметров взаимодействия
Таблица 2
|
Температурная зависимость |
< |
Температурная зависимость |
|
|
ео |
-375/7 |
243/7 |
|
|
369/7 |
375/7 |
||
|
ем |
- 1050/7 |
- 1772 / 7 |
|
|
е0 |
-386/7 |
-676/7 |
|
|
еос |
- 1853 /7 |
вс° |
- 1390/7 |
Работа выполнена при финансовой поддержке гранта МК-4255.2006.3.
Для расчета активностей компонентов оксидного расплава в системе CoO-SiO2 использовано приближение теории субрегулярных ионных расплавов [4]. Значения энергетических параметров теории, определенные по данным о диаграмме состояния этой системы, приведенным в справочнике [5]: 21ш = -91327 Дж/моль, 21122= -333607 Дж/моль и 21222= 125566 Дж/моль.
Рассмотрим построенную в ходе работы поверхность растворимости компонентов для системы Со-С-О. Расчет проводился для двух вариантов составов газовых фаз. В первом случае суммарное парциальное давление углекислого и угарного газов было принято равным 0,1 атм. Во втором случае оно равняется 1 атм. Результаты расчета представлены на рис. 1. В области I заданы составы металла, равновесного с твердым СоО, в области II - с газовой фазой (СО, СО2). Содержание СО2 в газе сильно уступает содержанию угарного газа. На линии 1-2 определены составы ме талла, равновесного с жидкими оксидами и газовой фазой. Очевидно, что повышение давления оксидов углерода смещает межфазную границу 1-2 в сторону более высоких концентраций углерода в жидком металле.
Рассмотренная диаграмма является ключевой для изучения более сложных систем.
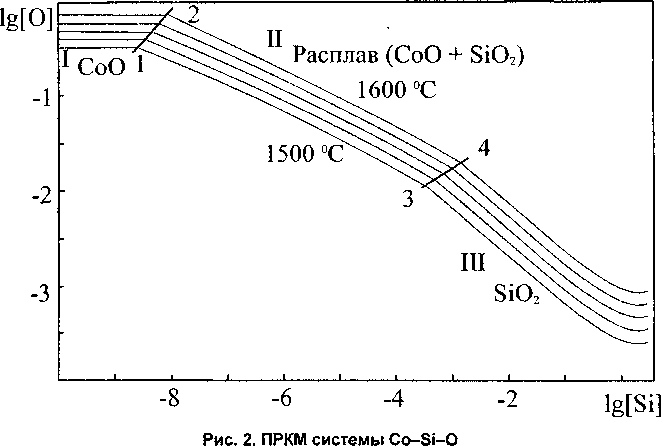
На рис. 2 построена ПРКМ системы Co-Si-O, изотермы растворимости кислорода и кремния в жидком кобальте.
Линия 1-2 показывает составы металла, находящегося в равновесии с твердым СоО и жидким расплавом оксидов кобальта и кремния. Аналогичная линия 3-4 разделяет составы металла, равновесного как с жидким шлаком, так и кремнеземом. В области I определены составы металла, равновесного с оксидом кобальта. В области II - составы металла, находящегося в равновесии с расплавом оксидов кремния и кобальта. Область III демонстрирует составы металла, равновесные с кремнеземом.
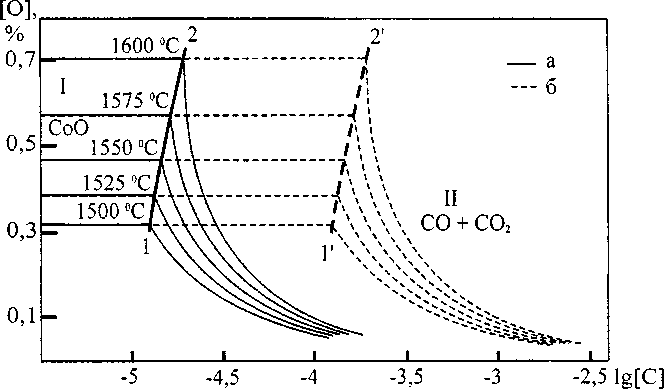
Рис. 1. ПРКМ системы Со-С-О:
а - суммарное давление оксидов углерода 0,0101 МПа; б - суммарное давление оксидов углерода 0,1013 МПа
Трофимов Е.А., Михайлов Г.Г.
Физико-химический анализ фазовых равновесий в системах Со-С-О, Co-Si-0, Co-AI-О и Co-C-Si-O...
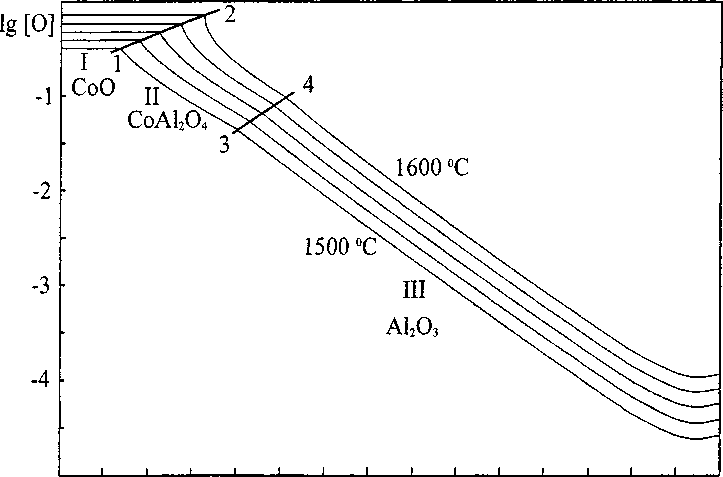
На рис. 3 построена ПРКМ системы Co-Al-O.
Линия 1-2 показывает составы жидкого металла, находящегося в равновесии с твердым СоО и твердой шпинелью (СоА12О4). В области I определены составы металла, находящегося в равновесии с твердым оксидом кобальта. В области II -составы металла, находящегося в равновесии со шпинелью СоА12С>4. Линия 3-4 показывает составы жидкого металла, находящегося в равновесии со шпинелью и твердым оксидом алюминия, а в области III определены составы жидкого металла, находящегося в равновесии с твердым А12О3.
Последовательность окисления примесей, температурный режим плавки, раскисленность расплава во многом определяются соотношением между содержащимися в нем углеродом и кремнием. Наибольшую информацию о фазовых равновесиях в системе Co-C-Si-O можно получить, построив ПРКМ этой системы. При определении координат ПРКМ были совместно проанализированы все возможные реакции между кислородом, кобальтом, кремнием и углеродом. На рис. 4 представлено изотермическое сечение ПРКМ при 155О°С и суммарном давлении оксидов углерода
-7 -6 -5 -4 -3 -2 -1 lg [А1]
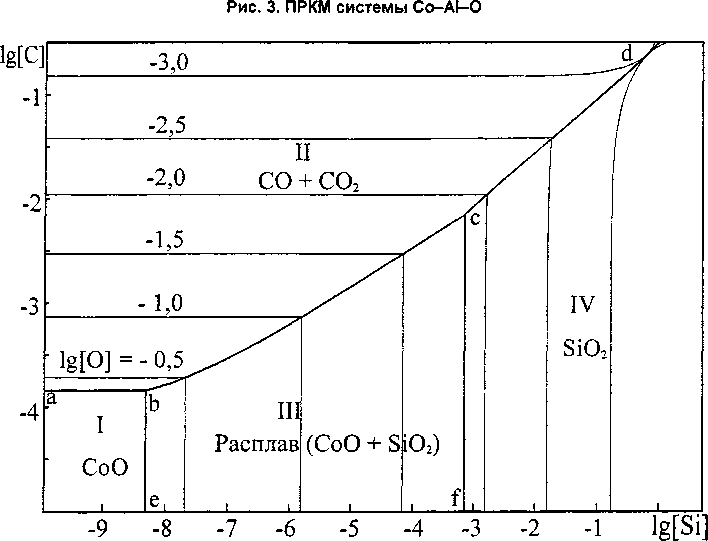
Рис. 4. Изотермический разрез ПРКМ системы Co-C-Si-O при 1550 °C и суммарном давлении оксидов углерода 0,1013 МПа
1 атм. На линии а-b заданы составы металла, равновесного с газовой фазой и твердым оксидом кобальта, на линии b-с - с газовой фазой и расплавом оксидов исследуемой системы, на линии b-е -жидким расплавом и СоО, на линии c-d показаны составы металла, находящегося в равновесии с газовой фазой и твердым кремнеземом и, наконец, линия с—f обозначает состав, равновесный как с кремнеземом, так и с расплавленными оксидами.
Полученные диаграммы позволяют объяснить состав неметаллических включений в кобальте, позволяют проектировать процессы рафинирования металлического расплава и моделировать технологически необходимые фазовые равновесия.
Выводы
Посредством термодинамических расчетов построены поверхности растворимости компонентов в металле (ПРКМ) для систем Со-С-О, Co-Si-O, Co-Al-О и Co-C-Si-O. Разработанные ПРКМ могут быть использованы для анализа технологиче ских процессов, связанных с взаимодействием кислорода, углерода, кремния и алюминия в жидком кобальте.
Список литературы Физико-химический анализ фазовых равновесий в системах Со-С-О, Co-Si-O, Co-Al-O и Co-C-Si-0 при температурах существования жидкого металла
- Береговский В.И., Кистяковский Б.Б. Металлургия меди и никеля. -М.: Металлургия, 1972. -456 с.
- Худяков И.Ф., Кляйн С.Э., Агеев Н.Г. Металлургия меди, никеля, сопутствующих элементов и проектирование цехов. -М.: Металлургия, 1993. -510 с.
- Куликов И.С. Раскисление металлов. -М.: Металлургия, 1975. -504 с.
- Михайлов Г.Г., Поволоцкий Д.Я. Термодинамика раскисления стали. -М.: Металлургия; 1993. -144 с.
- Диаграммы состояния силикатных систем: Справочник. Вып. 1. Двойные системы/Н.А. Торопов, В.П. Барзаковский, В.В. Лапин, Н.Н Курцева -Л.: Наука, Ленингр. отд., 1969 -822 с.