Физико-химическое изучение системы из мочевины, фосфорной кислоты и монохлорацетата
Автор: Абдурахманов У.К.
Журнал: Экономика и социум @ekonomika-socium
Рубрика: Основной раздел
Статья в выпуске: 11 (78), 2020 года.
Бесплатный доступ
Визуально политермическим методом изучена растворимость в системе мочевина - [84% фосфорная кислота + 16% вода] - монохлоруксусная кислота от 14,4 °С (полное затвердевание системы) до 100 °С и на основе политерм растворимости и внутренных разрезов построена политермическая диаграмма системы. На политермической диаграмме растворимости разграничены поля кристаллизации моногидрата фосфорной кислоты, мочевины и соединений составов: CO(NH2)2•H3PO4; ClCH2COOH•H3PO4; CO(NH2)2•ClCH2COOH; CO(NH2)2•2ClCH2COOH.
Мочевина, фосфорная кислота, монохлоруксусная кислота, политермическая диаграмма, поля кристаллизации
Короткий адрес: https://sciup.org/140251674
IDR: 140251674 | УДК: 541.123.3+547.495.2
Текст научной статьи Физико-химическое изучение системы из мочевины, фосфорной кислоты и монохлорацетата
Хлопководство является один из ведущих отраслей народного хозяйства Узбекистана. Первостепенной задачей технического прогресса в хлопководстве является механизированная уборка урожая, а для успешной работы хлопкоуборочных машин хлопчатник должен быть обезлиствлен при помощи химических препаратов (дефолиантов).
Дефолиация вызывает не только опадение листьев, но заметно ускоряет созревание коробочек хлопчатника, снижает себестоимости хлопка-сырца, сокращает затраты труда на уборку и повышает выход хлопка-сырца высших сортов, является средством борьбы с вредителями и болезнями коробочек и волокна.
Перед дефолиантами ставится ряд требований: они должны быть более концентрированными по действующему веществу, высокоэффективными, обеспечивающими опадение листьев хлопчатника до 80 - 90% за одну обработку при низких нормах расхода, действующими "мягко" на растения, а следовательно, не влияющими отрицательно на них и не снижающими урожая, его качество и масличность семян, а также не приводящими засорению хлопка волокна.
Целью настоящей работы является получение различных соединений на основе монохлорацетата, фосфорной кислоты и мочевины, интересующие при синтезе новых дефолиантов.
Для характеристики поведения исходных компонентов при их совместном присутствии в широком концентрационном и температурном интервале визуально политермическим методом изучена растворимость системы мочевина – [84% фосфорная кислота + 16% вода] - монохлоруксусная кислота [1].
Как известно, при обработке растений растворами производных галлоидкарбоновых кислот проявляют ростостимулирующую и дефолиирующую активность [2-4]. Получение различных соединений на их основе имеет большое значение при синтезе новых дефолиантов [5].
Система CO(NH2)2 - [84%H3PO4 + 16%H2O] - ClCH2COOH изучена с помощью девяти внутренних разрезов. Построена политермическая аснзсоон, мас.%
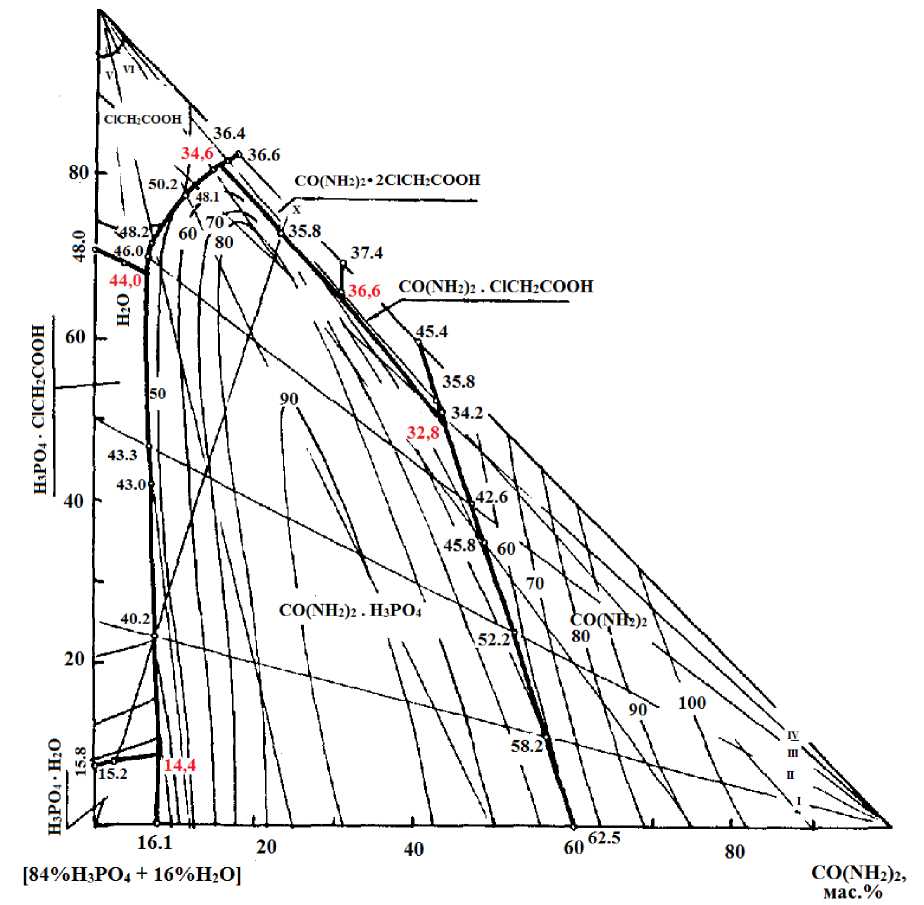
Рис. 1. Политерма растворимости системы монохлоруксусная кислота – мочевина – [84% фосфорная кислота +16%вода]
диаграмма растворимости системы от 14,4 °С (полное затвердевание системы) до 100 °С (рис. 1.), на которой разграничены поля кристаллизации моногидрата фосфорной кислоты, мочевины и соединений составов: CO(NH 2 ) 2 •H 3 PO 4 ; ClCH 2 COOH•H 3 PO 4 ; CO(NH 2 ) 2 •ClCH 2 COOH; CO(NH 2 ) 2 •2ClCH 2 COOH.
Поля сходятся в пяти тройных узловых точках (табл.1). На политермической диаграмме растворимости внутри полей кристаллизации через каждые 10 °С нанесены изотермы растворимости. Построены проекции политермических кривых растворимости на стороны [84%H 3 PO 4 + 16%H 2 O] - CO(NH 2 ) 2 , [84%H 3 PO 4 + 16%H 2 O] - ClCH 2 COOH.
На политермической диаграмме наибольшую область занимает поле кристаллизации фосфата мочевины, что свидетельствует о малой растворимости его по сравнению о остальными компонентами сиcтемы.
Соединение H 3 PO 4 •ClCH 2 COOH в системе существует в интервале температур 14,4 - 48,0 °С. Наименьшая концентрация монохлоруксусной кислоты, вызывающая образование данного соединения - 7,2 % .
Таблица 1.
Двойные и тройные узловые точки системы CO(NH 2 ) 2 -[84%H 3 PO 4 +16%H 2 O]- ClCH 2 COOH
|
Состав жидкой фазы, мас.% |
Темпера тура кристал лизации, 0C |
Твердая фаза |
||
|
ец ец И о и |
д о о и ец д W ^м W |
+ 2 $ те " ас ^^ |
||
|
17,8 |
82,2 |
- |
36,6 |
ClCH 2 COOH + CO(NH 2 ) 2 •2ClCH 2 COOH |
|
16,4 |
81,6 |
2,0 |
34,5 |
То же |
|
15,4 |
81,1 |
3,5 |
34,6 |
ClCH 2 COOH + CO(NH 2 ) 2 •2ClCH 2 COOH + CO(NH 2 ) 2 •H 3 PO 4 |
|
14,6 |
80,6 |
4,8 |
42,1 |
ClCH 2 COOH + CO(NH 2 ) 2 •H 3 PO 4 |
|
12,4 |
78,8 |
8,8 |
48,0 |
То же |
|
11,3 |
77,5 |
11,4 |
50,2 |
То же |
|
7,2 |
71,6 |
21,2 |
48,2 |
То же |
|
6,6 |
70,1 |
23,3 |
46,0 |
То же |
|
- |
70,8 |
29,2 |
48,0 |
ClCH 2 COOH + ClCH 2 COOH•H 3 PO 4 |
|
3,8 |
69,0 |
27,2 |
46,1 |
То же |
|
6,4 |
68,0 |
25,6 |
44,0 |
ClCH 2 COOH + CO(NH 2 ) 2 •H 3 PO 4 + ClCH 2 COOH•H 3 PO 4 |
|
6,8 |
46,6 |
46,6 |
43,3 |
CO(NH 2 ) 2 •H 3 PO 4 + ClCH 2 COOH•H 3 PO 4 |
|
7,0 |
42,0 |
51,0 |
43,0 |
То же |
|
7,4 |
23,1 |
69,5 |
40,2 |
То же |
|
8,0 |
8,4 |
83,6 |
14,4 |
H 3 PO 4 •H 2 O + ClCH 2 COOH•H 3 PO 4 + CO(NH 2 ) 2 •H 3 PO 4 |
|
2,6 |
7,7 |
89,7 |
15,2 |
H 3 PO 4 •H 2 O + ClCH 2 COOH•H 3 PO 4 |
|
- |
7,2 |
92,8 |
15,8 |
То же |
|
7,5 |
- |
92,5 |
10,1 |
H 3 PO 4 •H 2 O + CO(NH 2 ) 2 •H 3 PO 4 |
|
23,1 |
72,9 |
4,0 |
35,8 |
CO(NH 2 ) 2 •2ClCH 2 COOH + CO(NH 2 ) 2 •H 3 PO 4 |
|
31,2 |
64,9 |
3,9 |
36,6 |
CO(NH 2 ) 2 •2ClCH 2 COOH + CO(NH 2 ) 2 •ClCH 2 COOH + CO(NH 2 ) 2 •H 3 PO 4 |
|
31,0 |
65,7 |
3,3 |
36,9 |
CO(NH 2 ) 2 •2ClCH 2 COOH + CO(NH 2 ) 2 •ClCH 2 COOH |
|
30,8 |
69,2 |
- |
37,4 |
То же |
|
40,2 |
53,9 |
5,9 |
34,5 |
CO(NH 2 ) 2 •ClCH 2 COOH + CO(NH 2 ) 2 •H 3 PO 4 |
|
40,4 |
59,6 |
- |
45,4 |
CO(NH 2 ) 2 •ClCH 2 COOH + CO(NH 2 ) 2 |
|
42,6 |
52,6 |
4,8 |
35,8 |
То же |
|
43,4 |
50,9 |
5,7 |
34,2 |
То же |
|
43,8 |
49,6 |
6,6 |
32,8 |
CO(NH 2 ) 2 •ClCH 2 COOH + CO(NH 2 ) 2 + CO(NH 2 ) 2 •H 3 PO 4 |
|
47,2 |
39,6 |
13,2 |
42,6 |
CO(NH 2 ) 2 •H 3 PO 4 + CO(NH 2 ) 2 |
|
48,8 |
35,0 |
16,2 |
45,6 |
То же |
|
52,6 |
23,7 |
23,7 |
52,2 |
То же |
|
56,8 |
10,8 |
32,4 |
58,2 |
То же |
|
60,5 |
- |
39,5 |
62,5 |
То же |
Как видно из рис.1 поля кристаллизации монохлорацетат- и бис-монохлорацетатов мочевины занимают небольшую часть диаграммы. По занимаемой площади кристаллизации можно судить, что они являются хорошо растворимыми в данной системе.
Выделенные соединения идентифицированы химическим и физикохимическим методами анализа. Результаты элементного анализа соединения ClCH2COOH•H3PO4 соответствуют вычисленным значениям. Рентгенофазовый анализ показывает, что соединение характеризуется собственными дифракционными рефлексами, не характерными для составляющих компонентов (рис.2, а).
По данным термогравиметрического анализа ClCH 2 COOH•H 3 PO 4 , плавится при 40,0 °С (рис.3). При 170 °С происходит его разложение с
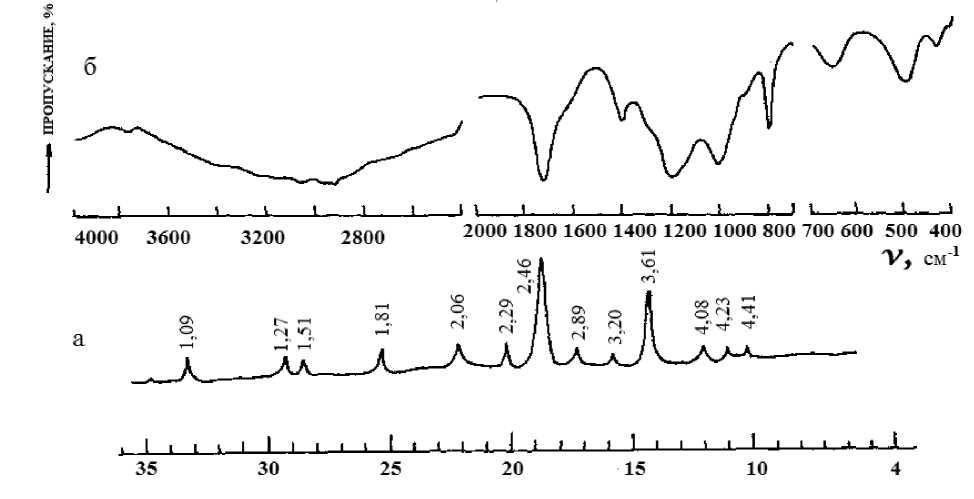
Рис.2. а) Рентгенограмма ClCH 2 COOH•H 3 PO 4 ; б) ИК-спектр ClCH 2 COOH•H 3 PO 4
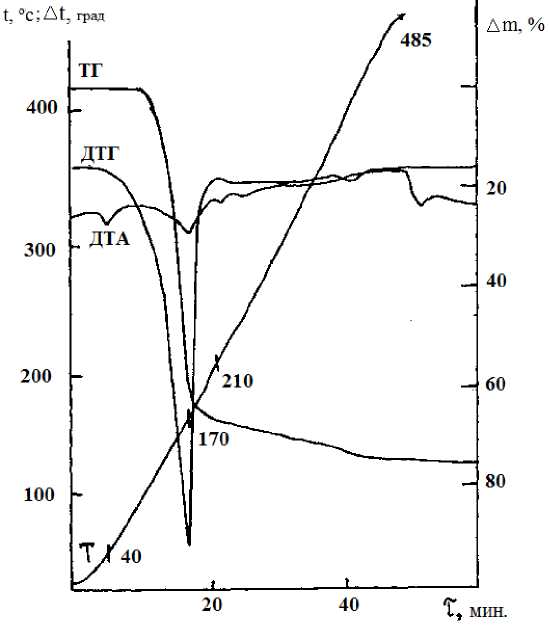
Рис.3. Дериватограмма ClCH 2 COOH•H 3 PO 4
удалением 61,3% вещества. В интервале температур 210-485 °С наблюдается сложный процесс превращения остатков продуктов распада соединения, которые не характеризуются ярко выраженными температурными эффектами. По ТГ дериватограмме потеря массы при этом составляет 7,8%.
Известно, что кристаллическая монохлоруксусная кислота находится в ассоциированном состоянии в виде димера, за счет водородной связи, о чем свидетельствует понижение полос поглощения валентных колебаний ν (СО) группы в ИК спектре кислоты от 1794 см-1 до 1735 см-1 при переходе ее из парообразного в кристаллическое состояние. Аналогичный димер образует также ортофосфорная кислота, подтверждением которого может служить появление в ИК спектре концентрированного раствора кислоты полосы поглощения в области 895 см-1, обусловленной валентным колебанием димер иона H5P2O8-.
В ИК спектре ClCH 2 COOH•H 3 PO 4 , полоса поглощения, обусловленная валентным колебанием карбоксильной и фосфатной группы, уменьшена соответственно на 15 и 10 см-1 по сравнению cо спектрами соответствующих свободных кислот. По-видимому, это обусловлено координацией молекул кислот через водородную связь между СО группой ClCH 2 COOH и ОН группой H 3 PO 4 , а также Р = О и НО группой фосфорной и монохлоруксусной кислот.
Атом хлора не участвует в специфическом взаимодействии с молекулой фосфорной кислоты, что подтверждает неизменное положение полосы поглощения С-Сl связи при 650 см-1 в ИК спектре соединения (рис. 2. б).
Таким образом в изученной системе установлено образование соединений составов CO(NH2)2•H3PO4; ClCH2COOH•H3PO4; CO(NH2)2•ClCH2COOH; CO(NH2)2•2ClCH2COOH интересных в качестве регуляторов роста и дефолиантов, выявлены их температурные и концентрационные пределы существования.
Список литературы Физико-химическое изучение системы из мочевины, фосфорной кислоты и монохлорацетата
- Абдурахманов У.К., Холбоев Ю.Х. Фазовые равновесия в водных системах из трихлорацетата и тиомочевины // Universum:химия и биология: электрон. научн. журн. 2020. № 9(75). URL: https:// 7universum.com /ru/ nature/archive/item/10683
- Кучаров Х. Физико-химические исследования и разработка малотоксичных дефолиантов хлопчатника. Автореф. дис..докт.хим.наук. - Ташкент. 1994. -49 с.
- Цукерваник И.П., Романова И.Б.//Докл.АН УзССР. 1956. № 6.
- Мельников Н.Н., Баскаков Ю.А. Химия гербицидов и регуляторов роста растений. М.: Госхимиздат, 1962. С.154-160.
- Абдурахманов У.К. Синтез дефолиантов на основе карбамида, тиокарбамида, аммиака, 2-хлорэтилфосфоновой, фосфорной, моно- и трихлоуксусных кисл.: Автореф. дис…канд. хим. наук.-Ташкент.1991.-25с.


