Физиологическая роль кальция при бобово-ризобиальном симбиозе
Автор: Васильева Г.Г., Ищенко А.А., Глянько А.К.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.7, 2011 года.
Бесплатный доступ
Обобщены данные литературы о физиологической роли кальция (Са2+) в развитии бобово-ризобиального симбиоза на начальных его этапах - инфицирования и образования симбиотических структур. Рассмотрены вопросы о функции Са2+ в растениях, особенности формирования бобово-ризобиального симбиоза и роль кальция при взаимодействии двух организмов. Проанализированы данные о взаимодействии АФК и Са2+ при развитии бобово-ризобиального симбиоза, а также связь НАДФН-оксидазной активности с кальциевой сигнальной системой. Особое внимание обращается на роль Са2+- спайков (calcium spiking) и кальций-кальмодулинзависимой киназы в инициации функционирования симбиотических путей у растения, приводящих к инфицированию и образованию симбиотических структур.
Бобово-ризобиальный симбиоз, кальций (са2+), са2+-спайки, са2+-кальмодулинзависимая киназа, nod-фактор ( nf), лизин-мотив рецепторподобная киназа (lysm rlk), лейцин-обогащенная рецепторподобная киназа (lrr rlk)
Короткий адрес: https://sciup.org/14323568
IDR: 14323568
Текст обзорной статьи Физиологическая роль кальция при бобово-ризобиальном симбиозе
Обобщены данные литературы о физиологической роли кальция (Са2+) в развитии бобово-ризобиального симбиоза на начальных его этапах – инфицирования и образования симбиотических структур. Рассмотрены вопросы о функции Са2+ в растениях, особенности формирования бобово-ризобиального симбиоза и роль кальция при взаимодействии двух организмов. Проанализированы данные о взаимодействии АФК и Са2+ при развитии бобово-ризобиального симбиоза, а также связь НАДФН-оксидазной активности с кальциевой сигнальной системой. Особое внимание обращается на роль Са2+- спайков (calcium spiking) и кальций-кальмодулинзависимой киназы в инициации функционирования симбиотических путей у растения, приводящих к инфицированию и образованию симбиотических структур.
Кальций и его физиологические функции в растениях
Содержание в тканях высших растений кальция (Са2+) связано с его специфической генетической ролью в обмене веществ. Большинство бобовых растений являются кальциефилами наряду с такими растениями как гречиха, подсолнечник, картофель, капуста, конопля. Накопление Са2+ в тканях растений в больших количествах (мМ) не совпадает с предельно низкими концентрациями (нМ) этого элемента в цитоплазме, которые требуются растению для осуществления физиологических и других жизненных функций. Вследствие этого распределение Са2+ в клетках растений крайне неравномерно: от 10-2 М (вакуоли, клеточные стенки) до 10-6 - 10-8 М (цитоплазма). В хлоропластах, митохондриях и ЭПР концентрация кальция равна 10-3 - 10-4 М (Trewavas, Malho, 1998). В корневой системе Са2+ меньше, чем в надземной части. При старении клеток или снижении их физиологической активности кальций из цитоплазмы перемещается в вакуоль и откладывается в виде нерастворимых солей щавелевой, лимонной и других кислот. Образующиеся кристаллические соединения затрудняют подвижность и возможность повторного использования этого элемента.
В настоящее время Са2+ рассматривается как вездесущий регулятор клеточных функций и изменение его уровня в клетке служит триггером для многих физиологических ответов. Ему свойственен широкий ряд физиологобиохимических функций в растениях: регуляция кислотно-химических свойств протоплазмы и прооксидантно-антиоксидатного равновесия; влияние на структуру мембран, ионные потоки и биоэлектрические явления, перестройку цитоскелета, поляризацию клеток и тканей. С действием Са2+ связывают проницаемость мембран, движение цитоплазмы, активность ферментов, секрецию, деление клеток. Он играет ведущую роль в регуляции жизненно важных процессов, связанных с развитием и дифференциацией клеток, трансдукцией гормональных сигналов, тропизмов, запрограммированной гибелью клеток и устойчивостью растений к стрессовым воздействиям (Bolwer, Fluhr, 2000; Колупаев, 2007; Медведев, 2010).
Метаболическая функция кальция как вторичного мессенджера при проведении экзогенных и эндогенных сигналов была сформулирована в начале 80-х годов прошлого столетия (Rasmussen, 1981) и его ключевая роль как универсального триггера клеточных реакций растительных и животных организмов в настоящее время не вызывает сомнений (Kaur,
Gupta, 2005; Колупаев, 2007; Медведев, 2005, 2010). Доказано, что цитозольный кальций составная часть общей сигнальной системы и эффективный регулятор процессов обмена веществ у растений.
Повышение концентрации ионов Са2+ в цитоплазме - одна из самых ранних реакций клетки на различные стрессовые воздействия. Однако это повышение носит кратковременный характер и быстро сменяется снижением его содержания в цитоплазме, что является, по-видимому, необходимым условием для функционирования сигнальных систем. Причина также в том , что сохранение длительное время высокой концентрации Са2+ в цитоплазме чревато гибелью клетки из-за развития деструктивных процессов (например, из-за связывания кальция с фосфатами и нарушения энергетических процессов клетки). Поэтому клетки организмов используют низкоамплитудные и кратковременные Са2+- сигналы.
Инициация функционирования кальциевой сигнальной системы кратковременным повышением уровня кальция в цитоплазме сменяется колебаниями в его уровне, что проявляется в виде спайков (calcium spiking): одиночных колебаний концентрации ионов кальция, осцилляций (повторяющихся спайков в виде ритмических изменений концентрации кальция в цитоплазме и органеллах) и распространяющихся по клетке Са2+ -волн. Эти процессы осуществляются за счет мембранного транспорта, активации вторичных посредников (Са2+-связывающих белков, например Са2+-АТФазы, киназ, белков-сенсоров) и др. процессов (Медведев, 2010). Особую роль в этом выполняют кальмодулин и протеинкиназы, зависимые от Са2+ и осуществляющие фосфорилирование белков – факторов регуляции транскрипции (Тарчевский, 2002).
Бобово-ризобиальный симбиоз и его формирование
Бобовые растения и клубеньковые бактерии (ризобии) формируют мутуалистический симбиоз с образованием корневых клубеньков, в которых ризобии локализуются в бактероидах и фиксируют атмосферный азот (N 2 ) за счет энергетических ресурсов растения-хозяина, давая растению взамен усвояемый минеральный азот (NH 3 ). Установление этого симбиоза требует успешного инфицирования корней бобовых ризобиями и образования симбиотических структур, что является сложно развивающимися процессами, осуществляемыми клубеньковыми бактериями и растением-хозяином под строгим контролем последнего (Gage, 2004; Jones et al., 2007; Kouchi et al., 2010; Oldroyd, Downie, 2008; Downie, 2010).
Необходимой предпосылкой для инфекции и клубенькообразования (нодуляции) бобовых растений является прикрепление ризобий к кончику (верхушке) растущей клетки корневого волоска. У адсорбированных на поверхности корня бактерий под влиянием специфических для ризобий растительных флавоноидов инициируется экспрессия Nod- генов, конечными продуктами которых являются сигнальные молекулы - липохитоолигосахариды, получившие название ризобиальных Nod - факторов (NF). Эти сигналы воспринимаются эпидермальными клетками растения, на плазмалемме которых, как установлено, локализованы рецепторы Nod-фактора(ов) - рецептор-подобные киназы (receptor-like kinases, RLK). Одна из них - белок LysM RLK, содержит внеклеточные лизиновые мотивы (LysM), другая – leucine rich repeat (LRR
RLK), богата лейциновыми повторностями (Ferguson et al., 2010). Так, у Lotus japonicum такими рецепторами типа LysM являются протеинкиназы NFP5 и NFP1, у гороха SYM10/SYM2, у люцерны – LYK3/LYK4 (Oldroyd, Downie, 2008). Примерами LRR RLK белков у Lotus japonicum являются SYMRK, у люцерны DMI2 (Popp, Ott, 2011).
Наличие двух (или более?) рецепторов в эпидермальных клетках объясняется их разной ролью в инициации включения сигнальных путей, ведущих к инфицированию растения ризобиями и образованию корневых клубеньков (Limpens et al., 2003; Madsen et al., 2003; Radutoiu et al., 2003; Arrighi et al., 2006). Так предполагают, что LRR RLK участвует в первоначальной инициации путей бактериальной инвазии (скручивание корневых волосков, образование инфекционных нитей), а LysM RLK может играть ключевую роль в дальнейшем развитии сигнального каскада, ведущего к органогенезу клубеньков в клетках коры и перицикла. Но в то же время активация LysM RLK, вероятно, необходимое условие для функционирования LRR RLK (Ferguson et al., 2010).
Следует отметить, что молекулярный скелет NF (липoхитоолигосахаридов) представляет хитоолигосахарид (N-ацетил-D-глюкозамин), который является элиситором у грибных патогенов и инициирует защитные реакции у растений. Каким образом бобовые растения отличают липохитоолигосахариды от хитоолигосахаридов окончательно не выяснено. Однако необходимо заметить, что основной скелет NF имеет модификации, различающиеся у разных видов ризобий главным образом длиной и степенью насыщенности боковых остатков жирных кислот (Gough, Cullimore, 2011). Поэтому считают, что боковые цепи NF специфически реагируют с RLK бобовых растений и этот молекулярный комплекс двух организмов осуществляет трансдукцию сигнала, блокирующего включение защитных реакций бобовых растений, и направляющего метаболизм организмов на мутуалистическое сожительство (Gough, Cullimore, 2011). Можно, по-видимому, считать, что сложная химическая структура NF определяет специфичность первичных этапов установления мутуалистических взаимоотношений между симбионтами.
Таким образом, молекулярное взаимодействие NF и RLK является необходимым условием для запуска генетических программ инфекции и нодуляции корней бобовых растений. Этим событиям предшествуют преинфекционные ответы растения-хозяина на действие NF, а именно: перестройка цитоскелета, набухание и скручивание кончика корневого волоска и формирование в наружных кортикальных клетках радиально направленных цитоплазматических мостиков, называемых преинфекционными нитями. Далее внутри деформированного корневого волоска образуется бактериальная микроколония, осуществляющая локальный гидролиз клеточной стенки корневого волоска. В этот момент корневой волосок прекращает наружный рост и начинает расти внутрь, образуя трубчатую инвагинацию клеточной стенки и мембраны - инфекционную нить (infection thread) (IT), в которой(ых) бактерии размножаются и перемещаются к клеткам кортекса.
Формирование IT скоординировано с морфогенезом клубенька в противолежащих кортикальных тканях. Участие NF-сигналинга в этих событиях доказано в опытах с мутантными организмами (Gough, Cullimore, 2011). Были охарактеризованы определённые гены, вовлечённые в NF-cигналинг, и транскрипционные факторы (например, белки NIN, RPG, ERN, CYCLOPS, CERBERUS), необходимые для инфекции и формирования примордия клубенька, а также идентифицированы гены, которые играют прямую роль в инфицировании, актиновой перестройке, синтезе ранних белков-нодулинов (ENODs), секреции и др. событиях (Ferguson et al., 2010). Доказано, что в инициации деления кортикальных клеток корня и образования примордия клубенька принимает участие цитокинин, рецептор которого – гистидинкиназа, активируется ССаМК (Ferguson et al., 2010).
Следует отметить, что ризобиальная инфекция может происходить и другим путем – через трещины на поверхности корневых клеток, когда участие Nod-сигнальной системы (как в случае инфекции через корневой волосок) может быть ограничено. Роль ризобий и Nod-сигнальной системы здесь может быть связана с модификацией гормонального ответа растения-хозяина при образовании меристемы клубенька и регуляцией изменений в генном аппарате макросимбионта (Oldroyd, Downie, 2008).
Роль кальция на начальных этапах бобово-ризобиального симбиоза
Бобовые (Leguminosae) усваивают азот атмосферы (N2) путем симбиоза с клубеньковыми бактериям из родов: Azorhizobium, Allorhizobium, Bradyrhizobium, Mezorhizobium, Rhizobium, Sinorhizobium. Этот процесс, как уже указывалось, представляет молекулярный диалог между двумя партнёрами с участием специфических бактериальных NF. Они включают определённые ответы растения-хозяина, такие как ионные изменения (К+, Cl-, Ca2+, H+), защелачивание цитоплазмы, осцилляции Са2+ и генную экспрессию, которые ведут к бактериальной инвазии и формированию клубенька (Cárdenas et al., 2000; Oldroyd and Downie, 2004). Под влиянием ризобиальной инфекции усиливается поглощение корнями гороха нитратов, что, вероятно, связано с влиянием NF-сигналов на анионные каналы (Митанова и др., 2006). В то же время известно, что как ризобии, так и нитраты, способствуют синтезу в корнях вещества Q, регулирующего процесс образования клубеньков. В случае ризобиальной инфекции этот Q-сигнал перемещается в надземную часть растения, а в случае нитратов остается в корнях. Связывание Q с растительным рецептором LRR RLK инициирует, как предполагают, cинтез соединения (фактора), оказывающего ингибирующий эффект на образование клубеньков (в случае нитратов) или осуществляющего авторегуляцию образования симбиотических структур (как в случае ризобиальной инфекции) (Ferguson et al., 2010).
NF вызывает быстрый транспорт ионов кальция в цитоплазму через плазмалемму (Shaw, Long, 2003) и деполяризацию мембраны (Cardenas et al., 2000). Этим самым кальциевая сигнальная система участвует в рецепции симбиотических сигналов на самых ранних стадиях взаимодействия симбионтов. Однако взаимодействие Nod-фактора с растительным рецептором на поверхности эпидермальных клеток корневого волоска ведет по меньшей мере к двум сигнальным путям: в один из них вовлечены Са2+-спайки, что инициирует экспрессию соответствующих генов; в другом, связанном с деформацией корневого волоска, Са2+-спайки могут не участвовать (Oldroyd, Downie, 2008).
Кроме ионов кальция сигнальную роль на ранних этапах симбиоза играют активные формы кислорода (АФК) и азота (АФА), такие как супероксидный анион-радикал (О 2 ∙- ), пероксид водорода (Н 2 О 2 ), оксид азота (NO) и др. Са2+ как вторичный мессенжер связан в растениях с АФК и АФА в сигнальном трансдукционном пути (Sama et al., 2004). Показано, что АФК активируют Са2+-каналы, которые являются сигнальным механизмом, ведущим к полярному росту корневого волоска (Foreman et al., 2003; Mori and Schroeder, 2004). Цепь событий в первые минуты после ризобиального инфицирования представляется следующим образом.
Спустя 1 мин после воздействия NF или ризобий наблюдается быстрый приток ионов кальция в цитоплазму, что наблюдается и при действии абиотических и других биотических стрессоров. В результате происходит деполяризация мембраны и отток ионов хлора и калия из цитоплазмы в клетках корневых волосков. Осцилляции в концентрации цитозольного Са2+ наблюдаются спустя минуты после индукции потока Са2+ (приблизительно через 10 мин после воздействия NF). Са2+-спайки происходят с участием белков ионных каналов (CASTOR, POLLUX) и нуклеопоринов (NUP85, NUP133), а активация Са2+-кальмодулинзависимой киназы (CCaMK) инициируется ритмическими изменениями концентрации Са2+ в цитоплазме и органеллах. Мутация по Са2+- спайкам ингибирует органогенез клубеньков у L. japonicus, который снимается предварительно активированной формой ССаМК (Нayashi et al., 2010). Подобные флуктуации в концентрации Са2+ вызывают (с участием активированной ССАМК) фосфорилирование белков – транскрипционных факторов, дальнейшую трансдукцию NF-сигнала, ведущего к экспрессии симбиотических генов в ядре.
Однако, как доказано с использованием мутанта люцерны dmi, Са2+-осцилляции не требуются для модуляции АФК или деформации корневого волоска (Catoira et al., 2000; Shaw and Long, 2003; Shaw and Long, 2003a; Esseling et al., 2004; Lohar et al., 2007). Быстрый Са2+-поток имеет место в пределах только 5 мин после обработки NF (10-8 М) (Shaw and Long, 2003), который происходит намного раньше, чем начинается модуляция АФК в корнях (через 2040 мин после обработки NF) (Shaw and Long, 2003a; Lohar et al., 2007). Таким образом, Са2+-поток не совпадает по времени с модуляцией АФК и деформацией корневого волоска при бобово-ризобиальном симбиозе. Взаимосвязь между АФК и Са2+ неоднозначна. Есть результаты опытов, в которых кальций вызывает генерацию АФК, а в других опытах АФК способствуют выходу Са2+ в цитозоль. Возможно взаимное усиление действия АФК и кальция как мессенджеров единой сигнальной системы (Медведев, 2005; Колупаев, 2007). При бобово-ризобиальном симбиозе роль этих соединений, по-видимому, сводится прежде всего к регуляции процессов метаболизма растения, обусловленное перестройкой метаболизма на уровень мутуалистического взаимодействия и блокирования защитных реакций против симбиотического партнера – ризобий. Взаимодействие АФК и Са2+ в этом случае может идти как по пути непосредственного влияния Са2+ и АФК на геном растения-хозяина (up- регуляция), так и косвенного влияния за счет последовательной активации факторов, оказывающих влияние на экспрессию генов (down-регуляция).
В перспективе важно понять основные механизмы АФК- сигналинга при раннем симбиотическом взаимодействии в дополнение к тесным связям между Са2+- сигналингом, экстраклеточной АТФ, активностью пероксидазы клеточной стенки и потенциальной перестройкой цитоскелета, включаемых временным увеличением концентрации Са2+ и образованием АФК.
Кальций и активные формы кислорода (АФК) при формировании бобово-ризобиального симбиоза
Хотя функции кальция и АФК в растительном организме изучены достаточно хорошо, остаётся много неясного относительно взаимодействия этих сигнальных молекул, особенно на начальных этапах бобово-ризобиального симбиоза (Колупаев, Карпец, 2010).
Литературные данные свидетельствуют о важной роли метаболизма АФК при формировании бобово-ризобиального симбиоза (Shaw, Long, 2003; Pauly et al., 2006). Считается, что АФК, наряду с жасмоновой кислотой, этиленом, являются отрицательными регуляторами формирования бобово-ризобиального симбиоза (Ferguson, Mathesius, 2003). Эти соединения принимают участие в защитных реакциях растения-хозяина, поскольку первоначально ризобии могут узнаваться как патогены, но затем они преодолевают защитный ответ бобового растения. Действительно, определённые защитные ответы растения индуцируются во время развития клубенька (Vasse et al., 1993; Gamas et al., 1998). Показано, что у люцерны многие IT прерывают рост даже при совместимых симбиотических взаимоотношениях вследствие развития сверхчувствительной реакции в клетках коры корня (Vasse et al., 1993). Показано, что у гороха защитный ответ как растения-хозяина более выражен при несовместимом взаимодействии, что, по-видимому, связано с ограничением распространения ризобиальной инфекции (Perotto et al., 1994). Тем не менее ризобиальная инфекция способна регулировать содержание цитотоксических соединений, как например, пероксида водорода и оксида азота в корнях. Так, по данным Митановой (2010) пик в накоплении пероксида водорода при инокуляции проростков гороха ризобиями наблюдается спустя 30 мин после инокуляции, а в последующие экспозиции (1, 2, 6, 24 и 48 ч) содержание пероксида водорода снижается в корнях и не отличается от контроля. Анализируя эти данные, следует отметить, что резкое повышение содержания Н2О2 (в 2,6 раза) через 30 мин после воздействия на корни ризобиальной инфекции, по-видимому, характеризует неспецифическую реакцию растения на патогенные и симбиотические микроорганизмы. При более длительном воздействии биотических факторов наблюдается, вероятно, специфическая реакция организма, характеризующая либо усилением синтеза АФК растением (как при действии авирулентного патогена), либо уменьшением синтеза – как в случае вирулентного патогена и симбиотических бактерий. В последнем случае растение-хозяин «узнает» микроорганизмы как «свои» и «снимает» защитные барьеры, позволяя ризобиальное инфицирование. Инфицирование корней проростков гороха клубеньковыми бактериями снижает также уровень оксида азота в корнях в 1,9 раза через 30 мин после инокуляции (Глянько и др., 2012).
Уменьшение уровня АФК и АФА под действием ризобиальной инфекции свидетельствует, по-видимому, о важной сигнальной роли ризобиальных NF и растительных RLK для узнавания партнеров и блокирования защитных механизмов растения-хозяина. Многочисленные исследования по вовлечению АФК в сигналинг растений, также подтверждают участие Са2+ в этих процессах (Jabs et al., 1997; Blume et al., 2000;. Pei et al., 2000; Baxter-Burrell et al., 2002; Foreman et al., 2003; Kwak et al., 2003).
Обнаружена ключевая роль АФК в регулировании полярного роста корневых волосков, зигот Fucus и пыльцевых трубок через их способность регулировать Са2+-каналы, которые вовлекаются в установление апикального кальциевого градиента (Potocky et al., 2007; Coelho et al., 2008). Раннее образование и распределение АФК тесно связано с АТФ и Са2+- сигналингом в корневых волосках бобовых (Cárdenas et al., 2008).
Одним из важных источников генерации АФК в растениях является НАДФН-оксидаза, локализованная на плазматической мембране клетки. Ингибирование активности этого фермента ведет не только к уменьшению генерации АФК, но и к торможению образования IT при симбиотических отношениях люцерны и Sinorhizobium meliloti (Peleg-Grossman et al., 2007; Cardenas et al., 2008). Ниже будут кратко изложены сведения о растительной НАДФН-оксидазе в связи с рассматриваемыми вопросами.
Связь НАДФН-оксидазы и АФК с кальциевой сигнальной системой
Усиление Са2+-сигнала происходит, в том числе, и за счет его взаимодействия с различными белками, которые после этого способны осуществлять ионный транспорт, регуляторные и другие функции, поддерживать низкий уровень Са2+ в органеллах клетки. Количество Са2+-содержащих белков в растениях достаточно велико: у арабидопсиса их более 150 (Reddy, 2001). Один из таких белков НАДФН-оксидаза (КФ 1.6.99.6) – стартовый фермент НАДФН-оксидазной сигнальной системы, связывающий, по крайней мере, два звена: генерацию АФК и потоки Са2+ (Sagi, Fluhr, 2006). Предполагается, что АФК и Са2+ являются основными сигнальными элементами механизма регуляции активности мембранной НАДФН-оксидазы у растений. Растительная НАДФН-оксидаза обозначается как Rboh (respiratory burst oxidase homologs) и является гомологом β-субъединицы (gp91phox) НАДФН-оксидазы фагоцитов. Rboh имеет N-концевой участок, который связывает ионы Са2+ с помощью двух мотивов (EF-рука). Предполагается, что цитозольные потоки кальция активируют Са2+-зависимые протеинкиназы (CDPK), которые фосфорилируют N-терминальный участок Rboh и тем самым активируют фермент (Kobayashi et al., 2006). Все это дает возможность говорить о регулирующей роли Са2+ в активности НАДФН-оксидазы растений (Глянько, Ищенко, 2010). НАДФН-оксидаза, локализованная на плазмалемме, активируется при действии на организмы абиотических и биотических факторов (Глянько и др., 2010а). Образовавшие в результате активации этого фермента АФК защищают растение от патогенов путем участия в реакции сверхчувствительности клеток, системной приобретенной и индуцируемой устойчивости, в укреплении клеточной стенки как механического барьера на пути инфекции
(Sagi, Fluhr, 2001). В отличие от патогенного воздействия на растительный организм, роль НАДФН–оксидазы и связанного с ее функциональной активностью кальция в мутуалистических взаимодействиях до конца не ясна.
Одним из таких вопросов является познание регуляторных механизмов НАДФН-оксидазы растений. Как установлено, важнейшим элементом регуляции активности этого фермента является кальций (Sagi, Fluhr, 2006). Этим растительная НАДФН-оксидаза отличается от животной, поскольку содержит Са2+-связывающие мотивы (EF-рука). Это обеспечивает непосредственное стимулирование активности фермента с помощью ионов кальция, выход которых из внеклеточного пространства в цитоплазму инициируется экзо- и эндогенными факторами. По нашим данным активность НАДФН-оксидазы в микросомальной фракции корней этиолированных проростков гороха резко возрастала (в 3 – 4 раза) спустя 5-10 мин после инокуляции корней разными штаммами Rhizobium leguminosarum и не отличалась от контроля через 15-30 мин. Это совпадает с максимальным увеличением содержания Н 2 О 2 в корнях гороха через 30 мин после инокуляции проростков ризобиями. Таким образом, эти результаты свидетельствуют о влиянии как эндогенного кальция на функциональную активность НАДФН-оксидазы, что подтверждает участие Са2+ в регуляции уровня АФК в клетке.
Следует отметить, что возможный цитозольный компонент растительной НАДФН-оксидазы (Rboh) – Rop ГТФаза, связывается с основным компонентом фермента после активации Са2+- зависимой киназы (ССаМК), обеспечивающей фосфорилирование N- терминального участка Rboh и активирование фермента, что ведет к усилению образования АФК. По мнению Wong et al. (2007) увеличение генерации АФК вызывает вторую фазу накопления кальция в цитоплазме, стимулируя открытие Са2+-каналов на плазматической мембране. Накопление Са2+ в цитоплазме может быть причиной ингибирования взаимодействия комплекса Rop ГТФазы – Rboh и вследствие этого снижения активности НАДФН-оксидазы. Таким образом, эти результаты позволяют предполагать, что концентрация цитозольного Са2+ может модулировать активность НАДФН-оксидазы, регулируя взаимодействие между Rop ГТФ-азой и Rboh. Уровень кальция в цитоплазме, зависящий от АФК, может служить частью механизма, регулирующего взаимодействие мембранной (Rboh) и цитозольной субъединицы (Rop ГТФазы), что оказывает влияние на активность НАДФН-оксидазы – генератора АФК.
По мнению других авторов (Sagi, Fluhr, 2001) стимулирование активности НАДФН-оксидазы растений может осуществляться непосредственно ионами кальция, без участия цитозольного компонента – Rop ГТФазы. Указанные авторы предполагают, что регуляция активности фермента происходит по принципу «самоусиливающей петли», в которую вовлечены Са2+и АФК.
Представляет интерес возможность участия в регуляции активности НАДФН-оксидазы свободного радикала NO. Эта молекула играет важную роль в ключевых физиологических процессах как в животных, так и растительных организмов (Glyan’ko et al., 2010). Заслуживает внимания гипотеза о возможном влиянии NO на потоки вне- и внутриклеточного Са2+, который, как уже обсуждалось, оказывает влияние на активность НАДФН-оксидазы (Courtois et al., 2008). Суть гипотезы в том, что NO может повышать или тормозить индуцированный действием экзогенных факторов поток Са2+ в цитоплазму путем изменения проницаемости Са2+-каналов с участием сигнальных белков, подвергшихся посттрансляционной модификации оксидом азота (нитрозилирование и нитрование белков) (Besson-Bard et al., 2008). Этот механизм регуляции потоков Са2+ на плазмалемме и мембранах внутриклеточных органелл с участием NO (Courtois et al., 2008) также может быть применен для объяснения функциональной активности НАДФН-оксидазы при бобово-ризобиальном симбиозе, когда чрезмерное накопление АФК будет препятствовать установлению мутуалистических взаимоотношений (Shaw, Long, 2003а). Последнее может быть снято антиоксидантными ферментами, в активации которых, по-видимому, также участвует кальций, поскольку АФК-генерирующие ферменты ингибируются антагонистами кальция (Grant et al., 2000).
Таким образом, на ранних стадиях симбиотического взаимодействия АФК и кальций играют ключевые роли, усиливая или подавляя взаимовлияние на процессы. Действительно, уровни АФК и кальция увеличиваются после обработки корневых волосков NF (Cárdenas et al., 1999;2008; Shaw and Long, 2003a). В свою очередь АФК могут активировать кальциевые каналы (Foreman et al., 2003; Mori and Schroeder, 2004).
Усиленный вход кальция в цитоплазму, наблюдаемый после воздействия NF может вовлекаться во временное увеличение АФК (Cárdenas et al., 2008). Предполагается, что ЕF-рука и кальмодулин-связывающие домены у растительных НАДФН-оксидаз хорошо подходят для этого типа регуляции (Banfi et al., 2004; Tirone, Cox, 2007). В связи с этим было показано, что некоторые кальмодулины по-разному экспрессируются в ответ на NF (Camas et al., 2002).
ЗАКЛЮЧЕНИЕ
Уникальность Са2+-сигнальной системы по сравнению с другими заключается, во-первых, в его особых химических свойствах (большое число координационных связей и их различная длина), во-вторых, наличием специализированной системы мембранных переносчиков, обеспечивающей эффективную регуляцию концентрации этого элемента в клеточных органеллах и компартментах (Медведев, 2010). Способность Са2+ передавать сигнал с помощью спайков и волн, а также специфических белков-сенсоров в гидрофильной и гидрофобных средах дает возможность растительному организму использовать с большой эффективностью Са2+-сигнальную систему при различных стрессовых воздействиях для быстрой перестройки процессов метаболизма, обеспечивающих выживание растений в новых условиях.
Вездесущность Са2+-сигнальной системы проявляется в сильной степени при действии на растительный организм биотических факторов. Роль ее в бобово-ризобиальном симбиозе, представляющем мутуалистическое сожительство двух организмов, интенсивно изучается в последние годы (Oldroyd, Downie, 2006, 2008; Шишова и др., 2008; Ferguson et al., 2010; Capoen et al., 2011). Активирование и реализация генетически обусловленных процессов мутуалистического взаимодействия двух организмов, приводящих к образованию и функционированию симбиотических структур (симбиосом, бактероидов, корневых клубеньков) осуществляется с участием многих механизмов. И одним из них является кальциевая сигнальная система. Действительно, самая ранняя реакция растения-хозяина на действие Nod-фактора – это изменение концентрации Са2+ в цитоплазме, совпадающая с осцилляциями кальция в ядре и околоядерном пространстве (Ehrhard et al., 1996). При этом образование Са2+-спайков предшествует активации под их влиянием ССаМК (Gough, Cullimore, 2011). Активированные Са2+-каналы на мембране цитоплазмы и клеточных органелл - необходимое условие для образования и функционирования кальциевых осцилляций, осуществляемых с участием Са-АТФазы (Oldroyd, Downie, 2006).
На представленной схеме (см. рис. 1), мы попытались, не претендуя на полноту, схематически отобразить имеющиеся в литературе представления о роли кальция в бобово-ризобиальном симбиозе на стадиях инфицирования растения и образования симбиотических структур. Из схемы следует, что центральную роль в процессах ризобиальной инфекции и клубенькообразования играют Са2+-спайки, которые способны передавать генетическую информацию с момента связывания бактериального Nod-фактора с растительным рецептором(ами) (LysM RLK, LRR RLK), что ведет к активации ответов растения-хозяина на инфекцию. Один из самых ранних ответов при этом являются осцилляции Са2+ в цитозоле. Этому предшествует открытие кальциевых каналов в мембране эпидермальных клеток и сброс Са2+ из внеклеточного пространства в цитоплазму. Происходящие при этом Са2+-осцилляции вызывают активирование
Обмен сигнальными молекулами
Растение
Nod-фактор флавоноиды
Rhizobia
- формирование инфекционной нити, ее рост к основанию корневого волоска, деление бактерий
- высвобождение бактерий в цитоплазму растительной клетки
- деполяризация плазмолеммы, искривление корневых волосков
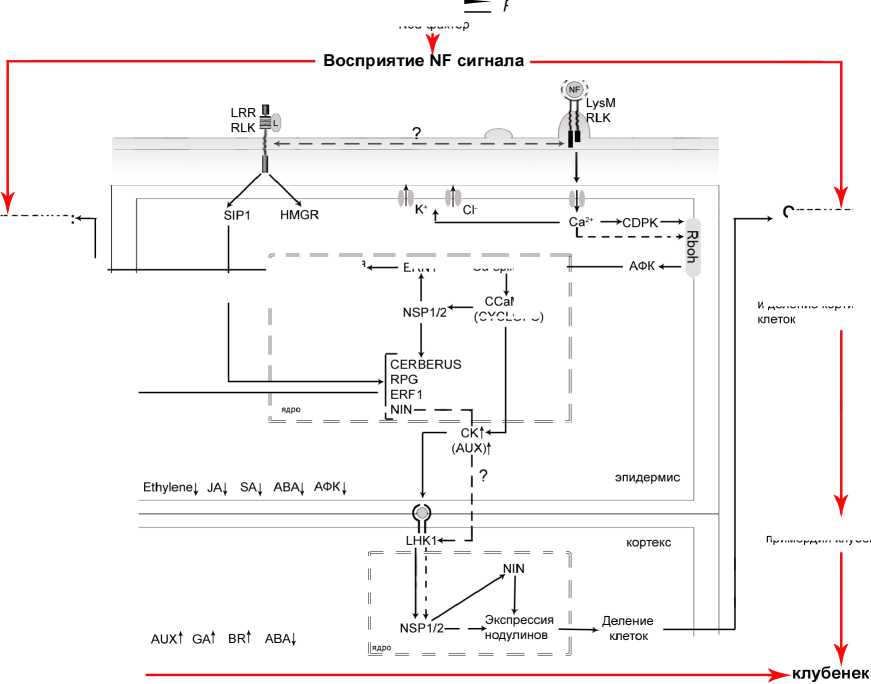
(CYCLOPS)
- образование бактероидов
Рисунок 1 Схема симбиотических сигнальных путей у макросимбионта и его взаимодействие с
Инфицирование:
Органогенез клубенька:

Экспрессия
II нодули нов
ERN1 Ca-spiking-
- деференцирование и деление кортикальных
- формирование примордия клубенька
ризобиальным Nod-фактором с участием кальциевого сигнального каскада.
LysM RLK – лизин-мотив рецепторподобная киназа; LRR RLK – лейцин-обогащенная рецепторподобная киназа; CDPK–кальцийзависимая протеинкиназа; CCaMK– кальций-кальмодулинзависимая киназа; SIP1 – белок взаимодействующий с SymRK; HMGR – 3-гидрокси 3-метилглутарил CoA редуктаза; NSP1/2, NIN – белки сигнального пути нодуляции; LHK–гистидинкиназа; ENOD – ранние белки-нодулины; Rboh- НАДФН-оксидаза; СК – цитокинин. Факторы транскрипции: ERN, RPG, ERF1, CERBERUS, CYСLOPS.
ССаМК и модуляцию фитогормонального баланса, ведущего к образованию примордия клубенька. Возникновение кальциевых осцилляций связывают с гиперполяризацией мембран и внутриклеточных органелл, что приводит к открытию на их мембранах Са2+-каналов и активации Са-АТФаз, закачивающих и выкачивающих кальций по и против градиента его концентрации (Capoen et al., 2011). Однако, хотя кальций и кальмодулинзависимая киназа являются ключевыми медиаторами симбиотического взаимодействия, декодирование Са2+-сигнала и молекулярные потоки, определяющие поток информации к геному, остаются предметом интенсивных исследований (Yano et al., 2008). Так предполагают, что под воздействием NF на мембране плазмалеммы возникает каскад реакций, связанных с активацией фосфолипаз С и D, продукт которых (вторичный мессенджер) может через ядерную пору вызывать осцилляции кальция в ядре и околоядерном пространстве, вызывающих (при участии кальций и кальмодулинзависимых киназ) экспрессию генов белков-нодулинов (Oldroyd, Downie, 2008). C другой стороны, информация, закодированная в Са2+-спайках, определяется, вероятно, как частотой, так и амплитудой колебаний концентрации кальция. И эти параметры будут различаться при действии различных по природе внешних факторов.
Внутриклеточными запасниками (накопителями) Са2+ могут быть оболочка ядра и эндоплазматический ретикулум (ЭПР), в которых обнаружены Са2+-спайки, ССаМК и два возможных регулятора транскрипции - NSP1и NSP2 (Oldroyd, Downie, 2006). Одна из функций органелл-запасников может заключаться в регулировании концентрации кальция в цитоплазме с участием Са-АТФазы.
Важнейшей проблемой, связанной с участием Са2+ в бобово-ризобиальном симбиозе, является его взаимодействие с другими сигнальными молекулами – АФК и АФА, в нормальных физиологических условиях и особенно при действии неблагоприятных биотических и абиотических факторов. Выше обсуждалась необходимость ионов кальция для функционирования НАДФН-оксидазы – генератора АФК. Есть данные о потребности Са2+ для функционирования растительного фермента(ов) генерирующего(их) NO c использованием в качестве субстрата L-аргинина (Courtois et al., 2008). Но с другой стороны, по нашим данным (Глянько и др., 2012) ризобиальная инфекция способна снижать уровень NO и H2O2 в тканях корней проростков гороха. Участие Са2+ в этих обоих процессах очевидна, но каков механизм влияния бобово- ризобиального симбиоза на функции кальция и каким образом кальциевый сигнал реализуется при симбиотическом взаимодействии, предстоит еще выяснить.
Список литературы Физиологическая роль кальция при бобово-ризобиальном симбиозе
- Глянько, А.К., Васильева, Г.Г., Ищенко, А.А. и др. (2010). Активность НАДФН-оксидазы в корнях проростков гороха при ризобиальной инфекции в зависимости от действия абиотических и биотических факторов. Прикладная биохимия и микробиология, 46: 479-485.
- Глянько, А.К., Ищенко, А.А. (2010а). Структурные и функциональные особенности НАДФН-оксидазы растений. Прикладная биохимия и микробиология, 46: 509-518.
- Глянько, А.К., Митанова, Н.Б., Степанов, А.В. (2012). Влияние факторов среды на генерацию оксида азота (NO) в корнях этиолированных проростков гороха. Прикладная биохимия и микробиология, 48: 95-102 (в печати).
- Колупаев, Ю.Е. (2007). Кальций и стрессовые реакции растений. Вестник Харьковского нац. аграрного ун-та. Серия Биология, вып.1 (10): 24-41.
- Колупаев, Ю.Е., Карпец, Ю. В. (2010). Формирование адаптивных реакций растений на действие абиотических стрессоров. Киев: «Основа», 352 с.
- Медведев, С.С. (2005). Кальциевая сигнальная система растений. Физиология растений, 52: 283-305.
- Медведев, С.С. (2010). Кальциевая сигнальная система растительной клетки. В кн.: Клеточная сигнализация (ред. А.Н. Гречкин). Казань: Изд-во ФЭН, с. 26-36.
- Митанова, Н.Б., Миронова, Н.В., Глянько, А.К. (2006). Поглощение нитратов проростками гороха в зависимости от дозы азота и инокуляции клубеньковыми бактериями. Агрохимия, № 1: 32-33.
- Митанова, Н.Б. (2010). Влияние минерального азота на начальные этапы формирования бобово-ризобиального симбиоза. Автореф. дис. … канд. биол. наук. Иркутск: СИФИБР СО РАН, 19 c.
- Тарчевский, И.А. (2002). Сигнальные системы клеток растений. М.: Наука, 294 с.
- Шишова, М.Ф., Танкелюн, О.В., Емельянов, В.В., Полевой, В.В. (2008). Рецепция и трансдукция сигналов у растений. СПб: Изд-во С.-Петерб. ун-та, с. 43-51.
- Arrighi, J.F., Barre, A., Ben Amor, B. et al. (2006). The Medicago truncatula lysine motif-receptor-like kinase gene family includes NFP and new nodule-expressed genes. Plant Physiol., 142: 265-279.
- Banfi, B., Tirone, F., Durussel, I. et al. (2004). Mechanism of Ca2+ activation of the NADPH oxidase 5 (NOX5). J. Biol. Chem., 279: 18583-18591.
- Baxter-Burrell, A., Yang, Z., Springer, P.S., Bailey-Serres, J. (2002). Rop GAP4-dependent Rop GTPase rheostat control of Arabidopsis oxygen deprivation tolerance. Science, 296: 2026-2028.
- Besson-Bard, A., Pugin, A., Wendehenne, D. (2008). New insights into nitric oxide signaling in plants. Annu. Rev. Plant Biol., 59: 21-39.
- Blume, B., Nurnberger, T., Nass, N., Scheel, D. (2000). Receptor-mediated increase in cytoplasmic free calcium required for activation of pathogen defense in parsley. Plant Cell, 12: 1425-1440.
- Bolwer, C., Fluhr, R. (2000). The role calcium and activated oxygens as signals for controlling cross-tolerance. Trends Plant Sci., 5: 241-246.
- Camas, A., Cardenas, L., Quinto, C. et al. (2002). Expression of different calmodulin genes in bean (Phaseolus vulgaris L.): role of Nod factor on calmodulin gene regulation. Mol. Plant-Microbe Interac.,15: 428-436.
- Capoen, W., Sun, J., Wysham, D. et al. (2011). Nuclear membranes control symbiotic calcium signaling of legumes. Proc. Natl. Acad. Sci. USA, 108: 14348-14353.
- Cardenas, L., Feijo, J.A., Kunkel, J.G. et al. (1999). Rhizobium root factors induce increases in intracellular free calcium and entracellular calcium influxes in bean root hairs. Plant J., 19: 347-352
- Cardenas, L., Holdaway-Clarke, T.L., Sanchez, F. et al. (2000). Ion changes in legume root hairs responding to Nod factors. Plant Physiol., 123: 443-452.
- Cardenas, L., Martinez, A., Sanchez, F. et al. (2008). Fast, transient and specific intracellular ROS changes in living root hair cells responding to Nod factors (NF). Plant J., 56: 802-813.
- Catoira, R., Galera, C., de Billy, F. et al. (2000). Four genes of Medicago truncatula controlling components of a Nod factor transduction pathway. Plant Cell, 12: 1647-1666.
- Coelho, S.M., Brownlee, C., Bothwell, J.H. (2008). A tip-high, Ca2+-interdependent, reactive oxygen species gradient is associated with polarized growth in Fucus serratus zygotes. Planta, 227: 1037-1046.
- Courtois, C., Besson, A., Dahan, J. et al. (2008). Nitric oxide signaling in plants: interplays with Ca2+ and protein kinases. J. Exp. Bot., 59: 155-163.
- Downie, J.A. (2010). The roles of extracellular proteins, polysaccharides and signals in the interactions of rhizobia with legume roots. FEMS Microbiol. Rev., 34: 150-170.
- Ehrhardt, D. W., Wais, R., Long, S.R. (1996). Calcium spiking in plant root hairs responding to Rhizobium nodulation signals. Cell, 85: 673-681.
- Esseling, J.J., Lhuissier, F.G.P., Emons, A.M.C. (2004). Nonsymbiotic root hair tip growth phenotype in NORK-mutated legumes: implications for nodulation factor-induced signaling and formation of a multifaceted root hair pocket for bacteria. Plant Cell, 16: 933-944.
- Ferguson, B.J., Mathesius, U. (2003). Signaling interactions during nodule development. J. Plant Growth Regul., 22: 47-72.
- Ferguson, B.J., Indrasumunar, A., Hayashi, S. et al. (2010). Molecular analysis of legume nodule development and autoregulation. J. Integr. Plant Biol., 52: 61-76.
- Foreman, J., Demidchik, V., Bothwell, J.H. et al. (2003). Reactive oxygen species produced by NADPH oxidase regulate plant cell growth. Nature, 422: 442-446.
- Gage, D.J. (2004). Infection and invasion of roots by symbiotic, nitrogen-fixing rhizobia during nodulation of temperate legumes. Microbiol. Mol. Biol. Rev., 68: 280-300.
- Gamas, P., de Billy F., Truchet, G. (1998). Symbiosis-specific expression of two Medicago truncatula nodulin genes, MtN1 and Mt13, incoding products gomologous to plant defense proteins. Mol. Plant-Microbe Interac., 11: 393-403.
- Glyan'ko, A.K., Mitanova, N.B., Stepanov, A. V. (2010). The physiological role of nitric oxide (NO) in plants. Вестник Харьковского нац. аграрного ун-та. Серия Биология, вып. 1(19): 6-20.
- Gough, C., Cullimore, J. (2011). Lipo-chitooligosaccharide signaling in endosymbiotic plant-microbe interactions. Mol. Plant-Microbe Interac., 24: 867-878.
- Grant, M., Brown, I., Adams, S. et al. (2000). The RPMI plant disease resistance gene facilitates a rapid and sustained increase in cytosolic calcium that is necessary for the oxidative burst and hypersensitive cell death. Plant J., 23: 441-450.
- Hayashi, T., Banda, M., Shimoda, Y. et al. (2010). A dominant function of CCaMK in intracellular accommodation of bacterial and fungal endosymbionts. Plant J., 63: 141-154.
- Jabs, T., Tschope, M., Colling, C. et al. (1997). Elicitor-stimulated ion fluxes and O2-from oxidative burst are essential components in triggering defense gene activation and phytoalexin synthesis in parsley. Proc. Natl. Acad. Sci. USA, 94: 4800-4805.
- Jones, K.M., Kobayashi, H., Davies, B.W. et al. (2007). How rhizobial symbionts invade plants: the Sinorhizobium-Medicago model. Nat. Rev. Microbiol., 5: 619-633.
- Kaur, N., Gupta, A.K. (2005). Signal transduction pathways under abiotic stresses in plants Curr. Sci., 88: 1771-1780.
- Kouchi, H., Imaizumi-Anraku, H., Hayashi, M. et al. (2010). How many peas in a pod? Legume genes responsible for mutualistic symbioses underground. Plant Cell Physiol., 51: 1381-1397.
- Kobayashi, M., Kawakita, K., Maeshima, M. et al. (2006). Subcellular localization of Strbon proteins and NADPH-dependent O2-generating activity in potato tuber tissues. J. Exp. Bot., 57: 1373-1379.
- Kwak, J.M., Mori, I.C., Pei, Z.M. et al. (2003). NADPH oxidase AtrbohD and AtrbohF genes function in ROS-dependent ABA signaling in Arabidopsis. EMBO J., 22: 2623-2633.
- Limpens, E., Franken, C., Smit, P. et al. (2003). LysM domain receptor kinases regulating rhizobial Nod factor-induced infection. Science, 302: 630-633.
- Lohar, D.P., Haridas, S., Gantt, J.S. et al. (2007). A transient decrease in reactive oxygen species in roots leads to root hair deformation in the legume-rhizobia symbiosis. New Phytol., 173: 39-54.
- Madsen, E.B., Madsen, L.H., Radutoiu, S. et al. (2003). A receptor kinase gene of the LysM type is involved in legume perception of rhizobial signals. Nature, 425: 637-640.
- Mori, I.C., Schroeder, J.S. (2004). Reactive oxygen species activation of plant Ca2+ channels. A signaling mechanism in polar growth, hormone transduction, stress signaling, and hypothetically mechanotransduction. Plant Physiol., 135: 702-708.
- Oldroyd, G.E.D., Downie, J.A. (2004). Calcium, kinases and nodulation signalling in legumes. Nat. Rev. Mol. Cell Biol., 5: 566-576.
- Oldroyd, G.E.D., Downie, J.A. (2006). Nuclear calcium changes at the core of symbiosis signaling. Curr. Opin. Plant Biol., 9: 351-357.
- Oldroyd, G.E.D., Downie, J.A. (2008). Coordinating nodule morphogenesis with rizobial infection in legumes. Annu. Rev. Plant Biol., 59: 519-546.
- Pauly, N., Pucciariello, C., Mandon, K. et al. (2006). Reactive oxygen and nitrogen species and glutathione: key players in the legume-Rhizobium symbiosis. J. Exp. Bot., 57: 1769-1776.
- Pei, Z.M., Murata, Y., Benning, G. et al. (2000). Calcium channels activated by hydrogen peroxide mediate abscisic acid signalling in guard cells. Nature, 406: 731-734.
- Peleg-Grossman, S., Volpin, H., Levine, A. (2007). Root hair curling and Rhizobium infection in Medicago tranculata are mediated by phosphatidylinositine -regulated endocytosis and reactive oxygen species. J. Exp. Bot., 58: 1637-1649.
- Perotto, S., Brewin, N.J., Kannenberg, E.L. (1994). Cytological evidence for a host defense response that cell and tissue invasion in pea nodules by lypopolysaccharide-defective mutants of Rhizobium leguminosarum strain 3841. Mol. Plant-Microbe Interac., 7: 99-112.
- Popp, C., Ott, T. (2011). Regulation of signal transduction and bacterial infection during root nodule symbiosis. Curr. Opin. Plant Biol., 14: 458-467.
- Potocky, M., Jones, M.A., Bezvoda, R. et al. (2007). Reactive oxygen species produced by NADPH oxidase are involved in pollen tube growth. New Phytol., 174: 742-751.
- Rasmussen, H. (1981). Calcium and cAMP as a synarchic messengers. N.Y.: Wiley. 370 p.
- Radutoiu, S., Madsen, L.H., Madsen, E.B. et al. (2003). Plant recognition of symbiotic bacteria requires two LysM receptor-like kinases. Nature, 425: 585-592.
- Reddy, A.S.N. (2001). Calcium: Siler bullet in signaling. Plant Sci., 160: 381-404.
- Sagi, M., Fluhr, R. (2001). Superoxide production by plant homologues of the gp91 (phox) NADPH oxidase. Modulation of activity by calcium and by tobacco mosaic virus infection. Plant Physiol., 126: 1281-1290.
- Sagi, M., Fluhr, R. (2006). Production of reactive oxygen species by plant NADPH oxidases. Plant Physiol., 141: 336-340.
- Sama, J., Baluska, F., Menzel, D. (2004). New signalling molecules regulating root hair tip growth. Trends Plant Sci., 9: 217-220.
- Shaw, S.L., Long, S.R. (2003). Nod factor elicits two separable calcium responses in Medicago truncatula root hair cells. Plant Physiol., 131: 976-984.
- Shaw, S.L., Long, S.R. (2003a). Nod factor inhibition of reactive oxygen efflux in host legume. Plant Physiol., 132: 2196-2204.
- Tirone, F., Cox, J.A. (2007). NADPH oxidase 5 (NOX5) interacts with and is regulated by calmodulin. FEBS Lett., 581: 1202-1208.
- Trewavas, A.J., Malho, R. (1998). Signalling in plant cells: the big network. Curr. Opin. Plant Biol., 1: 428-433.
- Vasse, J., de Billy F. and Truchet J. (1993). Abortion of infection during the Rhizobium meliloti -alfalfa symbiotic interaction is accompanied by a hypersensitive reaction. Plant J., 4: 555-566.
- Wong, H.L., Pinontoan, R., Hayashi, K. et al. (2007). Regulation of rice NADPH oxidase by binding of Rac GTPase to its N-terminal extension. Plant Cell, 19: 4022-4034.
- Yano, K., Yoshida, S., Muller, J. et al. (2008). CYCLOPS, a mediator of symbiotic intracellular accommodation. Proc. Natl. Acad. Sci. USA, 105: 20540-20545.


