Физиологические аспекты деструкции синтетических и природных полимеров коллекционными и аборигенными штаммами микромицетов
Автор: Горбань Мария Викторовна, Ямпольская Татьяна Даниловна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические ресурсы: флора
Статья в выпуске: 1-9 т.14, 2012 года.
Бесплатный доступ
В статье рассматривается возможность использования синтетических и природных полимеров в качестве источников углеродного питания для коллекционных и аборигенных штаммов микроскопических грибов. Даётся сравнительная характеристика биоповреждающей активности данных групп микромицетов в отношении синтетических полимеров и рассматриваются физиологические особенности процесса биодеструкции.
Микроскопические грибы, полимеры, биоповреждения
Короткий адрес: https://sciup.org/148201034
IDR: 148201034 | УДК: 678.5/.7.019.38:582.282.12
Текст научной статьи Физиологические аспекты деструкции синтетических и природных полимеров коллекционными и аборигенными штаммами микромицетов
При современном развитии научно-технического прогресса синтетические материалы во всех областях деятельности человека занимают прочные позиции. В системах холодного и горячего водоснабжения, отопительных системах и в системе бытовой канализации наблюдается тенденция применения труб из полимерных материалов (пластмасс). Полимерные трубы вытесняют металлические, так как дешевле, легче, что важно при транспортировке, не подвергаются электрохимической коррозии. Но синтетические материалы способны подвергаться биокоррозии, повреждаются мик-роорганизмами и, в первую очередь, микроскопическими грибами. Испытание полимерных материалов на стойкость к биологическому повреждению микроскопическими грибами (грибостойкость) регламентировано ГОСТами, в которых для испытаний рекомендуются коллекционные культуры микроскопических грибов. Стандартизация проводимых испытаний, с одной стороны, «уравнивает» испытуемые материалы, а с другой, не учитывает особенности дальнейшей их эксплуатации. В частности, не учитываются природно-климатические условия и адаптационные возможности аборигенных биологических агентов.
Одна из задач данной работы – сравнение биоповреждающей активности коллекционных культур и местных изолятов микроскопических грибов в отношении синтетических полимеров. Объектами исследований стали 8 коллекционных и 16 аборигенных штаммов микроскопических грибов, выделенных из различных источников (почва, техническая вода, изоляционные материалы). Коллекционные культуры микроскопических грибов предоставлены Институтом биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН. В качестве материалов взяты образцы полиэтиленовых и полипропиленовых труб, применяемых в системах водоснабжения и канализации. Полиэтилен представлен двумя разновидностями:
полиэтиленом высокой плотности HDPE германской фирмы Geberit и сшитым полиэтиленом РЕ-Хс во внешнем и внутреннем слоях металлопластиковой трубы бельгийской фирмы Henco; полипропилен – тремя: гомополипропиленом PP германской фирмы Rehau, полипропиленом рандом-сополимером PP-RC швейцарской фирмы Pipe Life и полипропиленом рандом-сополимером термостойким PP-RCТ турецкой фирмы Pilsa.
Исследования по определению грибостойко-сти проводились согласно ГОСТу 9.048-89 «Оценка грибостойкости полимерных материалов» [2] по трём методам: № 1, 2 и 4. Сущность метода №1 в том, что, очищенные от загрязнений, стерильные образцы заражают водной суспензией спор грибов; по методу №2 образцы материала без очистки от внешних загрязнений (нестерильные) заражают водной суспензией спор грибов; сущность метода №4 в том, что стерильные образцы заражают суспензией грибов в питательной среде.
Таким образом, методы №1 и №2 позволяют установить возможность использования микро-мицетами испытуемого синтетического углеродсодержащего материала в качестве единственного источника углерода, а метод №4 предусматривает наряду с испытуемым углеродсодержащим синтетическим полимерным субстратом наличие дополнительного источника углеродного питания – сахарозы питательной среды Чапека-Докса. Во всех случаях материал, зараженный суспензией спор грибов, выдерживали в оптимальных для развития микромицетов условиях в течение 28 суток. По истечении времени испытаний оценивалась грибостойкость образцов по 6-балльной шкале, приведённой в ГОСТе [2]. При оценке грибостойкости учитывалась площадь биообрастания и степень развития микромицетов на образцах. Результаты испытания материалов на грибостойкость представлены в таблице 1.
Таблица 1. Определение грибостойкости синтетических полимерных материалов по отношению к коллекционным и аборигенным штаммам микромицетов
|
№ п/п |
Видовое название |
Материал |
||||
|
HDPE |
РЕ-Хс /Al/ РЕ-Хс |
PP |
PP-RС |
PP-RCТ |
||
|
методы |
||||||
|
№1/2/4 |
№1/2/4 |
№1/2/4 |
№1/2/4 |
№1/2/ 4 |
||
|
коллекционные штаммы |
||||||
|
1 |
Aspergillus niger |
0/0/0 |
0/1/0 |
0/0/0 |
0/0/0 |
1/1/0 |
|
2 |
Aspergillus terreus |
0/0/0 |
0/1/0 |
0/0/0 |
0/0/0 |
1/1/1 |
|
3 |
Aureobasidium pullulans var. pullulans |
0/0/0 |
1/1/1 |
0/0/0 |
0/0/0 |
1/1/1 |
|
4 |
Paecilomyces variotii |
0/0/0 |
0/1/0 |
0/0/0 |
0/0/0 |
1/1/1 |
|
5 |
Penicillium funiculosum |
0/0/0 |
1/1/1 |
0/0/0 |
0/0/0 |
1/1/0 |
|
6 |
Penicillium ochrochloron |
0/0/0 |
1/1/0 |
0/0/0 |
0/0/0 |
1/1/1 |
|
7 |
Scopulariopsis brevicaulis |
0/0/0 |
1/1/1 |
0/0/0 |
0/0/0 |
1/1/1 |
|
8 |
Trichoderma virens |
0/0/0 |
0/1/0 |
0/0/0 |
0/0/0 |
1/1/0 |
|
средние баллы |
0/0/0 |
0,5/1/0,4 |
0/0/0 |
0/0/0 |
1/1/0,6 |
|
|
общий средний балл |
0 |
0,6 |
0 |
0 |
0,9 |
|
|
процентное соотношение грибов-биодеструкторов |
0/0/0 |
50/100/18,7 |
0/0/0 |
0/0/0 |
100/100/62,5 |
|
|
аборигенные штаммы |
||||||
|
1 |
Aspergillus flavus 1 |
0/0/0 |
0/1/0 |
0/0/0 |
1/0/1 |
2/1/2 |
|
2 |
Aspergillus flavus 2 |
0/0/0 |
1/0/1 |
0/1/0 |
1/1/1 |
1/1/1 |
|
3 |
Aspergillus fumigatus |
0/0/2 |
0/1/1 |
0/0/0 |
0/1/0 |
1/1/1 |
|
4 |
Aspergillus versicolor 1 |
0/0/0 |
0/0/1 |
0/0/0 |
0/0/0 |
0/0/1 |
|
5 |
Aspergillus versicolor 2 |
0/0/0 |
0/1/0 |
1/1/0 |
1/1/1 |
1/1/1 |
|
6 |
Cladosporium linicola |
0/0/3 |
2/1/2 |
0/0/3 |
1/1/3 |
2/0/3 |
|
7 |
Cladosporium transchelii |
0/0/3 |
2/1/2 |
0/1/1 |
1/1/1 |
2/1/2 |
|
8 |
Penicillium citrinum 1 |
0/0/0 |
1/1/1 |
0/1/0 |
0/0/0 |
1/1/1 |
|
9 |
Penicillium citrinum 2 |
0/0/0 |
0/0/1 |
0/0/0 |
0/0/0 |
1/1/1 |
|
10 |
Penicillium funiculosum |
0/0/0 |
0/0/0 |
0/0/1 |
0/0/1 |
0/1/1 |
|
11 |
Penicillium fuscum |
0/0/0 |
1/1/1 |
0/0/0 |
0/1/1 |
1/1/1 |
|
12 |
Penicillium nigricans |
0/0/0 |
0/1/0 |
0/0/0 |
0/0/0 |
1/1/0 |
|
13 |
Penicillium notatum |
0/0/0 |
1/1/0 |
0/1/0 |
0/1/1 |
1/1/2 |
|
14 |
Penicillium raciborskii |
0/0/0 |
1/1/0 |
1/1/0 |
1/0/1 |
1/1/1 |
|
15 |
Penicillium rugulosum |
0/0/0 |
0/1/0 |
0/0/0 |
0/0/1 |
1/1/2 |
|
16 |
Scopulariopsis sp. |
0/0/0 |
1/0/1 |
1/0/1 |
0/0/0 |
1/1/1 |
|
средние баллы |
0/0/0,5 |
0,6/0,7/0,7 |
0,2/0,4/0,4 |
0,4/0,4/0,7 |
1,1/0,9/1,3 |
|
|
общий средний балл |
0,2 |
0,7 |
0,3 |
0,5 |
1,1 |
|
|
процентное соотношение грибов-биодеструкторов |
0/0/ 18,7 |
50/68,7/ 56,2 |
18,7/37,5/ 25 |
37,5/43,7/6 2,5 |
87,5/100/93,7 |
|
По результатам испытания материалов на грибостойкость было выявлено, что коллекционные штаммы повреждают лишь два материала из пяти: сшитый полиэтилен (РЕ-Хс) и полипропилен рандом-сополимер термостойкий (PP-RCТ), в отношении остальных материалов ни один из представленных коллекционных штаммов не проявлял биокоррозионной активности. Аборигенные штаммы оказались более активными по сравнению с коллекционными штаммами: повреждают все материалы и на более высокий балл. По показателям биоповреждающей активности в отношении и коллекционных и аборигенных штаммов самым нестойким материалом оказался полипропилен рандом-сополимер термостойкий (PP-RCТ). В результате испытаний на грибостойкость была замечена интересная особенность: из всех представленных 24 штаммов лишь 3 способны повреждать полиэтилен высокой плотности (HDPE): это представители местной микофлоры: Clado-sporium linicola, Cladosporium transchelii и Aspergillus fumigatus. Названные аборигенные микро-мицеты способны обрастать данный материал по методу №4 (в присутствии дополнительного источника углерода – сахарозы питательной среды Чапека-Докса).
По результатам проведенных испытаний была выявлена общая тенденция: наибольшее количество коллекционных штаммов микромицетов проявляли биоповреждающую активность по методам №2 и №1, то есть представители коллекционных штаммов микроскопических грибов способны использовать в качестве единственного источника углеродного питания синтетические полимеры. У местных изолятов по показателям биоповреждающей активности и количеству повреждающих материал микромицетов почти равное распределение; однако, следует отметить, что аборигенные штаммы показали самые высокие значения биодеструкторной активности по методу №4 для всех материалов: сильнее повреждают материал в присутствии дополнительного источника углеродного питания – сахарозы питательной среды Чапека-Докса.
В биоповреждающей деятельности микро-мицетов большую роль играет выделение в среду агрессивных метаболитов: ферментов, органических кислот. Выделяя в среду кислоты, микро-мицеты устраняют конкурентов – бактерий, которые предпочитают нейтральные и щелочные значения рН. К тому же кислоты способны разъедать субстрат, способствуя более глубокому проникновению в него грибного мицелия. В ходе работы была исследована способность грибов к кислото- и щёлочеобразованию. Микромицеты выращивали в жидкой среде Чапека-Докса (рН 6,27) с индикатором бромтимоловым синим [8]; по изменению окраски и значений рН среды они были распределены на группы (табл. 2).
Таблица 2. Группы микромицетов по кислото- и щёлочеобразованию
|
Границы рН |
Группа |
Коллекционные штаммы |
Штаммы местных изолятов |
|
2 – 3 |
1) сильнокислая |
Aspergillus niger |
|
|
3 – 4 |
2) кислая |
Penicillium citrinum 1, Penicillium citrinum 2, Penicillium nigricans, Penicillium funiculosum, Penicillium notatum, Penicillium raciborskii, Penicillium rugulosum |
|
|
4 – 5 |
Aureobasidium pullulans var. pullulans, Penicillium funiculosum, Penicillium ochrochloron |
Aspergillus versicolor 2, Penicillium fuscum |
|
|
5 – 6 |
Paecilomyces variotii |
Cladosporium linicola, Scopulariopsis sp. |
|
|
6 – 7 |
3) слабокислая – нейтральная |
Aspergillus terreus, Scopulariopsis brevicaulis, Trichoderma virens |
Aspergillus flavus 1, Aspergillus fumigatus, Aspergillus versicolor 1 |
|
7 – 8 |
4) нейтральная – слабощелочная |
Aspergillus flavus 2 |
|
|
8 - 9 |
5) щелочная |
Cladosporium transchelii |
В результате исследования кислото- и щё-лочеобразования чёткой закономерности физиологического поведения доминирующих грибов-биодеструкторов замечено не было. Наоборот, следует отметить вариабельность изменения рН среды лидерами испытаний: Cladosporium linico-la незначительно подкисляет среду (с 6,27 до 6,00) , Cladosporium transchelii подщелачивает (с
6,27 до 8,35), а Aspergillus fumigatus не изменяет рН среды (6,27). Активный кислотообразователь – Aspergillus niger, значительно снизивший рН среды с 6,27 до 3,00, является одним из слабых биодеструкторов испытуемых полимеров. Анализируя полученные данные, можно заключить, что биодеструктивная деятельность исследуемых микромицетов в данном случае зависит не от выделения в среду кислот, а скорее всего от выделения агрессивных ферментов, оптимумы активности которых находятся в узкой области значений рН, соответствующих щелочным (Cladosporium transchelii), нейтральным (Aspergillus fumigatus) и слабокислым (Cladosporium linicola) значениям.
Следующий этап нашей работы - изучение роста микромицетов-биодеструкторов синтетических полимеров на природных полимерных субстратах, в качестве которых использовались полисахариды: крахмал и целлюлоза. Определение особенностей роста микроскопических грибов на этих природных полимерных субстратах проводилось путём поверхностного посева спор исследуемых штаммов на агаризованную среду Чапека, которая в качестве единственного источника углерода содержала крахмал или целлюлозу в количестве 30 г/л. Посев спор микроскопических грибов осуществляли уколом в центр чашки Петри диаметром 90 мм. Микромицеты на питательных средах культивировали 14 суток при температуре 25ºС. Каждые 48 часов инкубации измеряли диаметр выросших на чашках колоний и определяли радиальную скорость роста, которую рассчитывали по формуле [5]:
Кг = (г - ГоУ(t - to), где Кг - радиальная скорость роста; го - радиус колонии в начальный момент времени t0; г - радиус колонии в момент времени t.
На основании полученных данных представлены графики зависимости радиальной скорости роста от времени (рис. 1). На представленных графиках приведены кривые радиальной скорости роста наиболее сильных и слабых мик-ромицетов-биодеструкторов. Сильнейшие представлены местными изолятами микромицетов: Cladosporium transchelii , Aspergillus versicolor 2 и Penicillium raciborskii , слабейшие - коллекционными штаммами: Aspergillus niger и Trichoderma virens .
На графиках радиальной скорости роста микромицетов чётко прослеживаются общие закономерности. Во-первых, для коллекционных штаммов в целом характерен скачкообразный ход кривых радиальной скорости роста на крахмале и целлюлозе, выражающийся резкими подъёмами и спадами. К тому же большинство коллекционных штаммов перерастали диаметр чашки Петри на 6-10 сутки эксперимента. Аборигенные штаммы, наоборот, отличаются ровным, без резких колебаний, характером кривых радиальной скорости роста. Во-вторых, местные изоляты микромицетов отличаются гораздо более низкими значениями радиальной скорости роста, чем коллекционные штаммы: у сильнейшего микромицета-биодеструктора Cladosporium transchelii одни из самых низких значений, а один из лидеров-биодеструкторов -
Aspergillus versicolor 2 не обладает амилолитической активностью. В-третьих, при росте на природных полимерах: крахмале и целлюлозе, у всех коллекционных штаммов хорошо развивался воздушный мицелий, в то время как аборигенные штаммы отличались преобладающим развитием субстратного мицелия, особенно лидер-биодеструктор Cladosporium transchelii.
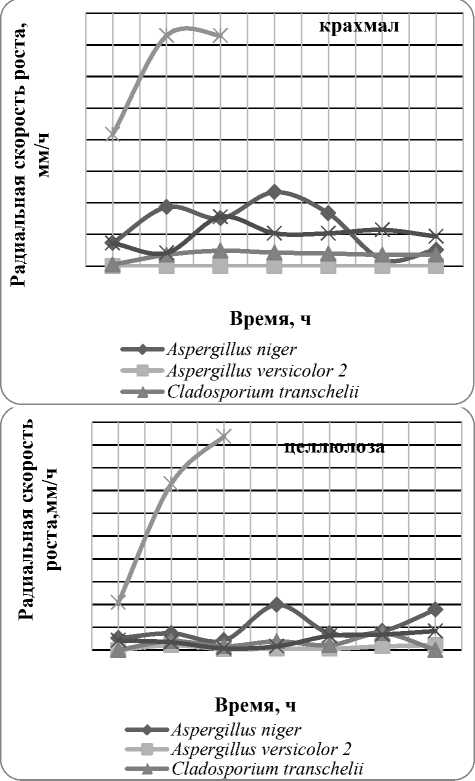
Рис. 1. Зависимость радиальной скорости роста микромицетов на природных полимерах (полисахаридах) от времени
Выводы: по результатам проведенных исследований можно заключить, что аборигенные штаммы микроскопических грибов отличаются высокой биоповреждающей активностью в отношении синтетических полимеров по сравнению с коллекционными штаммами. Лидирующие позиции среди микромицетов-биодеструкторов занимают представители рода Cladosporium. Активная биодеструктивная деятельность микромицетов в отношении синтетических полимеров обусловлена не кислотообра-зованием последних, а образованием и выделением в среду агрессивных ферментов. Аборигенные штаммы микромицетов медленнее растут на природных полимерах - полисахаридах крахмале и целлюлозе, но способны проникать в среду, «врастать» в субстрат благодаря развитию субстратного мицелия; коллекционные штаммы, напротив, быстро разрастаясь по поверхности среды за счёт воздушного мицелия, не проникают в неё. Такими физиологическими особенностями объясняется более высокая биоповреждающая активность аборигенных штаммов микромицетов по сравнению с коллекционными.
Список литературы Физиологические аспекты деструкции синтетических и природных полимеров коллекционными и аборигенными штаммами микромицетов
- Горбань, М.В. Сравнительная биоповреждающая активность микромицетов -деструкторов полимерных материалов/М.В. Горбань, Т.Д. Ямпольская//Современные проблемы биологических исследований в Западной Сибири и на сопредельных территориях: сб. мат-лов всерос. науч. конф. -Сургут, 2011. С. 246-248.
- ГОСТ 9.048-89. Изделия технические. Методы лабораторных испытаний на стойкость к воздействию плесневых грибов: государственный стандарт СССР//Государственный комитет СССР по стандартам. -М., 1989. 34 с.
- Ильичев, В.Д. Защита от биоповреждений -стратегия, подходы и принципы/В.Д. Ильичев//Актуальные проблемы биологических повреждений и защиты материалов, изделий и сооружений: сб. ст./под ред. Р.И. Фёдоровой и др. -М.: Наука, 1989. С. 3-19.
- Каневская, И.Г. Биологическое повреждение промышленных материалов/И.Г. Каневская. -Л.: Наука, 1984. 232 с.
- Методы экспериментальной микологии: справочник/И.А. Дудка и др.; под ред. В.И. Билай. -Киев: Наукова думка, 1982. 550 с.
- Мирчинк, Т.Г. Почвенная микология: учебник/Т.Г. Мирчинк. -М.: Изд-во МГУ, 1988. 220 с.
- Рубцова, Ю.П. Участие микроскопических грибов в биоповреждении древесностружечных плит: автореф. дис.. канд. биол. наук/Ю.П. Рубцова. -Н.Новгород, 2005. 23 с.
- Туркова, З.А. Роль физиологических критериев в идентификации микромицетов-биоразрушителей//Методы выделения и идентификации почвенных микромицетов-биодеструкторов: Сб. ст. -Вильнюс, 1982. С. 117-121.


