Физиологические и биохимические индикаторы стресс-реакции организма человека в динамике нормобарической гипоксии
Автор: Бурых Эдуард Анатольевич, Паршукова Ольга Ивановна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 1, 2023 года.
Бесплатный доступ
Цель. Исследовать динамику симпатоадреналового и адренокортикального компонентов стресс-реакции и их взаимосвязей с некоторыми физиологическими и биохимическими параметрами, характеризующими энергетический обмен организма человека при острой нормобарической гипоксии. Материалы и методы. Гипоксическое воздействие у испытуемых-добровольцев (n=14) моделировалось путем подачи кислородно-азотной смеси с 9 % содержанием кислорода для дыхания через маску в течение 40 мин. В фоне, на 5, 10, 20 и 40-й мин гипоксии производился забор крови из локтевой вены для последующего анализа. Определялся ряд физиологических показателей: частота пульса, артериальное давление, потребление кислорода, реографический индекс мозгового кровотока, а также содержание в крови на момент забора адреналина, норадреналина, кортизола, лактата и глюкозы. Оценивался прирост показателей в контрольных точках по отношению к фону, а также корреляция прироста различных показателей между собой. Результаты. При гипоксии в сравнении с фоном обнаружен достоверный прирост содержания в крови адреналина с максимумом на 20-й мин, норадреналина с максимумом на 10-й мин и лактата с максимумом на 40-й мин. Установлен достоверный прирост потребления кислорода и рео-графического индекса мозгового кровотока с максимумом на 40-й мин гипоксии. По мере увеличения длительности гипоксии увеличивалась степень сопряженности в динамике показателей симпатоадреналового ответа, мозгового кровотока и энергетического обмена (лактат, глюкоза). Выводы. Полученные факты свидетельствуют о гетерохронности включения симпатоадреналового и адренокортикального компонентов стресс-реакции в динамике ответа организма человека на воздействие острой нормобарической гипоксии. По мере развития гипоксии усиливается роль адренергической составляющей симпатоадреналового компонента стресс-реакции в мобилизации энергии гликолитических процессов.
Гипоксия, человек, стресс, симпатоадреналовый компонент, адренокортикальный компонент, адреналин, норадреналин, глюкоза, лактат, мозговой кровоток, потребление кислорода
Короткий адрес: https://sciup.org/14127215
IDR: 14127215 | УДК: 612.062 | DOI: 10.34014/2227-1848-2023-1-104-113
Текст научной статьи Физиологические и биохимические индикаторы стресс-реакции организма человека в динамике нормобарической гипоксии
Введение. Повышение функциональной активности симпатической нервной системы при гипоксии было обнаружено уже в ранних работах, посвященных систематическому изучению влияния кислородного дефицита на организм животных и человека [1], и впоследствии подтверждено во многих исследованиях [2–4].
В работах Г. Селье [5] было показано, что на многие экстремальные воздействия организм отвечает неспецифической реакцией – general adaptation syndrome. В этом синдроме автором была выделена реакция тревоги (alarm reaction), в которой наиболее ярко проявляется состояние напряжения организма – стресс (stress). Впоследствии термин «стресс»
стал синонимом общего адаптационного синдрома (general adaptation syndrome) и сегодня употребляется в отношении широкого круга воздействий. Однако необходимо заметить, что в исследованиях Г. Селье воздействия, приводившие к развитию общего адаптационного синдрома, такие как кровопотеря, травма, ожог, инфекции, носили достаточно продолжительный характер и требовали структурнофункциональной перестройки организма – адаптации. В то же время реакция тревоги, в которой наиболее отчетливо проявляется напряжение организма, зачастую позволяет избежать воздействий, требующих адаптации организма к стрессогенному фактору.
В настоящее время появляется все больше данных, свидетельствующих об известной автономности и асинхронности в развитии симпатоадреналового и адренокортикального компонентов стресс-реакции [6, 7]. При исследовании крыс с активной и пассивной стратегией поведения в условиях неизбегаемого стресса было обнаружено, что уровень кортикостерона (адренокортикальный компонент стресс-реакции) по окончании стрессорного воздействия достоверно увеличивается только у крыс с пассивной стратегией поведения [6]. В то же время было показано, что особенно резкое возрастание уровня адреналина в крови при стрессе (симпатоадреналовый компонент) наблюдается у животных с активной стратегией поведения [8]. Подобные индивидуальные различия позволили некоторым авторам связать активную стратегию поведения при стрессе с ответом симпатоадреналового компонента стресс-реакции, а пассивную (реактивную) стратегию поведения с адренокортикальным компонентом [9]. И хотя в дальнейшем эта точка зрения подверглась критическому осмыслению в свете новых данных [10], это не снизило актуальности проблемы индивидуальной вариабельности стресс-реактивности с точки зрения ее нейроэндокринного обеспечения [11].
Динамический аспект стресс-реакции организма на острую гипоксию также остается относительно малоисследованным. Вместе с тем очевидно, что в динамике острой гипоксии могут происходить выраженные изменения, связанные с изменением компенсаторных возможностей в отношении гипоксии и влияющие на выбор поведенческой стратегии организма – активной или пассивной. Одним из показателей активации организма под влиянием симпатоадреналовых механизмов является усиление гликолитических процессов [12].
Цель исследования. Изучение динамики симпатоадреналового и адренокортикального компонентов стресс-реакции у человека при острой нормобарической гипоксии, а также их взаимосвязей с некоторыми физиологическими и биохимическими параметрами, характеризующими энергетический обмен организма человека в динамике гипоксического воздействия.
Материалы и методы. В исследовании принимали участие 14 практически здоровых мужчин в возрасте от 20 до 40 лет, давших письменное согласие. На проведение исследования было получено разрешение комиссии по биоэтике Института физиологии ФИЦ «Коми научный центр Уральского отделения Российской академии наук» (г. Сыктывкар, Россия). Гипоксическое воздействие моделировалось путем вдыхания испытуемыми кисло-родно-азотной смеси со сниженным (9 %) содержанием кислорода в течение 40 мин. В фоне (15 мин) и в течение воздействия проводилась непрерывная регистрация физиологических показателей и периодически (на 5, 10, 20 и 40-й мин гипоксии) осуществлялся забор крови из локтевой вены для последующего анализа биохимических показателей и гормонов. Содержание в плазме крови адреналина, норадреналина, кортизола, глюкозы и лактата оценивалось с помощью иммунофермента-тивного анализа (Chronolab, Швейцария). Забор крови и ее анализ проводились в отделе экологической и социальной физиологии человека Института физиологии ФИЦ «Коми научный центр Уральского отделения Российской академии наук» (г. Сыктывкар).
Потребление кислорода организмом оценивалось при помощи датчика потока AWM720P1 (Honeywell, США) и датчика концентрации кислорода КЕ-25 (Figaro, Япония). Регистрация реоэнцефалограммы (РЭГ) осуществлялась на энцефалографе с расширенными функциями «Энцефалан – 131-03» («Медиком», Россия). При анализе РЭГ для каждого кардиоцикла программа оценивала амплитуду реограммы (АРГ), характеризующую пульсовое наполнение зоны мозга, а также амплитудно-частотный показатель (АЧП), являющийся отношением АРГ к длительности кардиоцикла.
В фоне, а также в каждой точке забора крови при гипоксии оценивались средние значения показателей по группе испытуемых. При оценке статистической значимости различий средних значений использовался непараметрический критерий Вилкоксона. При оценке статистической значимости коэффициентов корреляции использовались критические значения выборочного коэффициента корреляции. Статистическая обработка проводилась при помощи пакета программ Statistiсa 6.0.
Результаты. Одним из наиболее характерных признаков стресс-реакции как неспецифического компонента ответа организма на любые экстремальные воздействия является нейроэндокринная реакция, приводящая к увеличению содержания в крови гормонов: адреналина, норадреналина, кортизола и ряда других [11].
В течение всего периода гипоксического воздействия (на 5, 10, 20 и 40-й мин) содержание адреналина в крови выше, чем в фоне (табл. 1). Однако различия между фоном и гипоксией достигают уровня статистической значимости начиная с 20-й мин гипоксии: 45±22 пг/мл – в фоне, 74±35 пг/мл – на 20-й мин и 66±39 пг/мл – на 40-й мин. Пик прироста адреналина наблюдается на 20-й мин гипоксии.
Таблица 1
Table 1
Динамика ряда физиологических и биохимических показателей при гипоксическом воздействии
Dynamics of physiological and biochemical parameters under hypoxic exposure
|
Показатель Parameter |
Фон Baseline |
Период гипоксии, мин Hypoxic exposure |
|||
|
5-я Minute 5 |
10-я Minute 10 |
20-я Minute 20 |
40-я Minute 40 |
||
|
ЧСС, уд.×мин-1 HR, b×min-1 |
64±11 |
82±13* |
84±12* |
79±13* |
81±18* |
|
АДср, мм рт. ст. PP m , mm hg. |
96±12 |
96±13 |
89±13 |
93±15 |
93±10 |
|
ИндПК, мл×мин-1×кг-1 OxyCon, ml×min-1×kg-1 |
4,0±0,6 |
3,0±0,7 |
3,6±0,8 |
3,8±0,5 |
4,4±0,7* |
|
АЧП РЭГ МК, Ом×с-1 RI CBF, Om×sec-1 |
0,11±0,04 |
0,12±0,05 |
0,14±0,07* |
0,15±0,05* |
0,16±0,09* |
|
Адр, пг/мл Epi, pg/ml |
45±22 |
53±18 |
63±35* |
74±35* |
66±33* |
|
НрАдр, пг/мл NorEpi, pg/ml |
508±183 |
635±162 |
705±192* |
664±223 |
616±113 |
|
Корт, пг/мл Cort, pg/ml |
316±57 |
305±68 |
309±61 |
328±59 |
344±28 |
|
Глю, ммоль/л Glu, mmol/l |
5,08±0,67 |
5,07±0,79 |
5,05±0,81 |
5,07±0,71 |
5,67±0,88 |
|
Лак, ммоль/л Lac, mmol/l |
1,45±0,28 |
1,48±0,38 |
1,53±0,37* |
1,63±0,26* |
1,80±0,47* |
Примечание. АДср – среднее пульсовое артериальное давление, ИндПК – индекс потребление кислорода, АЧП РЭГ МК – реографический показатель мозгового кровотока, Адр – адреналин, НрАдр – норадреналин, Корт – кортизол, Глю – глюкоза, Лак – лактат. * – достоверные различия (p<0,05) при гипоксии по сравнению с фоном.
Note. HR – heart rate, PP m – medium pulse pressure, OxyCon – oxygen consumption index, RI CBF – rheo-graphic index of cerebral blood flow, Epi – epinephrine, NorEpi – norepinephrine, Cort – cortisol, Glu – glucose, Lac – lactate. * – p<0.05 hypoxia vs baseline.
Уровень норадреналина при гипоксии также увеличивается. Его наибольшее значение наблюдается на 10-й мин гипоксии – 705±192 пг/мл, что достоверно (p<0,05) больше, чем в фоне (508±183 пг/мл). В дальнейшем содержание норадреналина в крови несколько снижается. Его содержание в крови на 20-й (664±223 пг/мл) и 40-й мин (618±113 пг/мл) выше, чем в фоне, однако эти различия недостоверны.
Содержание кортизола в крови в течение воздействия остается практически неизменным и лишь на 40-й мин незначительно увеличивается (p>0,05).
Гормоны надпочечников играют важную роль в изменении показателей кислородного обеспечения и энергетического обмена при стрессорных воздействиях. Учитывая это, был проведен анализ взаимосвязи изменений содержания в плазме гормонов стресс-реакции, глюкозы и лактата, потребления кислорода организмом и мозгового кровотока на разных этапах гипоксического воздействия, а также анализ зависимости изменения данных показателей от их исходного уровня.
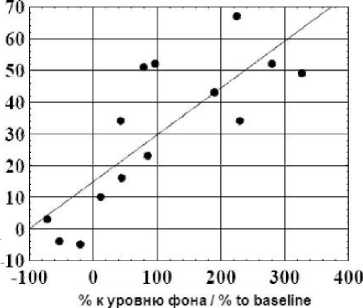
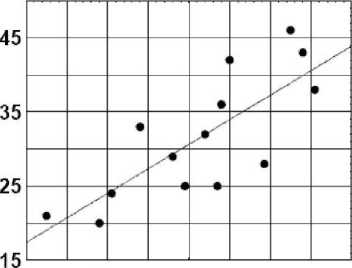
На рис. 1 приведены примеры подобной оценки взаимосвязи. Рис. 1А демонстрирует положительную корреляцию между изменениями содержания адреналина и лактата на 40-й мин гипоксии по сравнению с уровнем фона. Рис. 1В показывает положительную корреляцию между исходным содержанием норадреналина и приростом мозгового кровотока на 10-й мин гипоксии [11].
% «уровню фона/% to baseline А
% к уровню фона / % to baseline
100 300 500 700 900
Пг/мл / Pgfmi
Рис. 1А. Корреляция между изменениями содержания адреналина и лактата в венозной крови на 40-й мин гипоксии.
По оси абсцисс – прирост адреналина на 40-й мин гипоксии к уровню фона. По оси ординат – прирост лактата к уровню фона. Уровень фона взят за 100 %. Испытуемые обозначены кружочками Fig. 1A. Correlation between venous epinephrine and lactate, hypoxia, Minute 40.
X-axis: venous epinephrine shift, hypoxia, Minute 40, compared to baseline. Y-axis: venous lactate shift, hypoxia, Minute 40, compared to baseline. Baseline level is taken for 100 %. Subjects are marked by circles
Рис. 1В. Корреляция между изменениями индекса мозгового кровотока на 40-й мин гипоксии и фоновым уровнем норадреналина в венозной крови. По оси абсцисс – фоновый уровень норадреналина в венозной крови. По оси ординат – прирост индекса мозгового кровотока к уровню фона. Уровень фона взят за 100 %. Испытуемые обозначены кружочками
Fig. 1B. Correlation between venous baseline norepinephrine and cerebral blood flow index, hypoxia, Minute 40.
X-axis: venous norepinephrine, baseline. Y-axis: increase in cerebral blood index. Baseline level is taken for 100 %. Subjects are marked by circles
На рис. 2 отражены достоверные корреляции между вышеуказанными показателями в фоне, на 10-й и 40-й мин гипоксического воздействия. Следует отметить, что для ряда показателей отмечается корреляция между исходными значениями и изменениями тех же или других показателей на 10-й и 40-й мин гипоксии по сравнению с фоном. Так, между уровнем норадреналина в фоне и его изменениями на 10-й и 40-й мин гипоксии наблюдается отрицательная корреляция, а между уровнем норадреналина в фоне и изменениями мозгового кровотока на 10-й мин гипоксии и изменениями глюкозы на 40-й мин гипоксии – положительная [11].
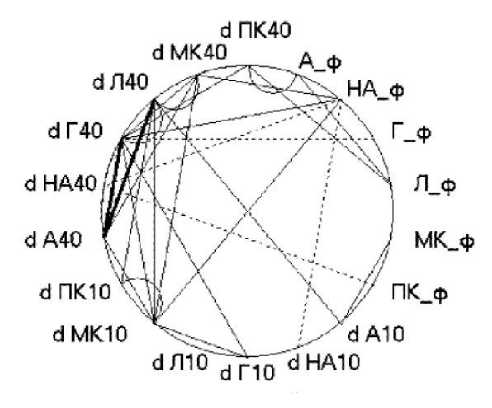
Рис. 2. Корреляции различных показателей в динамике гипоксического воздействия.
Сплошные линии – положительные корреляции: тонкая – p<0,05, толстая – p<0,01. Прерывистые линии – отрицательные корреляции: p<0,05. А – адреналин, НА – норадреналин, Л – лактат, Г – глюкоза, МК – индекс мозгового кровотока, ПК – потребление кислорода, _ф – фоновый уровень, d10, d40 – прирост к уровню фона на 10-й и 40-й мин гипоксии
Fig. 2. Correlation between different parameters under hypoxic exposure.
Full lines – positive correlation: p<0.05 – fine line, p<0.01 – heavy line. A – epinephrine, НА – norepinephrine, Л – lactate, Г – glucose, МК – cerebral blood flow index, ПК – oxygen consumption. d10, d40 – shifts to baseline, hypoxia, Minutes 10 and 40
Для ряда показателей обнаруживается корреляция между их изменениями на 10-й мин гипоксии и изменениями этих же или других показателей на 40-й мин. Так, изменения мозгового кровотока на 10-й мин обнаруживают положительную корреляцию с изменениями мозгового кровотока, адреналина, лактата и глюкозы на 40-й мин гипоксии.
Также обращает на себя внимание, что на 40-й мин гипоксии отмечается положительная корреляция между изменениями всех следующих показателей: адреналина, лактата, глюкозы и мозгового кровотока. Кроме того, на 40-й мин увеличивается уровень значимости корреляции между изменениями адреналина, с одной стороны, и глюкозы и лактата – с другой.
Обсуждение. В настоящем исследовании было подтверждено, что в течение 40 мин воздействия нормобарической гипоксии, соответствующей 9 % содержанию кислорода, у большинства испытуемых уровень адреналина и норадреналина в крови повышен по сравнению с предгипоксическим фоном. Также было установлено, что уровень кортизола – другого гормона стресс-реакции – в течение воздействия достоверно не повышается. Динамика норадренергического и адренергического компонентов при данном уровне гипоксии также несколько отличается. Пик содержания в крови норадреналина при гипоксии отмечается раньше, чем пик содержания адреналина. Были выявлены и различия в характере взаимодействия указанных компонентов стресс-реакции с физиологическими и биохимическими показателями, характеризующими энергообмен всего организма и головного мозга в частности. Обнаружена более тесная вовлеченность адренергического компонента в указанное взаимодействие, особенно на более поздних этапах гипоксического воздействия.
Следует отметить, что симпатоадреналовый компонент реакции на гипоксию не является обязательным и, вероятно, зависит от силы гипоксического воздействия. Так, в исследовании [13] при гипоксическом воздействии, соответствующем дыханию воздухом с
Одним из ключевых механизмов симпатоадреналовой реакции при экстремальных воздействиях является перераспределение имеющихся ресурсов организма в пользу жизненно важных органов, в первую очередь – головного мозга [2, 14]. Такой механизм реализуется через повышение артериального давления в системе сосудов головного мозга за счет вазоконстрикторных реакций в висцеральных органах [2].
Вполне вероятно, что данный механизм проявляется в положительной корреляции между исходным уровнем норадреналина в плазме и приростом мозгового кровотока в первые 10 мин гипоксии (рис. 1В). Можно предположить, что реализация данного механизма происходит не только во время самого гипоксического воздействия, но и в периоде его ожидания. При этом более высокий уровень симпатоадреналовой реакции в периоде ожидания воздействия предопределяет и более высокую реактивность вазоконстрикторных механизмов, обеспечивающих более высокий рост мозгового кровотока в ответ на гипоксию.
На более поздних этапах гипоксического воздействия значительно возрастает уровень положительной корреляции между изменениями содержания в плазме крови адреналина и изменениями мозгового кровотока. Вероятно, в данном случае усиливается рассмотренный выше механизм перераспределения кровотока в пользу мозга. Однако нельзя исключать и другой механизм, связанный с усилением готовности организма к избеганию гипоксии и требующий мобилизации дополнительной энергии, повышения скорости потребления кислорода головным мозгом и соответствующего увеличения мозгового кровотока [15].
Известно, что при определенном уровне гипоксического воздействия у крыс возникает состояние паники или реакции, похожие на панические (panic like reactions) и направленные на избегание гипоксии [16]. Эти реакции многими авторами связываются с норадренергическими структурами головного мозга. С другой стороны, известно, что гормоны симпатоадреналового звена стресс-реакции вызывают значительное повышение скорости потребления кислорода головным мозгом [15]. Увеличение потребления глюкозы мозгом предполагается даже в большей степени, поскольку помимо роста потребления глюкозы, необходимого для увеличения скорости потребления кислорода, катехоламины усиливают еще и гликолиз таким образом, что кис-лород-глюкозный индекс (OGI – oxygen glucose index) вместо максимально возможной теоретической величины в 6,0 колеблется между 5,0 и 2,8 [12]. Усиление корреляции между содержанием в крови глюкозы и адреналина на 40-й мин (рис. 2) может свидетельствовать как об адренергической стимуляции гликолиза, так и об усилении окислительных процессов в головном мозге – органе, на который приходится значительная доля потребления глюкозы.
Увеличение продукции лактата при гипоксии во многих исследованиях рассматривается как следствие усиления анаэробного гликолиза, т.е. как механизм, который компенсирует недостаток продукции энергии в реакциях окисления [17]. Однако уже в ранних биохимических исследованиях по гипоксии был обнаружен феномен увеличения продукции лактата в головном мозге на фоне неизменного и даже несколько повышенного по сравнению с нормой потребления кислорода головным мозгом [18]. Авторы, подтвердившие этот феномен [19], рассматривают лактат с точки зрения сигнальной молекулы, участвующей в вазодилатации, или с точки зрения биохимического взаимодействия между нейроглией и нейронами [20]. Другие авторы указывают на то, что лактат не является продуктом, от которого мозг должен избавиться, а, напротив, может быть субстратом для дальнейших реакций окислительного фосфорилирова- ния. В связи с этим они даже предлагают отменить определения «аэробный» или «анаэробный» в отношении термина «гликолиз» [21].
Заключение. Результаты настоящего исследования свидетельствуют о различиях в динамике симпатоадреналового и адренокортикального компонентов стресс-реакции организма на острое гипоксическое воздействие. Также в развитии при гипоксии норадренергической и адренергической составляющих симпатоадреналового компонента стресс-реакции обнаружена гетерохронность. Выявлена более тесная вовлеченность адренергической составляющей во взаимодействие с системами энергетического обеспечения всего организма и головного мозга в частности, особенно на поздних стадиях гипоксического воздействия. Одно из возможных объяснений полученных результатов может строиться на основе предположения об усилении мобилизационного компонента стресс-реакции по мере постепенного уменьшения компенсаторных возможностей организма в ходе увеличения длительности гипоксического воздействия.
Список литературы Физиологические и биохимические индикаторы стресс-реакции организма человека в динамике нормобарической гипоксии
- Cannon W.B. Bodily changes in pain, hunger, fear and rage. New York: D. Appleton & Co; 1929. 230.
- Гелльгорн Э. Регуляторные функции автономной нервной системы. Москва: Иностранная литература; 1948. 236.
- Lopes-Barneo J. Oxygen sensing and stem cell activation in the hypoxic carotid body. Cell Tissue Res. 2018; 372 (2): 417-425.
- Nurse C.A., Salman S., Scott A.L. Hypoxia-regulated catecholamine secretion in chromaffin cells. Cell Tissue Res. 2018; 372 (2): 433-441.
- Selye H. Stress. Montreal: Acta Inc.; 1950. 578.
- Жуков Д.А. Психогенетика стресса. Поведенческие и эндокринные корреляты генетических детерминант стресс-реактивности при неконтролируемой ситуации. Санкт-Петербург: СПбЦНТИ; 1997. 184.
- Gunnar M.R., Howland M.A. Calibration and recalibration of stress response systems across development: Implications for mental and physical health. Adv Child Dev Behav. 2022; 63: 35-69.
- Van Raaij M.T., Pit D.S., Balm P.H., Steffens A.B., van den Thillart G.E. Behavioral strategy and the physiological stress response in rainbow trout exposed to severe hypoxia. Horm. Behav. 1996; 30 (1): 85-92.
- MacKenzie S., Ribas L., PilarczykM., Capdevila D.M., Kadri S., HuntingfordF.A. Screening for coping style increases the power of gene expression studies. PLoS One. 2009; 4 (4): e5314.
- Hoglund E., Moltesen M., Castanheira M.F., Thornqvist P., Silva P., 0verli 0., Maltins C., Winberg S. Contrasting neurochemical and behavioral profiles reflects stress coping styles but not stress responsiveness in farmed head-gilted seabrem (Sparus aurata). Physiol Behav. 2020; 214: 112759.
- Wong R. Y., French J., Russ J.B. Differences in stress reactivity between zebrafish with alternative stress coping styles. R Soc Open Sci. 2019; 6 (5): 181797.
- Dienel G., Rothman D. Glycogenolysis in cerebral cortex during sensory stimulation, acute hypoglycemia and exercise: impact on astrocyte energetics, aerobic glycolysis and astrocyte-neuron interactions. Adv Neurobiol. 2019; 23: 209-267.
- Williams T.B., Corbett J., McMorris T., Young J.S., DicksM., Ando S., Thelwell R.C., Tipton M.J., Cos-tello J.T. Cognitive performance is associated with cerebral oxygenation and peripheral oxygen saturation, but not plasma catecholamines, during graded normobaric hypoxia. Exp Physiol. 2019; 104 (9): 1384-1397.
- Lantto J., Erkinaro T., Haapsamo M., Huhta H., Alanne L., Kokki M., Ohtonen P., Bhide A., Acharya G., Rasanen J. Peripheral chemoreflex activation and cardiac function during hypoxemia in near-term fetal sheep without placental compromise. J Appl Physiol (1985). 2021; 131 (5): 1486-1495.
- Berntman L., Dahlgren N., Siesjo B.K. Influence of intravenously administered catecholamines on cerebral oxygen consumption and blood flow in the rat. Acta Physiol. Scand. 1978; 104 (1): 101-108.
- Fernandes G., Frias A., Spiacci Jr.A., Pinheiro L., Tanus-Santos J.-E., Zangrossi H. Nitric oxide in the dorsal periaqueductal gray mediates the panic-like escape evoked by exposure to hypoxia. Prog Neuro-psychopharm Biol Psychiatry. 2019; 92: 321-327.
- Hochachka P.W. Defense strategies against hypoxia and hypothermia. Science. 1986; 17 (231 (4735)): 23-41.
- Cohen P.J., Alexander P.G., Smith T.C. Effects of hypoxia and normocarbia on cerebral blood flow and metabolism in conscious man. J. Appl. Physiol. 1967; 23 (2): 184-195.
- VestergaardM.B., Ghanizada H., Lindberg U., Arngrim N., Paulson O.B., Gjedde A., Ashina M., Lars-son H.B. Human cerebral perfusion, oxygen consumption and lactate production in response to hypoxic exposure. Cerebral Cortex. 2022; 32 (6): 1295-1306.
- Bonvento G., Bolanos J.P. Astrocyte-neuron metabolic activity cooperation shapes brain activity. Cell Metab. 2021; 33 (8): 1546-1564.
- Schurr A., Passarella S. Aerobic glycolisis: a deOxymoron of (neuro) biology. Metabolites. 2022; 12 (1): 72-83.


