Физиологические особенности устойчивых к ванкомицину штаммов коагулазонегативных стафилококков
Автор: Кононова Л.И., Коробов В.П.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2010 года.
Бесплатный доступ
Селекционированные в лаборатории и клинические изоляты коагулазонегативных стафилококков, устойчивые к гликопептидному антибиотику ванкомицину, имеют ряд отличительных физиологических особенностей по сравнению с бактериями чувствительного к ванкомицину коллекционного штамма Staphylococcus epidermidis 33. Все Vanr-штаммы обладают не только высокой степенью устойчивости с ванкомицину, но и характеризуются множественной устойчивостью к другим антибиотикам, а также ослабленной чувствительностью к антибактериальному пептиду варнерину, снижением уровня гидрофобности поверхности клеточных стенок, замедленным ростом и слабой способностью к накоплению биомассы.
Коагулазонегативные стафилококки, антибиотикоустойчивость, ванкомицин, низкомолекулярные катионные пептиды, варнерин, гидрофобность
Короткий адрес: https://sciup.org/147204483
IDR: 147204483 | УДК: 579.22+579.253.2
Текст научной статьи Физиологические особенности устойчивых к ванкомицину штаммов коагулазонегативных стафилококков
Появление в 80-х гг. прошлого столетия резистентности бактерий родов Enterococcus и Staphylococcus к гликопептидным антибиотикам ванкомицину и тейкопланину быстро нашло биохимическое и генетическое объяснение благодаря интенсивному изучению ванкомицин-резистентных штаммов энтерококков (Al-Obeid et al., 1990) и S. aureus (Lyon et al., 1987). Однако, несмотря на неуклонный рост резистентных штаммов, гликопептидные антибиотики во всех странах мира в настоящее время остаются препаратами выбора при инфекциях, обусловленных метициллин-резистентными штаммами S. aureus (MRSA) и S. epidermidis (MRSE), а также устойчивыми к ампициллину и аминогликозидам штаммами энтерококков (Huycke et al., 1998; Зайцев, 2003).
Существенным событием последнего времени является появление и значительное увеличение гетерорезистентности к гликопептидам среди мети-циллин-устойчивых коагулазонегативных стафи-локков (КНС), механизмы которой до сих пор не раскрыты (Sieradzki et al., 1999). Это определяет необходимость дополнительных исследований природы такой устойчивости КНС и поиска путей ее преодоления.
Типы устойчивости к гликопептидам, обнаруженные среди различных видов энтерококков, обусловлены генами резистентности, которые расположены на мобильных генетических элементах и способны к переносу не только в чувствительные реципиенты этого рода, но и в другие грамположи-тельные бактерии (Arthur et al., 1993). При этом ус- тановлено, что для штаммов S. aureus со сниженной чувствительностью или устойчивостью к ванкомицину (Van) характерно существенное утолщение клеточной стенки и избыточная продукция новых мишеней действия гликопептидов, локализованных вдали от истинных мишеней на плазматической мембране (Hanaki et al., 1998; Cui et al., 2003).
Механизмы устойчивости КНС к гликопептидам полностью не раскрыты (Biavasco et al., 2000). Показано, что устойчивые к Van КНС отличаются по некоторым свойствам (появлению множественной устойчивости к антибактериальным препаратам, изменению способности поглощать ванкомицин из среды культивирования) от чувствительных бактерий. Более того, гетерогенная природа устойчивости КНС к Van является характерной особенностью этой группы микроорганизмов (Biavasco et al., 2000).
Целью работы было изучение физиологических характеристик устойчивых к ванкомицину штаммов КНС и сравнение их со свойствами чувствительного к Van штамма S. epidermidis 33.
Материалы и методы
В работе исследовали коллекционный штамм S. epidermidis 33, полученный в ГНИИСКМБП им. Тарасевича, и его Vanr-производные, селекционированные в лаборатории культивированием на средах с возрастающими концентрациями антибиотика, а также клинические Vanr-штаммы КНС, выявленные посевом на агаризованные среды с градиентом концентрации этого антибиотика (Hanaki et al., 2001).
Выращивание бактерий проводили в питатель-
ной среде LB (Миллер, 1976) на орбитальном шейкере Certomat (Sartorius, Германия) при 150 об/мин и температуре 37ºC. За динамикой роста следили по изменению оптической плотности бактериальных культур при 600 нм на спектрофотометре PD-303 (APEL, Япония). МПК ванкомицина всех изучаемых штаммов определяли методом двукратных серийных разведений в 96-луночных иммунологических планшетах. В лунки, содержащие питательную среду LB, вносили бактерии логарифмической фазы роста в конечной концентрации 105 КОЕ/мл.
Определение чувствительности бактерий к низкомолекулярному пептиду варнерину проводили, как представлено ранее (Korobov et al., 2003). Чувствительность к антибиотикам выявляли методом диффузии с дисков (Скала и др. 2004). Степень гидрофобности поверхности бактериальных клеток определяли с помощью BATH-теста в двухфазной системе с гексадеканом (Rosenberg et al., 1980). Способность штаммов к образованию биопленок изучали в плоскодонных полистироловых планшетах при культивировании на среде LB при 37ºC без перемешивания в течение двух суток.
После окончания культивирования и двухкратного промывания биопленок физиологическим раствором проводили их окрашивание 0.1% раствором генцианвиолета. Количество связавшегося красителя определяли после экстракции пленок этанолом и измерения оптической плотности спиртовых экстрактов на планшетном спектрофотометре Benchmark Plus (Bio-Rad, США) при 570 нм (Christensen et al., 1985).
Результаты и их обсуждение
Результаты исследований представлены в табл. 1, 2. Обнаружено, что полученные в лаборатории под прессом возрастающих концентраций антибиотика Vanr-производные штамма S. epidermidis 33 и клинические Vanr-изоляты стафилококков обладали высоким уровнем устойчивости к Van (МПК от 250 до 1000 мкг/мл). Устойчивость всех изученных Vanr-штаммов к варнерину была приблизительно одинакова. МПК варнерина для них составляла ≥125 мкг/мл, что значительно превышало МПК варнерина родительского штамма S. epidermidis 33, равную 0.25 мкг/мл.
Таблица 1
Характеристика гидрофобности и чувствительности к ванкомицину и варнерину использованных в работе штаммов
|
Штаммы |
МПК ванкомицина, мкг/мл |
МПК варнерина, мкг/мл |
Гидрофобность клеточной поверхности, % |
|
S. epidermidis 33 |
1.1 |
0.25 |
34 – 55 |
|
S. epidermidis 33 Vanr (16)* |
≥ 400.0 |
≥ 125.0 |
7 – 14 |
|
S. epidermidis 33 Vanr2 (12)* |
≥ 500.0 |
≥ 125.0 |
7 – 26 |
|
S. epidermidis 33 Vanr3 (12)* |
≥ 1000.0 |
≥ 125.0 |
22 – 26 |
|
КНС клинический 337 Vanr |
≥ 250.0 |
≥ 62.5 |
5 – 15 |
|
КНС клинический 713 Vanr |
≥ 250.0 |
≥ 62.5 |
4 – 9 |
|
КНС клинический 699 Vanr |
≥ 250.0 |
≥ 62.5 |
6 – 12 |
(12)*, (16)* – число пассажей на средах с возрастающей концентрацией ванкомицина.
Таблица 2
Чувствительность исследованных штаммов стафилококков к антибиотикам
|
Штаммы |
Антибиотики |
|||||||||||
|
Бен |
Ген |
Цеф |
Тет |
Лин |
Окс |
Риф |
Эр |
Фуз |
Лев |
Ван |
Цип |
|
|
S. epidermidis 33 |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
Ч |
|
S. epidermidis 33 Vanr (16)* |
У |
Ч |
Ч |
П |
У |
У |
П |
Ч |
У |
Ч |
У |
Ч |
|
S. epidermidis 33 Vanr2 (12)* |
У |
Ч |
Ч |
П |
У |
У |
П |
Ч |
У |
Ч |
У |
Ч |
|
S. epidermidis 33 Vanr3 (12)* |
У |
Ч |
Ч |
П |
У |
У |
П |
Ч |
У |
Ч |
У |
Ч |
|
КНС клинический 337 Vanr |
У |
Ч |
Ч |
Ч |
У |
У |
Ч |
Ч |
Ч |
Ч |
У |
Ч |
|
КНС клинический 713 Vanr |
У |
Ч |
Ч |
Ч |
У |
У |
Ч |
Ч |
Ч |
Ч |
У |
Ч |
|
КНС клинический 699 Vanr |
У |
Ч |
Ч |
Ч |
У |
У |
Ч |
Ч |
Ч |
Ч |
У |
Ч |
Степень устойчивости к антибиотикам: У – устойчивый, П – промежуточный, Ч – чувствительный. Антибиотики: Бен – бензилпенициллин, Ген – гентамицин, Цеф – цефалексин, Тет – тетрациклин, Лин – линкомицин, Окс – оксациллин, Риф – рифампицин, Эр – эритромицин, Фуз – фузидин, Лев – левомицетин, Ван – ванкомицин, Цип – ципрофлоксацин.
Как видно из табл. 1, для всех Vanr-штаммов было характерно значительное снижение гидрофобности клеточной поверхности. Возможно, это играет существенную роль в снижении чувствительности Vanr-штаммов к варнерину за счет ослабления гидрофобных взаимодействий молекул пептида с поверхностными структурами бактериальных клеток. Интересно отметить, что рост всех Vanr-штаммов подавлялся концентрациями NaCl (10 – 15%), при которых чувствительный штамм S. epidermidis 33 обладал способностью к обильному росту.
Исследования показали, что образование Vanr-фенотипа стафилококков сопровождалось приобретением устойчивости и к ряду других антибиотиков (табл. 2). При этом клинические штаммы, по данным первых экспериментов, обладали одинаковыми плазмидными спектрами.
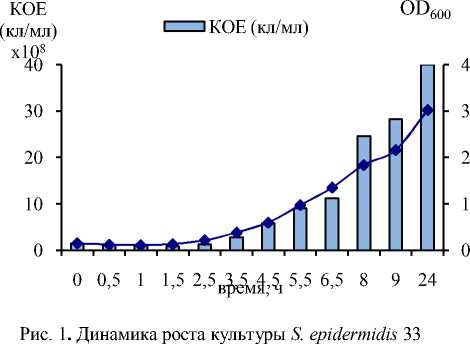
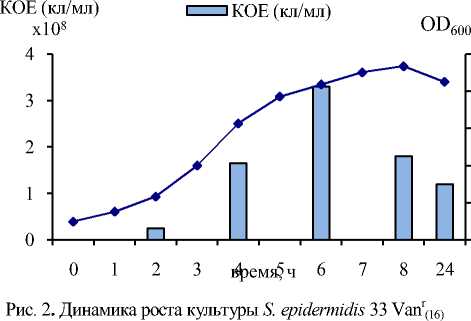
Сравнительный анализ динамики роста на среде LB стафилококков, различающихся по чувствительности к Van, показал, что характерной особенностью всех клинических и лабораторных Vanr-штаммов стафилококков является значительное увеличение времени генерации и меньшее накопление биомассы по сравнению с исходными штаммами (рис. 1, 2). Особенно важно отметить, что приобретение устойчивости к Van не вызывало каких-либо значительных изменений в способности штаммов к образованию биопленок. На рис. 3 приведены результаты двух независимых исследований биопленок, образованных на вторые сутки культивирования штаммов.
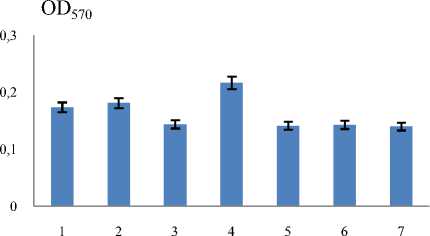
штаммы
Рис. 3 . Способность изученных штаммов стафилококков к образованию биопленок:
1 – S. epidermidis 33, 2 – S. epidermidis 33Vanr (16) , 3 – S. epidermidis 33 Vanr2 (12) , 4 – S. epidermidis 33 Vanr3 (12) , 5 – КНС клинический 337 Vanr, 6 – КНС клинический
713 Vanr, 7 – КНС клинический 699 Vanr
Таким образом, развитие устойчивости к Van сопровождается выраженными изменениями некоторых важных физиологических характеристик коагулазонегативных стафилококков. Обнаруженная взаимосвязь резистентности стафилококков к ванкомицину с изменением чувствительности к антибактериальному пептиду варнерину требует дальнейшего изучения для выяснения механизмов формирования защиты Van-устойчивых бактерий от катионных антибактериальных пептидов.
Работа поддержана грантами Российского фонда фундаментальных исследований и Министерства промышленности, инноваций и науки Пермского края № 10-04-96086-р_урал_а, Программы Президиума РАН «Молекулярная и клеточная биология», Междисциплинарного проекта фундаментальных исследований, выполняемых в учреждениях УрО РАН.
Список литературы Физиологические особенности устойчивых к ванкомицину штаммов коагулазонегативных стафилококков
- Зайцев, А.А. Стафилококки и ванкомицин: тенденции противостояния/А.А. Зайцев, О.И. Карпов, С.В. Сидоренко//Антибиотики и химиотерапия. 2003. Т. 48, № 6. С. 20-26.
- Миллер, Д. Эксперименты в молекулярной генетике/Д. Миллер. М.: Мир, 1976. 394 с.
- Скала, Л.З. Практические аспекты современной клинической микробиологии/Л.З. Скала, С.В. Сидоренко, А.Г. Нехорошева, И.Н. Лукин, С.А. Грудинина. М.: ООО Изд-во Триада. 2004. 312 с.
- Arthur, M. Genetics and mechanisms of glycopeptide resistance in enterococci/M. Arthur, P Courvalin//Antimicrob. Agents Chemother. 1993. Vol. 37, № 8. P. 1563-1571.
- Biavasco, F. Glycopeptide resistance in coagulasenegative staphylococci/F. Biavasco, C. Vignaroli, P.E. Varaldo//Eur. J. Clin. Microbiol. Infect. Dis. 2000. Vol. 19, № 6. P. 403-417.
- Christensen, G.D. Adherence of coagulase-negative staphylococci to plastic tissue culture plates: a quantitative model for the adherence of staphylococci to medical devices // G.D. Christensen, W.A. Simpson, J.J. Younger [et al.] // J. Clin. Microbiol. 1985. Vol. 22, № 6. P. 996-1006.
- Cui, L. Cell wall thickening is common feature of vancomycin resistance in Staphylococcus aureus/L. Cui, X. Ma, K. Sato [et al.]//J. Clin. Microbiol. 2003. Vol. 41, № 1. P. 5-14.
- Hanaki, H. Activated cell-wall synthesis is associated with vancomycin resistance in methicillin-resistant Staphylococcus aureus clinical strains Mu3 and Mu50/H. Hanaki, K. Kuwahara-Arai, S. Boyle-Vavra [et al.]//J. Antimicrob. Chemother. 1998. Vol. 42, № 2. P. 199-209.
- Hanaki, H. Detection methods of glycopeptideresistant Staphylococcus aureus/H. Hanaki, K. Hiramatsu//Antibiotic resistance. Humana Press, 2001. Vol. 48. P. 85-91.
- Huycke, M. M. Multiple-drug resistant Enterococci: The nature of the problem and an agenda for the future/M. M. Huycke, D.F. Sahm, M.S. Gilmore//Emerg. Infect. Dis. 1998. Vol. 4, № 2. P. 239-249.
- Korobov, V.P. Production of a wide-spectrum antibacterial factor by Staphylococcus warneri cells/V.P. Korobov, L.M. Lemkina, T.V. Polyudova//Docl. Biol. Sci. 2003. Vol. 390, № 5. P. 286-288.
- Lyon, B.R. Antimicrobial resistance of Staphylococcus aureus: genetic basis/B.R. Lyon, R. Skurray//Microbiol. Rev. 1987. Vol. 51, № 1. P. 88-134.
- Al-Obeid, S. Mechanism of Resistance to Vancomycin in Enterococcus faecium D366 and Enterococcus faecalis A256/S. Al-Obeid, E. Collatz, L. Gutmann//Antimicrob. Agents Chemother. 1990. Vol. 34, № 2. P. 252-256.
- Rosenberg, M. Adherence of bacteria to hydrocarbons: a simple method for measuring cell-surface hydrophobicity/M. Rosenberg, D. Gutnick, E. Rosenberg//FEMS Microbiol. Lett. 1980. Vol. 9, № 1. P. 29-33.
- Sieradzki, K. Heterogeneously vancomycin-resistant Staphylococcus epidermidis strain causing recurrent peritonitis in a dialysis patient during vancomycin therapy/K. Sieradzki, R.R. Roberts, D. Serur [et al.]//J. Clin. Microbiol. 1999. Vol. 37, № 1. P. 39-44.


