Физиологическое состояние Fucus vesiculosus L. Баренцева моря при длительном нахождении в воздушной среде
Автор: Рыжик Инна Валериевна, Макаров Михаил Владимирович
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Гидробиология
Статья в выпуске: 2 т.21, 2018 года.
Бесплатный доступ
Увеличение антропогенной нагрузки на экосистемы обусловило необходимость проведения мероприятий, направленных на очищение окружающей среды и восстановление нарушенных биоценозов. Для очистки морской среды от тяжелых металлов, радионуклидов, нефтепродуктов предложено использовать плантации-биофильтры, биологической составляющей которых являются водоросли-макрофиты. В качестве наиболее подходящих объектов определены фукусовые водоросли, в частности Fucus vesiculosus, поскольку они обладают высокой сорбционной активностью по отношению к тяжелым металлам, радионуклидам, способны включать нефтяные углеводороды в процесс метаболизма. При исследовании физиологических особенностей растений с помощью стандартных методов (определение фотосинтетической активности, содержания фотосинтетических пигментов, относительного содержания воды) выявлена способность F. vesiculosus выдерживать длительное нахождение в воздушной среде. В ходе эксперимента водоросли помещали на сетку, скручивали в рулон, который обматывали брезентом (для предотвращения высыхания растений), и устанавливали в разных экспериментальных условиях при постоянной (8 ºС) и переменной (7-19 ºС) температурах. Водоросли сохраняли фотосинтетическую способность в течение 30 дней; через 20 дней наблюдалось снижение интенсивности фотосинтеза по сравнению с контрольными растениями; после эксперимента F. vesiculosus восстанавливали уровень фотосинтетических процессов в течение одних суток. Общее содержание хлорофиллов и соотношение Chl А / Chl C в течение эксперимента не изменялись, что также свидетельствует об устойчивости фотосинтетического аппарата растений. Показано, что F. vesiculosus при нахождении в условиях, обеспечивающих сохранение влаги в талломах не менее 55 %, в течение 30 дней способны сохранять физиологическую активность. Эта способность расширяет возможности использования F. vesiculosus в качестве объекта санитарной аквакультуры; возможно предварительное строительство модулей плантаций-биофильтров и их длительная транспортировка.
Санитарная плантация-биофильтр, биоремедиация, загрязнение нефтепродуктами, баренцево море
Короткий адрес: https://sciup.org/142215137
IDR: 142215137 | УДК: 57.(022 | DOI: 10.21443/1560-9278-2018-21-2-253-260
Текст научной статьи Физиологическое состояние Fucus vesiculosus L. Баренцева моря при длительном нахождении в воздушной среде
В настоящее время увеличивающаяся антропогенная нагрузка на экосистемы обусловила необходимость проведения мероприятий, направленных на очищение окружающей среды и восстановление нарушенных биоценозов. Актуальной проблемой, предваряющей проведение подобных мероприятий, является подбор средств и методов, безопасных для окружающей среды. В ходе проведенных исследований установлен наиболее подходящий способ – биоремедиация, т. е. очистка среды с помощью биологических объектов, в основном микроорганизмов [1–3]. Также возможно применение сорбентов, изготовленных из природных материалов [4–6]. Для очистки морской среды от тяжелых металлов, радионуклидов, нефтепродуктов предложено использовать водоросли-макрофиты в качестве основных компонентов плантации-биофильтра [7–10]. Наиболее подходящими объектами были определены бурые водоросли, поскольку они обладают высокой сорбционной активностью по отношению к тяжелым металлам, радионуклидам, способны включать нефтяные углеводороды в процесс метаболизма [11–13]. Самым устойчивым из фукусовых водорослей является F. vesiculosus [14].
При разработке плантаций-биофильтров одной из задач является создание определенного пула отдельных мобильных секций с возможностью их транспортировки к местам постановки. Для решения данной задачи необходимо определение оптимальных и возможных условий, а также длительности периода, в течение которого водоросли могут находиться вне водной среды без потери жизнеспособности и функциональной активности.
Целью данной работы было определение максимальной продолжительности нахождения талломов F. vesiculosus в безводных условиях посредством оценки физиологического состояния растений (функционального состояния модулей плантации-биофильтра).
Материалы и методы
Экспериментальные работы проводили в июле – августе 2015 и 2017 гг.; использовали талломы Fucus vesiculosus длиной 20–25 см, имеющие 6–8 дихотомических ветвлений; при отборе водорослей не учитывали наличие рецептакулов. Растения закрепляли на сетчатом полотне, которое применяли в качестве основы для отдельной секции плантации [15], скручивали и заворачивали в брезентовую ткань для снижения потерь влаги, формируя рулон. Рулоны находились в термостатированном помещении при температуре 8 ºС (регулируемые условия) и на улице под навесом (для защиты от прямых солнечных лучей), где наблюдались перепады температур от 7 до 19 ºС (нерегулируемые условия). Рулоны периодически
(раз в два дня) поливали морской водой. Поскольку водоросли были завернуты в плотную ткань, они также оказались в условиях отсутствия освещения, необходимого для функционирования фотосинтетического аппарата.
Длительность эксперимента составила 30 суток, в течение которых каждые 10 дней определяли содержание воды в талломах и оценивали физиологическое состояние водорослей по интенсивности фотосинтеза (ИФ) растений скляночным методом в модификации Винклера. Для этого несколько растений изымали из рулона и помещали в сосуды со свежей морской водой. Измерения проводили в течение часа после изъятия водорослей из рулонов в лабораторных условиях при постоянном освещении люминесцентными лампами интенсивностью 100 Вт/м2 и температуре 10 ºС. Для измерения ИФ использовали не менее трех растений из каждого варианта. После проведения измерений растения в экспериментальные рулоны не возвращали.
После 30 суток нахождения водорослей в условиях эксперимента их поместили в естественные условия для оценки возможности и скорости восстановления физиологических показателей. Через 1, 2 и 24 часа определяли содержание воды в талломе и интенсивность фотосинтеза. Для оценки состояния фотосинтетического аппарата в начале и в конце эксперимента, а также через сутки после восстановления растений определяли концентрацию и соотношение хлорофиллов (Хл А, Хл С (С1 + С2)).
Содержание воды в талломах рассчитывали по соотношению сырой и сухой массы высечек таллома (^ = 20). Массу высечек определяли на весах ВЛТЭ-210 с точностью до 0,001 г: сырую – после удаления с поверхности высечек капельно-жидкой влаги фильтровальной бумагой; сухую – после высушивания в сушильном шкафу (Т = 105 °С) в течение 24 часов.
Показатели растений, находившихся в условиях эксперимента, сравнивали с показателями растений из природных зарослей (контроль).
Эксперимент проводили в двукратной повторности; статистическую обработку данных осуществляли с использованием программного пакета Excel. На рис. 1–4 представлены средние арифметические значения и доверительные интервалы.
Результаты и обсуждение
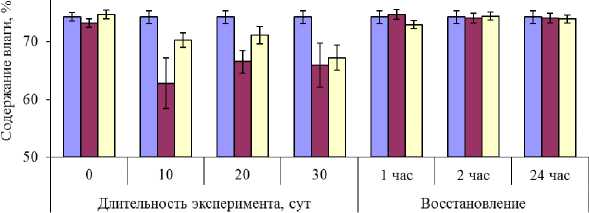
Содержание влаги в талломах растений при естественных условиях (контрольных) составляло 74–75 %. У растений, находившихся в условиях эксперимента, содержание влаги со временем снижалось. Минимальное содержание влаги составляло 63 % и наблюдалось у растений, помещенных в термостатируемые (регулируемые) условия (рис. 1), возможно, вследствие того, что постоянство температуры в помещении обеспечивалось работой кондиционера, который создавал постоянное движение воздуха и осушал его. В результате высыхание рулонов с водорослями в помещении происходило быстрее, чем на улице.
80 -i
□ контроль ■регулируемые условия □ нерегулируемые условия
Рис. 1. Содержание влаги в талломах F. vesiculosus в течение эксперимента
Fig. 1. The moisture content in the F. vesiculosus thallus during the experiment
Содержание влаги в тканях растений, находившихся в условиях эксперимента, уменьшалось намного меньше по сравнению с растениями из природных зарослей, у которых во время отлива содержание влаги может снижаться до 30 %, а близкородственный вид F. spiralis может терять до 90 % имеющейся влаги [16], но при наступлении прилива растения быстро восстанавливают физиологическую активность.
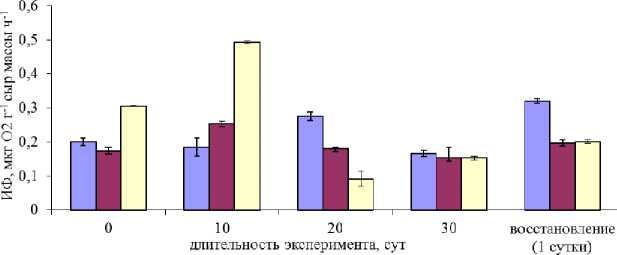
Водоросли при нахождении в воздушной среде сохраняли фотосинтетическую активность в течение всего периода исследований (30 суток), их ИФ была сравнима с показателями растений из природных зарослей (рис. 2).
В течение первых 10 суток у растений, находившихся в воздушной среде, после переноса их в морскую воду отмечалась более высокая ИФ как по сравнению с начальным уровнем, так и по сравнению с контрольными растениями. Возможно, это связано с потерей влаги в период нахождения растений в воздушной среде и активным восстановлением фотосинтетических процессов при переносе в водную среду и достаточном освещении. На 20-е сутки ИФ экспериментальных растений снижалась, что может быть обусловлено индивидуальными особенностями талломов, отобранных из рулонов для определения показателей, поскольку через 30 суток их ИФ была вновь сравнима с показателями контрольных растений.
□ контроль □ регулируемые условия □ нерегулируемые условия
Рис. 2. Интенсивность фотосинтеза F. vesiculosus в течение эксперимента
Fig. 2. The intensity of photosynthesis of F. vesiculosus during the experiment
Общее содержание хлорофиллов (рис. 3, А) и соотношение Хл А / Хл С (рис. 3, Б) в течение эксперимента не менялось, что также свидетельствует о сохранности фотосинтетического аппарата F. vesiculosus при длительном нахождении растений в воздушной среде и при отсутствии освещения.
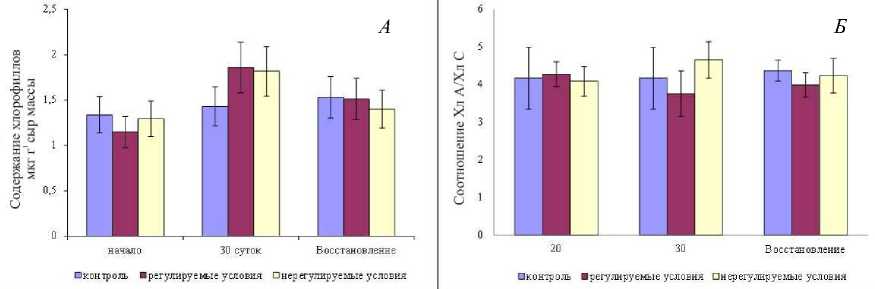
Рис. 3. Содержание хлорофиллов (А) и соотношение Хл А / Хл С (Б) в ткани F. vesiculosus в течение эксперимента и в период восстановления
Fig. 3. Chlorophyll content (A) and Chl A / Chl C ratio (Б) in the F. vesiculosus tissue during the experiment and the period of recovery
После переноса растений из условий эксперимента в нормальные условия (свежая морская вода и естественное освещение) происходило быстрое восстановление фотосинтетической активности: уже через час ИФ экспериментальных растений была всего в 1,5 раза ниже, чем контрольных, через два часа показатели достигли уровня контрольных растений. Через сутки ИФ была в два раза выше по сравнению с начальным уровнем (рис. 4). Неизменность содержания и соотношения фотосинтетических пигментов и быстрое восстановление функциональных показателей свидетельствуют о сохранности фотосинтетического аппарата в активном состоянии в течение всего периода эксперимента.
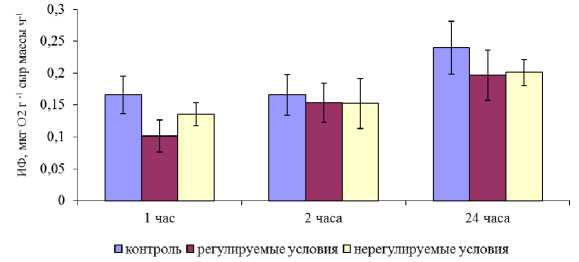
Рис. 4. Интенсивность фотосинтеза экспериментальных растений F. vesiculosus в период восстановления
Fig. 4. The intensity of photosynthesis of experimental plants of F. vesiculosus during the recovery period
В ряде работ по изучению влияния осушения на водоросли было показано, что скорость восстановления физиологических показателей зависит от количества потерянной влаги: если достигнута критическая потеря воды, то восстановления ИФ не происходит. Для каждого вида водоросли максимальная степень осушения, при которой еще возможно восстановление физиологической активности, индивидуальна [17; 18]. F. vesiculosus может выдерживать более длительное осушение по сравнению с другими фукоидами и быстро восстанавливать потерянную влагу: растения способны терять до 91 % воды [19] и до 32 часов находиться в воздушной среде без потери жизнеспособности [20; 21]. За сохранение жизнеспособности водорослей отвечают дегидрин-подобные белки (члены группы белков тканей наземных растений), устойчивые к высыханию и способствующие стабилизации мембран и ферментов при значительной потере влаги [22; 23]. Способность литоральных водорослей находиться продолжительное время вне водной среды может также определяться возможностью переключения механизмов карбоксилирования и использования атмосферной двуокиси углерода в качестве источника неорганического углерода, что было обнаружено еще в середине XX в. известным физиологом растений R. Bidwell [24].
Заключение
По результатам проведенных исследований [14; 25–28], F. vesiculosus является уникальным видом водорослей, способным существовать в широком диапазоне условий окружающей среды и имеющим высокую степень толерантности к воздействию загрязнителей. В ходе эксперимента показано, что этот вид водорослей может выдерживать отсутствие освещения и находиться вне воды при положительных температурах окружающей среды в течение 30 суток.
Практический результат данной работы состоит в установлении возможности хранения или длительной транспортировки указанного вида фукоидов или готовых модулей плантации-биофильтра, изготовленных на его основе, без организации специальных условий. Главным требованием сохранности растительного материала является его содержание в условиях постоянной влажности, доступа воздуха и при отсутствии прямых солнечных лучей.
Работа выполнена в рамках государственного задания ММБИ КНЦ РАН по теме "Механизмы адаптации, регуляции роста, размножения и рационального использования водорослей-макрофитов арктических морей", № 0228-2018-0004.
Список литературы Физиологическое состояние Fucus vesiculosus L. Баренцева моря при длительном нахождении в воздушной среде
- Baker K. H., Herson D. S. Bioremediation. New York: McGraw-Hill, 1994. 375 p.
- Atlas R. M. Bioremediation of petroleum pollutants//International Biodeterioration & Biodegradation. 1995. V. 35, N 1-3. P. 317-327.
- Alexander M. Biodegradation and bioremediation. 2nd Edition. Academic Press, 1999. 453 p.
- Choi H. M., Cloud R. M. Natural sorbents in oil spill cleanup//Environmental Science & Technology. 1992. V. 26, N 4. P. 772-776 DOI: 10.1021/es00028a016
- Thomson B. M. Removal of metals and radionuclides using apatite and other natural sorbents//Journal of Environmental Engineering. 2003. V. 129, N 6. P. 492-499. (ASCE)0733-9372(2003)129:6(492) DOI: https://doi.org/10.1061/
- Hlihor R. M., Gavrilescu M. Removal of some environmentally relevant heavy metals using low-cost natural sorbents//Environmental Engineering and Management Journal. 2009. V. 8, N. 2. P. 353-372.
- Способ очистки морских прибрежных вод от пленочных и диспергированных в поверхностном слое воды нефтепродуктов: пат. 2375315 Рос. Федерация/Воскобойников Г. М., Коробков В. А., Макаров М. В. № 2007106573/13; заявл. 21.02.07; опубл. 10.12.2009, Бюл. № 34.
- Воскобойников Г. М., Макаров М. В., Рыжик И. В. Теоретические основы и перспективы использования плантации-биофильтра для очистки морской акватории от нефтяного загрязнения//Комплексные исследования больших морских экосистем России = Integrated investigations of the Russian large marine ecosystems. Апатиты: КНЦ РАН, 2011. С. 202-234.
- Воскобойников Г. М., Ильинский В. В., Лопушанская Е. М., Макаров М. В., Пуговкин Д. В., Рыжик И. В. . Санитарная водорослевая плантация для очистки прибрежных акваторий от нефтепродуктов: от теории к практике//Вопросы современной альгологии. Специальный выпуск. Доклады Сабининских чтений (2012-2016). М.: Перо, 2017. С. 160-186.
- Воскобойников Г. М., Зубова Е. Ю., Макаров М. В., Пуговкин Д. В., Рыжик И. В. Санитарная водорослевая плантация (СВП): варианты//Биоразнообразие и устойчивое развитие: материалы III междунар. науч.-практ. конф., Симферополь, 15-19 сент. 2014 г. Симферополь: Крымский научный центр, 2014. С. 66.
- Золотухина Е. Ю., Тропин И. В., Кононенко Р. В. Распределение тяжелых металлов в талломах бурой водоросли Laminaria sacharina (Ag.) Kjellm//Вестник Московского университета. Сер. 16: Биология. 1992. № 1. С. 72-76.
- Степаньян О. В. Морфо-функциональные перестройки у водорослей-макрофитов Баренцева моря под воздействием нефти и нефтепродуктов: дис.. канд. биол. наук: 25.00.28. Мурманск, 2003. 146 с.
- Усягина И. С., Воскобойников Г. М., Макаров М. В., Ильин Г. В., Салахов Д. О. Биосорбция радионуклидов водорослями-макрофитами из морской воды (на примере Fucus vesiculosus)//Материалы научных мероприятий, приуроченных к 15-летию Южного научного центра РАН: Междунар. науч. форума "Достижения академической науки на Юге России", Междунар. молодежной науч. конф. "Океанология в XXI в.: современные факты, модели, методы и средства" памяти члена-корреспондента РАН Д. Г. Матишова, Всерос. науч. конф. "Аквакультура: мировой опыт и российские разработки", г. Ростов-на-Дону, 13-16 декабря 2017 г. Ростов н/Д: ЮНЦ РАН, 2017. С. 290-293.
- Макаров М. В., Рыжик И. В., Воскобойников Г. М. Выбор объектов для санитарной аквакультуры, или Fucus vesiculosus vs Терминатор: шансы на выживание//Материалы научных мероприятий, приуроченных к 15-летию Южного научного центра РАН: Междунар. науч. форума "Достижения академической науки на Юге России"; Междунар. молодежной науч. конф. "Океанология в XXI в.: современные факты, модели, методы и средства" памяти члена-корреспондента РАН Д. Г. Матишова; Всерос. науч. конференции "Аквакультура: мировой опыт и российские разработки" г. Ростов-на-Дону, 13-16 декабря 2017 г. Ростов н/Д: ЮНЦ РАН, 2017. С. 406-408.
- Устройство для биологической очистки морских вод от техногенных загрязнений (варианты): пат. на полезную модель 136037 Рос. Федерация/Воскобойников Г. М., Макаров М. В. № 2013137328/10; заявл. 08.08.2013; опубл. 27.12.2013, Бюл. № 36.
- Schagerl M., Möstl M. Drought stress, rain and recovery of the intertidal seaweed Fucus spiralis//Marine Biology. 2011. V. 158, Iss. 11. P. 2471-2479. DOI: https://doi.org/10.1007/s00227-011-1748-x.
- Dring M. J., Brown F. A. Photosynthesis of intertidal brown algae during and after periods of emersion: a renewed search for physiological causes of zonation//Marine Ecology: Progress Series. 1982. V. 8. Р. 301-308.
- Beer S., Kautsky L. The recovery of net photosynthesis during rehydration of three Fucus species from the Swedish west coast following exposure to air//Botanica Marina. 1992. V. 35, Iss. 6. Р. 487-491. DOI: https://doi.org/10.1515/botm.1992.35.6.487. Published Online: 2009-10-23.
- Kanwisher J. Freezing and drying in intertidal algae//Biological Bulletin. 1957. V. 113, N 2. P. 275-285 DOI: https://doi.org/10.2307/1539085
- Kawamitsu Y., Driscoll T., Boyer J. S. Photosynthesis during desiccation in an intertidal alga and a land plant//Plant and Cell Physiology. 2000. V. 41, Iss. 3. P. 344-353 DOI: https://doi.org/10.1093/pcp/41.3.34
- Андреев В. П., Маслов Ю. И., Сороколетова Е. Ф. Функциональные особенности фотосинтетического аппарата трех видов Fucus в условиях Белого моря. Влияние обезвоживания//Физиология растений. 2012. Т. 59, № 2. С. 244-250.
- Xu D., Duan X., Wang B., Hong B., Ho T. H. D. Expression of a late embryogenesis abundant protein gene, HVA1, from Barley confers tolerance to water deficit and salt stress in transgenic rice//Plant Physiology. 1996. V. 110, N 1. P. 249-257 DOI: https://doi.org/10.1104/pp.110.1.249
- Close T. J. Dehydrins: a commonalty in the response of plants to dehydration and low temperature//Physiologia Plantarum. 1997. V. 100, N 2. P. 291-296. DOI: https://doi.org/10.1111/j.1399-3054.1997.tb04785.x.
- Bidwell R. G. S. Photosynthesis and metabolism of marine algae: II. A survey of rates and products of photosynthesis in C14O2//Canadian Journal of Botany. 1958. V. 36, N 3. P. 337-349. 10.1139/b58-029 DOI: https://doi.org/
- Воскобойников Г. М., Макаров М. В., Рыжик И. В. Изменения в составе фотосинтетических пигментов и структуре клеток у бурых водорослей Fucus vesiculosus L. и F. serratus L. Баренцева моря при длительном нахождении в темноте//Биология моря. 2006. Т. 32, № 1. С. 26-33.
- Макаров М. В., Рыжик И. В., Воскобойников Г. М., Матишов Г. Г. Влияние интенсивности движения воды на морфологические и физиологические показатели Fucus vesiculosus L. Баренцева моря//Доклады академии наук. 2007. Т. 415, № 4. С. 569-570.
- Макаров М. В., Рыжик И. В., Воскобойников Г. М., Матишов Г. Г. Влияние глубины произрастания на морфофизиологические показатели Fucus vesiculosus L. Баренцева моря//Доклады академии наук. 2010. Т. 430, № 3. С. 427-429.
- Makarov M. V. Influence of ultraviolet radiation on the growth of the dominant macroalgae of the Barents Sea//Chemosphere: Global Change Science. Climate Change Effect on Northern Terrestrial and Freshwater Ecosystems. 1999. V. 1, N 4. P. 461-467.


