Физиолого-биохимические характеристики микропобегов чая (Camellia sinensis L.) в условиях in vitro: норма, осмотический стресс, влияние кальция
Автор: Малюкова Л.С., Нечаева Т.Л., Зубова М.Ю., Гвасалия М.В., Конинская Н.Г., Загоскина Н.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Физиология, биохимия
Статья в выпуске: 5 т.55, 2020 года.
Бесплатный доступ
К важным факторам, определяющим продуктивность растений, относится их устойчивость к стрессовым воздействиям, в том числе к засухе, гипотермии, минеральной недостаточности и засолению. Решению этих проблем, актуальных в связи со всеобщей аридизацией климата, посвящена серия исследований на различных сельскохозяйственных культурах (J.K. Zhu, 2016; E. Fleta-Soriano, S. Munné-Bosch, 2016), в том числе на чае (Camellia sinensis L.) (T.K. Maritim с соавт., 2015; Л.С. Самарина с соавт., 2019). При достаточно детальном изучении физиолого-биохимических и молекулярных механизмов устойчивости чая к засухе практически не охвачена тема их экзогенной регуляции на основе использования химических и биологических веществ. При этом на многих культурах показана важная роль ионов кальция (Ca2+) в распознавании клеткой внешнего стрессорного воздействия и запуске системы трансдукции ответного сигнала (M.C. Kim, 2009; Е.Г Рихванов с соавт., 2014). При исследовании этих аспектов достаточно часто в качестве «моделей засухи» используют агаризованные питательные среды с добавлением в них осмотически активных веществ (R.M. Pérez-Clemente с соавт., 2012; M.K. Rai с соавт., 2011) и модельные биосистемы (микропобеги и ткани in vitro), позволяющие раскрыть клеточные механизмы адаптации. Однако в отношении растений чая число подобных исследований невелико (Л.С. Самарина с соавт., 2018; М.В. Гвасалия с соавт., 2019), и они направлены на расшифровку биохимических и молекулярных ответов растений на стрессы. В настоящем сообщении мы впервые на основе отечественных методик получения микропобегов чая в культуре in vitro (М.В. Гвасалия, 2013) и протоколов моделирования осмотического стресса исследовали роль кальция в адаптации растений к стрессовым условиям, вызванным длительным культивированием и осмотическим стрессом, а также продемонстрировали перспективу изучения роли экзогенных индукторов в повышении устойчивости растений на такого рода «моделях засухи». Целью работы было выявление особенностей функционального состояния культивируемых in vitro микропобегов чая, выращиваемых в оптимальных условиях и при моделировании слабого осмотического стресса, обусловленного действием маннита, на фоне разных концентраций кальция (Ca2+) в питательной среде. Оценивали морфофизиологическое состояние листьев, их оводненность, проницаемость мембран растительных клеток, содержание малонового диальдегида, пролина и фотосинтетических пигментов. Установлено, что при повышении концентрации Ca2+ в питательной среде (с 440 до 880 мг/л) при длительном культивировании микропобегов чая in vitro (4 мес) происходит замедление формирования и развития их листьев, а также достоверное снижение содержания малонового диальдегида и проницаемости мембран растительных клеток (в среднем на 50 %, р ≤ 0,05), свидетельствующее о менее выраженном развитии процессов липопероксидации. Добавление в питательную среду маннита (40 г/л) снижало оводненность побегов (в среднем на 2 %, р ≤ 0,05), формируя тем самым незначительный осмотический стресс, что приводило к накоплению пролина (увеличение на 30-40 %, р ≤ 0,05), а также к структурно-функциональной перестройке фотосинтетического аппарата (уменьшение количества фотосинтетических пигментов в среднем на 35-40 %). При этом отмечали достоверное снижение содержания малонового альдегида (на 50-70 %, р ≤ 0,05) и интенсивности выхода электролитов из тканей листьев (в среднем на 50 %, р ≤ 0,05), что указывало на менее выраженный окислительный стресс в сравнении с контролем (без добавления маннита). Повышение концентрации Ca2+ в питательной среде (с 440 до 880 мг/л) (на фоне добавления маннита) не оказывало достоверного влияния на оводненность тканей и структуру фотосинтетического аппарата (содержание и соотношение хлорофиллов/каротиноидов). Незначительное воздействие кальция (на фоне маннита) проявилось в достоверном уменьшении содержания малонового диальдегида на 20 мкмоль/г сухой массы. Следовательно, добавление в питательную среду повышенной концентрации кальция (660-880 мг/л) обеспечивает улучшение функционального состояния длительно культивируемых микропобегов чая in vitro (4 мес) за счет снижения активности липопероксидации в мембранах и повышения их стабильности. Выявленные закономерности доказывают положительную роль ионов кальция в снижении комбинированного окислительного стресса, вызванного длительным культивированием растений in vitro в сочетании с осмотическим стрессом.
Чай, camellia sinensis l, микропобеги in vitro, кальций, маннит, осмотический стресс, пигменты, пролин, малоновый диальдегид
Короткий адрес: https://sciup.org/142229439
IDR: 142229439 | УДК: 633.72:581.1:58.085 | DOI: 10.15389/agrobiology.2020.5.970rus
Текст научной статьи Физиолого-биохимические характеристики микропобегов чая (Camellia sinensis L.) в условиях in vitro: норма, осмотический стресс, влияние кальция
Важный фактор, определяющий продуктивность растений, — их устойчивость к стрессовым воздействиям (1, 2). К ним относится осмотический стресс, обусловленный действием засухи, гипотермии, засоления, который приводит к обезвоживанию тканей и даже гибели растения (3, 4). Воздействие стрессоров прослеживается по комплексу физиолого-биохимических и молекулярных процессов, к числу которых относится рост, овод-ненность и водный потенциал листьев, ферментативная активность, мета-боломный профиль, экспрессия генов (1, 5, 6).
Особую функцию в поддержании устойчивости растений к действию неблагоприятных факторов среды выполняет кальций (Са2+) (7, 8). Согласно данным литературы, изменение его концентрации в цитозоле представляет собой первый этап в распознавании клеткой внешнего воздействия и запуске системы трансдукции сигнала для ответной реакции (7, 9, 10). Важную группу сенсоров, вовлеченных в каскад кальциевых ионных сигналов в клетках высших растений, составляют Ca-зависимые протеинкиназы (11, 12). При действии кальция отмечаются изменения в росте, фотосинтезе и водно-воздушном режиме растений, работе устьиц, а также накоплении белков стресса (7, 13). За счет индукции антиоксидантной системы снижается степень окислительных повреждений (14, 15).
Растения чая ( Camellia sinensis L.), которые относятся к важным культурам промышленного использования, возделываются в регионах мира, подверженных засухе (16-18). По данным ряда исследователей (9, 16, 18), в том числе и авторов (17), гидротермический стресс приводит к потере более 50 % урожая чая при богарном возделывании. Прогрессирующая аридиза-ция климата актуализирует задачу повышения устойчивости растений к засухе. В этой связи большое внимание в исследованиях по культуре чая уделяется изучению механизмов его устойчивости к засухе, поиску наиболее информативных маркеров засухоустойчивости, а также созданию новых устойчивых сортов (4, 9, 15). При этом практически не охвачены вопросы углубленного понимания метаболизма молодых побегов чая при экзогенном воздействии ряда биогенных элементов и других веществ. В то же время эти аспекты широко исследуются на других культурах, где в качестве «моделей засухи» используют агаризованные питательные среды с добавлением в них осмотически активных веществ (19-21). Это позволяет эффективно контролировать величину водного потенциала, что существенно для обеспечения высокой точности, воспроизводимости и сравнительной оценки различных экспериментов (22).
Культивируемые в условиях in vitro ткани и микропобеги растений представляют собой информативные модельные системы, позволяющие изучать метаболические процессы и ответные клеточные реакции на стрессовые воздействия, включая физиологические и биохимические изменения. Такой подход использовался для выделения устойчивых генотипов картофеля (23), чины посевной (24), огурца (25), фасоли (26) в условиях осмотического стресса (засухи).
Однако в отношении растений чая число подобных исследовании невелико (27, 28), и они направлены преимущественно на расшифровку биохимических и молекулярных ответов на действие засухи и получение новых знаний о вызываемых ею изменениях в протеоме и метаболоме. В настоящем сообщении мы впервые установили роль кальция в адаптации микропобегов чая к стрессу, вызванному длительным культивированием в условиях in vitro в сочетании с осмотическим стрессом, а также проде- монстрировали перспективу изучения роли экзогенных индукторов в устойчивости растений на такого рода «моделях засухи», созданных на основе агаризованных питательных средах с добавлением в них маннита.
Целью работы было выявление особенностей функционального состояния культивируемых in vitro микропобегов чая, выращиваемых в оптимальных условиях и при моделировании слабого осмотического стресса, обусловленного действием маннита, на фоне разных концентраций кальция (Ca2+) в питательной среде.
Методика. Микропобеги местной популяции растений чая ( Camellia sinensis L.) выращивали in vitro на питательной среде Мурасиге-Скуга, содержащей 6-бензиламинопурин (БАП, 6 мг/л), 1-нафталинуксусную кислоту (НУК, 1 мг/л), гибберелловую кислоту (ГК, 2 мг/л) (29). При изучении устойчивости микропобегов чая к Ca2+ в питательную среду, содержащую или не содержащую маннит (40 г/л), вносили различные концентрации СaCl 2 . Дизайн эксперимента включал следующие варианты: 1 — основная питательная среда с CaCl 2 (440 мг/л, контроль); 2 — основная питательная среда с CaCl 2 (880 мг/л); 3-5 — основная питательная среда с маннитом (40 г/л) и CaCl 2 (соответственно 440, 660 и 880 мг/л). В каждом варианте было по 10-15 микропобегов, которые культивировали в течение 4 мес в факторостатной комнате, где соблюдали следующие условия: фотопериод 16/8 ч, температурный режим 25±1,0 °С, влажность 70 %, освещенность 3000 лк (лампы L 36 W/765, «OSRAM GmbH», Германия). Для анализа использовали листья микропобегов.
Для определения оводненности растительный материал высушивали в термостате (BD-115, «Binder GmbH», Германия) при 70 °С до постоянной массы (30).
При оценке стабильности клеточных мембран навеску листьев (50 мг) помещали в деионизированную воду (50 мл). Электропроводность измеряли портативным кондуктометром ST300C, датчик STCON3 (с поверкой) («OHAUS Corporation», США). Измерения проводили через 0; 60 и 120 мин после погружения листьев, а также после 60 мин кипячения растительной пробы. Относительную электропроводность инкубационного раствора рассчитывали по формуле: REC = L 1 /L 2 ½ 100 %, где L 1 — электропроводность через 0 мин, L 2 — электропроводность в остывшем растворе после кипячения на водяной бане 1 ч при 100 °С (31).
Перекисное окисление липидов (ПОЛ) определяли по содержанию малонового диальдегида (МДА) (32). Листья микропобегов чая гомогенизировали в 0,1 М Трис-HCl буфере (рН 7,5) с 0,35 М NaCl, после чего добавляли 0,5 % раствор тиобарбитуровой кислоты в 20 % водном растворе трихлоруксусной кислоты. Реакционную смесь инкубировали в течение 30 мин на кипящей водяной бане (WB-4MS, «BioSan», Латвия), охлаждали и измеряли оптическую плотность надосадочной жидкости (спектрофотометр СФ-46, «ЛОМО», Россия) при X = 532 нм.
Пигменты экстрагировали из листьев микропобегов чая 96 % этанолом (32). В надосадочной жидкости, полученной после центрифугирования гомогената (13000 об/мин, 5 мин) спектрофотометрически (СФ-46, «ЛО-МО», Россия) определяли количество хлорофилла a (Chlа) и хлорофилла b (Chlb) (соответственно X = 665 нм и X = 649 нм), а также каротиноидов (Car) (X = 440 нм). Содержание всех пигментов рассчитывали стандартным методом (33).
Пролин экстрагировали из листьев микропобегов чая стандартным методом и определяли его содержание при X = 520 нм на приборе УСФ-01
(«ВНИИИОФИ», Россия), используя нингидриновый реактив (27).
Все определения проводили в трех биологических и трех аналитических повторностях. Статистическую обработку полученных данных осуществляли с помощью программ Microsoft Excel 2010 и SigmaPlot 12.2 . В таблице и на рисунках представлены средние арифметические значения определений (M) и их стандартные ошибки (±SEM). Достоверность различий средних оценивали по t-критерию Стьюдента; значения, помеченные разными латинскими буквами, различаются при р ≤ 0,05.
Результаты . Известно, что маннит in vitro вызывает осмотический стресс (27, 34). В наших опытах микропобеги чая, выращиваемые в течение 4 мес in vitro, были невысокими, что отмечалось и ранее (27). Для них было характерно формирование ярко-зеленых листьев (рис. 1). При высоком содержании Ca2+ в основной питательной среде, которое в 2 раза превышало норму (соответственно 880 и 440 мг/л СаCl 2 ), четко проявлялось уменьшение их размера (см. рис. 1, А). Следовательно, повышение его концентрации замедляло формирование и развитие листьев у микропобегов чая. Эта тенденция сохранялась и в условиях осмотического стресса — чем выше была концентрация Ca2+ в среде, тем меньше был размер листьев (см. рис. 1, Б). При этом они были хорошо развиты, то есть ярких проявлений стрессовых реакций мы не наблюдали, что может служить доказательством защитного действия Ca2+, как это отмечалось и в других исследованиях, например у картофеля (23). Отметим, что в доступной литературе мы не обнаружили сообщений о моделировании засухи у чая в условиях in vitro, кроме наших работ.
А

Б

Рис. 1. Микропобеги чая ( Camellia sinensis L.), выращенные in vitro на питательной среде с разными концентрациями CaCl 2 в отсутствие (А) или в присутствии (Б) осмотика (маннит, 40 г/л) : верхний ряд — 400 мг/л и 800 мг/л, нижний ряд — слева направо 400 мг/л, 600 мг/л и 800 мг/л.

Важный показатель физиологического состояния растения, особенно в условиях засухи, — содержание воды в клетках (19). Наше исследование показало, что оводненность листьев микропобегов чая, выращиваемых на основной питательной среде, не зависела от действующей концентрации Ca2+ и была практически равной в обоих вариантах (табл. 1).
В присутствии маннита оводненность незначительно, но достоверно снижалась (на 2 %, р ≤ 0,05), и этот эффект не зависел от количества CaCl 2
в среде. Исходя из этого можно предположить, что Са2+ способствовал поддержанию водного гомеостаза листьев in vitro у микропобегов чая, культивируемых в условиях осмотического стресса, и этот эффект был практически равным при всех исследованных концентрациях (от 440 до 880 мг/л). Имеются сообщения, что Са2+ участвует в регуляции реакции растений на неблагоприятное действие засухи (35). У проростков Vernicia fordii Hemsley и Hordeum vulgare L. после обработки этим макроэлементом содержание воды в листьях повышалось, и этот эффект зависел от длительности воздействия и концентрации Са2+, а также от генотипа растения (36, 37).
1. Оводненность листьев микропобегов чая ( Camellia sinensis L.), выращенных in vitro, в зависимости от концентрации CaCl 2 и присутствия осмотика в питательной среде
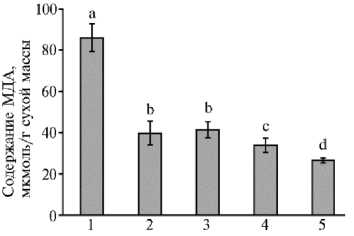
Рис. 2. Содержание малонового диальдегида (МДА) в листьях микропобегов чая ( Camellia sinensis L.), выращенных in vitro на питательной среде с разными концентрациями CaCl 2 в отсутствие (1, 2) или в присутствии (3-5) осмотика (маннит, 40 г/л): 1 — основная среда с 440 мг/л CaCl 2 (контроль); 2 — основная среда с 880 мг/л CaCl 2 ; 3-5 — среда с маннитом (40 г/л) и соответственно 440 мг/л, 660 мг/л и 880 мг/л CaCl 2 . Достоверные различия средних значений (при р ≤ 0,05) отмечены разными латинскими буквами.
Стрессовые условия, в том числе засуха, часто способствуют образованию активных форм кислорода в клетках растений и усилению окислительных процессов (1, 4, 19, 35). Для их оценки определяют показатели ПОЛ в клетках, о котором судят по количеству МДА (19, 38). Более высокое содержание МДА (в среднем почти в 2 раза выше, чем для остальных вариантов) (рис. 2) мы отмечали в листьях микропобегов, выращиваемых на основной среде с низкой концентрацией Ca2+ (440 мг/л СаCl2). Возможно, такой эффект обусловлен недостатком этого соединения в питательной среде при длительном выращивании микропобегов чая в условиях in vitro. При повышении количества Ca2+ в среде (до 880 мг/л СаCl2) содержание МДА в них значительно снижалось и приближалось к значениям в вариантах с действием осмотического стресса в сочетании с различными концентрациями Са2+. Так, при наличии маннита в питательной среде количество МДА в варианте 3 (440 мг/л СаCl2) было на 51,8 % ниже, чем в варианте 1 (контроль), на 60,7 % ниже, чем в варианте 4 (660 мг/л СаCl2), и почти на 70 % ниже, чем в варианте 5 (880 мг/л СаCl2) (при р ≤ 0,05). Эти результаты позволяют сделать вывод о регуляторном действии не только маннита, но и Са2+ (особенно высоких его концентраций) на антиоксидантную систему микропобегов чая, что подтверждается данными по снижению уровня ПОЛ в вариантах 2-5 по сравнению с контролем (вариант 1). Как уже отмечалось выше, условия засухи способствуют развитию окислительного стресса, нарушая равновесие между образованием активных форм кислорода и их детоксикацией (39). В этом случае важными вторичными мессенджерами в передаче внутриклеточных сигналов в растениях и регулировании окислительных реакций служат ионы Ca2+ (7, 8). Показано уменьшение негативных последствий от действия засухи у проростков Helianthus annuus L. после экзогенного применения Са2+ (40). Данные нашего исследования также свидетельствуют о значительном снижении интенсивности окислительных процессов в клетках микропобегов чая под влиянием Са2+ в условиях осмотического стресса.
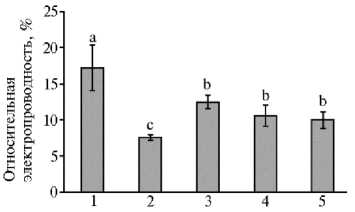
Рис. 3. Относительная электропроводность листьев микропобегов чая ( Camellia sinensis L.), выращенных in vitro на питательной среде с разными концентрациями CaCl 2 в отсутствие (1, 2) или в присутствии (3-5) осмотика (маннит, 40 г/л): 1 — основная среда с 440 мг/л CaCl 2 (контроль); 2 — основная среда с 880 мг/л CaCl 2 ; 3-5 — среда с маннитом (40 г/л) и соответственно 440 мг/л, 660 мг/л и 880 мг/л CaCl 2 . Достоверные различия средних значений (при р ≤ 0,05) отмечены разными латинскими буквами.
Один из начальных этапов реакции клеток растений на стрессоры — изменение состояния мембран, показателем которого служит их относительная электропроводность (7, 10). Мембранная регуляция клетки, будучи частью всего комплекса систем регуляции в организме, рассматривается как важнейший адаптационный механизм, определяющий сохранение жизнеспособности растения, а проницаемость мембран растительных клеток (интенсивность выхода из тканей электролитов) — как показатель устойчивости растений к стрессу, в том числе осмотическому (41). Для микропобегов чая, выращиваемых на основной среде с Ca2+, по аналогии с содержанием МДА отмечали наиболее высокий выход электролитов (рис. 3). При повышении количества Ca2+ в среде (880 мг/л СаCl 2 ), а также в присутствии маннита выход электролитов снижался в среднем в 1,5-2,0 раза (при р ≤ 0,05), что свидетельствовало о повышении стабильности клеточных мембран. В условиях осмотического стресса в большей степени это проявлялось при повышенных концентрациях Ca2+ (660 и 880 мг/л СаCl 2 ), где отмечалось снижение этого показателя (см. рис. 3). Такое снижение указывало на менее выраженное развитие процессов липопероксидации в мембранах этих in vitro культур на фоне действия повышенных концентраций Ca2+, что согласуется с данными литературы (14, 15). Закономерности изменения анализируемого показателя напрямую коррелировали с содержанием в листьях МДА, демонстрируя более выраженное развитие процессов липопероксидации в клетках при недостаточном содержании Ca2+ в среде (до 440 мг/л СаCl 2 ) в условиях длительного культивирования.
Известно, что при стрессе усиливаются гидролитические процессы, что приводит к накоплению так называемых стрессовых метаболитов, например пролина — низкомолекулярного осмотически активного соединения, способного образовывать гидрофильные коллоиды, что защищает белки от денатурации при различных стрессах (9). Наши исследования показали увеличение содержания свободного пролина в микропобегах чая в условиях осмотического стресса (рис. 4). При этом повышение концентрации Ca2+ в питательной среде до 880 мг/л приводило к достоверному снижению содержание пролина в листьях микропобегов чая. Соотношение абсолютного содержания пролина в микропобегах на средах +маннит/-маннит (после стресса/до стресса), которое отражает интенсивность образования пролина, было наибольшим в варианте с 400 мг/л СаCl 2 в питательной среде и составило 1,45 против 1,36 для 880 мг/л СаCl 2 .
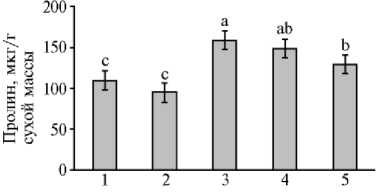
Рис. 4. Содержание пролина в листьях микропобегов чая ( Camellia sinensis L.), выращенных in vitro на питательной среде с разными концентрациями CaCl 2 в отсутствие (1, 2) или в присутствии (3-5) осмотика (маннит, 40 г/л) : 1 — основная среда с 440 мг/л CaCl 2 (контроль); 2 — основная среда с 880 мг/л CaCl 2 ; 3-5 — основная среда с маннитом (40 г/л) и соответственно 440 мг/л, 660 мг/л и 880 мг/л CaCl 2 . Достоверные различия средних значений (при р ≤ 0,05) отмечены разными латинскими буквами.
2. Содержание (мг/г сухой массы) хлорофилла а (Chla) , хлорофилла b (Chlb) и каротиноидов (Car) в листьях микропобегов чая ( Camellia sinensis L.), выращенных in vitro, в зависимости от концентрации CaCl 2 и присутствия осмо-тика в питательной среде
Влияние осмотиков может вызывать стрессовую реакцию у растений, в том числе приводить к структурно-функциональной перестройке фотосинтетического аппарата и ингибированию фотосинтеза (42, 43). Определение содержания фотосинтетических пигментов в листьях микропобегов чая, выращиваемых на основной питательной среде с Са2+ , показало их наибольшие значения, которые были практически равными при обеих его концентрациях (табл. 2). Это может быть следствием структурно-функциональной перестройки фотосинтетического аппарата, а также изменения количества активных форм кислорода, чем и объясняются высокие значения ПОЛ и выхода электролитов (см. рис. 2 и 3) при длительном культивировании микропобегов на питательной среде с низкой концентраций Са2+ (440 мг/л СаCl 2 ). Этот аспект представляется нам интересным и будет изучен в дальнейшем.
При выращивании микропобегов на основной среде с разными концентрациями Са2+ количество Chla в их листьях было наибольшим, тогда как при добавлении маннита оно снижалось у всех вариантов на 35-40 % (р ≤ 0,05), то есть практически в равной степени (см. табл. 2). Аналогичная тенденция характерна и для содержания Chlb. Количество хлорофилла b было высоким в контрольном варианта (440 мг/л CaCl 2 ), при добавлении к этой среде маннита оно уменьшалось на 20 % (р ≤ 0,05). В случае совместного действия маннита и более высоких концентраций Са2+ (660 и 880 мг/л CaCl 2 ) это снижение составило 40 % относительно контроля (р ≤ 0,05). Уменьшение количества хлорофиллов в растительных тканях считается симптомом окислительного стресса и может быть результатом как деградации пигментов, так и структурной реорганизации хлоропластов (43, 44).
Пигментная система растений, помимо хлорофиллов, содержит каротиноиды, которые поглощают свет в синей области спектра, защищают фотосинтетический аппарат от фотодеструкции, а также выполняют другие защитные функции (45). Как следует из наших данных, тенденции изменения их количества были в значительной степени аналогичны таковым для хлорофиллов, особенно для Chlb (см. табл. 2). Более высокое содержание каротиноидов было характерно для листьев микропобегов чая, выращиваемых на основной среде в присутствии Са2+, при добавлении к среде осмо-тика оно снижалось, но лишь в вариантах 4 и 5 (660 и 880 мг/л CaCl2).
Выявленные изменения в содержании пигментов отражают структурно-функциональную реорганизацию фотосинтетического аппарата микропобегов чая при незначительном стрессе, вызванном действием осмотика. Возможно также, что наблюдаемые изменения произошли вследствие роста микропобегов в условиях in vitro, и они в значительной степени обусловлены степенью дифференциации клеточных структур, о чем неоднократно сообщалось (21, 23, 29).
Таким образом, выращивание микропобегов чая в условиях in vitro на питательной среде Мурасиге-Скуга, содержащей маннит (40 г/л) и 440880 мг/л CaCl 2 , вызывает изменения их физиолого-биохимических характеристик. Это проявляется в снижении оводненности (на 2 %, р ≤ 0,05), что свидетельствует о незначительном осмотическом стрессе, в накоплении в листьях свободного пролина, а также в уменьшении количества фотосинтетических пигментов (хлорофилл а, хлорофилл b, каротиноиды). При добавлении в питательную среду маннита и повышении концентрации Са2+ относительная электропроводность и количество малонового диальдегида в микропобегах уменьшается, что указывает на снижение активности липо-пероксидации в мембранах. Проведенные исследования раскрывают некоторые клеточные механизмы действия и роль экзогенного Са2+ в функционировании микропобегов чая при длительном культивировании, в том числе в условиях осмотического стресса. Полученные данные имеют важное значение для депонирования растений чая в биотехнологических коллекциях. Кроме того, они свидетельствуют о значимой роли осмолитов в сохранении и поддержании жизнеспособности растений, особенно в условиях in vitro.
Список литературы Физиолого-биохимические характеристики микропобегов чая (Camellia sinensis L.) в условиях in vitro: норма, осмотический стресс, влияние кальция
- Zhu J.K. Abiotic stress signaling and responses in plants. Cell, 2016, 167(2): 313-324 (doi: 10.1016/j.cell.2016.08.029).
- Fleta-Soriano E., Munne-Bosch S. Stress memory and the inevitable effects of drought: a physiological perspective. Frontiers in Plant Science, 2016, 7: 143 (doi: 10.3389/fpls.2016.00143).
- Marcinska I., Czyczylo-Mysza I., Skrzypek E., Filek M., Grzesiak S., Grzesiak M.T., Jan-owiak F., Hura T., Dziurka M., Dziurka K., Nowakowska A., Quarrie S.A. Impact of osmotic stress on physiological and biochemical characteristics in drought-susceptible and drought-resistant wheat genotypes. Acta Physiologiae Plantarum, 2013, 35(2): 451-461 (doi: 10.1007/s11738-012-1088-6).
- Самарина Л.С., Рындин А.В., Малюкова Л.С., Гвасалия М.В., Маляровская В.И. Физиологические и генетические механизмы ответа чайного растения Camellia sinensis (L.) Kuntze на засуху. Сельскохозяйственная биология, 2019, 54(3): 458-468 (doi: 10.15389/agrobiol-ogy.2019.3.458rus).
- Fayez K.A., Bazaid S.A. Improving drought and salinity tolerance in barley by application of salicylic acid and potassium nitrate. Journal of the Saudi Society of Agricultural Sciences, 2014, 13(1): 45-55 (doi: 10.1016/j.jssas.2013.01.001).
- Yang Y., Guo Y. Unraveling salt stress signaling in plants. Journal of Integrative Plant Biology, 2018, 60(9): 796-804 (doi: 10.1111/jipb.12689).
- Медведев С.С. Кальциевая сигнальная система растений. Физиология растений, 2005, 52(2): 282-305.
- Song W.Y., Zhang Z.B., Shao H.B., Guo X.L., Cao H.X., Zhao H.B., Fu Z.Y., Hu X.J. Relationship between calcium decoding elements and plant abiotic-stress resistance. International Journal of Biological Sciences, 2008, 4(2): 116-125 (doi: 10.7150/ijbs.4.116).
- Maritim T.K., Kamunya S.M., Mireji P., Wendia C.M., Muoki R.C., Cheruiyot E.K., Wachira F.N. Physiological and biochemical response of tea (Camellia sinensis (L.) O. Kuntze) to water-deficit stress. The Journal of Horticultural Science and Biotechnology, 2015, 90(4): 395400 (doi: 10.1080/14620316.2015.11513200. 0.4236/ajps.2012.34054).
- Hetherington A.M., Brownlee C. The generation of Ca2+ signals in plants. Annual Review of Plant Biology, 2004, 55: 401-427 (doi: 10.1146/annurev.arplant.55.031903.141624).
- Kim M.C. Calcium and calmodulin-mediated regulation of gene expression in plant. Molecular Plant, 2009, 2(1): 13-21 (doi: 10.1093/mp/ssn091).
- Saidi Y., Finka A., Muriset M., Bromberg Z., Weiss Y. G., Maathuis F.J., Goloubinoff P. The heat shock response in moss plants is regulated by specific calcium-permeable channels in the plasma membrane. Plant Cell, 2009, 21: 2829-2843 (doi: 10.1105/tpc.108.065318).
- Рихванов Е.Г., Федосеева И.В., Пятрикас Д.В., Боровский Г.Б., Войников В.К. Механизм функционирования кальциевой сигнальной системы у растений при действии теплового стресса. Роль митохондрий в этом процессе. Физиология растений, 2014, 61(2): 155-169 (doi: 10.7868/S0015330314020134).
- Shu M.Y., Fan M.Q. Effect of osmotic stress and calcium on membrane-lipid peroxidation and the activity of defense enzymes in fir seedling. Forest Research, 2000, 4: 391-396.
- Upadhyaya H., Panda S.K., Dutta B.K. CaCl2 improves post-drought recovery potential in Camellia sinensis (l) O. Kuntze. Plant Cell Reports, 2011, 30(4): 495-503 (doi: 10.1007/s00299-010-0958-x).
- Bhagat R.M., Baruah R.D., Cacigue S. Climate and tea [Camellia sinensis (L.) O. Kuntze] production with special reference to north eastern India: a review. Journal of Environmental Research and Development, 2010, 4(4): 1017-1028.
- Малюкова Л.С., Козлова Н.В., Рогожина Е.В., Струкова Д.В., Керимзаде В.В., Великий А.В. Возделывание субтропических культур на Черноморском побережье России: эколого-агрохимические аспекты. Сельскохозяйственная биология, 2014, 3: 24-31 (doi: 10.15389/agrobiology.2014.3.24rus).
- Baruah R.D., Bhagat R.M. Climate trends of Northeastern India: a longterm pragmatic analysis for tea production. Two and a Bud, 2012, 59(2): 46-49.
- Osmolovskaya N., Shumilina J., Kim A., Didio A., Grishina T., Bilova T., Frolov A. Methodology of drought stress research: experimental setup and physiological characterization. International Journal of Molecular Sciences, 2018, 19(12): 4089-4114 (doi: 10.3390/ijms19124089).
- Rai M.K., Kalia R.K., Singh R., Gangola M.P., Dhawan A.K. Developing stress tolerant plants through in vitro selection — an overview of the recent progress. Environmental and Experimental Botany, 2011, 71(1): 89-98 (doi: 10.1016/j.envexpbot.2010.10.021).
- Pérez-Clemente R.M., Gómez-Cadenas A. In vitro tissue culture, a tool for the study and breeding of plants subjected to abiotic stress conditions. In: Recent advances in plant in vitro culture /A. Leva, L.M.R. Rinaldi (eds.). IntechOpen Limited, London, 2012: 91-108 (doi: 10.5772/50671).
- Sunaina N.A., Singh N.B. PEG imposed water deficit and physiological alterations in hydroponic cabbage. Iranian Journal of Plant Physiology, 2016, 6(2): 1651-1658.
- Gelmesa D., Dechassa N., Mohammed W., Gebre E., Monneveux P., Bьndig C., Winkelmann T. In vitro screening of potato genotypes for osmotic stress tolerance. Open Agriculture, 2017, 2(1): 308-316 (doi: 10.1515/opag-2017-0035).
- Piwowarczyk B., Kami ska I., Rybi ski W. Influence of PEG generated osmotic stress on shoot regeneration and some biochemical parameters in Lathyrus culture. Czech Journal of Genetics and Plant Breeding, 2014, 50(2): 77-83 (doi: 10.17221/110/2013-cjgpb).
- Abu-Romman S., Suwwan M., Al-Shadiadeh A., Hasan H. Effects of osmotic stress on cucumber (Cucumis sativus l.) microshoots cultured on proliferation medium. World Applied Sciences Journal, 2012, 20(2): 177-181 (doi: 10.5829/idosi.wasj.2012.20.02.2817).
- Tejavathi D.H., Devaraj V.R., Murthy S.M., Nijagunaiah R., Shobha K. Effect of PEG induced osmotic stress on proline, protein and relative water content in vitro plants of Macrotyloma uni-florum (Lam.) Verdc. Acta Hortic., 2010, 865: 87-93 (doi: 10.17660/ActaHortic.2010.865.10).
- Гвасалия М.В., Самарина Л.С., Малюкова Л.С., Маляровская В.И., Рахмангулов Р.С., Конинская Н.Г., Платонова Н.Б., Пащенко О.И. Влияние маннита на рост и физиологические параметры микропобегов чая (Camellia sinensis (L) O. Kuntze) в культуре in vitro. Вестник Мичуринского государственного аграрного университета, 2019, 4(59): 49-53.
- Гвасалия М.В. Отбор на засухоустойчивость соматических клонов растений чая (Camellia sinensis (L) O. Kuntze) в культуре in vitro. Новые технологии, 2020, 3: 117-124 (doi: 10.24411/2072-0920-2020-10313).
- Гвасалия М.В. Клональное микроразмножение растений чая (Thea sinensis L.) в культуре in vitro. Садоводство и виноградарство, 2013, 4: 20-22.
- Зубова М.Ю., Николаева Т.Н., Нечаева Т.Л., Малюкова Л.С., Загоскина Н.В. О содержании пигментов, фенольных соединений и антирадикальной активности молодых побегов чая (Сamellia sinensis L.). Химия растительного сырья, 2019, 4: 249-257 (doi: 10.14258/jcprm2019046065).
- Yoshida К., Matsuo К. A simple method of evaluating the freezing resistance of tea plants (Camellia sinensis (L.) Kuntze) by measuring electrolyte leakage from low-temperature-treated overwintering buds and leaves. Chagyo Kenkyu Hokoku (Tea Research Journal), 2012, 113: 63-69 (doi: 10.5979/cha.2012.113-63).
- Цыпурская Е.В., Казанцева В.В., Фесенко А.Н., Загоскина Н.В. Рост проростков гречихи обыкновенной (Fagopyrum esculentum) и накопление первичных и вторичных метаболитов при различных условиях минерального питания. Сельскохозяйственная биология, 2019, 54(5): 946-957 (doi: 10.15389/agrobiology.2019.5.946rus).
- Шлык А. А. Определение хлорофиллов и каротиноидов в экстрактах зеленых листьев. В сб.: Биохимические методы в физиологии растений. М., 1971: 154-170.
- Tholakalabavi A., Zwiazek J.J., Thorpe T.A. Effect of mannitol and glucose-induced osmotic stress on growth, water relations, and solute composition of cell suspension cultures of poplar (Populus deltoides var. occidentalis) in relation to anthocyanin accumulation. In Vitro Cellular & Developmental Biology-Plant, 1994, 30(3): 164-170 (doi: 10.1007/bf02632208).
- Xu C., Li X., Zhang L. The effect of calcium chloride on growth, photosynthesis, and antioxidant responses of Zoysia japonica under drought conditions. PloS ONE, 2013, 8(7): e68214 (doi: 10.1371/journal.pone.0068214).
- Li Z., Tan X.F., Lu K., Liu Z.M., Wu L.L. The effect of CaCl2 on calcium content, photosynthesis, and chlorophyll fluorescence of tung tree seedlings under drought conditions. Photosyn-thetica, 2017, 55(3): 553-560 (doi: 10.1007/s11099-016-0676-x).
- Kaczmarek M., Fedorowicz-Stronska O., Glowacka K., Waskiewicz A., Sadowski J. CaCl2 treatment im-proves drought stress tolerance in barley (Hordeum vulgare L.). Acta Physiologiae Planta-rum, 2017, 39(1): 41-52 (doi: 10.1007/s11738-016-2336-y).
- Farmer E.E., Mueller M.J. ROS-mediated lipid peroxidation and RES-activated signaling. Annual Review of Plant Biology, 2013, 64: 429-450 (doi: 10.1146/annurev-arplant-050312-120132).
- Noctor G., Mhamdi A., Foyer C.H. The roles of reactive oxygen metabolism in drought: not so cut and dried. Plant Physiology, 2014, 164(4): 1636-1648 (doi: 10.1104/pp.113.233478).
- Madany M., Khalil R. Seed priming with ascorbic acid or calcium chloride mitigates the adverse effects of drought stress in sunflower (Helianthus annuus L.) seedlings. The Egyptian Journal of Experimental Biology (Botany), 2017, 13(1): 119-133 (doi: 10.5455/egyjebb.20170409090612).
- Demidchik V., Straltsova D., Medvedev S.S., Pozhvanov G.A., Sokolik A., Yurin V. Stress-induced electrolyte leakage: the role of K+-permeable channels and involvement in programmed cell death and metabolic adjustment. Journal of Experimental Botany, 2014, 65(5): 1259-1270 (doi: 10.1093/jxb/eru004).
- Hu W., Tian S.B., Di Q., Duan S.H., Dai K. Effects of exogenous calcium on mesophyll cell ultrastructure, gas exchange, and photosystem II in tobacco (Nicotiana tabacum Linn.) under drought stress. Photosynthetica, 2018, 56(4): 1204-1211 (doi: 10.1007/s11099-018-0822-8).
- Софронова В.Е., Чепалов В.А., Дымова O.B., Головко Т.К. Роль пигментной системы вечнозеленого кустарничка Ephedra monosperma в адаптации к климату Центральной Якутии. Физиология растений, 2014, 61(2): 266-274 (doi: 10.7868/s001533031401014x).
- Fathi A., Tari D.B. Effect of drought stress and its mechanism in plant. International Journal of Life Sciences, 2016, 10(1): 1-6 (doi: 10.3126/ijls.v10i1.14509).
- Sun T., Yuan H., Cao H., Yazdani M., Tadmor Y., Li L. Carotenoid metabolism in plants: the role of plastids. Molecular Plant, 2018, 11(1): 58-74 (doi: 10.1016/j.molp.2017.09.010).


