Физиолого-биохимические свойства лабораторных мутантов грибов Fusarium, резистентных к флудиоксонилу
Автор: Орина А.С., Гаврилова О.П., Гагкаева Т.Ю., Арабина Е.П., Буркин А.А., Кононенко Г.П.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Технические культуры и секвестрация
Статья в выпуске: 1 т.60, 2025 года.
Бесплатный доступ
Фузариоз зерновых культур - вредоносное заболевание, вызываемое несколькими видами грибов Fusarium . Один из наиболее распространенных патогенов - гриб Fusarium graminearum , поражение которым приводит к загрязнению зерна микотоксинами, в том числе дезоксиниваленолом (ДОН) и зеараленоном (ЗЕН), опасными для здоровья человека и животных. В последнее время все чаще в возделываемом зерне обнаруживают гриб F. proliferatum , продуцирующий фумонизины (ФУМ). Обычно при защите растений от патогенов используются фунгициды, однако они могут приводить к развитию резистентности у грибов Fusarium и изменению их свойств, что увеличивает риск снижения эффективности защитных мероприятий и, как следствие, загрязнения зерна микотоксинами. В представленной работе впервые определена чувствительность генетически охарактеризованных штаммов двух видов F. graminearum и F. proliferatum , выделенных из зерна, к флудиоксонилу (ФДО) и получены лабораторные мутанты грибов, резистентные к этому действующему веществу (д.в.). Также впервые установлены достоверные отличия лабораторных мутантов F. graminearum и F. proliferatum от исходных штаммов по скорости роста, патогенности для пшеницы и токсинопродуцирующей способности. Целью работы был сравнительный анализ физиолого-биохимических свойств коллекционных штаммов грибов Fusarium graminearum и F. pro-liferatum и полученных из них в лабораторных условиях мутантов, резистентных к ФДО. Объектами исследования стали 16 моноконидиальных штаммов грибов Fusarium различного происхождения, идентифицированных по морфологическим признакам как F. graminearum и F. proliferatum , из коллекции Всероссийского НИИ защиты растений (MFG) (ВИЗР, г. Санкт-Петербург, Россия). Для проведения экспериментов штаммы предварительно выращивали на картофельно-сахарозной агаризованной среде (КСА) при 25 °С в темноте. Для молекулярно-генетической идентификации грибов секвенировали фрагмент гена фактора элонгации трансляции EF-1a (tef). В исследовании использовали фунгицид Максим, КС («Syngenta AG», Швейцария), содержащий 25 г/л ФДО, который разводили в стерильной воде до концентрации 5 г/л д.в. Для получения мутантов исходные штаммы Fusarium последовательно культивировали на КСА, содержащем увеличивающиеся концентрации фунгицида. При определении чувствительности грибов к ФДО его концентрации в питательной среде для исходных штаммов составляли 5; 0,5; 0,05 и 0,005 мг/л, для мутантов - 250; 50; 5 и 0,5 мг/л. Из колоний штаммов, выращенных на КСА, вырезали диски диаметром 4 мм и помещали на поверхность питательной среды в центр пластиковой чашки Петри диаметром 85 мм. В контрольном варианте диск помещали на поверхность КСА без добавления фунгицида. Через 3 и 5 сут инкубации соответственно штаммов F. graminearum и F. proliferatum определяли средний диаметр колонии гриба, вычитая диаметр инокуляционного диска. Концентрацию фунгицида, приводящую к 50 % подавлению роста (полумаксимальное ингибирование; IC50) рассчитывали с помощью программы Quest Graph™ IC50 Calculator. Для оценки влияния температуры на скорость роста грибы культивировали при 25 °С и 35 °С в темноте в термостате Innova 44R («Eppendorf», Германия), измеряя диаметр колоний: для F. graminearum соответственно на 3-и и 7-е сут, для F. proliferatum - на 5-е и 7-е сут. Скорость роста определяли как отношение диаметра колонии к числу суток культивирования (мм/сут). Патогенность штаммов оценивали посредством инокуляции отрезков листьев пшеницы (Triticum aestivum L.) сорта Васса. Для изучения токсинообразования штаммы грибов выращивали на автокловированном зерне пшеницы. Количество ДОН и ЗЕН в культурах F. graminearum и ФУМ в культурах F. proliferatum определяли с помощью аттестованных коммерческих иммуноферментных тест-систем (ВНИИВСГЭ, Россия). При культивировании на КСА без фунгицида диаметр колоний исходных штаммов F. graminearum варьировал от 34 до 52 мм на 3-и сут, а исходных штаммов F. proliferatum - от 48 до 64 мм на 5-е сут. Концентрации флудиоксонила (IC50), приводящие к полумаксимальному ингибированию роста мутантов F. graminearum и F. proliferatum , оказались соответственно в 900-60000 и 6-458 раз выше значений IC50 для исходных штаммов. Два штамма F. proliferatum изначально показали высокую резистентностью к ФДО и образовывали ФУМ в количестве, которое в 6 и 22 раза превышало средний показатель для исходных штаммов этого вида. Средняя скорость роста у лабораторных мутантов F. graminearum и F. proliferatum при 25 °С составила соответственно 17,2±1,0 и 12,8±0,2 мм/сут и оказалась на 2,6 и 1,6 мм/сут больше, чем средние показатели у исходных штаммов этих видов грибов. Шесть лабораторных мутантов F. graminearum были патогенными для пшеницы, и при инокуляции на отрезках листьев появлялись некрозы длиной от 14±3 до 44±1 мм, что оказалось в среднем в 1,6 раза меньше, чем у исходных штаммов гриба, тогда как два мутанта F. graminearum не вызывали некрозы в отличие от исходных культур.
Грибы fusarium, флудиоксонил, резистентность, патогенность, микотоксины
Короткий адрес: https://sciup.org/142244146
IDR: 142244146 | УДК: 632.4.01/.08::615.015.8 | DOI: 10.15389/agrobiology.2025.1.138rus
Текст научной статьи Физиолого-биохимические свойства лабораторных мутантов грибов Fusarium, резистентных к флудиоксонилу
Фузариоз зерновых культур — одно из наиболее вредоносных и активно изучаемых грибных заболеваний, которое приводит к значительным потерям урожая зерна и снижению его качества. Среди грибов Fusarium , вызывающих это заболевание, многие виды образуют токсичные вторичные метаболиты (микотоксины), которые имеют выраженный видоспецифичный характер (1-3). К широко распространенным и агрессивным патогенам зерновых культур относится вид F. graminearum Schwabe, образующий микотоксины дезоксиниваленол (ДОН) и зеараленон (ЗЕН) (4-6). Другой вид F. proliferatum (Matsush.) Nirenberg ex Gerlach & Nirenberg, с недавнего времени также часто выявляемый в микобиоте зерна, способен продуцировать фумонизины группы В, представленные преимущественно фумонизином В 1 (ФУМ) (7-9).
Обработку фунгицидами считают наиболее эффективной и распространенной стратегией борьбы с фузариозом, однако известно, что при применении этого элемента технологии в популяциях грибов Fusarium могут появиться изоляты, резистентные к препаратам с действующими веществами из разных классов — бензимидазолов (10), стробилуринов (11), триазолов (12), а также к флудиоксонилу (ФДО) — несистемному фунгициду из класса фенилпирролов (13). Штаммы Fusarium , устойчивые к ФДО, впервые выявлены в популяциях F. oxysporum и F. sambucinum , выделенных из клубней картофеля (14), а позже обнаружены в популяциях F. graminearum (15-17) и F. pseudograminearum (18).
Свойства резистентных к ФДО штаммов Fusarium (скорость роста, чувствительность к осмотическому стрессу, интенсивность спороношения, патогенность и токсинообразование) могут существенно отличаться от свойств чувствительных штаммов того же вида в популяции, что было продемонстрировано ранее на примере F. graminearum (15, 19, 20), тогда как для гриба F. proliferatum такие исследования не проводились.
В представленной работе впервые определена чувствительность генетически охарактеризованных штаммов двух видов — F. graminearum и F. proliferatum , выделенных из зерна, к ФДО и получены лабораторные мутанты грибов, резистентные к этому действующему веществу (д.в.). Также впервые установлены достоверные отличия лабораторных мутантов F. graminearum и F. proliferatum от исходных штаммов по скорости роста, патогенности для растений пшеницы и токсинопродуцирующей способности.
Целью работы был сравнительный анализ физиолого-биохимических свойств коллекционных штаммов грибов Fusarium graminearum и F. proliferatum и полученных из них в лабораторных условиях мутантов, резистентных к флудиоксонилу.
Методика. Объектами исследования стали 16 моноконидиальных штаммов грибов Fusarium различного происхождения, предварительно идентифицированных по морфологическим признакам как F. graminearum и F. proliferatum, из коллекции лаборатории микологии и фитопатологии (MFG) Всероссийского НИИ защиты растений (ВИЗР, г. Санкт-Петербург, Россия). Для последующих экспериментов штаммы предварительно выращи- вали на картофельно-сахарозной агаризованной среде (КСА) при 25 °C в темноте.
Для молекулярно-генетической идентификации грибов из 10-50 мг мицелия, собранного с поверхностей колоний на КСА, выделяли ДНК по адаптированной методике с помощью 2 % раствора бромида цетилтриметиламмония и хлороформа. Фрагмент гена фактора элонгации трансляции EF-1a ( tef) амплифицировали с использованием праймеров EF1 (5 ‘ -ATG-GGTAAGGARGACAAGAC-3 ’ ) и EF2 (5 ‘ -GGARGTACCAGTSATCATGTT-3 ‘ ) (21). Реакцию проводили в объеме смеси 25 мкл, содержащей 20,5 мкл dH 2 O, 2,5 мкл 10х Taq ПЦР-буфер («Qiagen N.V.», Нидерланды), 0,5 мкл dNTP 10 мМ (ЗАО «Евроген», Россия), по 0,3 мкл каждого праймера в концентрации 25 мкМ (ООО «Компания Алкор Био», Россия), 0,1 ед. акт. TaqAB полимеразы (ООО «Компания Алкор Био», Россия), 1 мкл ДНК. Амплификацию осуществляли по следующему протоколу: 3 мин при 95 ° C; 15 с при 95 ° C, 15 с при 62 ° C, 1 мин при 72 ° C (35 циклов); 3 мин при 72 ° C (C1000 Touch Thermal Cycler, «Bio-Rad», CША).
Нуклеотидные последовательности амплифицированных фрагментов ДНК определяли на секвенаторе ABIPrism 3500 («Applied Biosystems, Hitachi», Япония) с использованием набора реактивов BigDye Terminator v3.1 Cycle Sequencing Kit («Applied Biosystems», CША). Консенсусные нуклеотидные последовательности выравнивали в программе Vector NTI Advance 10 («Thermo Fisher Scientific», CША) и депонировали в базу данных NCBI GenBank. Видовую принадлежность штаммов подтверждали посредством поиска наибольшего сходства среди гомологичных последовательностей репрезентативных штаммов грибов Fusarium из коллекции Northern Regional Research Laboratory (NRRL, CША) и коллекции культур CBS-KNAW (CBS, Нидерланды), представленных в базе данных NCBI GenBank.
В исследовании использовали фунгицид Максим, КC («Syngenta AG», Швейцария), содержащий 25 г/л ФДО, который разводили в стерильной воде до концентрации 5 г/л д.в., соответствующей концентрации рабочего раствора для протравливания семян с максимальной рекомендованной нормой расхода. Рабочий раствор далее последовательно 10-кратно разводили стерильной водой и вносили в KCA, охлажденный до 50 ° C. После тщательного перемешивания питательную среду разливали по 20 мл в чашки Петри диаметром 85 мм.
Для получения мутантов исходные штаммы Fusarium культивировали на КCА, содержащем 0,5 мг/л ФДО, через 7 сут отмечали наличие роста и переносили диск диаметром 4 мм, вырезанный стерильным пробочным сверлом из активно растущей части колонии, на КCА с 5 мг/л ФДО. Затем выросшую культуру вновь пересевали таким же способом на КCА с 25 мг/л ФДО. Через 7-14 сут инкубации отмечали наличие роста и повторяли пересев в тех же условиях. Лабораторные мутанты, полученные в результате пассажей на среде с возрастающей концентрацией фунгицида, проверяли на стабильность, сохраняли и далее использовали для сравнения свойств с исходными коллекционными штаммами.
При определении чувствительности грибов к ФДО его концентрации в питательной среде для исходных штаммов составляли 5; 0,5; 0,05 и 0,005 мг/л, для мутантов — 250; 50; 5 и 0,5 мг/л. Диски с культурами грибов помещали мицелием вниз на поверхность питательной среды в центр каждой чашки. В контрольном варианте диск помещали на поверхность КCА без добавления фунгицида. Через 3 и 5 сут инкубации соответственно штаммов F. graminearum и F. proliferatum определяли средний диаметр колонии гриба, вычитая диаметр инокуляционного диска. Действие фунгицида на линейный рост штамма оценивали по уменьшению диаметра колонии в каждом варианте по сравнению с контролем, выраженному в процентах. Концентрацию фунгицида, приводящую к 50 % подавлению роста (полу-максимальное ингибирование; IC50), рассчитывали с помощью программы Quest Graph™ IC50 Calculator («AAT Bioquest», США).
Для оценки влияния температуры на скорость роста из колоний исходных штаммов и мутантов, выращенных на КСА, вырезали диски диаметром 4 мм, которые помещали на поверхность КСА в центр пластиковой чашки Петри диаметром 85 мм. Культивировали при 25 ° С и 35 ° С в темноте в термостате Innova 44R («Eppendorf», Германия), измеряя диаметр колоний в двух взаимно перпендикулярных направлениях и вычитая диаметр иноку-ляционного диска: для F. graminearum соответственно на 3-и и 7-е сут, для F. proliferatum — на 5-е и 7-е сут. Скорость роста определяли как отношение диаметра колонии к числу суток культивирования (мм/сут).
Патогенность штаммов оценивали при инокуляции отрезков листьев пшеницы ( Triticum aestivum L.) сорта Васса, которую выращивали в вегетационных сосудах с почвой в течение 10 сут при искусственном освещении. Отрезки листьев длиной 5-7 см помещали в кюветы на фильтровальную бумагу, увлажненную 0,004 % водным раствором бензимидазола (22). В каждом варианте опыта использовали по 10 отрезков листьев. В центре каждого отрезка листа делали укол стерильной иглой и помещали диск диаметром 5 мм с культурой каждого штамма, располагая его мицелием вниз. В контрольном варианте на отрезки листьев раскладывали диски, вырезанные из среды КСА без культуры гриба. Кюветы накрывали стеклом, выдерживали при 20 ° С, влажности 60 % и переменном освещении в режиме свет/темнота 16 ч/8 ч в климатической камере MLR-352H («Panasonic», Япония). Через 5 сут измеряли длину образовавшегося некроза (мм) для каждого отрезка листа. Штамм считали непатогенным, если средняя длина некроза был меньше диаметра инокуляционного диска.
Для оценки токсинообразования штаммов в колбы, содержащие по 20 г зерна пшеницы сорта Васса, добавляли по 12 мл воды, стерилизовали при 1 атм. в течение 60 мин в автоклаве (MLS-3751L, «PHCBI», Япония) и инокулировали остывший субстрат двумя дисками диаметром 5 мм с культурой гриба. В качестве контроля использовали неинокулированный стерилизованный субстрат. Все образцы инкубировали в течение 2 нед при 25 ° С, ежесуточно встряхивая, после чего высушивали при 50 ° С в течение 24 ч и измельчали на лабораторной мельнице («IKA-Werke», Германия). Далее к 1 г муки добавляли 10 мл водного раствора ацетонитрила (84:16, v/v) и выдерживали 14-16 ч на шейкере S-3M («ELMI», Латвия) при 300 об/мин с 2-кратным интенсивным перемешиванием в начале и конце экстракции.
Количество ДОН и ЗЕН в культурах F. graminearum и ФУМ в культурах F. proliferatum определяли с помощью аттестованных коммерческих иммуноферментных тест-систем Дезоксиниваленол-ИФА, Зеараленон-ИФА и Фумонизин В 1 -ИФА (ВНИИВСГЭ, Россия). При 10-кратном разведении экстрактов фосфатно-солевым буферным раствором (рН 7,4) с Tween 20 предел определения ДОН, ЗЕН и ФУМ был равен 0,1 мкг/г.
Для расчета средних значений ( M) показателей и их доверительных интервалов при уровне значимости 95 % ( 1 0,05 х SEM) использовали программы Microsoft Excel 2010 и Statistica 10.0 («StatSoft, Inc.», США). В зависимости от типа распределения сравнение средних значений выборок проводили с помощью параметрического критерия Тьюки или непараметрического критерия Краскела-Уоллиса. Различия считали достоверными при p < 0,05.
Резуёьтаты . Штаммы грибов Fusarium, использованные в работе, приведены в таблице 1.
1. Штаммы грибов Fusarium , включенные в исследование
|
Штамм |
Вид |
Происхождение, год |
Растение-хозяин |
Номер последователь ности tef в GenBank |
|
MFG 58922 |
F. graminearum |
Краснодарский край, 2016 |
Ячмень |
PP449338* |
|
MFG 58954 |
F. graminearum |
Курская область, 2016 |
Пшеница |
PP449339* |
|
MFG 59151 |
F. graminearum |
Краснодарский край, 2016 |
Рис |
PP449340* |
|
MFG 59156 |
F. graminearum |
Воронежская область, 2016 |
Пшеница |
PP449341* |
|
MFG 60025 |
F. graminearum |
Алтайский край, 2016 |
Пшеница |
PP449342* |
|
MFG 60327 |
F. graminearum |
Псковская область, 2018 |
Ячмень |
PP449344* |
|
MFG 60782 |
F. graminearum |
Амурская область, 2019 |
Ячмень |
MW273166 |
|
MFG 60789 |
F. graminearum |
Амурская область, 2019 |
Пшеница |
MW273174 |
|
MFG 58471 |
F. proliferatum |
Краснодарский край, 2012 |
Пшеница |
MW811115* |
|
MFG 58589 |
F. proliferatum |
Ленинградская область, 2013 |
Овес |
MW811118* |
|
MFG 58590 |
F. proliferatum |
Приморский край, 2012 |
Овес |
MW811119* |
|
MFG 58603 |
F. proliferatum |
Липецкая область, 2014 |
Кукуруза |
MW811120* |
|
MFG 58666 |
F. proliferatum |
Нижегородская область, 2014 |
Овес |
PP449337* |
|
MFG 60308 |
F. proliferatum |
Воронежская область, 2017 |
Ячмень |
PP449343* |
|
MFG 60309 |
F. proliferatum |
Краснодарский край, 2018 |
Пшеница |
MW811125* |
|
MFG 60412 |
F. proliferatum |
Краснодарский край, 2012 |
Пшеница |
PP449345* |
Примечание. Звездочками обозначены последовательности, полученные в настоящем исследовании.
Предварительную идентификацию штаммов подтвердили при анализе последовательности фрагмента гена tef , наиболее информативного для дифференциации видов Fusarium (23). Установлено наибольшее сходство (99,51-99,85 %) последовательностей tef анализируемых штаммов F. graminearum с гомологичной последовательностью репрезентативного штамма F. gra-minearum NRRL 31084 (GenBank acc. MW233103). Последовательности tef анализируемых штаммов F. proliferatum сравнивали с гомологичными последовательностями трех штаммов этого вида — NRRL 31071 (AF291058), NRRL 32155 (FJ538242), CBS 131570 (JX118976), сходство составило 98,99100 %.
При культивировании на КСА в контроле без фунгицида диаметр колоний у исходных штаммов F. graminearum варьировал от 34 до 52 мм на 3-и сут культивирования, у исходных штаммов F. proliferatum — от 48 до 64 мм на 5-е сут (рис. 1).
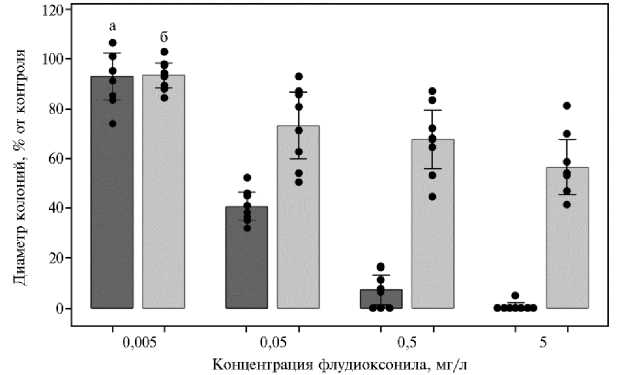
Рис. 1. Рост исходных штаммов Fusarium graminearum (а) на 3-и сут культивирования и F. proliferatum (б) на 5-е сут культивирования под влиянием флудиоксонила в различных концентрациях. Точками указаны значения для индивидуальных штаммов, отрезками — доверительные интервалы средних значений для выборки штаммов одного вида при уровне значимости 95 %, M± ( t 0,05 * SEM).
При минимальной концентрации фунгицида в среде 0,005 мг/л по- давление роста пяти штаммов F. graminearum в сравнении с контролем составляло 4-26 % (р < 0,02), а у двух штаммов MFG 58922 и 60789 наблюдали стимулирование роста на 7 % (р < 0,003). При этой же концентрации ФДО ограничение роста штаммов MFG 58590 и 58603 F. proliferatum составило 6 и 16 % в сравнении с контролем (р < 0,01), а у шести штаммов не имело статистически значимых отличий от контроля. При концентрации ФДО 5 мг/л только один штамм F. graminearum MFG 60782 образовал колонию небольшого диаметра (2,5±0,3 мм), тогда как рост остальных штаммов этого вида был полностью подавлен. В тех же условиях все штаммы F. proliferatum были способны к росту, подавление которого составило 19-58 % (р < 0,01). Два штамма F. proliferatum MFG 58471 и MFG 58590 продемонстрировали низкую чувствительность к ФДО — подавление их роста при наибольшей концентрации вещества не превышало 30 % (р < 0,01). Очевидно, эти штаммы изначально обладали резистентностью к ФДО, поэтому дальнейшего индуцирования их резистентности к этому действующему веществу не проводили.
При поэтапном культивировании исходных штаммов F. graminearum и F. proliferatum на среде с возрастающей концентраций ФДО были получены лабораторные мутанты, которые на 7-е сут культивирования на питательной среде КСА, содержащей 25 мг/л ФДО, формировали колонии диаметром более 50 мм. У мутантов отмечали нетипичное очертание колоний с появлением более активно растущих секторов из отдельных гиф. После субкультивирования в течение ряда пассажей и хранения при 4 ° C на КСА без добавок на протяжении нескольких месяцев у мутантов сохранялся исходный уровень резистентности.
При культивировании на КСА диаметр колоний мутантов F. graminearum варьировал от 39 до 63 мм на 3-и сут, а у мутантов F. proliferatum составил 54-68 мм на 5-е сут (рис. 2).
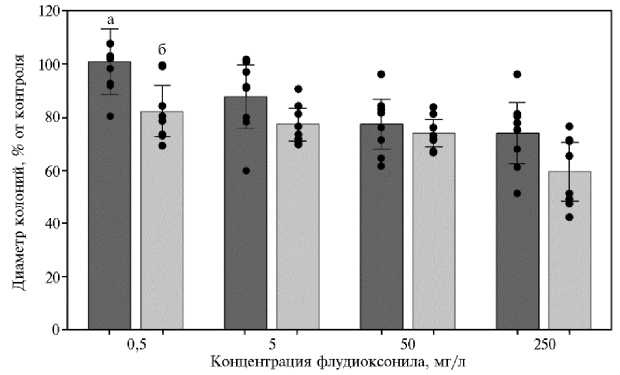
Рис. 2. Рост лабораторных мутантов Fusarium graminearum (а) на 3-и сут культивирования и F. proliferatum (б) на 5-е сут культивирования под влиянием флудиоксонила в различных концентрациях. Точками указаны значения для индивидуальных штаммов, отрезками — доверительные интервалы средних значений для выборки штаммов одного вида при уровне значимости 95 %, M± ( 1 0,05 х SEM).
При концентрации ФДО 5 мг/л рост шести исходных штаммов F. graminearum был подавлен на 3-40 % (р < 0,03) в сравнении с контролем, а два штамма оказались толерантными к такой концентрации действующего вещества. При той же концентрации действующего вещества ингибирование роста мутантов F. proliferatum происходило на 9-30 % (р < 0,009). При максимальной концентрации действующего вещества в среде (250 мг/л) подавление роста мутантов у F. graminearum составило 4-49 % (р < 0,001), у F. proliferatum - 24-58 % (р < 0,0002).
Концентрация ФДО, приводящая к полумаксимальному ингибированию роста, для исходных штаммов F. graminearum варьировала от 1,6 до 5,5 мг/л, для их мутантов — от 4000 до 199000 мг/л (табл. 2).
2. Концентрации флудиоксонила, вызывающие полумаксимальное ингибирование роста исходных штаммов и лабораторных мутантов Fusarium
|
Штамм |
Вид |
IC 50 , мг/л |
|
|
исходный штамм |
мутант |
||
|
MFG 58922 |
F. graminearum |
4,7 |
66000 |
|
MFG 58954 |
F. graminearum |
3,3 |
199000 |
|
MFG 59151 |
F. graminearum |
4,7 |
4200 |
|
MFG 59156 |
F. graminearum |
2,8 |
52000 |
|
MFG 60025 |
F. graminearum |
4,1 |
36000 |
|
MFG 60327 |
F. graminearum |
4,0 |
148000 |
|
MFG 60782 |
F. graminearum |
1,6 |
24000 |
|
MFG 60789 |
F. graminearum |
5,5 |
62000 |
|
Среднее, M± ( t 0,05 х |
SEM) |
3,8±0,4 |
74000±23000 |
|
MFG 58471 |
F. proliferatum |
20000 |
- |
|
MFG 58589 |
F. proliferatum |
345 |
156000 |
|
MFG 58590 |
F. proliferatum |
34000 |
- |
|
MFG 58603 |
F. proliferatum |
2100 |
102000 |
|
MFG 58666 |
F. proliferatum |
5700 |
36000 |
|
MFG 60308 |
F. proliferatum |
75 |
34000 |
|
MFG 60309 |
F. proliferatum |
721 |
30000 |
|
MFG 60412 |
F. proliferatum |
650 |
49000 |
|
Среднее, M± ( t 0,05 х |
SEM) |
1600±700а |
57000±16000 |
Примечание. Прочерки означают, что у штаммов MFG 58471 и MFG 58590, исходно резистентных к флудиоксонилу (ФДО), мутантов не получали; а — без учета IC 50 ФДО для штаммов MFG 58471 и MFG
В среднем IC 50 ФДО для исходных штаммов и мутантов F. graminearum достоверно различались в 18500 раз (р = 0,008). У шести исходных штаммов F. proliferatum и полученных из них лабораторных мутантов интервалы варьирования IC 50 ФДО составили соответственно 75-5650 и 30000156000 мг/л. В среднем IC 50 ФДО у мутантов F. proliferatum оказалась в 36 раз выше (р = 0,002), чем среднее значение этого показателя для исходных штаммов и в ~ 2 раза выше, чем для двух штаммов F. proliferatum MFG 58471 и 58590, изначально резистентных к ФДО.
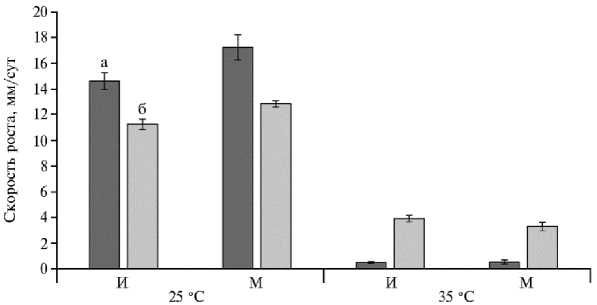
Рис. 3. Скорость роста исходных штаммов (И) и лабораторных мутантов (М) Fusarium graminearum (а) и F. proliferatum (б) при 25 и 35 ° С. Отрезками указаны доверительные интервалы средних значений для выборки штаммов одного вида при уровне значимости 95 %, M± ( t 0,05 х SEM).
При 25 ° C скорость роста исходных штаммов F. graminearum (от 11,4
до 17,3 мм/сут) в среднем была в 1,3 раза выше, чем у F. proliferatum (от 9,6 до 12,9 мм/сут), тогда как при 35 ° C культуры F. proliferatum росли в 7,5 раза активнее, чем F. graminearum (рис. 3).
У шести мутантов F. graminearum при 25 ° C скорость роста увеличилась на 0,6-7,4 мм/сут в сравнении с исходными штаммами, тогда как у MFG 59151 и MFG 60025 оказалась ниже на 0,7 и 3,8 мм/сут. В тех же условиях скорость роста лабораторных мутантов F. proliferatum была больше на 0,3-3,1 мм/сут, чем у исходных штаммов этого вида.
Средние показатели скорости роста мутантов F. graminearum и F. proliferatum (17,2±1,0 и 12,8±0,2 мм/сут) статистически значимо (р = 0,045 и р = 0,02) превышали рассчитанные для исходных штаммов (14,6±0,7 и 11,2±0,4 мм/сут). При 35 ° C достоверных различий по средней скорости роста у исходных штаммов и мутантов F. graminearum и F. proliferatum мы не выявили.
При инокуляции отрезков листьев пшеницы все исходные штаммы F. graminearum были патогенными и вызывали некрозы длиной от 22±2 до 45±1 мм (рис. 4). В среднем агрессивность мутантов F. graminearum оказалась в 1,6 раза ниже (р = 0,03), чем у исходных штаммов. Два мутанта — MFG 60025 и MFG 60782, в отличие от исходных культур, не вызывали появления некрозов, тогда как остальные шесть приводили к их образованию (длина от 14±3 до 44±1 мм). При этом у двух мутантов агрессивность была сопоставима с исходными штаммами, у четырех — снижалась в 1,52,6 раза. Все проанализированные коллекционные штаммы F. proliferatum , а также полученные из них резистентные к ФДО мутанты оказались непатогенными в условиях эксперимента.
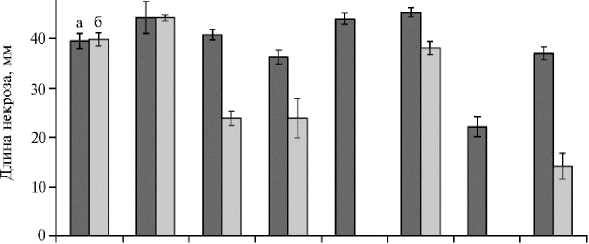
58922 58954 59151 59156 60025 60327 60782 60789
MFG Fusarium graminearum
Рис. 4. Патогенность исходных штаммов (а) и лабораторных мутантов (б) Fusarium graminearum в отношении листьев пшеницы ( Triticum aestivum L.) сорта Васса (5 сут, 20 ° С). Отрезками указаны доверительные интервалы средних значений для выборки штаммов одного вида при уровне значимости 95 %, M± ( 1 0,05 х SEM) ( n = 10).
3. Токсинопродуцирующая способность исходных штаммов и лабораторных мутантов Fusarium graminearum (зерно пшеницы сорта Васса, 25 ° C, 14 сут в темноте)
|
Штамм |
Дезоксиниваленол, мкг/г |
Зеараленон, мкг/г |
||
|
исходный штамм |
мутант |
исходный штамм | |
мутант |
|
|
MFG 58922 |
20 |
0,5 |
631 |
52 |
|
MFG 58954 |
0,2 |
0,2 |
36 |
0,3 |
|
MFG 59151 |
52 |
1,6 |
45 |
0,8 |
|
MFG 59156 |
0,8 |
1,0 |
5 |
0,4 |
|
MFG 60025 |
0,3 |
< LOQ |
39 |
1,0 |
|
MFG 60327 |
133 |
0,2 |
82 |
0,4 |
Ïðîäîëæåíèå òàáëèöû 3 MFG 60782 2,6 3,2 40 1,7
MFG 60789 9,6 1,9 75 1,1
Среднее, M± ( ®,05 x SEM) 27±16 1,1±0,4 119±72 7,2±6,3
Примечание. < LOQ означает количество микотоксина ниже предела обнаружения.
Все исходные штаммы F. graminearum продуцировали ДОН и ЗЕН in vitro (табл. 3). Средние количества микотоксинов, выявленные у мутантов F. graminearum , были ниже соответственно в 25 (р = 0,09) и 16 (р = 0,005) раз, чем у исходных штаммов. Резкое снижение способности продуцировать ДОН, вплоть до полного прекращения его синтеза, наблюдалось у большинства (62,5 %) мутантов F. graminearum , тогда как у остальных не было отличий от исходных штаммов. У всех мутантов F. graminearum способность продуцировать ЗЕН была выражена в 12-205 раз меньше, чем у исходных культур.
Все штаммы F. proliferatum продуцировали ФУМ, количества которого также существенно варьировали (табл. 4). Четыре мутанта F. proliferatum образовывали в 2-25 раз больше этого микотоксина, а два — в 2,0-2,2 раза меньше, чем исходные штаммы. В среднем мутанты F. proliferatum продуцировали в 4 раза больше ФУМ (р = 0,02), чем исходные культуры. Штаммы F. proliferatum MFG 58471 и 58590 с изначально высокой резистентностью к ФДО образовывали ФУМ в 6 и 22 раза выше среднего показателя для шести исходных чувствительных штаммов, а также в 1,4 и 5,4 раза — для мутантов, полученных в лабораторных условиях.
4. Токсинопродуцирующая способность исходных штаммов и лабораторных мутантов Fusarium proliferatum (зерно пшеницы сорта Васса, 25 ° С, 14 сут в темноте)
|
Штамм |
Фумонизин В 1 , мкг/г |
|
|
исходный штамм |
мутант |
|
|
MFG 58471 |
1259 |
- |
|
MFG 58589 |
327 |
164 |
|
MFG 58590 |
4842 |
- |
|
MFG 58603 |
531 |
245 |
|
MFG 58666 |
160 |
1622 |
|
MFG 60308 |
81 |
148 |
|
MFG 60309 |
48 |
1216 |
|
MFG 60412 |
164 |
2000 |
|
Среднее, М± ( / 0,05 x SEM) |
219±63 |
900±284a |
Примечание. Прочерки означают, что у штаммов MFG 58471 и MFG 58590, исходно резистентных к флудиоксонилу (ФДО), мутантов не получали; а — без учета штаммов MFG 58471 и MFG 58590.
Выбранные для исследования коллекционные штаммы F. graminearum и F. proliferatum были выделены из образцов различных зерновых культур и идентифицированы с помощью молекулярно-генетических методов. Коллекционные штаммы F. proliferatum оказались в среднем в 421 раз менее чувствительны к ФДО, чем штаммы F. graminearum. Ранее уже сообщалось о межвидовых различиях по чувствительности грибов Fusarium к этому фунгициду (24-26), в том числе было показано, что штаммы F. proliferatum , выделенные из кукурузы, менее чувствительны к ФДО (при концентрации д.в. 0,5 мг/л подавление роста грибов на 3-и сут составило 4-33 %), чем F. graminearum (подавление роста достигало 100 %) (26).
Поэтапное культивирование штаммов двух видов Fusarium на питательной агаризованной среде с последовательным повышением содержания ФДО привело к получению мутантов с устойчивым признаком резистентности. Неоднородный характер роста колоний у мутантов, который выражался в появлении активно растущих секторов воздушного мицелия из гиф, преодолевших прессинг фунгицида, уже отмечали для некоторых штаммов
Fusarium spp. после культивирования на средах с добавлением ФДО, как и факт сохранения этого нового признака при пересевах на среду с тем же фунгицидом (26, 27).
Мутанты F. graminearum достоверно отличались от исходных штаммов по ряду свойств: средняя скорость их роста на КСА без фунгицида при 25 ° С была выше, тогда как агрессивность в отношении листьев пшеницы и количество продуцируемых микотоксинов ДОН и ЗЕН — значительно ниже. Выявленное нами увеличение скорости роста с приобретением резистентности к ФДО у штаммов F. graminearum отличается от описанных ранее наблюдений, в которых резистентные к ФДО мутанты демонстрировали снижение скорости роста по сравнению с чувствительными изолятами (17, 19). Температура 35 ° С оказалась неблагоприятной для роста исходных штаммов и мутантов F. graminearum , который был одинаково слабым без статистически значимых различий по средним показателям. Многие авторы также отмечали у резистентных изолятов F. graminearum снижение способности поражать листья, колосья, проростки пшеницы и плоды томата, а также пониженную способность продуцировать ДОН (15-17). Известно, что ДОН служит фактором патогенности у F. graminearum и способствует инфицированию зерновых культур (28, 29), снижение его продуцирования приводит к потере агрессивности патогена при взаимодействии с растением.
В нашем исследовании впервые получены лабораторные мутанты F. proliferatum , резистентные к ФДО, а также проанализированы их свойства в сравнении с исходными штаммами этого вида и природными мутантами — штаммами MFG 58471 и 58590, изначально обладающими резистентностью к этому действующему веществу. Как и в случае с F. graminearum , мутанты F. proliferatum при 25 ° С росли быстрее, чем исходные штаммы. При повышении температуры до 35 ° С скорость роста у исходных штаммов и мутантов F. proliferatum была одинаковой. Следовательно, при повышении температуры в период вегетации встречаемость F. proliferatum в микобиоте зерновых культур будет возрастать, но в то же время при высокой температуре (30-35 ° С) продуцирование ФУМ снижается (30, 31).
Известно, что количества продуцируемого ФУМ зависят от множества факторов, таких как температура, влажность, освещенность, субстрат. Оптимальная температура для роста гриба не всегда совпадает с температурой, при которой гриб продуцирует наибольшее количество микотоксинов. Ранее выявлено, что максимальная скорость роста трех штаммов F. proliferatum , выделенных из зерна пшеницы, наблюдалась при 25 ° C, а два из них продуцировали максимальные количества ФУМ при более низкой температуре — 15 ° C (32). Предположительно, зерно пшеницы служит менее благоприятным субстратом для продуцирования ФУМ грибами, чем зерно кукурузы (33, 34).
Как исходные штаммы, так и мутанты F. proliferatum не вызывали появления некрозов на отрезках листьев пшеницы в лабораторном тесте, что подтверждает слабую агрессивность этого гриба в отношении зерновых культур (35-37). Важным результатом стало отмеченное значительное увеличение количества синтезируемого ФУМ у большинства лабораторно индуцированных мутантов по сравнению с исходными штаммами, а также значительное продуцирование микотоксина двумя природными резистентными мутантами. Роль ФУМ, в частности фумонизина B1, как фактора патогенности грибов до сих пор остается спорной, что, вероятно, связано с конкретными взаимоотношениями, возникающими между различными растениями-хозяевами и продуцентами этих микотоксинов (9, 38, 39). Многочисленные исследования демонстрируют отсутствие связи между способно- стью грибов Fusarium продуцировать ФУМ и их патогенностью в отношении кукурузы и других культур (40-42). Однако, согласно некоторым публикациям, фумонизин B1 способствует подавлению иммунных реакций растения-хозяина за счет ингибирования синтеза церамидов, что приводит к запрограммированной гибели клеток (29, 43).
Неоднородность окружающей среды приводит к сосуществованию в популяциях грибов штаммов, характеризующихся различной чувствительностью к фунгицидам (44). Наряду с глобальными природными процессами, обусловленными изменением климата, агробиоценоз подвергается всем видам воздействия, которые связаны с деятельностью человека, направленной на получение высоких урожаев. Применение фунгицидов может приводить к сдвигу в базовой чувствительности к их действующему веществу у представителей биоты. Распространение резистентности к фунгицидам в популяциях грибов во многом зависит от изменений их адаптационных свойств и динамики конкуренции между устойчивыми и чувствительными штаммами.
В России научное обеспечение защиты зерновых культур от заболеваний, вызванных патогенными микроорганизмами, успешно развивается и остается в числе приоритетных направлений поиска (45). Гетерогенный характер влияния фунгицидных обработок на токсиногенез F. graminearum, а также способность триазолов стимулировать образование ДОН ранее были установлены в серии лабораторных экспериментов (46, 47). Однако системный комплексный подход к изучению многих важных аспектов формирования резистентности популяций пока не реализован. При планировании будущих проектов, несомненно, следует учитывать все многообразие разнонаправленных динамических процессов, приводящих к изменениям адаптационных свойств фитопатогенов, а также особенностей конкурентных отношений между устойчивыми и чувствительными штаммами.
Таким образом, мы определили базовую чувствительность генетически охарактеризованных штаммов двух видов Fusarium graminearum и F. proliferatum , выделенных из зерновых культур на территории России, к фунгициду, содержащему флудиоксонил. Получены лабораторные мутанты грибов F. graminearum и (впервые в мире) F. proliferatum , резистентные к этому действующему веществу, изучены их свойства в сравнении с исходными коллекционными штаммами. Показано, что концентрации флудиок-сонила IC 50 , приводящие к полумаксимальному ингибированию роста мутантов F. graminearum и F. proliferatum , соответственно в 900-60000 и 6-458 раз выше значений для исходных штаммов. Скорость роста лабораторных мутантов F. graminearum и F. proliferatum при 25 ° С выше на 2,6 и 1,6 мм/сут в сравнении со средними показателями исходных культур. При 35 ° С достоверных различий по средней скорости роста у исходных штаммов и мутантов обоих видов грибов не выявлено. Шесть лабораторных мутантов F. graminearum были патогенными для пшеницы, однако вызываемые ими некрозы на отрезках листьев оказались в 1,6 раза меньше, чем в случае исходных штаммов гриба, тогда как два мутанта F. graminearum утратили патогенность. Все лабораторные мутанты F. proliferatum , как и исходные штаммы, оказались неспособны инфицировать листья пшеницы в условиях эксперимента. Средние количества ДОН и ЗЕН, продуцируемые мутантами F. graminearum , были соответственно в 25 и 16 раз ниже, чем у исходных штаммов гриба. При этом мутанты F. proliferatum в среднем синтезировали в 4 раза больше ФУМ, чем исходные штаммы. Полученные нами результаты показывают, что у разных видов Fusarium приобретение резистентности к одному и тому же химическому препарату неодинаково влияет на метаболизм грибов, что
îòðàæàåòñÿ â èçìåíåíèè èõ ñâîéñòâ.
ËÈÒÅÐÀÒÓÐÀ
1 ФГБНУ Всероссийский НИИ защиты растений,
Поступила в редакцию 13 июля 2024 года Принята к публикации 19 августа 2024 года
Sel’skokhozyaistvennaya biologiya [ Agricultural Biology ], 2025, V. 60, № 1, pp. 138-152
PHYSIOLOGICAL AND BIOCHEMICAL CHARACTERS OF LABORATORY INDUCED Fusarium MUTANTS RESISTANT TO FLUDIOXONIL
A.S. Orina1 8 , O.P. Gavrilova1, T.Yu. Gagkaeva1, E.P. Arabina1, A.A. Burkin2, G.P. Kononenko2
-
1Al l-Russian Institute of Plant Protection , 3, sh. Podbel’skogo, St. Petersburg, 196608 Russia, e-mail orina-alex@yandex.ru ( И corresponding author), olgavrilova1@yandex.ru , t.gagkaeva@mail.ru , arabina2001@gmail.com ;
-
2Al l-Russian Research Institute of Veterinary Sanitation, Hygiene, and Ecology — Branch of FSC ARRIEV RAS, 5, Zvenigorodskoe sh., Moscow, 123022 Russia, e-mail aaburkin@mail.ru , kononenkogp@mail.ru
The authors declare no conflict of interests
Final revision received July 13, 2024
Accepted August 19, 2024


