Флуоресценция 9-аминоакридина в препаративных суспензиях грибов Aspergillus и Penicillium
Автор: Варехов Алексей Григорьевич
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение физико-химической биологии
Статья в выпуске: 3 т.25, 2015 года.
Бесплатный доступ
В статье приводятся результаты экспериментальных исследований флуоресценции 9-аминоакридина в водных суспензиях, содержащих диспергированный мицелий и споры грибов-биодеструкторов рода Aspergillus и Penicillium. Показано, что кроме характерного для аминопроизводных акридина тушения флуоресценции в основном максимуме (460 нм для 9-аминоакридина) имеет место появление длинноволновой флуоресценции (около700 нм). Предложена модельная схема, объясняющая генерацию длинноволновой флуоресценции как результат димеризации молекул красителя на полисахаридной матрице грибного мицелия. Предложено использовать измерение уровня длинноволновой флуоресценции как инструментальный метод контроля развития грибов на различных материалах.
9-аминоакридин, плесневые грибы, длинноволновая флуоресценция, измерение
Короткий адрес: https://sciup.org/14264991
IDR: 14264991 | УДК: 577.352;
Текст научной статьи Флуоресценция 9-аминоакридина в препаративных суспензиях грибов Aspergillus и Penicillium
Плесневые грибы как составная часть природной среды, во многом определяющая ее микробиологический статус, стали интересны в связи с проблемой биостойкости различных материалов [1, 2] Способность микроскопических грибов к биодеградации материалов определяет высокий уровень эмиссии этих микроорганизмов [3, 4]. Грибы имеют мощные гликолитические системы и при недостатке питательных веществ образуют клеточные компоненты за счет ассимиляции питательного субстрата и его полного окисления без заметного накопления промежуточных продуктов обмена. В других условиях они сами образуют и выделяют в окружающую среду разнообразные вещества, например многие органические кислоты, а также и такие высокотоксичные соединения, как продуцируемый колониями Aspergillus flavus гепатоканцероген афлатоксин B1. Общеизвестна устойчивость грибов и их выживание в безводной среде, при высокой концентрации солей и в широком диапазоне кислотности (до pH 2.0).
Большинство грибов-биодеструкторов представлено родами Aspergillus и Penicillium . Наиболее часто агрессивные грибы представлены штаммами Aspergillus niger .
Флуоресцентные исследования препаратов грибов традиционно связаны с люминесцентной микроскопией. Лишь в немногих случаях исследована собственная флуоресценция белковых молекулярных компонентов грибов, например рибонуклеаз С2 из Aspergillus clavatus и Т1 из Aspergillus oryzae [5]. Еще реже в исследованиях грибов, и в частности их мембранных структур, используется флуоресцентное зондирование, несмотря на то что применение флуоресцирующих красителей, нековалентно связанных с мембранными структурами, уже давно стало одним из наиболее признанных методов исследований.
Относительно широкое использование аминопроизводных акридина в исследованиях, связанных с биоэнергетикой, началось с работы Краай-енхофа [6], показавшего на суспензиях хлоропластов связь между тушением флуоресценции диамино-акридина атебрина (3-хлор-9-(4-диэтил-амино-1-метилбутил)-7-метоксиакридина) и уровнем электронного транспорта, гидролиза АТФ и трансмембранного градиента pH.
В этой статье показана возможность использования флуоресценции аминопроизводных акридина, и в частности 9-аминоакридина для изучения структуры поверхности мицелия, клеточной периферии грибов в целом, а также выживания и развития грибов в различных условиях.
ПОСТАНОВКА ЗАДАЧИ
В статье представлены результаты исследований спектров флуоресценции 9-аминоакридина в суспензиях мицелия и спор грибов Aspergillus и Penicillium. Частичное или полное тушение флуоресценции аминоакридинов (акридиновый оранжевый, атебрин, 9-аминоакридин, 1-ацета-мидоакридин и др.) традиционно используется для анализа трансмембранного градиента pH [7]. В наших экспериментах показано, что при некоторых условиях имеет место не только тушение флуоресценции с длиной волны около 500 нм, но также перенос излучения флуоресценции далеко к границе инфракрасной области (около 700 нм). В некоторых случаях, в особенности в суспензиях A. niger, квантовый выход такой длинноволновой флуоресценции может быть очень велик. Наличие длинноволновой флуоресценции интересно не только для изучения структуры поверхности мицелия грибов и других особенностей, но и как важное инструментальное преимущество. Хорошо известно, что большинство подложек, используемых как аналитические фильтры для сбора спор грибов из воздуха или с твердых поверхностей с целью последующего выращивания на них грибов, флуоресцируют в желто-зеленой части спектра. Таким образом, измерение длинноволновой флуоресценции может быть совмещено с практикой отбора проб.
Детали связывания акридинов с мембранами почти неизвестны. Точно так же неизвестен механизм тушения флуоресценции, как и то, что именно следует рассматривать в качестве тушителя. Известны результаты модельных экспериментов, в которых в качестве тушителей флуоресценции 9-аминоакридина использовались такие флуорофоры, как фенантрен (Phen), пирен (Py) и перилен (Pe), нанесенные на поверхность диоксида кремния (коллоидного (аэросил) или кристаллического) [8]. В другом исследовании [9] тушителями флуоресценции 9-аминоакридина были растительный гликолипид дигалактозилдиацилглицерид и фосфатидиловая кислота. Изучалось также тушение флуоресценции пирена в абиогенных ионных мицеллярных системах [10]. Остаются неясными многие принципиальные вопросы, касающиеся механизмов связывания красителя с мембранами биологических частиц. Таким образом, поставленная задача сводится также к исследованию механизмов связывания флуоресцентных индикаторов с поверхностью биологического субстрата, в частности мицелия плесневых грибов. При этом процесс связывания может сопровождаться не только тушением флуоресценции, но и переизлучением в длинноволновой части спектра.
МЕТОДИКА И РЕЗУЛЬТАТЫ
Доминантные формы грибов-биодеструкторов, первоначально растущих в естественных условиях на неметаллических подложках (пластики, резины, теплоизоляционные материалы и др.), выращивались далее на твердом агаре Чапека—Докса или в жидкой питательной среде Виноградского. Собранная биомасса озвучивалась в течение 1–2 мин с 10 мл дистиллированной воды. Для озвучивания использовался дезинтегратор марки MSE (DaweInstr., England) с частотой 22 кГц и мощно- стью до 50 Вт. Микроскопия озвученного материала показывала споры и нитевидные фрагменты мицелия. Дальнейшее центрифугирование давало не очень плотный осадок, который затем ресус-пендировался в дистиллированной воде при концентрации 10 мкг/мл. Предварительные эксперименты показали, что связывание 9-аминоакридина с суспендированным мицелием увеличивалось с течением времени очень медленно (5–6 дней). Для ускорения процесса связывания использовали термическую обработку суспензии с целью денатурации мембранного материала частиц. Такие действия были аналогичны тем, которые использовал Краайенхоф [6] при работе с термически денатурированными хлоропластами.
В экспериментах использовался спектрально чистый 9-аминоакридин в концентрации около 1.7 мкМ. Молекула 9-аминоакридина содержит два атома азота, один из которых (азот пиридинового кольца ) имеет значение константы диссоциации pK 1 9.99, т. е. значительно более высокое, чем объемное значение pH, а второй (азот аминогруппы) pK 2 < –2, т. е. гораздо меньшее, чем объемное значение pH, и тем более меньшее, чем цитоплазматическое значение pH. Таким образом, в интервале pH от 6 до 9 почти все молекулы 9-аминоакридина протонированы, т. е. несут положительный заряд. Вода стабилизирует флуоресцирующие конформеры аминоакридинов с достаточно высоким квантовым выходом (около 0.04 для атебрина [7]).
Флуоресценция измерялась с помощью флуориметра на основе двух кварцевых монохроматоров. Возбуждающий свет получали от ртутной лампы высокого давления мощностью 100 Вт при длине волны 365 нм. Для измерения спектров флуоресценции использовался фотоэлектронный умножитель, тщательно скомпенсированный по темновому току.
Ниже приводятся некоторые экспериментальные результаты по исследованиям флуоресценции грибов.
На рис. 1 показаны нормированные спектры флуоресценции 9-аминоакридина в суспензиях двух штаммов грибов A. niger (условные обозначения А и Б), выделенных из материалов, подвергшихся биодеструкции. В обоих случаях ясно выражены длинноволновые пики флуоресценции.
На рис. 2 для сравнения показаны спектры флуоресценции 9-аминоакридина в суспензиях A. niger и A. terreus . Абсолютный максимум флуоресценции (уровень 1.0) A. terreus при длине волны λ = 461 нм, равный 3.2 мВ, был приблизительно в 2 раза больше, чем тот же уровень (1.0) при длине волны λ = 687 нм для A. niger (соответственно 1.6 мВ). Следовательно, абсолютные уровни длинноволновой флуоресценции A. niger
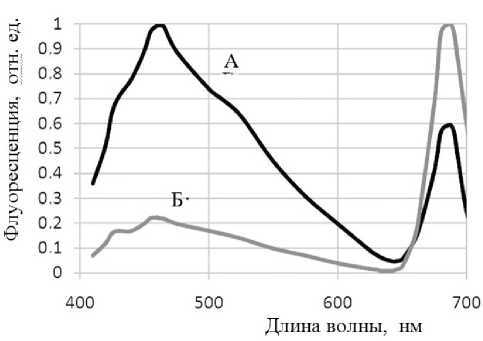
Рис. 1. Нормированные спектры флуоресценции 9-аминоакридина в суспензиях двух штаммов грибов Aspergillus niger (условные обозначения А и Б)
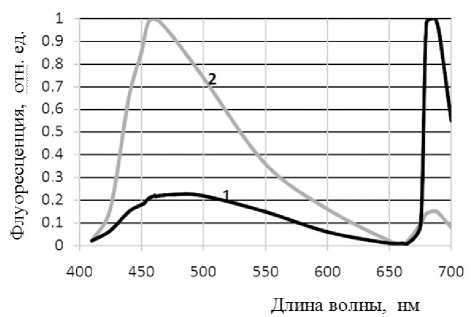
Рис. 2. Спектры флуоресценции 9-аминоакридина в суспензиях A. niger (1) и A. terreus (2).
Условия: концентрация 9-аминоакридина 1.7 мкМ; массовая концентрация частиц 10 мкг на миллилитр суспензии; главный максимум — 461 нм; длинноволновый максимум — 687 нм; возбуждение при 365 нм; абсолютный уровень сигнала флуоресценции, соответствующий максимуму (1.0), равен 1.6 мВ для A. niger и 3.2 мВ для A. terreus и A. terreus при длине волны λ = 687 нм относились приблизительно как 3:1.
Для выделения связанной части 9-амино-акридина и ее длинноволновой флуоресценции производилось повторное центрифугирование суспензии A. niger с последующим ресуспендированием осадка в дистиллированной воде. При этом подавлялась флуоресценция в области 400–530 нм и значительно повышался нормированный уровень длинноволновой флуоресценции. Еще больший эффект достигался после фильтрации суспензии через стеклянный фильтр, что приводило к почти 100 %-му отделению водной (несвязанной) части 9-аминоакридина.
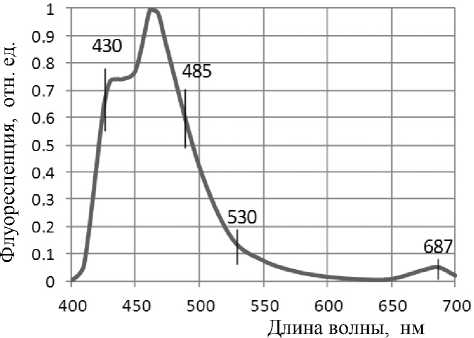
Рис. 3. Флуоресценция 9-аминоакридина в суспензиях грибов A. ustus , A. sydowii , A. thomii , A. versicolor , A. puniceus .
Условия те же, что и для рис. 2; абсолютный уровень сигнала располагался для этой видовой последовательности в интервале 1.0–0.16 мВ
Общие изменения в спектре флуоресценции 9-аминоакридина в суспензиях A. niger сводятся к следующим признакам: уменьшается флуоресценция в области 400–530 нм; увеличивается полуширина максимума в этой области; возрастает уровень длинноволновой флуоресценции.
В специальной серии экспериментов исследовалась флуоресценция грибов A. niger в зависимости от возраста исходной культуры гриба. Для этого измерялась флуоресценция суточной и двухсуточной культур, прорастающих спор и зрелых спор. В частности, было отмечено, что уровень флуоресценции препаратов на основе суточной и двухсуточной культур A. niger и его прорастающих спор был значительно ниже по сравнению с флуоресценцией препаратов из зрелых (музейных) спор.
На рис. 3 показан усредненный спектр флуоресценции грибов A. ustus , A. sydowii , A. thomii , A. versicolor и A. puniceus . Абсолютное значение среднего по всем видам грибов уровня длинноволновой флуоресценции составляло приблизительно 0.6 мВ, т. е. примерно в 5 раз меньше, чем для A. terreus.
Длинноволновая флуоресценция грибов рода Penicillium была еще меньше и слабо детектировалась на фоне собственных шумов фотоэлектронного умножителя. Однако, как уже отмечалось, даже в тех случаях, когда длинноволновая флуоресценция была выражена очень слабо, наблюдалось тушение флуоресценции, т. е. во-первых, уменьшалась флуоресценция в основном максимуме и, во-вторых, деформировался спектр в этой области.
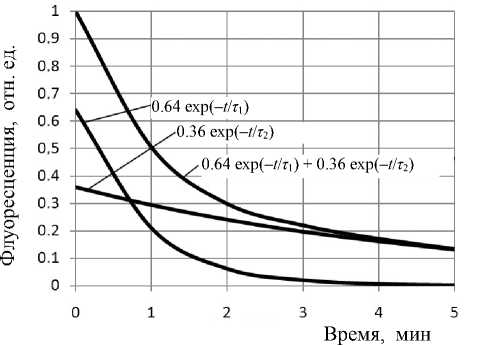
Рис. 5. Кинетика связывания 9-аминоакридина
Нормализ. амплитуда главн. макс.
Полуширина главн. макс., нм
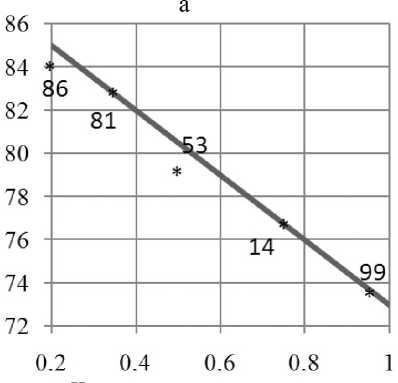
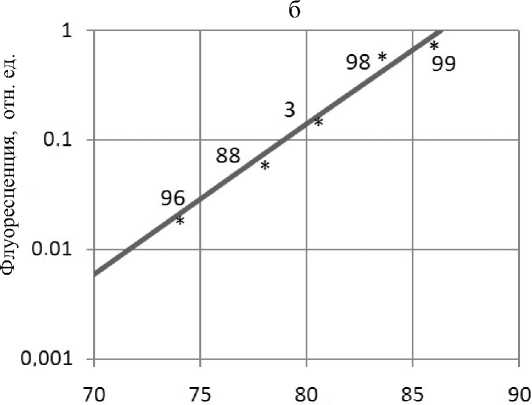
Рис. 4. . Спектральное разрешение для пяти неидентифицированных штаммов Penicillium (а) и пяти неидентифи-цированных штаммов A. niger (б).
Числа на диаграммах — условные обозначения штаммов. Пояснения в тексте
На рис. 4, а, показаны результаты анализа спектров пяти неидентифицированных штаммов Penicillium. Хотя для всех этих штаммов длинноволновая флуоресценция уверенно не детектировалась, в координатах "интенсивность—полуширина главного максимума" они были достаточно хорошо разрешены. На рис. 4, б, показан еще один пример хорошего разрешения пяти неиден-тифицированных штаммов A. niger в координатах "(F687 / F430)—полуширина основного максимума", где (F687 / F430) — относительный уровень длинноволновой флуоресценции. Для некоторых из этих штаммов уровень длинноволновой флуоресцеции также невелик, но деформация главного максимума свидетельствует о связывании красителя.
На рис. 5 показана скорость связывания флуорохрома при импульсном добавлении 9-амино-акридина. Временнáя зависимость связывания хорошо аппроксимируется суммой двух кинетических компонент первого порядка (экспонент) в соответствии с уравнением
F (t) = F exp (-1/т) + F exp (-1/т 2), в котором обе временные константы т1 = 54 c и т2 = 300c определяют соответственно процессы:
-
1) электродиффузии к поверхности и адсорбции молекул красителя;
-
2) более длинный процесс установления равновесия, включающий эксимеризацию на поверхности или в более глубоких слоях клеточной периферии.
ОБСУЖДЕНИЕ И ВЫВОДЫ
Наиболее вероятный механизм генерации длинноволновой флуоресценции состоит в том, что поверхностные гетерополимеры мицелия способствуют ассоциации молекул красителя, возрастанию дипольного момента таких ассоциатов и соответственно генерации длинноволновой флуоресценции. Медленная компонента представленной на рис. 5 кинетики связывания отражает перестройки акридиновых колец на поверхности периферического гетерополимерного матрикса грибов.
Капсульные полисахариды грибов классифицируются как макромолекулярные полианионы и, как считается [11], выполняют катионсвязываю-щие функции. Таким образом, связывание катионов 9-аминоакридина, является общим неспецифическим свойством. Специфика процесса связывания состоит в образовании поверхностных ассоциатов красителя. Хорошо известна способность акридинов к димеризации, а регулярная структура мицелярной поверхности может катализировать этот процесс. В частности, известно, что молекулы акридинового желтого или акридинового оранжевого, встроенные в твердые поливинилацетатные пленки, могут образовывать флуоресцирующие ассоциаты с гораздо более высоким квантовым выходом, чем мономерные образования красителя [12]. Такие частично кристаллизованные поливинилацетатные пленки, а также и гетерополимеры ("маннан + β-глюкан" или "хитин + β-глюкан") клеточной стенки грибов [13, 14] играют, по-видимому, одну и ту же структурирующую роль.
Процесс связывания красителя с поверхностью мицелия начинается как электродиффузия катионов 9-аминоакридина к поверхности. Этот процесс ускоряется при тепловой денатурации фрагментированного мицелия, которая не только ингибирует сильно выраженную кислотообразующую способность грибов, т. е. инжекцию протонов в окружающий раствор, но также снижает адсорбцию противоионов среды и обнажает анионный связанный заряд поверхности мицелия. Процесс заканчивается образованием на поверхности плотного двойного электрического слоя [7].
Генерацию длинноволновой флуоресценции можно определить как суммарный процесс тушения в возбужденной мономерной системе (донор), резонансный безызлучательный переход энергии к димерной (эксимерной) излучающей системе (акцептор) и длинноволновое излучение как результат. В дальнейшем предполагается, что резонансный переход происходит без потерь энергии. Эта схема, впервые описанная Ферстером [15, 16] как процесс индуктивно-резонансного переноса энергии, стала основой многочисленных работ по флуоресценции [17].
Все процессы происходят в полярной дисперсионной среде (вода), в которой взвешены способные поляризоваться твердые частицы (дисперсная фаза). Под "частицей" понимается одна или несколько молекул красителя, ассоциированных с полимерным материалом грибного мицелия. Поглощение энергии возбуждающего света сопровождается поляризацией как дисперсионной среды, так и материала взвешенных частиц.
В теории Кирквуда—Фрелиха [18] среднее значение квадрата дипольного момента частиц M 2 V в расчете на единицу объема при отсутствии мак-
роскопического электрического поля определяется соотношением
8s - 1 =
εs
M 2 V •------------------------
8 0 ( 28, + 1 ) к в Т ’
где εs — статическое значение диэлектрической проницаемости частицы.
Аналогичное выражение, полученное Кирквудом для полярных жидкостей, записывается в виде
ε
s
-
ε
го
8 N цц л \
-----s ---0 1 + z cos y , 2 8 s + 8 „ 8 0 к в Т ( )
где 8 го = n 2 — высокочастотное значение диэлектрической проницаемости ( n — показатель преломления); N 0 = N/V — число ячеек в единице объема. Ячейкой считается группа молекул или атомов, дающая в среднем один и тот же вклад в поляризацию объема; ц* — векторная сумма момента µ неподвижного (фиксированного) диполя, расположенного в центре сферической ячейки, и среднего значения суммы дипольных моментов ближайших соседей фиксированного диполя. В контексте настоящей статьи — это сумма дипольного момента фиксированной молекулы 9-аминоакридина и ассоциированных с ней молекул эксимера. Если обозначить z число ближайших соседей фиксированной молекулы, то можно постулировать [17] соотношение цц =
= ц 2 ( 1 + z cos y ) , аналогичное величине M 2, в котором фактор Кирквуда ( 1 + z cos Y ) - ( 1 + z ) отражает взаимную ориентацию диполей. Абсолютное среднестатистическое значение косинуса угла между направлениями дипольных моментов соседних молекул ( cos у ) является, таким образом, мерой "ближнего порядка" для полярной жидкости.
Для случая твердых диполей (приближение "дальнего порядка") формула Кирквуда записывается в аналогичном виде:
εs
-
8 „
εs
•
N 0 µ 2
2 8 s + 8 ГО
ε 0 k B T
• 4 w ( 1 - w ) ,
где w — зависящая от температуры вероятность ориентации диполей, сорбированных (параллельно или антипараллельно) на матрице гетерополимера клеточной стенки. Если обе ориентации (при достаточно высокой температуре) равновероятны ( w = 0,5 ) , величина 4 w ( 1 - w ) достигает максимума, равного 1.
Для двумерного приближения дипольных твердых дисков в модели заторможенного вращения
молекул [19] ориентационный фактор вычисляется следующим образом:
2π j cos y • exp (z cos Y) dY/ x cos Y _ _ 1 x _ I (z),
‘ 2 пI jexp(zcosy)dY где I1 (z), I0 (z) — функции Бесселя первого и нулевого порядков.
При этом фактор Кирквуда ( 1 + z cos y ) описывается эквивалентным выражением [ 1 - 1 ( z ) ] . Для димеров ( z = 1) получаем I 1 ( z ) = 0.4401, I o ( z ) = 0.7652 и [ 1 - 1 ( z ) ] - = 2.354.
Отметим, следуя [19], что статистическая теория полярных жидкостей сталкивается с рядом непреодолимых трудностей и в целом далека от завершения. Еще более эти трудности характерны для коллоидных систем.
Можно, однако, по крайней мере оценить число молекул красителя, включенных в эксимерный комплекс. Связь между дипольным моментом единицы объема P 0 и собственной частотой ω 0 колебаний осциллирующего диполя, соответствующей максимуму флуоресценции, определяется выражением [18]
P _ e2ENcos2 9 _ e2EN 0 = Mro20 = 3Mro2’ где e — заряд электрона; E — электрическая компонента поля; N — число осциллирующих молекул на единицу объема; M — масса осциллирующей молекулы; θ — угол между направлениями поля и дипольного момента; множитель 1/3 получается как результат усреднения cos2 θ по всем направлениям. Для дипольного момента эксимерного комплекса можно записать эквивалентное выражение
P _ e 2EN
0 3 Mω 0 2 1
e 2 EN
3 M ( 1 + z ) ( 1 + z cos y ) ro 0 2
в котором ω 01 — резонансная частота возбуждающего света, равная собственной частоте мономеров 9-аминоакридина; ω 02 — резонансная частота флуоресценции, равная собственной частоте эксимеров 9-аминоакридина. Это последнее выражение следует понимать таким образом.
-
1) Произведение M ( 1 + z ) соответствует суммарной массе осциллирующего эксимерного ком-
- плекса при сохранении общего числа молекул N;
-
2) Эксимеризация, т. е. образование автономно поляризующихся субъединиц, соответствует числу nJ ( 1 + z cos y ) таких субъединиц также при сохранении общего числа молекул.
Из последнего равенства следуют соотношения
ω 021 ω 0 2 2
(л λ 02
х А л ,
где λ 01 — длина волны поглощения мономеров 9-аминоакридина; λ 02 — длина волны флуоресценции эксимеров. При λ 01 = 365 нм; λ 02 = = 687 нм и соответственно ( Л 02/ Л 01 ) 2 _ 3.54 простой расчет дает значения z _ 2.54 при cos у = 0; z _ 1.2 при cos y _ 0.5; z _ 0.88 при cos y = 1. Это означает, что в среднем около 100 % адсорбированных молекул красителя образуют димеры. Если использовать для оценки фактора Кирквуда приближение дипольных твердых дисков [19] и соответственно выражение [ 1 - 1 ( z ) ] , то для димеров ( z = 1) получаем значение ( 1 + z ) [ 1 - 1 ( z ) ] 1 _ 4.71, достаточно близкое к значению ( Л 02/ Л 01 ) 2 _ 3.54, что также свидетельствует в пользу димеризации.
Вероятность индуктивно-резонансного переноса энергии в модели Ферстера [15] уменьшается с ростом расстояния по закону 1 [ 1 + ( RR 0 ) 6 ] , т. е. очень быстро. Ферстеровский радиус R _ R0 , соответствующий 50 %-й вероятности резонансного переноса энергии, для системы "мономер— димер" акридинового оранжевого был найден равным 39 Å [12]. Приблизительно таково же расстояние между поперечными сшивками полисахаридных цепей на мицелярной поверхности [15].
Основные выводы статьи могут быть кратко сформулированы следующим образом. Исследование спектров флуоресценции аминопроизводных акридина, и в первую очередь 9-амино-акридина, может быть эффективно использовано при исследованиях структурных компонентов грибного мицелия, а также в систематике грибов, поскольку структура гетерополимеров поверхности мицелия является одним из системообразующих признаков. Детектирование длинноволновой флуоресценции достаточно просто реализуется инструментально и может стать основой рутинной техники для изучения развития и выживания плесневых грибов на различных материалах и в широком круге условий.
Список литературы Флуоресценция 9-аминоакридина в препаративных суспензиях грибов Aspergillus и Penicillium
- Семенов С.А. Гумаргалиева К.З., Калинина И.Г., Заиков Г.Е. Биоразрушения материалов и изделий техники//Вестник МИТХТ. 2007. Т. 2, № 6. C. 3-26.
- Старцев С.А. Проблемы обследования строительных конструкций, имеющих признаки биоповреждения//Инж.-строительный журнал. 2010. № 10. C. 41-46.
- Широких А.А., Колупаев А.П. Грибы в биомониторинге наземных экосистем//Теор. и прикл. экология. 2009. № 3. C. 4-14.
- Hamada N., Fujita T. Effect of air-conditioner on fungal contamination//Atmospheric Environment. 2002. Vol. 36. P. 5443-5448 DOI: 10.1016/S1352-2310(02)00661-1
- Бушуева Т.Л. Изучение механизмов и динамических условий тушения флуоресценции триптофана в белках и модельных системах. Дис. … канд. наук. Пущино, Институт биологической физики АН СССР, 1975.
- Kraayenhof R. Quenching of uncoupler fluorescence in relation on the "energized state" in chloroplasts//FEBS Letters. 1970. Vol. 6, no. 3. P. 161-165 DOI: 10.1016/0014-5793(70)80047-3
- Владимиров Ю.А., Добрецов Г.Е. Флуоресцентные зонды в исследовании биологических мембран. М.: Наука, 1980. 320 с.
- Eremenko A.M., Chujko A.A. Exciplexes photonics on the silica surface//Research on Chemical Intermediates. 1993. Vol. 19, no. 4. P. 375-391 DOI: 10.1163/156856793X00172
- Brauer D.K., Yermiyahu U., Ritwo G., Kinraide T.B. Characteristics of the quenching of 9-aminoacridine fluorescence by liposomes from plant lipids//J. Membrane Biol. 2000. Vol. 178. P. 43-48 DOI: 10.1007/s002320010013
- Graetzel M., Thomas J.K. On the dynamics of pyrene fluorescence quenching in aqueous ionic micellar systems. Factors affecting the permeability of micelles//J. Am. Chem. Soc. 1973. Vol. 95, no. 21. P. 6885-6889 DOI: 10.1021/ja00802a002
- Storck R. Molecular Mycology//Сб. "Молекулярная микробиология". М.: Изд. Мир, 1977. C. 153-161.
- Грачев А.В., Пономарев А.Н., Южаков В.И. Изучение кинетики флуоресценции акридиновых красителей в полимерных матрицах//Химическая физика. 1991. Т. 10, № 4. C. 459-464.
- Nicholas R.O., Williams D.W., Hunter P.A. Investigation of the value of β-glucan -cpecific fluorochromes for predicting the β-glucan content of the cell walls of zoopathogenic fungi//Mycol. Res. 1994. Vol. 98. P. 694-698 DOI: 10.1016/S0953-7562(09)80419-X
- Woodside E.E., Kwapinski J.B.G. Polysaccharides of microorganisms//Cб. "Молекулярная микробиология". М.: Изд. Мир, 1977. C. 145-240.
- Förster Th. Zwischenmolekulare Energiewanderung und Fluoreszenz//Ann. Phys. 1948. Vol. 437, no. 1-2. P. 55-75 DOI: 10.1002/andp.19484370105
- Förster Th., Selinger B. Der Konzentrationsumschlag der Fluoreszenz aromatischer Kohlenwasserstoffe in mizell-kolloidaler Lösung//Z. für Naturforsch. A. 1964. Vol. 19a. P. 38-41.
- Selvin P.R. The renaissance of fluorescence resonance energy transfer//Nature Structural and Molecular Biology. 2000. Vol. 7, no. 9. P. 730-734 DOI: 10.1038/78948
- Фрёлих Г. Теория диэлектриков. Диэлектрическая проницаемость и диэлектрические потери. М.: Изд. Иностр. лит., 1960. 249 с.
- Литинский Г.Б. Фактор Кирквуда жидкости дипольных твердых сфер. Модель заторможенного вращения молекул//Ж. структурной химии. 1998. Т. 39, № 5. C. 843-850.


