Формирование биопленок Escherichia coli при модификации редокс-статуса клеток
Автор: Лепехина Е.В., Смирнова Г.В., Октябрьский О.Н.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Исследована способность к биопленкообразованию у бактерий Escherichia coli, имеющих мутации по компонентам редокс-систем глутатиона и тиоредоксина и по регулятору общего стрессового ответа RpoS при разных ростовых температурах. Выявленная статистически значимая корреляция между удельным биопленкообразованием бактерий и экспрессией антиоксидантного гена katG при 37°С указывает на возможный вклад активации OxyR регулона при формировании биопленок бактериями. Мониторинг экспрессии гена sodA в исследуемых мутантах при 37°С показал 1.15-1.8-кратное ее повышение у gshA, gor, trxA, gshAtrxA и gortrxB мутантов. Установлена прямая зависимость между биопленкообразованием и экспрессией гена sodA в этих же условиях. Наличие мутаций по компонентам тиоловых редокс-систем значительно изменяло профиль зависимости продукции биопленок от температуры, что, вероятно, связано с нарушениями в редокс-регуляции путей передачи внутриклеточных сигналов. Показаны участие RpoS в процессе биопленкообразования при оптимальной ростовой температуре и RpoS-зависимый характер индукции биопленкообразования при 24°С и 44°С.
Биопленкообразование, тиоловые редокс-системы, окислительный стресс, дисульфидный стресс
Короткий адрес: https://sciup.org/147204792
IDR: 147204792 | УДК: 579.22
Текст научной статьи Формирование биопленок Escherichia coli при модификации редокс-статуса клеток
В отличие от планктонных свободно плавающих одиночных бактерий, биопленки представляют собой микробные консорциумы прикрепленных к субстрату и погруженных в эксграклегочный матрикс клеток Этот жизненный стиль бактерий характеризуется высокой устойчивостью ко всем типам стрессовых воздействий, включая действие антибиотиков и дезин-фвКТанТОВ. ЧТО приводит к существенным медицинским и техническим проблемам и стимулирует исследование факторов, влияющих на биопленкообразова- иис [Mah et al.. 2003; Николаев. Плакунов. 2007]. Изменения условий окружающей среды напрямую влияют на формирование и дисперсию биопленок. В качестве стимулов, влияющих на образование био-пленок. могут выступать доступность питательных компонентов, железа и кислорода в среде, осмотический шок и другие виды стрессов, межклеточная сигнализация и т.д.
Известно, что как в эукариотических, так и в прокариотических клетках многие ключевые регу-
(С Лепехина Е В., Смирнова Г. В., Октябрьский О. Н., 2016
ляторы и ферменты содержат существенные SH-группы* окисление которых сопровождается образованием дисульфидных связей и изменением активности этих молекул* В качестве оксидантов SH-групп могут выступать активные формы кислорода, например Н2О2 в случае OxyR* регулирующего ответ на пероксидный стресс, или хиноны дыхательной цепи* как в случае сенсорной киназы АгсВ, отвечающей на изменение условий аэрации. Восстановление дисульфидных связей в белках может осуществляться с участием глутаредоксинов и тиоредоксинов* окисленные формы которых, в свою очередь, восстанавливаются при помощи глутатиона (GSH) и глутатионредуктазы (GOR) или тиоредоксинредуктазы, соответственно [Potamitou, Holmgren, Vlamis-Gardikas, 2002, Октябрьский, Смирнова, 2007]. Под контролем OxyR и Arc АВ находятся малые РНК OxyS и ArcZ, которые ингибируют подвижность бактерий Е. coh, связываясь с матричной РНК jlhDC, а также влияют на уровень RpoS и, прямо или косвенно, на экспрессию гена cxgD, кодирующего ключевой регулятор, контролирующий биопленкообразование. Кроме того* OxyR участвует в регуляции адгезина AG43. необходимого для образования биопленок на различных поверхностях [Beloin* Roux. Ghigo* 2008]. Таким образом, можно ожидать, что изменение рсдокс-ситуации в клетках должно модулировать их способность к формированию биопЛС-НОК. В данной работе мы изучали влияние мутаций в компонентах редокс-систем глутатиона и тиоре-доксина на биопленкообразование Е. coli при разных ростовых температурах
Материалы и методы исследования
Штаммы бактерий и условия культивирования* Объектом исследования служили бактерии Е. coll BW25113 (A(«raD-croB)567, AlacZ4787(: :rmB-3), Л- rph-L A(rhaD-rhoB)568, hsdR514) и одиночные делеционные мутанты JW2663 (AgshA). JW3467 (Agor), JW0833 (Ag^), JW1051 (Ag^B). JW5856 (A^), JW0871 <^rxB\ JW5536 <^rcB). JW2755 (Arei4), JW0427 (AcfpP) и JW5437 (ДкроВ) из коллекции Keio [Baba ct al* 2006]* Кроме того, использовали сконструированные в нашей лаборатории методом трансформации плазмид и трансакции с фагом PI двойные мутанты NM3655 (A^/lI^I) и NM3761 (EgortrxB\ а также штаммы, содержащие одновременно соответствующие мутации и слияния промоторов генов katG и sodA СО структурным геном iacZ^ кодирующим 0-галактозидазу.
Для проведения экспериментов бактерии Е. coh выращивали при 37°С на минимальной среде М9 (Na2HPOrl2H2O - 15.13 г/л: КН2РО4 - 3 г/л: NH.C1 - 1 г/л; NaCl - 0.5 г/л: MgSO<7 Н2О - 0.246 г/л; СаС12 - 0.011 г/л) [Miller* 1972] с добавлением 0* 15%-ной глюкозы и антибиотиков, к которым был устойчив исследуемый штамм* затем клетки центрифугировали и ресуспендировали в 5 мл среды М9 (0.4% глюкозы) с добавлением 0.2%-ных казаминовых кислот и тиамина (10 мкг/мл) до значения оптической плотности OD6W = 0.1* В лунки полистирольных планшетов вносили по 100 мкл суспензии бактериальных клеток или среды М9 (контроль)* культивировали НО минут при 37°С в термостатируемом шейкере ST-32 ELMI* а затем помещали в термостат при температурах 2 4° С* 37°С или 44 °C.
Способность к биоплеикообразовапшо определяли по модифицированной методике, описанной Naves et al. [2008]. Для этого через 21 ч. измеряли OD^jq, сливали содержимое лунок, дважды отмывали стерильным физраствором по 250 pl и сушили на открытом воздухе 30 мин. Затем вносили в лунки по 150 pl 0.1%-ного раствора генциан-виолета и оставляли на 30 мин., после чего удаляли краситель, промывали 5 раз по 200 pl водой и подсушивали в течение 40 мин. Дтя количественного определения биопленкообразования в лунки вносили по 200 ц1 96%-ного этанола, пипетирова-ли, переносили по 125 pl в новый планшет и измеряли оптическую плотность связанных с красителем клеток и контрольных лунок на микроплан-шетном спектрофотометре xMarkTM Bio-Rad при длине волны 540 нм.
Расчеты проводили, согласно формулам BF = АВ - CW, где BF - валовое биопленкообразование, АВ -OD540 окрашенных бактериальных клеток, CW -OD540 окрашенных контрольных лунок;
sBF = (АВ - CW)/AOD6№ где sBF - удельное биопленкообразование, AOD^ - разность между ODW0 планктонной культуры и OD№) бактерий без среды.
Экспрессию генов оценивали путем измерения 0-галакгозидазной активности в клетках репортерных штаммов Е* coh, несущих генные слияния katG;:lacZ и sodA::lacZ при температурах 24°С 37°С и 44°С по методу’ Миллера [Miller. 1972].
Подвижность бактерий определяли путем измерения диаметра зоны роста на полужидком агаре (0.3%) через сутки интубации при 30 °C по методике* описанной Pittman et al. [2002]*
Статистическую обработку экспериментальных данных осуществляли с помощью пакета программ Microsoft Excel (Microsoft Office 2003) и Sta-tistica 6.0* вычисляя среднее значение* стандартную ошибку7 и доверительный интервал. Каждый результат показан как среднее значение не менее чем из пяти независимых экспериментов ± стандартная ошибка среднего. Достоверность различий между средними величинами оценивали согласно критерию Стьюдента, различия считались значимыми при р < 0.05*
Результаты и их обсуждение
Мутации по компонентам тиоловых редокс-систем слабо влияли на способность к биопленко-образованию при оптимальной температуре 37°С. В отсутствии глутаредоксина В этот параметр снижался в 1.2 раза, а у двойного мутанта gortrxB и мутанта по тиоредоксину I биопленкообразова-ние возрастало в 1.3 и L2 раза, соответственно, по сравнению с клетками дикого типа (рис* 1).
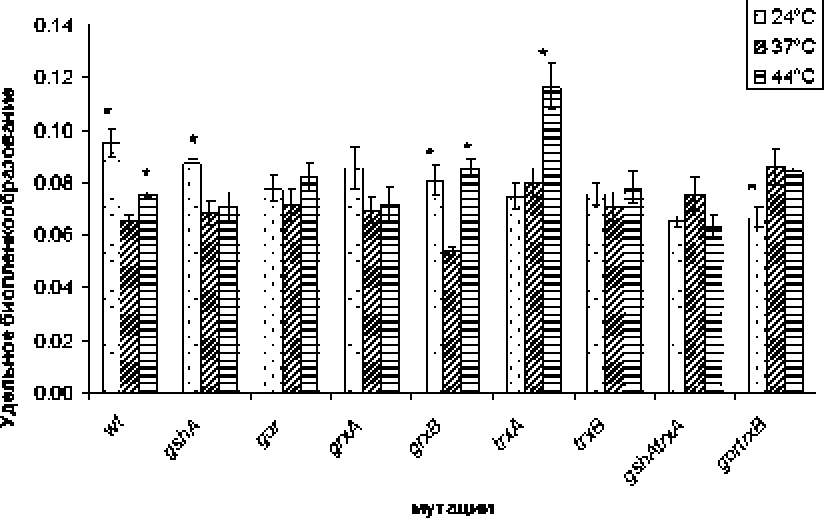
Рис. I* Способность к биопленкообразованию мутантов Е. coh по тиоловым редокс-системам при разных температурах культивирования
В то же время мутации по компонентам тиоловых редокс-систем значительно влияли на подвижность бактерий при температуре 30°С. Максимальное ингибирование подвижности (от 2 до 6 раз) было характерно для штаммов* несущих мутации gor. grxB. trxA „ gshA trxA и gortrxB.
За исключением делеции по глутаредоксину В* во всех \гутантах по компонентам тиоловых редокс-систем* и? особенно, у двойных мутантов в первые два часа инкубации в планшетах наблюдалось возрастание экспрессии гена katG относительно ее значения в родительском штамме (рис. 2)* что является следствием активации регуляторного белка OxyR в условиях дисульфидного стресса* испытываемого этими мутантами. Была выявлена статистически значимая корреляция между удельным биопленкообразованием бактерий и экспрессией гена katG при 37°С (г = 0.69* р < 0.05). В этих условиях возрастает также экспрессия OxyR-контролируемого гена шъ5\ кодирующего малую регуляторную РНК OxyS. Индукция OxyS приводит к ингибированию FlhDC регулона, что может объяснить наблюдаемое нами снижение подвижности у мутантных бактерий.
Вероятно, дисульфидный стресс влияет и на активность сенсорной киназы АгсВ. которая ингибируется при окислении ее редокс-активных цистеиновых остатков, локализованных в цитоплазме. Известно, что редуктанты (дигиотреитол и меркап тоэтанол) повышают* а оксидант хлорамин значительно снижает активность АгсВ [Malpica el al** 2004]. Следует ожидать* что в условиях дисульфидного стресса активность АгсВ будет ингибироваться* что сопровождается дефосфорилированием транскрипционного регулятора АгсА* репрессирующего многие гены* участвующие в дыхательном метаболизме* Под негативным контролем двухкомпонентной системы АгсАВ находится малая регуляторная РНК ArcZ* которая способна ингибировать подвижность бактерий* одновременно стимулируя продукцию биопленок за счет активи-рующего эффекта на центральный регулятор био-пленкообразования CsgD. Таким образом* этот молекулярный механизм может вносить вклад в наблюдаемую нами стимуляцию биопленкообразо-вания у мутантов по генам системы тиоредоксина. Под негативным контролем АгсАВ системы находится ген sodA. кодирующий Mn-су пероксид-дисмутазу. Мониторинг экспрессии этого гена в мутантах по тиоловым редокс-системам в первые два часа инкубации в планшетах показа*! ее повышение у gshA. gor* trxA, gshAtrxA и gortrxB мутантов в 1.15-1.8 раза (рис. 2)* Следует отметить* что через 21 ч. инкубации в планшете наблюдали 1*2-3.6-кратное снижение экспрессии sodA у бактерий* несущих мутации grol* grxB* trxA. IrxB, gortrxB. Двойной мутант gshAtrxA показывал 20-кратное снижение этого параметра. Стоит отметить* что делеция гена агсВ не влияла на способность к об-
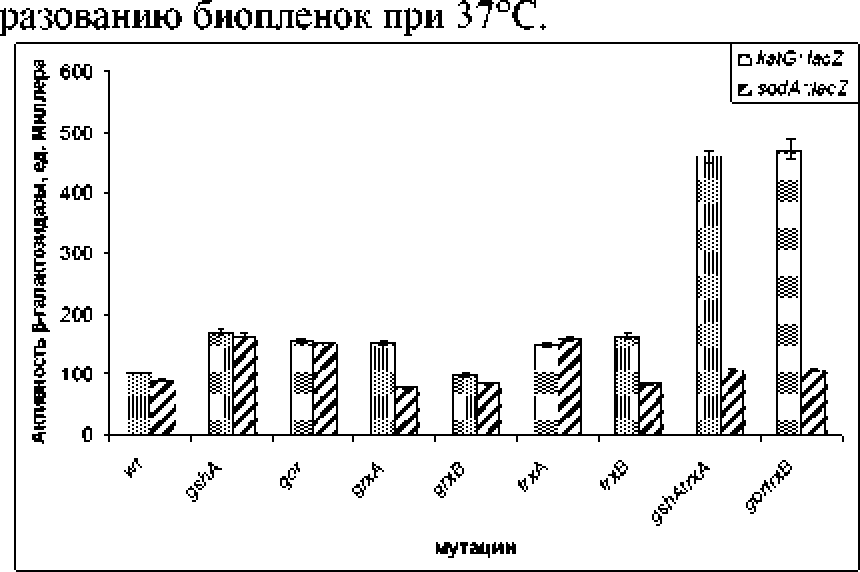
Рис 2, Экспрессия антиоксидантных генов katG и sodA у мутантов Е. coll по тиоловым редокс-сисгемам через 2 ч. экспозиции при 37°С
Ранее было установлено* что наличие RpoS не является обязательным условием для процесса биопленкообразования при оптимальной ростовой температуре [White-Ziegler et al** 2008]. В наших экспериментах при 37°С* штамм, лишенный гена rpoS, продуцировал в 2.1 раза больше биопленок* чем клетки дикого типа* При этом делеции генов relA. кодирующих ppGpp синтетазу* активирующую экспрессию генов rpoS. и с!рР. кодирующих протеазу RpoS* не влияли на степень продукции биопленок (рис. 3). Была выявлена статистически значимая корреляция между валовым биопленко- образованием мутантов по тиоловым редокс-системам и регулятору общего стрессового ответа RpoS и экспрессией гена sodA в первые два часа инкубации в планшете (г = 0.7 L р < 0*05)*
Среди факторов окружающей среды, оказывающих влияние на процесс биопленкообразования, важную роль играет температура культивирования Ранее было показано, что при 37°С в первичном прикреплении Е. colt к субстрату участвуют фимбрии первого типа (пили) и адгезии AG43, а основным компонентом матрикса является PGA [Mika, Hengge* 2013]. При температурах ниже 30°С первичная адгезия осуществляется с участием фимбрий другого типа (curb), при этом матрикс состоит в основном из целлюлозы и колановой кислоты, Показано, что снижение температуры культивирования до 23 °C сопровождается RpoS-зависимой стимуляцией продукции биопленок [White-Ziegler el al„ 2008]. В наших экспериментах для бактерий Е. coli дикого типа было выявлено повышение биопленкообразования при 24 и 44°С. Повышение продукции биопленок при 24°С отсутствовало в ЫрР и rpoS мутантах, но сохранялась в штамме с делецией reLL что подтверждает RpoS-зависимый характер индукции биопленкообразования при этой температуре (рис.З). Аналогичную картину наблюдали и при повышенной температуре 44°С, Стоит отметить, что штамм с мутацией reLA демонстрировал характерные для дикого типа пики биопленкообразования при 24 и 44ЛС
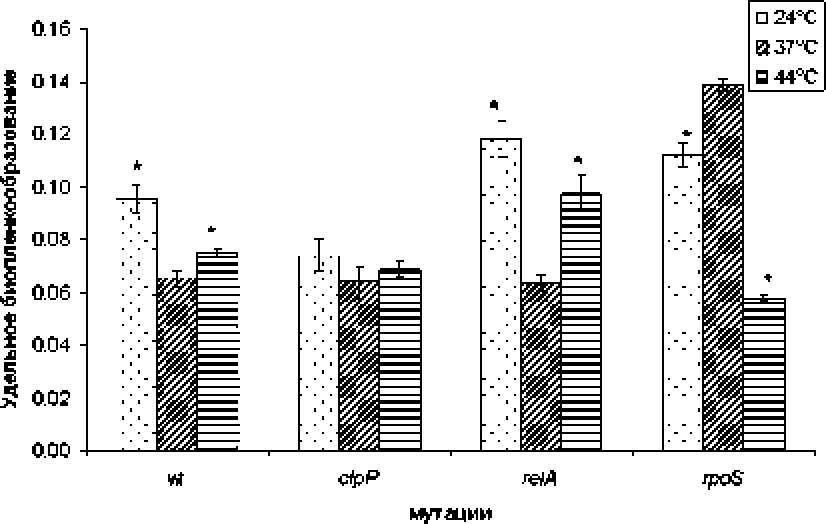
Рис. 3. Способность к биопленкообразованию мутантов Е. со И по генам reiA, clpP и rpoS при разных температурах культивирования
Наличие мутаций по компонентам тиоловых редокс-систем значительно изменяло профиль зависимости продукции биопленок от температуры. Удельное биопленкообразование бактерий не изменялось при сдвиге температур до 24 и 44°С у штаммов, несущих мутации по генам gor, grxA, trxB. gsMtrxA (см. рис. 1). В этих же условиях наблюдали статистически значимую стимуляцию способности к биопленкообразованию у мутанта по глутаредоксину В. Мутант по глутатиону показывал увеличение удельного биопленкообразования при 24°С? а мутант по тиоредоксину I - при 44°С.
Наблюдаемые процессы могут быть связаны с нарушениями в редокс-регуляции путей передачи внутриклеточных сигналов, При 24°С экспрессия антиоксидантного гена katG возрастала у штаммов, мутантных по глутатиону; обоим глутаредок-синам, тиоредоксинредуктазе и у двойного мутанта gortrxB. по сравнению с диким типом, В этих же условиях экспрессия гена sodA повышалась у мутантов по генам системы глутаредоксина и снижалась у двойных мутантов и мутантов по генам системы тиоредоксина, по сравнению с родительским штаммом, Была обнаружена статистически значимая обратная зависимость между уровнем экспрессии гена katG на момент начала холодового стресса и удельным биопленкообразованием при 24 ° С (г = -0.79, р < 0.05). При 44°С экспрессия генов kaiG и sodA значительно снижалась у всех штаммов, по сравнению с 37°С, Статистически значимая корреляция была выявлена при 44°С между валовым биопленкообразованием и экспрессией katG (г = -0.71, р < 0.05),
Известно, что RpoS негативно контролируется Аге АВ двухкомпонентной системой, а малая регуляторная РНК Оху S оказывает ингибирующий эффект на экспрессию гена rpoS. Следовательно, образование S-S связей в регуляторных белках OxyR и АгсВ в тиоловых мутантах, испытывающих дисульфидный стресс, должно ингибировать RpoS-зависимое биопленкообразование при неоптимальных температурах, что и наблюдалось в наших экспериментах.
Заключение
Выявленные нами различия в способности к биопленкообразованию у бактерий Е. cob указывают на модулирующее действие изменений ре-докс-статуса клеток, в основе которого может лежать дисульфидный стресс и активация OxyR ре-гулона. Показан RpoS-зависимый характер индукции биопленкообразования вблизи границ температурного оптимума для роста Е cob. Поскольку многие патогенные микроорганизмы образуют биопленки в инфицированном макроорганизме, а также на поверхности изделий, имеющих медицинское назначение, полученные нами в работе данные открывают возможности для модуляции биопленкообразования путем изменения редокс-статуса среды и клеток.
Работа поддержана грантами РФФИ № 16-04-00762 и № 14-04-96031.
Список литературы Формирование биопленок Escherichia coli при модификации редокс-статуса клеток
- Николаев Ю.А., Плакунов В.К. Биопленка -«Город микробов» или аналог многоклеточного организма?//Микробиология. 2007. Т. 76. С. 149-163.
- Октябрьский О.Н., Смирнова Г.В. Редокс регуляция клеточных функций//Биохимия. 2007. Т. 72. С. 158-174
- Baba T. et al. Construction of Escherichia coli strain K-12 in-frame, single-gene knockout mutants: the Keio Collection//Mol. Syst. Biol. 2006. Vol. 2. P. 1-11
- Beloin C., Roux A., Ghigo J-M. Escherichia coli biofilms//Curr. Top Microbiol. Immunol. 2008. Vol. 322. P. 249-289
- Mah T.F. et al. A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance//Nature. 2003. V. 426. P. 306-310
- Malpica R. et al. Identification of a quinone-sensitive redox switch in the ArcB sensor kinase//Proc. Natl. Acad. Sci. 2004. Vol. 101. P. 13318-13323
- Mika F., Hengge R. Small Regulatory RNAs in the control of motility and biofilm Formation in E. coli and Salmonella//Int. J. Mol. Sci. 2013. Vol. 14. P. 4560-4579
- Miller J. N. Experiments in molecular genetics. New York: Cold Spring Harbor Laboratory Press, 1972
- Naves P. et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is methoddependent//J. Appl. Microbiol. 2008. Vol. 105. P. 585-590
- Pittman M.S. et al. Cysteine is exported from the Escherichia coli cytoplasm by CydDC, an ATP-binding cassette-type transporter required for cytochrome assembly//J. Biol. Chem. 2002. Vol. 277. P. 49841-49849
- Potamitou A., Holmgren A., Vlamis-Gardikas A. Protein levels of Escherichia coli thioredoxins and glutaredoxins and their relation to null mutants, growth phase, and function//J. Biol. Chem. 2002. Vol. 277. P. 18561-18567
- Povolotsky T.L., Hengge R. 'Life-style' control networks in Escherichia coli: Signaling by the second messenger c-di-GMP//J Biotechnol. 2012. Vol. 160. P. 10-16
- White-Ziegler C.A. et al. Low temperature (23°C) increases expression of biofilm-, cold-shock-and RpoS-dependent genes in Escherichia coli K-12//Microbiology. 2008. Vol.154. P. 148-166


