Формирование ферментного компонента секретов пищеварительных желез (обзор)
Автор: Коротько Г.Ф.
Журнал: Физическая культура, спорт - наука и практика @fizicheskaya-kultura-sport
Рубрика: Из портфеля редактора
Статья в выпуске: 1, 2013 года.
Бесплатный доступ
В обзорной статье представлены результаты авторских исследований и данные литературы о роли транспортных процессов в формировании двух пулов ферментов пищеварительных желез и адаптации их спектра к виду принятой пищи и нутриентному составу химуса.
Пищеварительные железы, секреция, пищевая адаптация, ферменты
Короткий адрес: https://sciup.org/14263795
IDR: 14263795 | УДК: 612.342.5
Текст обзорной статьи Формирование ферментного компонента секретов пищеварительных желез (обзор)
Система пищеварения в организме человека наиболее многоорганная, многофункциональная и сложная, обладающая большими адаптационными и компенсаторными возможностями. Этим, увы,
нередко злоупотребляют или поступают неосмотрительно и самонадеянно в питании. Такое поведение зачастую основано на недостаточном объеме знаний о деятельности данной физиологической системы, а специалисты, как нам кажется, недостаточно настойчиво популяризируют данный раздел науки. В статье мы пытаемся уменьшить свою «вину» перед читателем, который мотивирован на иные сферы профессиональных знаний. Однако пищеварение реализует биологическую потребность – питание, а к нему возникает интерес каждого не только в потребности пищи, но и в знании, как осуществляется процесс ее использования, имеющего свои особенности в связи с многими факторами, в том числе профессиональной деятельностью человека. Это относится к пищеварительным функциям: секреторной, моторной и всасывательной. Данная статья о секреции пищеварительных желез.
Важнейшим компонентом секретов пищеварительных желез являются гидролитические ферменты (их более 20 видов), производящие в несколько этапов последовательную химическую деградацию (деполимеризацию) нутриентов пищи на протяжении всего пищеварительного тракта до стадии мономеров, которые абсорбируются слизистой оболочкой тонкой кишки и используются макроорганизмом как энергетический и пластический материал. Следовательно, гидролазы пищеварительных секретов выступают в роли важнейшего фактора жизнеобеспечения организма человека и животных. Синтез гидролитических ферментов гландулоцитами пищеварительных желез производится по общим законам синтеза белка. В настоящее время механизмы данного процесса детально исследованы [30]. В секреции белков-ферментов принято различать несколько последовательных стадий [29]: поступление исходных веществ из кровеносных капилляров в клетку, синтез первичного секрета, накопление секрета, транспорт секрета и выделение его из гландулоцита. Классическая схема секреторного цикла ферментсинтезирующих гланду-лоцитов с внесенными в нее дополнениями считается практически общепризнанной [29]. Однако она постулирует непараллельность секреции разных ферментов различной длительностью синтеза каждого из них [30]. Разноречивы суждения о механизме и срочной адаптации ферментного спектра экзосекретов к составу принятой пищи и содержимого отделов пищеварительного тракта. Вместе с тем показано [30], что длительность секреторного цикла, в зависимости от полноты включенных в него компонентов, меняется от получаса (когда исключены из синтеза и внутриклеточного транспорта фазы грануляции секреторного материала, перемещения гранул и экзоцитоза из них энзимов) до нескольких десятков минут и часов.
Срочный транспорт ферментов гландулоцитами составляет процесс их рекреции. Под ним принято считать поглощение эндогенных секреторных продуктов гландулоцитами из крови и последующее выделение их в неизмененном виде в составе экзосекрета. Гидролитические ферменты пищеварительных желез, циркулирующие в составе крови, также рекретируются из нее [8].
Транспорт ферментов из крови в гландулоцит осуществляется через его базолатеральную мембрану посредством лигандзависимого эндоцитоза. В роли его лиганда выступают энзимы и зимогены крови. Энзимы в клетке транспортируются фибриллярными структурами цитоплазмы и посредством диффузии в ней, и, видимо, без заключения в секреторные гранулы и, следовательно, не посредством экзоцитоза, а диффузии [30, 33]. Впрочем, не исключен и экзоцитоз, что мы наблю- дали в рекреции α-амилазы энтероцитами в условиях вызванной гиперамилаземии [22].
Следовательно, экзосекреты пищеварительных желез содержат два пула ферментов: заново синтезированные и рекретированные. В классической физиологии секреции акцентируется внимание на первом пуле, как правило, не принимается во внимание второй. Однако скорость синтеза ферментов существенно ниже темпа их стимулированной экзосекреции, что было показано на примере учета ферментовыделительной деятельности поджелудочной железы [43]. Следовательно, дефицит синтеза ферментов восполняется их ре-крецией.
Рекреция ферментов характерна для гландулоци-тов не только пищеварительных, но и непищеварительных желез. Так, доказана рекреция пищеварительных ферментов потовыми и молочными железами [12]. Это столь же универсальный процесс, характерный для всех желез, как и то, что все экзосекреторные гланду-лоциты являются дуакринными, то есть выделяют свой секреторный продукт не строго полярно, а двунаправ-лено – через апикальную (экзосекреция) и базолатеральную (эндосекреция) мембраны [12, 43]. Эндосекреция является первым путем транспорта ферментов из гландулоцитов в интерстиций, а из него в лимфо– и кровоток. Вторым путем транспорта ферментов в кровоток выступает резорбция ферментов из протоков пищеварительных желез (слюнных, поджелудочной и желудочных) – «уклонение» ферментов [8, 9, 10, 12]. Третьим путем поставки ферментов в кровоток названа их резорбция из полости тонкой кишки (в основном, из подвздошной кишки) [1, 2, 5, 19, 2, 31, 32, 39]. Количественная характеристика каждого из названных путей транспорта ферментов в кровоток в адекватных условиях требует специального исследования.
Ферментсинтезирующие гландулоциты рекрети-руют, во-первых, синтезированные ими же ферменты, то есть ферменты данной железы циркулируют между гландулоцитами, их синтезирующими и транспортирующими в кровоток, и рекретирующими железами. Они неоднократно принимают участие в гидролизе нутриентов, если ферменты резорбируются из тонкой кишки. По такому принципу организована энтерогепатиче-ская циркуляция желчных кислот при 4–12 циклах циркуляции в сутки одного и того же пула данного секреторного продукта печени [12]. Тот же принцип экономизации использован в энтерогепатической циркуляции желчных пигментов.
Во-вторых, гландулоциты данной железы рекрети-руют ферменты гландулоцитов других желез. Поэтому слюна содержит синтезированные слюнными железами карбогидразы (амилаза и мальтаза), а также желудочный пепсиноген, панкреатические амилазы, трипсиноген и липазу [9]. Данное явление используется в энзимосаливадиагностике морфофункционального состояния желудка и поджелудочной железы, в оценке ферментного гомеостазиса [9]. Панкреатический секрет содержит собственную p-α-амилазу, а так- же слюнную s-α-амилазу [8]; в составе кишечного сока выделяется собственная γ-амилаза и панкреатическая α-амилаза [22]. В данных примерах циркуляцию (или рециркуляцию) ферментов можно назвать полиглан-дулярной, при которой экзосекреты содержат два пула ферментов, но рекреторный пул представлен ферментами гландулоцитов разных желез.
Рассмотренные процессы секреции ферментов относятся к числу сложно управляемых по принципам стимуляции, ингибиции и модуляции гландулоцитов. Рекреция ферментов в большой мере определяется их концентрацией и активностью в капиллярной крови ткани железы. Это, в свою очередь, зависит от транспорта ферментов в лимфоток и кровоток.
Транспорт ферментов в лимфоток меняется в результате действия физиологических и патогенных факторов. К числу первых относится стимуляция клеток-продуцентов в активную фазу периодической деятельности пищеварительного тракта. Первооткрыватель этого фундаментального физиологического процесса В. Н. Болдырев в 1914 году (то есть через 10 лет после официального открытия им же моторной периодики желудка) назвал поставку в кровь панкреатических ферментов функциональным назначением периодики, «изменяющим процессы ассимиляции и диссимиляции во всем организме» [обзор:12]. Нами экспериментально доказано увеличение транспорта панкреатической α-амилазы в лимфу [8] и в активную фазу периодики ренального выделения пепсиногена железами желудка [10]. Транспорт ферментов в лимфу и кровоток стимулируется приемом пищи (то есть, постпран-диально) [12].
Выше названы три механизма транспорта ферментов в кровоток, каждый из которых может количественно изменяться. Наиболее значимым в повышении транспорта ферментов из железы в кровоток признано сопротивление оттоку экзосекрета из протоковой системы желез. Это доказано в деятельности слюнных, желудочных и поджелудочной желез при сниженном переносе ферментов через апикальную мембрану в полость протоков желез [12].
Интрадуктальное давление секрета является гидростатическим фактором сопротивления фильтрации компонентов цитоплазмы из гландулоцитов, но и выступает в роли фактора управления секрецией железы с механорецепторов ее протоковой системы. Показано, что ими достаточно плотно снабжены выводные протоки слюнных и поджелудочной желез [37, 38]. При умеренном повышении внутрипротокового давления панкреатического секрета (10–15 мм рт. ст.) секреция дуктулоцитов нарастает при неизмененной секреции ациноцитов поджелудочной железы [8]. Это имеет особое значение для снижения вязкости секрета, так как ее повышение является естественной причиной возросшего внутрипротокового давления и затрудненности оттока секрета из протоковой системы железы [7]. При более высоком гидростатическом давлении панкреатического секрета (20–40 мм рт. ст.) секреция дук- тулоцитов и ациноцитов снижается путем торможения их секреторной активности рефлекторно и посредством серотонина [8, 44]. Это рассматривается как защитный механизм саморегуляции панкреатической секреции.
Традиционно панкреатологией протоковой системе поджелудочной железы отведена активная секреторная и реабсорбционная роль, и пассивная роль дренажа образованного секрета в двенадцатиперстную кишку, регулируемого только состоянием сфинктерного аппарата дуоденального сосочка, то есть сфинктера Одди. Напомним, он представляет собой систему жомов общего желчного протока, панкреатического протока и ампулы дуоденального сосочка [8]. Данная система служит для одностороннего тока желчи и панкреатического секрета в направлении выхода их из папиллы в двенадцатиперстную кишку. Гистологические исследования протоковой системы человека показали наличие в ней (за исключением вставочных протоков) активных и пассивных клапанов четырех типов [3, 24, 25, 26]. Первые (полипообразные, угловые, мышечно-эластические подушки), в отличие от вторых (створчатые внутридольковые), имеют в своем составе лейомиоциты. Их сокращение открывает просвет протока, а при расслаблении миоцитов он перекрывается [3, 4, 15]. Протоковые клапаны определяют общий и раздельный антеградный транспорт секрета из регионов железы, его депонирование в микрорезервуарах протоков и высвобождение секрета из данных резервуаров в зависимости от градиента давления секрета по сторонам клапана. Микрорезервуары имеют лей-омиоциты, сокращение которых при открытом клапане способствует выведению депонированного секрета в антеградном направлении. Клапаны протоков препятствуют рефлюксу желчи в панкреатические протоки и ретроградному току секрета поджелудочной железы [15].
Нами показана регулируемость клапанного аппарата протоковой системы поджелудочной железы рядом миотоников и миолитиков [16, 17, 18], влияниями с рецепторов протоков и слизистой оболочки двенадцатиперстной кишки. Это положено в основу предложенной нами теории модульной морфофункциональной организации экзосекреторной деятельности поджелудочной железы, признанной открытием [21]. По аналогичному принципу организована секреция крупных слюнных желез.
С учетом резорбции ферментов из протоковой системы поджелудочной железы, зависимости данной резорбции от гидростатического давления секрета в полости протоков, в первую очередь, в полости расширенных этим давлением микрорезервуаров секрета, данный фактор в большой мере определяет количество панкреатических ферментов, транспортируемых в интерстиций железы, ее лимфо– и кровоток в норме и при нарушении оттока экзосекрета из протоковой системы [8, 12]. Данный механизм выступает в роли важнейшего в поддержании уровня панкреатических ги- дролаз в циркулирующей крови в норме и его нарушении при патологии, возможно, превалируя над размерами эндосекреции ферментов ациноцитами и резорбции ферментов из полости тонкой кишки. Такое допущение нами сделано на основании того, что эндотелий сосудов дуоденальных аркад имеет более высокую активность адсорбированных на нем ферментов, чем эндотелий аркад сосудов подвздошной кишки [14], несмотря на то, что абсорбционная способность стенки дистальной части кишки выше, чем ее проксимальной части [8, 12]. Это является следствием высокой проницаемости эпителия микрорезервуаров протоков и в более высокой концентрации ферментов и зимогенов в протоках железы, чем в полости дистального отдела тонкой кишки.
Транспортированные в кровоток ферменты пищеварительных желез находятся в солюбилизированном в плазме крови и депонированном ее белками и форменными элементами состояниях. Между этими формами циркулирующих с кровотоком ферментов установлено некое динамическое равновесие при некоторой избирательной аффинности разных ферментов с фракциями белков плазмы крови [12, 23]. В плазме крови здорового человека амилаза связана, преимущественно, с альбуминами, пепсиногены менее селективны в адсорбции их именно альбуминами, данный зимоген в большом количестве связан с глобулинами. Описаны видовые особенности распределения адсорбции ферментов по фракциям белков плазмы крови. Примечательно, что при гипоферментемиях (резекция поджелудочной железы, гипотрофия ее в поздние сроки после лигирования панкреатического протока) аффинность ферментов и плазменных белков повышается. Это способствует депонированию ферментов в крови, резко снижая в этих состояниях ренальную и экстраре-нальную экскрецию ферментов из организма. При ги-перферментемиях (экспериментально вызванных и у больных) аффинность плазменных белков и ферментов снижается, что способствует выделению солюбилизированных ферментов из организма.
В обеспечении ферментного гомеостазиса принимают участие ренальное и экстраренальное выделение ферментов из организма, деградация ферментов сериновыми протеиназами, инактивация ферментов посредством специфических ингибиторов. Последнее актуально для сериновых протеиназ – трипсина и химотрипсина. Их основными ингибиторами в плазме крови являются α1-ингибитор протеиназ и α2-макроглобулин. Первый полностью инактивирует панкреатические протеиназы, а второй лишь ограничивает их способность расщеплять высокомолекулярные белки [1, 2]. Данный комплекс имеет субстратную специфичность только к некоторым низкомолекулярным белкам. Он не чувствителен к другим ингибиторам протеиназ плазмы крови, не подвергается аутолизу, не проявляет антигенных свойств, но распознается клеточными рецепторами, вызывает в некоторых клетках образование физиологически активных веществ [2].
Описанные процессы представлены на рисунке с соответствующими комментариями. Гландулоциты (ациноциты поджелудочной и слюнных желез, главные клетки желудочных желез) синтезируют и рекретиру-ют ферменты (а, б). Последние поступают в гландуло-циты (А, Б) из кровотока, куда они были транспортированы путем эндосекреции (в), резорбции из резервуаров протоков (м) и тонкой кишки (е). Транспортированные из кровотока ферменты (г) поступают в гландуло-циты (А, Б), оказывают стимулирующее (+) или ингибирующее (–) влияние на секрецию ферментов и совместно с «собственными» ферментами (а) рекретируются (б) гландулоцитами.
На данном уровне секреторного цикла реализуется сигнальная роль ферментов в формировании конечного ферментного спектра экзосекрета с использованием принципа отрицательной обратной связи на уровне внутриклеточного процесса, что было показано в опытах in vitro [42]. Этот принцип используется и в саморегуляции панкреатической секреции с двенадцатиперстной кишки через рефлекторные и паракринные механизмы. Следовательно, экзосекреты пищеварительных желез содержат два пула ферментов: синтезированные de novo (а) и рекретированные (б), которые синтезированы данной и иными железами. Постпран-диально, в полость пищеварительного тракта в первую очередь транспортируются порции депонированного в протоках секрета, затем – порции секрета с рекрети-рованными ферментами, и, наконец, выводится секрет с рекретированными и заново синтезированными ферментами.
Эндосекреция ферментов – неизбежное явление в деятельности экзокринных гландулоцитов, как и наличие в циркулирующей крови относительно постоянного количества синтезируемых ими ферментов. При этом процесс их рекреции – это один из путей их экскреции для поддержания ферментного гомеостазиса [12], то есть проявление экскреторной и метаболической [28] деятельности пищеварительного тракта. Однако размеры рекреции ферментов пищеварительными железами многократно превышают количество экскретируемых ферментов ренальными и экстрареналь-ными путями. Логично допустить, что ферменты, обязательно транспортируемые в кровоток, депонируемые в крови и на эндотелии сосудов, а затем рекрети-руемые пищеварительными железами, имеют какое-то функциональное назначение.
Конечно, справедливо, что рекреция ферментов органами пищеварения совместно с экскрецией является одним из механизмов ферментного гомеостазиса организма, поэтому между ними имеются выраженные связи. Например, гиперферментемия, связанная с недостаточностью ренального выделения ферментов, приводит к викарному повышению рекреции ферментов пищеварительным трактом [8, 12]. Немаловажно то, что рекретируемые гидролазы могут участвовать и участвуют в пищеварительном процессе. Потребность в этом связана с тем, что темп синтеза фер-
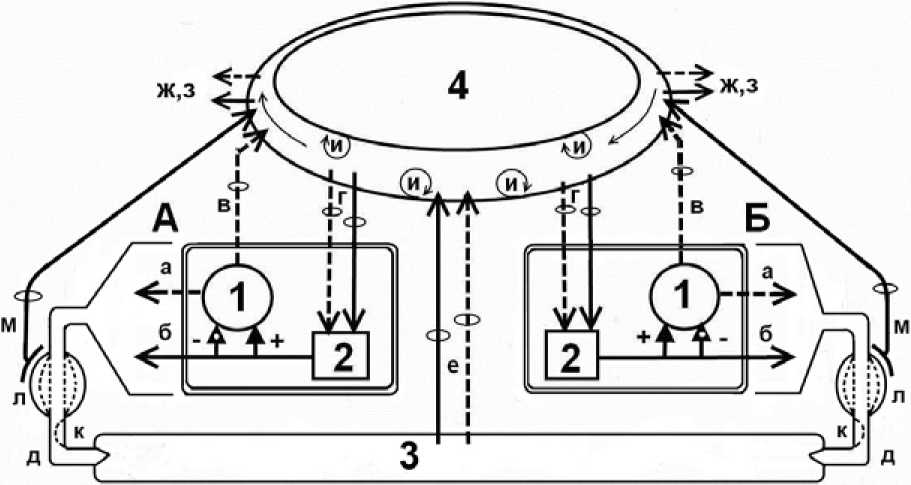
Рисунок. Формирование ферментного спектра секрета пищеварительных желез:
-
А, Б – ферментсинтезирующие гландулоциты; 1 – синтез ферментов;
-
2 – интрагландулярный пул подлежащих рекреции ферментов;
-
3 – тонкокишечный химус; 4 – кровоток; а – экзосекреция ферментов;
б – рекреция ферментов; в – эндосекреция ферментов в кровоток;
г – транспорт ферментов из циркулирующего с кровотоком эндосекреторного пула гландулоцитами аутожелезы и иных пищеварительных желез; д – образованный двумя пулами ферментов (а-секреторный, б-рекреторный) общий их экзосекре-торный транспорт в полость пищеварительного тракта; е – резорбция ферментов из полости тонкой кишки в кровоток; ж – ренальная и экстраренальная экскреция ферментов из кровотока; з – инактивация и деградация ферментов;
-
и – адсорбция и десорбция ферментов эндотелием капилляров;
-
к – клапаны протоков; л – микрорезервуары секрета протоков;
-
м – резорбция ферментов из микрорезервуаров протоков;
-
н – транспорт ферментов в кровоток и из кровотока.
ментов соответствующими гландулоцитами ниже количества постпрандиально экзосекретируемых железами ферментов, которые «затребованы» пищеварительным конвейером. Это особенно ярко проявляется в начальный постпрандиальный период, при максимальном дебите ферментовыделения в секреции слюнных, желудочных, поджелудочной желез, то есть в период максимальных дебитов обоих пулов (синтезируемых в пост-прандиальный период и рекретированных) ферментов. Около 30 % амилолитической активности ротовой жидкости здорового человека обеспечено не слюнной, а панкреатической амилазой, которые совместно в желудке производят гидролиз полисахаридов [9, 10]. Так, 7–8 % амилолитической активности панкреатического секрета обеспечивается слюнной амилазой [8]. В тонкую кишку из крови рекретируются слюнная и панкреатическая α-амилазы, которые совместно с кишечной γ-амилазой гидролизуют полисахариды [22]. Рекретор-ный пул ферментов быстро включается в экзосекрецию желез не только количественно, но и по ферментному спектру, соотношению в экзосекрете различных гидролаз, срочно адаптируемому к нутриентному соста- ву принятой пищи. Это заключение основано на факте срочной адаптируемости спектра ферментов лимфы грудного лимфатического протока, поставляемых в венозный кровоток [8, 12]. Однако этой закономерности не всегда следуют гидролазы плазмы крови здорового человека в постпрандиальный период, но она отмечена у больных острым панкреатитом [6, 27]. Мы это связываем с демпферированием варьирования уровня гидролаз крови в процессе их депонирования на фоне нормальной и пониженной ферментативной активности. Такое демпферирование отсутствует на фоне ги-перферментемии, так как емкость депо исчерпана [12], и поступление в системный кровоток эндогенных панкреатических ферментов приводит к постпрандиаль-ному (или при иной стимуляции секреции железы) повышению активности или концентрации ферментов (и их зимогенов) в плазме крови.
Наконец, гидролазы не только в полости пищеварительного тракта, но и циркулирующие с кровотоком выполняют сигнальную роль [11, 12]. Этот аспект проблемы гидролаз крови привлекает внимание клиницистов только с недавнего времени открытия и клониро- вания протеиназо-активируемых рецепторов (ПАР) [34, 35, 36, 45, 46]. В настоящее время протеиназы предложено считать гормоно-подобными физиологически активными веществами, оказывающими модулирующее влияние на многие физиологические функции через вездесущие ПАР клеточных мембран [13, 41]. В пищеварительном тракте широко представлены ПАР второй группы, локализованные на базолатеральных и апикальных мембранах гландулоцитов желез, эпителиоцитов пищеварительной трубки (особенно двенадцатиперстной кишки), лейомиоцитов, энтероцитов [40, 41].
Представления о двух ферментных пулах экзосекретов пищеварительных желез снимают вопрос о количественном несоответствии выделяемых и срочно синтезированных ферментов пищеварительными железами, так как экзосекреты всегда составляют сумму названных двух пулов ферментов. Соотношения между пулами могут изменяться в динамике экзосекреции из-за их разной мобильности в постпрандиальный период секреции желез. Рекреторный компонент экзосекрета в большой мере определяется транспортом ферментов в кровоток и содержанием ферментов в нем, изменяясь в норме и патологии. Определение ферментовы-деления и двух его пулов в экзосекретах желез имеет диагностическую перспективу.


