Формирование групп потенциального онкологического риска при профессиональном облучении на основе технологий молекулярной и радиационной эпидемиологии
Автор: Иванов В.К., Замулаева И.А., Кащеева П.В., Саенко А.С., Орлова Н.В., Смирнова С.Г., Корело А.М., Горский А.И., Максютов М.А., Вайзер В.И.
Рубрика: Научные статьи
Статья в выпуске: 2 т.18, 2009 года.
Бесплатный доступ
В представленной работе рассматривается технология формирования групп потенциального онкологического риска при профессиональном облучении на основе методов молекулярной и радиационной эпидемиологии. Оценена частота генных мутаций по локусу Т-клеточного рецептора у 320 сотрудников ГНЦ РФ Физико-энергетический институт имени академика А.И.Лейпунского. Средняя накопленная доза указанных сотрудников составила 100 мЗв. Установлено, что применение технологии радиационной эпидемиологии, связанной с выделением персонала, для которого величина радиационного атрибутивного риска составляет 10 % и выше, дает увеличение в этой группе доли лиц, имеющих повышенный уровень генных мутаций. Отмечается, что полученные результаты носят предварительный характер в связи с ограничением статистической мощности исследований.
Группы потенциального онкологического риска, профессиональное облучение, частота генных мутаций по локусу т-клеточного рецептора, атрибутивный риск
Короткий адрес: https://sciup.org/170169975
IDR: 170169975
Текст научной статьи Формирование групп потенциального онкологического риска при профессиональном облучении на основе технологий молекулярной и радиационной эпидемиологии
Министерство здравоохранения РФ 1 ноября 2003 г. ввело в действие Руководство по оценке профессионального риска для здоровья работников (P 2.2.1766-03), разработанное Государственным учреждением Научно-исследовательский институт медицины труда РАМН (руководитель разработки – академик РАМН Н.Ф.Измеров) [1].
Для оценки степени причинно-следственной связи нарушений здоровья и профессиональной деятельности в Руководстве используются понятия относительного риска ( RR ) и этиологической доли ( EF ). Если в эпидемиологических исследованиях через O обозначить наблюдаемое число заболеваний, а через E – ожидаемое число заболеваний, то величина относительного риска определяется по формуле: RR = O / E , а величина этиологической доли (атрибутивного риска) по формуле: EF = ( 1 - 1/ RR) ⋅ 100 % .
Иванов В . К . * – Первый зам . Председателя РНКРЗ , зам . директора МРНЦ РАМН по научной работе , член - корреспондент РАМН ; Замулаева И . А . – зав . лабораторией МРНЦ РАМН ; Кащеева П . В . – аспирант МРНЦ РАМН ; Саенко А . С . – зам . директора МРНЦ РАМН по научной работе , профессор ; Орлова Н . В . – старший научный сотрудник МРНЦ РАМН ; Смирнова С . Г . – старший научный сотрудник МРНЦ РАМН ; Корело А . М . – ведущий программист МРНЦ РАМН ; Горский А . И . – ведущий научный сотрудник , к . т . н .; Максютов М . А . – зав . лабораторией МРНЦ РАМН , к . т . н .; Вайзер В . И . – начальник отдела радиационной безопасности и охраны окружающей среды ГНЦ РФ ФЭИ .
Так, в частности, если величина относительного риска RR =1,5 (т.е. наблюдаемое число заболеваний в 1,5 раза превышает ожидаемое), то величина этиологической доли составляет 33 % (т.е. каждое третье заболевание из числа наблюдаемых в данном примере следует отнести к профессионально-обусловленным).
В Руководстве по оценке профессионального риска для здоровья работников (P 2.2.176603) отмечается необходимость подготовки конкретных методических указаний, реализующих базовую технологию Руководства для отдельных факторов риска рабочей среды.
На рисунке 1 показана в общем виде технология оценки онкологических рисков на основе молекулярной и радиационной эпидемиологии. Основная идея такого подхода понятна – необходимо сформировать (если это возможно) группу риска таким образом, чтобы доля лиц с высокой этиологической долей (атрибутивным риском) была максимальна. В этом случае, за счет сокращения общей численности группы риска, возможно использование дорогостоящих диагностических технологий ранней диагностики при онкопатологии, повышение продолжительности жизни выявленных онкологических больных и, следовательно, укрепление кадрового потенциала предприятий атомной промышленности.
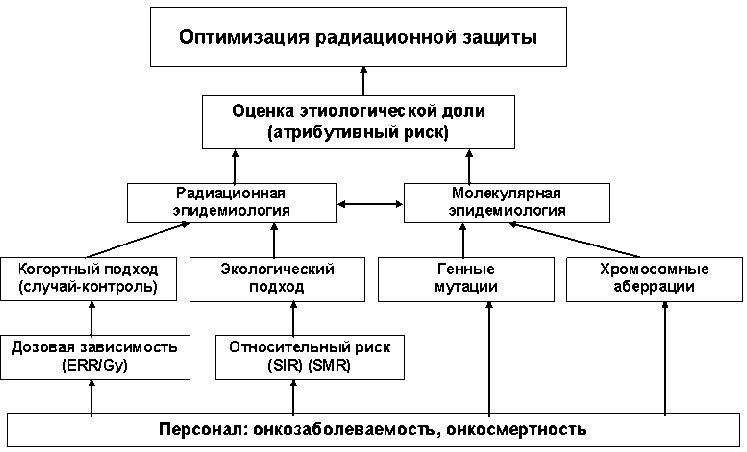
Рис . 1. Технология оценки онкологического риска на основе молекулярной и радиационной эпидемиологии.
Материалы и методы
Определение генных мутаций по локусу Т-клеточного рецептора
Метод определения генных мутаций по локусу Т-клеточного рецептора был разработан в Японии в Фонде по исследованию радиационных эффектов [16] и использован нами с небольшими модификациями.
Принцип метода заключается в следующем. Т-клеточный рецептор, состоящий из нескольких белковых цепей, играет главную роль в распознавании антигена и активации зрелых
Т-клеток. Он находится на поверхности зрелых Т-лимфоцитов и образует комплекс с CD3-антигеном. Мутации, которые происходят в локусе, кодирующем белки TCR, могут быть выявлены по изменению способности последнего образовывать комплекс с СD3-антигеном. В случае такой мутации на поверхности Т-клеток отсутствует TCR/CD3-комплекс. Поэтому мутантные Т-клетки (в отличие от немутантных) не связывают антитела к CD3 антигену и по этому признаку регистрируются с помощью проточной цитометрии. Как известно, кроме Т-клеток в периферической крови находятся и другие субпопуляции лимфоцитов, которые так же, как и мутантные Т-клетки, характеризуются отсутствием СD3-антигена. По этой причине одновременно с выявлением CD3-антигена необходимо очень точно выявить сами Т-клетки. Это делают с помощью антител к CD4-антигену. В итоге получают распределение лимфоцитов периферической крови по интенсивности связывания указанных антител, как показано на рисунке 2. Анализируя это распределение, определяют количество мутантных CD4+/CD3- клеток.
НИЗКАЯ ЧАСТОТА CD4+CD3-МУТАНТНЫХ КЛЕТОК
ВЫСОКАЯ ЧАСТОТА CD4+CD3-
МУТАНТНЫХ КЛЕТОК
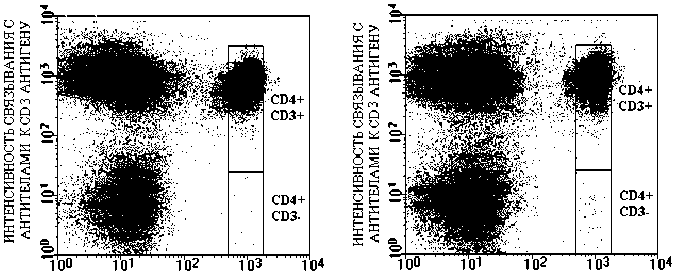
ИНТЕНСИВНОСТЬ СВЯЗЫВАНИЯ с АНТИТЕЛАМИ К CD 4 АНТИГЕНУ
ИНТЕНСИВНОСТЬ СВЯЗЫВАНИЯ С АНТИТЕЛАМИ К CD 4 АНТИГЕНУ
Рис . 2. Распределение лимфоцитов периферической крови по интенсивности связывания антител к CD3 и CD4-антигенам.
Подробное описание методики приведено ниже. Венозная кровь обследуемых лиц была помещена в пробирки с гепарином и транспортирована к месту анализа в течение 1 ч. С помощью центрифугирования в градиенте плотности фиколл-урографина («Панэко», РФ, плотность 1,077) из 3 мл крови выделяли мононуклеарную фракцию клеток. При этом кровь, разбавленную в два раза раствором Хенкса («Панэко», РФ), наслаивали на 3 мл раствора фиколл-урографина и центрифугировали в течение 30 минут при 250 g. Клетки из слоя мононуклеаров собирали и отмывали по 2 раза раствором Хенкса, а затем 0,01 М фосфатным буфером, содержащем 0,15 М NаCl (ФБ, рН 7,2), с помощью центрифугирования при 350 g в течение 15 мин. Для последующего окрашивания отбирали (1,0-1,5)⋅106 клеток.
Окрашивание мононуклеарных клеток проводили по методике, описанной в работе [18], с некоторыми модификациями. К клеткам приливали по 10 мкл моноклональных антител: к CD4, меченных ФИТЦем, к CD3 и HLA-DR, меченных фикоэритрином («Becton Dickinson Immunocytometry Systems» - «BDIS», США), и инкубировали в темноте 30 минут. Затем клетки отмывали в 1,0 мл ФБ, содержащего 1,0 % бычьего сывороточного альбумина («Sigma», США) и 0,1 % NaN 3
(«Sigma», США), с помощью центрифугирования (300 g, 5 мин). К осадку добавляли 0,5 мл ФБ, затем суспензию клеток фильтровали через нейлоновый фильтр (Д-45 мкм) и фиксировали в 0,5 мл 1 % раствора формальдегида в ФБ.
Образцы анализировали на проточном цитофлуориметре FACS Vantage («BDIS», США), оборудованном 488 нм лазером (Enterprise 621, Coherent Inc., США) не позднее, чем через 2 часа после окрашивания. Анализ клеток в образце проводили по четырем параметрам: интенсивности прямого и бокового светорассеяния (линейная шкала), флуоресценции ФИТЦа и фикоэритрина (логарифмическая шкала). Для измерения флуоресценции ФИТЦа использовали узкополосные фильтры 530/30 нм, фикоэритрина – 575/26 нм. Мощность лазера составляла 30 мВт.
Компьютерную обработку проводили с использованием программы LysysΙΙ («BDIS», США). На графике распределения клеток по интенсивности светорассеяния выбирали регион неповрежденных лимфоцитов и в дальнейшем оценивали флуоресценцию клеток, меченных ФИТЦем и фикоэритрином, только в этом регионе. На графике распределения клеток по интенсивности флуоресценции определяли количество клеток с иммунофенотипом СD3+CD4+, характерным для Т-хелперных лимфоцитов, и с вариантным иммунофенотипом СD3-СD4+, который соответствует клеткам с мутациями по TCR-локусу. Частоту мутантных клеток определяли как отношение числа клеток с фенотипом СD3-CD4+ к числу СD3+СD4+клеток. В каждом образце анализировали 2⋅105 лимфоцитов.
Основные характеристики профессионального облучения обследованных лиц
В настоящее время в ФЭИ с источниками ионизирующего излучения (ИИИ) работает около 1100 человек, 80 % из которых – мужчины. Эти люди находятся на индивидуальном дозиметрическом контроле. Электронная база данных индивидуального дозиметрического контроля содержит персонифицированную информацию о ежегодных дозовых нагрузках персонала с момента начала работы с ИИИ. На рисунке 3 приведена динамика годовых доз облучения работника, который начал работать с 1963 г. В 1980 г. он получил наибольшую дозу – 30 мЗв, а в 1990 и 1991 гг. не работал с ИИИ. За 41 год работы он получил 590 мЗв, при этом средняя за весь период работы годовая доза составила 15 мЗв/год.
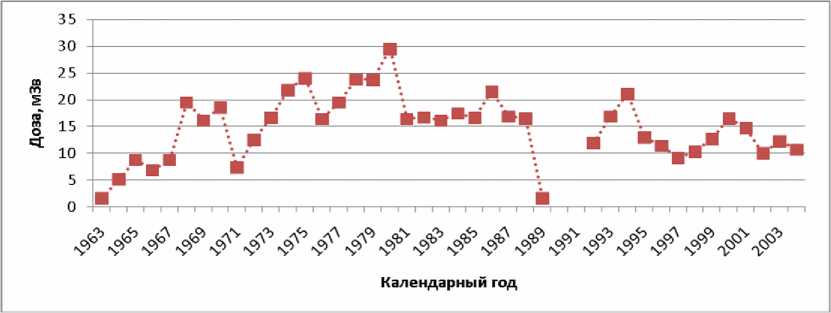
Рис . 3. Пример динамики годовых доз облучения.
Работники, находящиеся на индивидуальном дозиметрическом контроле, каждый год проходят обязательный медицинский осмотр. В ходе проведения медицинских осмотров 20022006 гг. у 320 мужчин в возрасте от 23 до 75 лет были взяты пробы крови для определения генных мутаций по локусу Т-клеточного рецептора. Распределение обследованных лиц по возрасту, достигнутому в год взятия проб крови, приведено на рисунке 4. Средний возраст – 56 лет, медиана и мода – 57 лет.
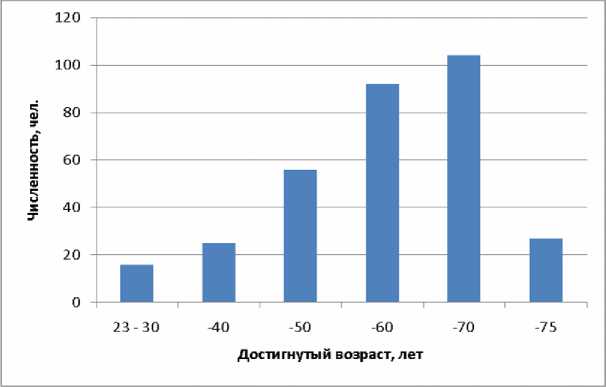
Рис . 4. Распределение обследованных лиц по возрасту, достигнутому в год взятия пробы крови.
Наиболее распространенной характеристикой профессионального облучения является величина накопленной дозы. Средняя накопленная доза у 320 обследованных лиц составила
100 мЗв, максимальная – 590 мЗв, у 270 человек накопленная доза не превысила 200 мЗв (рисунок 5).
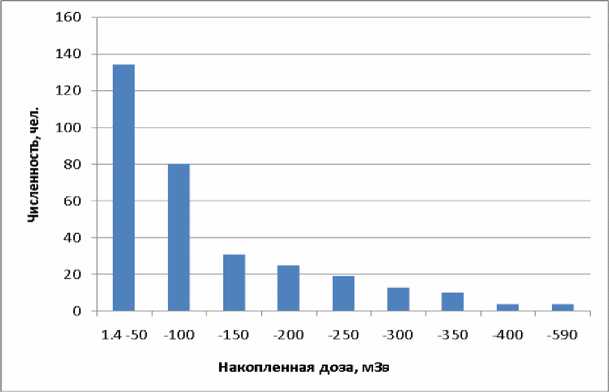
Рис . 5. Распределение обследованных лиц по накопленной дозе.
Начиная с 1972 г. среднегодовая доза облучения для всей группы обследованных лиц колебалась в пределах 2-4 мЗв (рисунок 6, по правой вертикальной оси приведена численность работников, для которых вычислялась средняя доза).
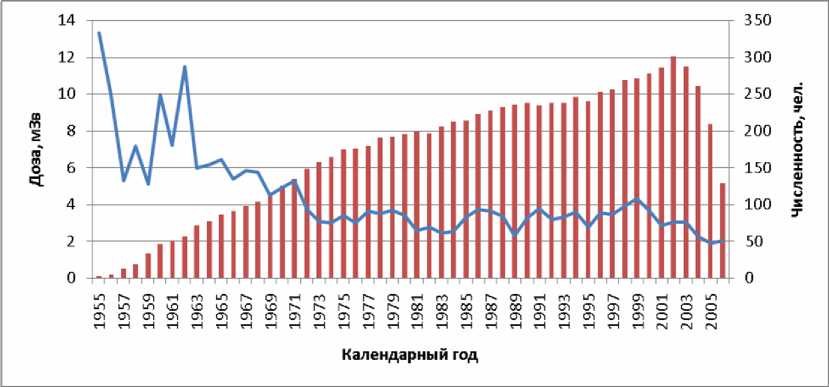
Рис . 6. Динамика среднегодовой дозы у обследованных лиц (ломаная линия) и численности работников, для которых вычислялась средняя доза (вертикальные полосы).
Несмотря на то, что в среднем за год дозы облучения небольшие, 48 работников в разное время получили годовые дозы свыше 20 мЗв, а у четверых максимальная годовая доза была более 100 мЗв (рисунок 7).
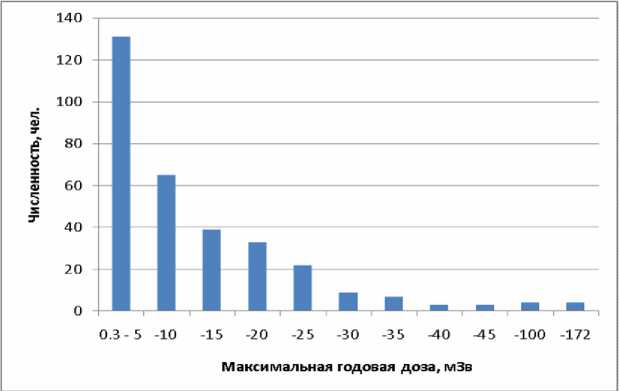
Рис . 7. Распределение обследованных лиц по максимальной годовой дозе.
Распределение обследованных лиц по длительности работы с источниками ионизирующего облучения приведено на рисунке 8. Средняя продолжительность работы с ИИИ – 26 лет, максимальная – 51 год, 202 человека проработали с ИИИ более 20 лет.
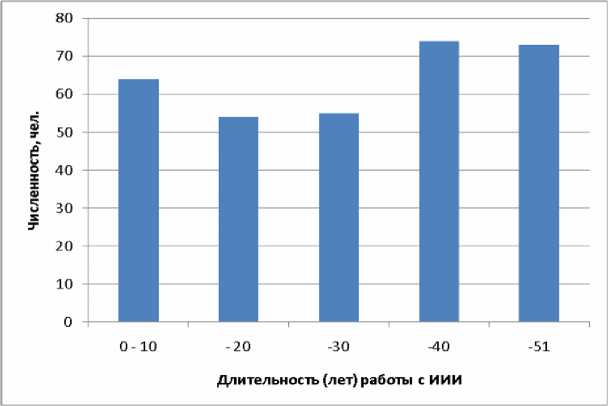
Рис . 8. Распределение обследованных лиц по длительности работы с источниками ионизирующего излучения.
Персонал начинал работать с ИИИ преимущественно в возрасте до 30 лет – 248 человек, 20 человек были в возрасте старше 50 лет на момент начала работы (рисунок 9).
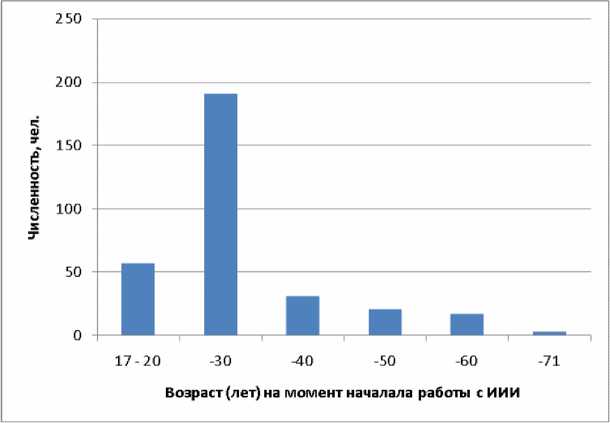
Рис . 9. Распределение обследованных лиц по возрасту на момент начала работы с источниками ионизирующего излучения.
Воздействие профессионального облучения на здоровье работника наиболее полно характеризуется такой интегральной мерой как риск, ассоциированный с фактором воздействия (атрибутивный риск) [9]. Атрибутивный риск солидных злокачественных новообразований, выраженный в процентах, AR % (или этиологическую долю) при однократном облучении обычно вычисляют исходя из оценки избыточного относительного риска ERR:
AR% =
ERR
Список литературы Формирование групп потенциального онкологического риска при профессиональном облучении на основе технологий молекулярной и радиационной эпидемиологии
- Гигиена труда. Руководство по оценке профессионального риска для здоровья работников. Организационно-методические основы, принципы и критерии оценки. P 2.2.1766-03. М.: Министерство здравоохранения РФ, 2003.
- Замулаева И.А., Смирнова С.Г., Орлова Н.В. и др. Повышенная частота мутантных по локусам Т-клеточного рецептора и гликофорина А клеток как возможный критерий для формирования группы риска онкологических заболеваний//Российский онкологический журнал. 2001. № 1. С. 23-25.
- Иванов В.К., Панфилов А.П., Василенко Е.К. и др. АРМИР: «международный аудит» состояния обеспечения радиационной безопасности//АНРИ. 2006. № 4 (47). С. 56-60.
- Иванов В.К., Цыб А.Ф., Панфилов А.П., Агапов А.М. Оптимизация радиационной защиты: «дозовая матрица». М.: Медицина, 2006. 304 с.
- Саенко А.С., Замулаева И.А. Результаты и перспективы использования методов определения частоты мутантных клеток по локусам гликофорина А и Т-клеточного рецептора для оценки генотоксического действия ионизирующих излучений в отдаленные сроки после воздействия//Радиационная биология. Радиоэкология. 2000. Т. 40, № 5. C. 549-553.
- Саенко А.С., Замулаева И.А., Смирнова С.Г. и др. Соматический мутагенез у облученных в малых дозах лиц в отдаленные сроки после воздействия//Труды регионального конкурса научных проектов в области естественных наук. Калуга: Эйдос, 2003. Вып. 4. С. 233-237.
- Akiyama M., Kyoizumi S., Hirai Y. et al. Mutation frequency in human blood cells increases with age//Mutat. Res. 1995. V. 338. P. 141-149.
- Akiyama M., Umeki S., Kusunoki Y. et al. Somatic-cell mutation as a possible predictor of cancer risk//Health Phys. 1995. V. 68. P. 643-649.
- Breslow N.E., Day N.E. Statistical methods in cancer research. IARC Scientific publications N 32. Lyon, 1980. P. 73-78.
- Cole J., Scopek T.R. Somatic mutant frequency, mutation rates and mutational spectra in the human population in vivo//Mutat. Res. 1994. V. 304. P. 33-105.
- Dean A.G., Sullivan K.M., Soe M.M. OpenEpi: Open Source Epidemiologic Statistics for Public Health, Version 2.2.1. www.OpenEpi.com.
- Grant B.W., Trombley L.M., Hunter T.C. et al. HPRT mutations in vivo in human CD34+ hemopoietic stem cells//Mutation Research. 1999. V. 431. P. 183-198.
- http://csrld.org.uk.
- Ivanov V.K., Tsyb A.F., Agapov A.M. et al. Concept of optimization of the radiation protection system in the nuclear sector: management of individual cancer risks and providing targeted health care//Journal of Radiation Protection. 2006. V. 26. P. 361-374.
- Ivanov V.K., Tsyb A.F., Panfilov A.P. et al. Estimation of individualized radiation risk from chronic occupational exposure in Russia//Health Physics. 2009. V. 97, N 1. P. 470-477.
- Kyoizumi S., Akiyama M., Hirai Y. et al. Spontaneous loss and alteration of antigen receptor expression in mature CD4+ T cells//J. Exp. Med. 1990. V. 171. P. 1981-1999.
- Kyoizumi S., Kusunoki Y., Seyma T. et al. In vivo somatic mutations in Werner's syndrome//Hum. Genet. 1998. V. 103, N 4. P. 405-410.
- Kyoizumi S., Umeki S., Akiyama M. et al. Frequency of mutant T lymphocytes defective in the expression of the T-cell antigen receptor gene among radiation-exposed people//Mutat. Res. 1992. V. 265. P. 173-180.
- Land C., Gilbert E., Smith J.M. Report of the NCI-CDC Working Group to Revise the 1985 Radioepidemiological Tables, NIH Publication No. 03-5387. Washington, DC: US Department of Health and Human Services, 2003. 118 p.
- Little J.B. Radiation-induced genomic instability//Int. J. Radiat. Biol. 1998. V. 74, N 6. P. 663-671.
- Loeb L.A. Mutator phenotype may be required for multistage carcinogenesis//Cancer Research. 1991. V. 51. P. 3075-3079.
- National Council on Radiation Protection (NCRP). Uncertainties in fatal cancer risk estimates used in radiation protection. NCRP Report No. 126. Bethesda, MD, 1997. 111 p.
- Pathak S. Organ-and tissue-specific stem cells and carcinogenesis//Anticancer Research. 2002. V. 22. P. 1353-1356.
- Schmutte C., Fishel R. Genomic instability: first step to carcinogenesis//Anticancer Research. 1999. V. 19. P. 4665-4696.
- United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR). UNSCEAR 2006 Report Vol. I: Effects of Ionizing Radiation. New York: Unated Nations, 2008. P. 216.
- Vijg J. Somatic mutations and aging: a re-evaluation//Mutation Research. 2000. V. 447. P. 117-135.


