Формирование групп риска повышенного уровня соматического мутагенеза среди работников предприятия атомной промышленности г. Обнинска
Автор: Горский А.И., Щукина Н.В., Замулаева И.А.
Рубрика: Научные статьи
Статья в выпуске: 4 т.34, 2025 года.
Бесплатный доступ
В основе развития злокачественных новообразований лежат соматические мутации. Можно полагать, что частота возникновения мутантных клеток и их сохранение являются показателем предрасположенности к канцерогенезу. Разработан подход для формирования групп повышенного риска соматического мутагенеза среди работников атомной отрасли, базирующийся на статистическом анализе частоты TCRмутантных лимфоцитов в периферической крови человека. В основу статистического анализа положен взвешенный метод наименьших квадратов. Критерием для включения конкретной персоны в группу риска является частота мутантных клеток, которая превышает верхнюю границу 95% доверительного интервала, рассчитываемого индивидуально для каждого лица с учётом возраста, фактора курения и индивидуальной дозы облучения. Подход апробирован с использованием данных измерений частоты мутантных клеток у 339 работников мужского пола Физикоэнергетического института им. А.И. Лейпунского (г. Обнинск), одного из старейших предприятий атомной отрасли России. В среднем для всей исследованной группы работников наблюдалось статистически значимое увеличение частоты TCRмутантных клеток с увеличением средней годовой накопленной дозы облучения. Сформированы группы повышенного риска среди обследованных работников. Среди обследованных 339 лиц группа риска включает 23,6% работников.
Соматический мутагенез, TCR-метод, радиационный риск, доза радиации, курение, группа онкологического риска, метод наименьших квадратов, линейная модель, радиобиология, здравоохранение
Короткий адрес: https://sciup.org/170211336
IDR: 170211336 | УДК: 621.039+616-006.6-02:575.224.46.043 | DOI: 10.21870/0131-3878-2025-34-4-18-27
Текст научной статьи Формирование групп риска повышенного уровня соматического мутагенеза среди работников предприятия атомной промышленности г. Обнинска
Как известно, радиационный риск возникновения злокачественных новообразований (ЗНО) зависит не только от физических факторов (доза, мощность дозы, качество излучения), но и биологических (возраст, индивидуальная способность репарировать повреждения ДНК, элиминировать повреждённые клетки и т.д.). Однако, если первые составляют основу при формировании групп повышенного канцерогенного риска, то вторые (за исключением возраста) практически никак не учитываются.
В последние годы значительные усилия специалистов в области радиационной генетики были направлены на поиск наследственных факторов индивидуальной радиочувствительности, которые были бы полезны в плане оценки канцерогенного риска. Однако в этой связи следует отметить, что только 5-10% от всех случаев онкологических заболеваний составляют наследственные формы ЗНО, причиной которых являются герминальные мутации или полиморфизм. И ещё 15-25% случаев относят к семейным формам ЗНО, когда частота онкологических заболеваний у членов одной семьи повышена, но не установлены конкретные гены и мутации, ставшие причиной развития онкологической патологии [1]. Принято считать, что около 80% ЗНО являются спорадическими и развиваются в результате накопления в соматических клетках генетических нарушений, возникающих под действием канцерогенных факторов в процессе жизни человека. Поэтому, несмотря на достижения в области изучения генома человека, выяснение наследственных факторов канцерогенного риска даже в перспективе вряд ли позволит объяснить возникновение подавляющего большинства ЗНО, включая радиационно-индуцированные.
Горский А.И.* – вед. науч. сотр., к.т.н.; Щукина Н.В. – ст. науч. сотр.; Замулаева И.А. – зав. отд., д.б.н., проф. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
В то же время общеизвестно, что в основе развития ЗНО лежат соматические мутации, а уровень соматического мутагенеза зависит не только от интенсивности генотоксического воздействия, но и от перечисленных выше индивидуальных особенностей организма, включая наследственные особенности. Поэтому можно полагать, что именно эффективность возникновения и сохранения мутантных клеток является интегральным показателем предрасположенности к канцерогенезу. Следовательно, при формировании групп канцерогенного риска необходимо учитывать уровень соматического мутагенеза.
В настоящее время имеется техническая возможность определять частоту соматических мутаций в нескольких генных локусах клеток периферической крови [2]. Среди них перспективным представляется локус, кодирующий белки Т-клеточного рецептора (T-cell receptor – TCR), т.к. доказано, что: 1) количество таких клеток увеличивается при действии генотоксических факторов (включая ионизирующие излучения) на организм человека; 2) у лиц с наследственной предрасположенностью к возникновению ЗНО наблюдается крайне высокая частота TCR-мутантных клеток [2-4]; 3) радиационно-индуцированная нестабильность генома действительно проявляется по TCR-локусу после действия радиации в малых дозах [5, 6]; 4) больные раком ряда локализаций имеют повышенную частоту TCR-мутаций [7, 8]; 5) TCR-метод обладает достаточно высокой производительностью при относительно невысокой стоимости. Детальное описание этого метода приведено в работах [8, 9].
Учитывая все вышеперечисленные обстоятельства, в 2002-2006 гг. у сотрудников ГНЦ РФ – ФЭИ было проведено обследование, по результатам которого определена частота TCR-мутантных клеток с целью выяснения зависимости этого показателя соматического мутагенеза от дозы, возраста, курения и результатов анализа гетерогенности облучённого персонала по индивидуальной реакции на радиационное воздействие как потенциальной основы для формирования групп канцерогенного риска.
Материалы и методы
Общее описание обследованных лиц
Частота TCR-мутантных клеток определена у 339 сотрудников (мужского пола) ГНЦ РФ – ФЭИ (г. Обнинск), одного из старейших предприятий атомной индустрии России. Выбор обследованных лиц произведён случайным образом при проведении ежегодных медицинских осмотров сотрудников, находящихся на индивидуальном дозиметрическом контроле. На рис. 1 приведено распределение обследованной группы сотрудников по накопленной дозе.
Как видно из рис. 1, у половины обследованных лиц накопленная доза превышает 200 мЗв. Среднее значение накопленной дозы равно 100 мЗв.
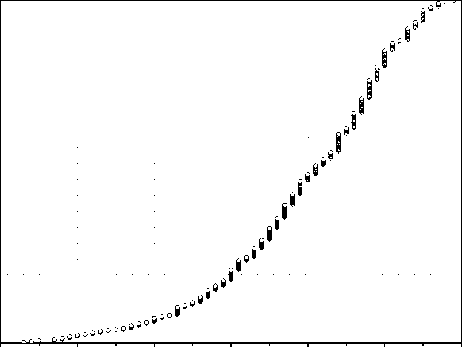
Рис. 2 представляет распределение сотрудников по возрасту на момент забора крови для анализа. Более половины сотрудников имеют возраст старше 60 лет, т.е. находятся в группе повышенного онкологического риска, который растёт с увеличением возраста. Средний возраст в группе равен 56,4 года.
По данным литературы [10-14] частота мутантных клеток у человека возрастает с увеличением его возраста. Поэтому результаты наблюдений при анализе были сгруппированы в четыре возрастные группы с интервалами на момент забора крови: 18-49, 50-59, 60-69 и 70-79 лет. На частоту мутантных клеток у человека могут влиять также курение и доза ионизирующей радиации. Основные характеристики выбранных возрастных групп приведены в табл. 1. Общее число мутантных клеток равно 1927.
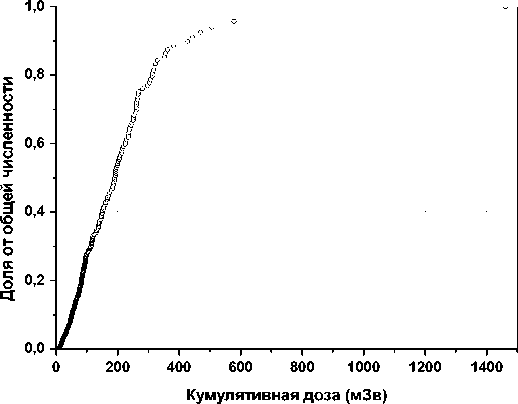
Рис. 1. Распределение группы из персонала ГНЦ РФ – ФЭИ по накопленной дозе на момент обследования (2002-2006 гг.).
1,0
0,0
с 0,8
s
ь г 0,6 г
Q 0,4 X
20 30 40 50 60 70 80
Возраст на момент взятия пробы крови (годы)
Рис. 2. Распределение группы из персонала ГНЦ РФ – ФЭИ по возрасту на момент обследования (2002-2006 гг.).
Таблица 1
Основные характеристики возрастных групп
|
Характеристики |
Возрастные группы, годы |
|||
|
18-49 |
50-59 |
60-69 |
70-79 |
|
|
Число лиц |
82 |
95 |
100 |
61 |
|
Средний возраст, годы |
38,8 |
53,8 |
64,0 |
72,2 |
|
Доля курильщиков |
0,40 |
0,43 |
0,43 |
0,28 |
|
Средняя годовая накопленная доза, мЗв |
4,10 |
3,62 |
2,68 |
3,38 |
|
Среднее число мутантных клеток на 10000 |
4,94 |
6,13 |
5,58 |
6,26 |
Метод анализа (взвешенный метод наименьших квадратов)
Пусть частота мутантных клеток у M =339 сотрудников зависит от n =3 факторов риска (возраст, курение, доза облучения). Частоту мутантных клеток для i -ой персоны ( i =1, 2, ..., M =339) можно задать линейной моделью зависимости от факторов риска мутагенеза:
ЛОХ d) = Z '=1 W • f tj + в з -^ + ь , (1)
где и - возраст; 0 (и) - коэффициент чувствительности мутаций к воздействию фактора j ( j =1 -возраст, j =2 - курение); 0 i (u) - спонтанная частота мутантных клеток в возрасте и ( f i,i =1); 0 з -коэффициент чувствительности к дозе облучения; d i - доза облучения i -ой персоны; s i - ошибка определения частоты мутантных клеток у i -ой персоны; f i,j - дихотомная переменная, принимающая значение 1 при наличии воздействия j -го фактора, или 0 - в противоположном случае.
Математический аппарат метода наименьших квадратов хорошо разработан и в дальнейшем будем следовать изложению этого метода, приведённого в работе [15].
В общем виде модель, описывающую зависимость мутаций от изучаемых факторов риска, выразим системой уравнений:
у = W-1A •в + Е , (2)
где W-1 - обратная весовая матрица; A - матрица плана; 0 - вектор определяемых коэффициентов (коэффициентов чувствительности); s - вектор ошибок, которые считаем независимыми и с математическими ожиданиями, равными нулю; величина у - вектор частоты мутантных клеток в определённый период.
Далее предположим, что дисперсии ошибок отдельных измерений известны с точностью до постоянного множителя, т.е. ст 2 = ы} • ст 2 . Естественно предположить, что ошибка измерения будет обратно пропорциональна общей численности клеток, использованных для определения числа мутантных клеток. Выбрав численность клеток для любой персоны в качестве нормирующего множителя ( N 0 ), получим, что веса о будут равны отношению численности N j /N 0 .
В рассматриваемой модели (2) матрица W = diagtWi'5,^'5,...,^5') , матрица A плана состоит из n векторов-столбцов, в первых n -2 столбцах нули и единицы, в зависимости от того, в какую возрастную группу попадает рассматриваемая персона, в n -1 столбце - нули или единицы, в зависимости от фактора курения, и в n -ом столбце - значения дозы облучения, 0 =( 0 i , 0 2 ,...,&i)T , У=(У 1 ,У 1 ,-;У м )Т и S =( s i , S 2 ,..., S M )T .
Решение системы (2) равно [16]:
в = (Ат • У -1 • A) -1 • Ат • У -1 • у , (3)
где V = W •W = diag(M1'M2,...,MM) .
Дисперсионная матрица вектора § равна:
D@) = о 2 • (А т • V -1 • А) -1 . (4)
Дисперсией j -го параметра будет j -й диагональный элемент матрицы (4), а ковариация cov(d},dk) равна ( j , к ) элементу.
Остаточная сумма квадратов для модели (2), необходимая для оценки дисперсии ошибки, имеет вид:
г=(у-А^д)т •У-^у-А^в) , (5)
а сама дисперсия оценивается из выражения:
92 = r/(M-ri) , (6)
где n – число определяемых параметров.
Дисперсия для показателя интенсивности мутаций для персоны i – линейная комбинация параметров fT - в = f± - в±+ f2- e2+...+f ■ eri , где fT - вектор значений дихотомной переменной f определяется из формулы:
92-(fT -(AT -V-1-A)-1-fT).(7)
Центральный доверительный 100(1- a )% интервал для параметра et определяется с использованием распределения Стьюдента с ( M - n ) степенями свободы:
(di + tM-ri-trijA-i),(8)
где A i,i - диагональный элемент матрицы (A T - V -1 - A) -1 .
Приближённый доверительный интервал (ДИ) для показателя частоты мутантных клеток у конкретной персоны (fT - д) рассчитывается следующим образом:
(Г - в) ± t^^ -9-(Г- (AT - V-1 - A)-1 - fT)05.(9)
Таким образом, если наблюдаемое значение частоты мутантных клеток для конкретной персоны превышает 95% ДИ, рассчитанный по формуле (9), персона включается в группу онкологического риска.
Определение группы риска среди сотрудников ГНЦ РФ – ФЭИ, находящихся на индивидуальном дозиметрическом контроле
Результаты расчёта спонтанной частоты мутантных клеток (за вычетом эффектов курения и облучения) и избыточной частоты, связанной с исследуемыми факторами (избыточный абсолютный риск, EAR), приведены в табл. 2. Суммарная спонтанная частота мутантных клеток, полученная при расчёте по модели (1) с коэффициентами табл. 2, равна 1678.
Таблица 2
Оценки коэффициентов модели (1)
|
Параметр |
θ 1 (u), 1/10000 |
θ 2 , 1/10000 |
θ 3 , 1/(Зв·10000) |
|||
|
Возраст (u), годы Оценки параметров при учёте среднегодовой накопленной дозы 95% ДИ |
18-49 3,9 2,3; 5,4 |
50-59 5,1 3,6; 6,6 |
60-69 5,0 3,6; 6,3 |
70-79 5,2 3,5; 6,8 |
||
|
0,3 -1,0; 1,6 |
0,024 4,4×10-3; 0,044 |
|||||
Как видно из табл. 2, избыточный риск мутаций значим для дозы и статистически не значим для курения. Согласно статистике хи-квадрат по данным табл. 2, статистически значимый тренд частоты спонтанных мутаций по возрасту не выявлен.
Так как зависимость мутаций от возраста и эффекта курения статистически не значимы, рассмотрим модель с двумя факторами: спонтанные мутации и средняя годовая накопленная доза. Для спонтанных мутаций коэффициент модели равен 4,90 (3,99; 5,82 95% ДИ), для дозы 0,023 (4,17×10-3; 0,043) на 1 Зв.
Для каждого обследованного сотрудника с этими коэффициентами были рассчитаны индивидуальные риски мутаций и выявлены лица, которые в соответствии с предложенной моделью могут быть отнесены к группе повышенного канцерогенного риска. Численность группы риска равна 80 человек или 23,6% от полной численности группы.
Дозовая и возрастная структуры группы риска показаны в табл. 3, где представлено двумерное распределение отношение числа лиц, попавших в группу риска в определённой категории возраста (колонки), и средней годовой накопленной дозы (ряды), к полной численности обследованных в этой категории. Трёхмерное отображение затенённой матрицы представлено на рис. 3.
Таблица 3
Доли лиц, попавших в группу риска повышенного мутагенеза, по дозовозрастным группам (средняя годовая доза)
|
Возраст, годы |
0 |
1 |
2 |
3 |
|
|
Доза |
, мЗв |
18-49 |
50-59 |
60-69 |
70-79 |
|
0 |
[0-2] |
0,22 |
0,60 |
0,11 |
0,33 |
|
1 |
(2-4] |
0,16 |
0,13 |
0,27 |
0,08 |
|
2 |
(4-8] |
0,24 |
0,21 |
0,13 |
0,50 |
|
3 |
(8+) |
0,32 |
0,09 |
0,11 |
0,00 |
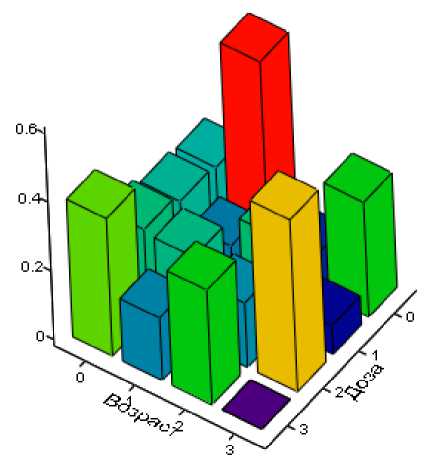
Рис. 3. Распределение частоты попадания в группу риска в зависимости от возраста и дозы радиации (ось Х – возрастная группа; ось У – доза радиации, мЗв; ось Z – доля лиц с повышенным мутагенезом, отн. ед.).
Как следует из приведённых табл. 3 и рис. 3, наибольшие доли лиц с повышенным мутагенезом наблюдались для возрастной категории 50-59 лет при среднегодовых дозах облучения до 2 мЗв (доля лиц в группе риска 0,60) и для возрастной категории 70-79 лет при среднегодовых дозах облучения свыше 4 мЗв (доля лиц в группе риска 0,5).
Суммарная доля лиц, предрасположенных к канцерогенезу в рассматриваемой группе, составляет 23,6%, что близко к доле лиц, заболевающих онкологическими заболеваниями по данным государственной медицинской статистики России.
Обсуждение
Задача формирования групп онкологического риска, в том числе и радиогенного, не является новой. Например, в публикации [17] группы онкологического и радиогенного риска были сформированы для того же набора соматических мутаций, использованного в данном исследовании. Для групп онкологического риска критерием отбора был 95% перцентиль функции распределения мутантных клеток (15 мутаций на 10000 клеток), для группы радиогенного риска – пожизненный 10% атрибутивный риск, полученный по модели риска НКДАР ООН [18].
Формирование групп повышенного радиационного риска среди облучённых лиц (в частности ликвидаторов последствий аварии на ЧАЭС) является одним из приоритетных направлений работ Национального радиационно-эпидемиологического регистра (НРЭР). В работе [19] получены прогнозные пожизненные оценки радиационных рисков заболеваемости ЗНО и цереброваскулярными заболеваниями для ликвидаторов, начавших работу в чернобыльской зоне в 1986-1987 гг.
Оценки радиационных рисков в этих работах проведены с использованием моделей, рекомендованных Международной комиссией по радиологической защите (МКРЗ) для обоснования международных норм радиационной безопасности, а также с использованием моделей, разработанных в НРЭР для прогноза ожидаемых радиационных рисков в когорте российских ликвидаторов. Для исследованной когорты российских ликвидаторов предложена методика формирования групп радиационного риска на основе одной из количественных оценок радиационного риска – пожизненной атрибутивной доли радиации (LARF).
С учётом международной правоприменительной практики в группу повышенного радиационного риска включены ликвидаторы, для которых индивидуальные оценки LARF по модели МКРЗ или НРЭР превышали 10%. Показано, что в этом случае группа повышенного радиационного риска по заболеваемости ЗНО составляет не более 6,5%.
Данная работа представляет дальнейшее развитие подходов для решения проблемы прогнозирования онкологической заболеваемости, в том числе и радиогенной. Исследована зависимость количества мутантных клеток крови человека от возраста, дозы облучения и курения. В качестве фактора облучения рассматривалась средняя годовая доза, накопленная в процессе всей трудовой деятельности. Результаты анализа показали статистически значимую зависимость частоты мутантных клеток от рассмотренной дозы.
Какие же лица попадают преимущественно в группу повышенного онкологического риска? По полученным данным можно выделить 2 подгруппы: для возрастной категории 50-59 лет при среднегодовых дозах облучения в группе 0-2 мЗв (доля лиц в группе риска 0,60) и для возрастной категории 70-79 лет при среднегодовых дозах облучения в группе 4-8 мЗв (доля лиц в группе риска 0,5). С другой стороны, высокая частота мутантных клеток у этих лиц свидетельствует об их высокой индивидуальной радиочувствительности – фактор, который следует учитывать при допуске сотрудника к работе с ионизирующими излучениями, но который пока не учитывается в РФ (в отличие, например, от Хорватии [20]).
Основные выводы
-
1. Получена статистически значимая зависимость числа TCR-мутантных клеток от дозы облучения (накопленной и годовой).
-
2. Разработана методика статистического анализа для выявления лиц с повышенным уровнем соматического мутагенеза с учетом дозы радиационного воздействия и возраста. Предполагается, что в дальнейшем методика может быть использована для формирования групп повышенного канцерогенного риска среди работников атомной промышленности (после сравнительной оценки онкологической заболеваемости среди лиц с разным уровнем соматического мутагенеза по критерию частоты TCR-мутантных клеток).
-
3. Показано, что доза облучения не всегда является определяющим фактором при прогнозировании медико-биологических последствий облучения.
-
4. Сформированы группы риска повышенного уровня мутагенеза среди обследованного персонала ГНЦ РФ – ФЭИ. Среди обследованных 339 лиц в группу риска попали 23,6% сотрудников.


