Формирование и функционирование микробных матов минерального источника Хойто-Гол (Восточный Саян)
Автор: Кашкак Елена Сергеевна, Гайсин Василь Анварович, Дагурова Ольга Павловна, Брянцева Ирина Андреевна, Данилова Эржена Викторовна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-2 т.18, 2016 года.
Бесплатный доступ
Проведено исследование видового состава бактерий, участвующих в продукции и деструкции органического вещества, в микробных матах источника Хойто-Гол, расположенного в горной системе Восточного Саяна. Химический анализ воды минерального источника показал, что вода относится к гидрокарбонатно-натриевому типу с содержанием сероводорода до 7 мг/л. Сероводород поступает с вулканическими флюидами, а также из донных осадков в результате микробной сульфатредукции. Установлено, что основными формообразующими бактериями микробных матов источника являются цианобактерии Phormidium sp. и бесцветные серобактерии Thiothrix sp. Была обнаружена высокая численность автотрофных и гетеротрофных микроорганизмов (до 108 кл/мл). Отличительной особенностью микробных матов источника Хойто-Гол являлось доминирование и разнообразие бактерий цикла серы. Важная роль бактерий серного цикла в источнике Хойто-Гол подтверждается высокими численностями сульфатредуцирующих и тионовых бактерий, интенсивностями процессов сульфатредукции и аноксигенного фотосинтеза. Выделены чистые культуры пурпурных несерных бактерий ( Rhodopseudomonas palustris, Rhodobacter capsulatus, Rhodomicrobium vannielii ), нитчатых аноксигенных бактерий ( Oscillochloris trichoides ), зеленых серобактерий ( Chlorobium limicola ), тионовых бактерий ( Thiobacillus thioparus ), сульфатредуцирующих бактерий ( Desulfovibrio alcoholivorans ) и показано их участие в цикле серы в микробных матах.
Микробные маты, цианобактерии, аноксигенные фототрофные бактерии, тионовые бактерии, бесцветные серобактерии, сульфатредуцирующие бактерии, хлорофилл, бактериохлорофилл, продукция, деструкция, круговорот серы, сульфидсодержащие источники, восточный саян
Короткий адрес: https://sciup.org/148204495
IDR: 148204495 | УДК: 576.809.51
Текст научной статьи Формирование и функционирование микробных матов минерального источника Хойто-Гол (Восточный Саян)
формирования и функционирования матов [7]. Формирование микробных матов определяется многими факторами, такими, как температура, рН, освещение, содержание сероводорода, химический состав воды; расстояние от выхода источника также может влиять на сукцессию микроорганизмов [2, 8].
Сульфидные термальные источники с нейтральными или щелочными значениями рН относительно редко встречаются [2]. Бактерии, которые в них развиваются, часто образуют маты или длинные нити, которые могут быть белого или ярко-желтого цвета из-за осажденной серы. В этих источниках важнейшим абиотическим фактором, влияющим на формирование микробного сообщества, является сероводород. К такому типу источников относится мезотермальный источник Хойто-Гол, расположенный в горной системе Восточного Саяна. Особенности формирования микробных матов и оценка активности физиологических групп микроорганизмов в матах этого источника изучены недостаточно полно. Ранее были исследовано влияние экологических условий на распределение микроорганизмов и роль микроорганизмов в травер-тинобразовании [9-11].
Цель исследования :– изучение особенностей формирования и функционирования микробных матов сульфид-содержащего источника Хойто-Гол.
Материалы и методики исследования. Минеральный источник Хойто-Гол имеет 5 выходов воды, расположенных вниз по течению реки Аршан (приток реки Хойто-Гол) на высоте 1712 м над уровнем моря
(52.37.255 N, 099.00.875 E). Пробы воды и микробных матов отбирали летом 2013 г. Определение физикохимических характеристик воды проводили с помощью портативных приборов и стандартных методов гидрохимии [12]. Скорости микробных процессов определяли радиоизотопным методом [13]. Учет численности зеленых нитчатых бактерий, зеленых и пурпурных серобактерий, пурпурных несерных бактерий, тионовых, целлюлозоразлагающих, амилолитических, протеолитических, сульфатредуцирующих бактерий проводили методом предельных разведений на селективных питательных средах [14]. Морфологию клеток, размеры и подвижность изучали микроскопированием с помощью световых микроскопов Axiostar plus (Carl Zeiss, Германия) и Olympus BX 41 (Olympus, Япония). Исследование поверхности и элементного состава микробных матов и пленок, образовавшихся при культивировании тионовых бактерий, проводили с помощью сканирующего электронного микроскопа SEM TM-1000 (HITACHI, Япония). Определение таксономической принадлежности цианобактерий проводили на основании морфологических признаков по определителям [15, 16]. Пигментный состав фототрофных бактерий определяли по положению максимумов на спектрах поглощения пигментов, полученных на спектрофотометре СФ-56 (ЛОМО, Россия).
ДНК клеток монокультур аноксигенных нитчатых фототрофных бактерий выделяли с помощью ЦТАБ-метода с незначительными изменениями [17].
ДНК клеток всех остальных культур бактерий выделяли с помощью метода, описанного ранее Булыгиной с соавторами [18]. Молекулярно-генетическую идентификацию монокультур аноксигенных фототрофных бактерий и чистых культур сероокисляющих и суль-фатредуцирующих бактерий проводили посредством анализа последовательностей генов 16S рРНК и fmoA (Fenna–Matthews–Olson protein) в Центре «Биоинженерия» РАН (г. Москва). Сравнительный анализ нуклеотидных данных с последовательностями базы данных GenBank проводили с помощью программных пакетов BLAST .
Результаты исследования и их обсуждение.
Характеристика минерального источника Хойто-Гол. В период исследования температура воды в местах отбора проб составляла 32,5-34,0°С, рН воды был нейтральным (табл. 1). Тип воды источников – гидрокарбонатно-натриевый. Содержание гидрокар-бонат-ионов составляло более 400 мг/дм3, содержание СО 2 достигало 57,0 мг/дм3. Содержание ионов Na+ составляло 143-149 мг/дм3. Низкий окислительновосстановительный потенциал (от -23 до -130 мВ) обусловлен, скорее всего, наличием сероводорода, поступающего с вулканическими эксгаляциями, а также из донных осадков в процессе сульфатредукции. Содержание сероводорода колебалось от 0,52 до 7,05 мг/дм3. По литературным данным, содержание сульфида может достигать 20 мг/л [9]. Концентрация ионов SO 4 2-достигала 33 мг/дм3, а Сl- – 24 мг/дм3.
Таблица 1. Физико-химические и микробиологические показатели источника Хойто-Гол
|
Станция |
Описание микробных матов |
T, °C |
рН |
H 2 S, мг/л |
Видовой состав матообразующих форм бактерий |
|
Hg1 верхний выход источника |
тонкая зеленая биопленка толщиной 1 мм |
34,0 |
7,32 |
6,69 |
цианобактерии Phormidium sp., Anaba-ena sp., Microcystis sp. |
|
Hg2 новый выход |
темно-зеленый мат толщиной 5 мм |
33,6 |
7,33 |
7,03 |
цианобактерии Phormidium sp., Ana-baena sp., Microcystis sp. |
|
далее по ручью: Hg2-1 в 3 м от ст. Hg2 |
зеленый мат с белыми и рыжими обрастаниями толщиной до 2 см |
33,4 |
7,45 |
7,05 |
цианобактерии Phormidium sp., Ana-baena sp., Oscillatoria sp., Synechococcus sp., Gloeocapsa magma , бесцветные серобактерии Thiothrix sp. |
|
Hg2-2 в 5 м от ст. Hg2 |
серный мат с зелеными вкраплениями толщиной 1 см |
32,6 |
7,84 |
7,28 |
цианобактерии Phormidium sp., Oscilla-toria sp., Gloeocapsa magma , Synechococ-cus sp., бесцветные серобактерии Thiothrix sp. |
|
Hg2-3 ручей после ванного комплекса №1 |
зеленый мат с белыми обрастаниями толщиной 1 см |
32,5 |
7,65 |
7,17 |
цианобактерии Phormidium sp., Oscilla-toria sp., Gloeocapsa magma , Sy-nechococcus sp., бесцветные серобактерии Thiothrix sp. |
|
Hg2-4 ручей после ванного комплекса №2 |
светло-зеленый мат толщиной 7 мм |
32,7 |
7,35 |
7,03 |
цианобактерии Phormidium sp., Ana-baena sp., Oscillatoria sp., Gloeocapsa magma , Microcystis sp. |
|
Hg3 новый выход «Питьевой источник» |
тонкая зеленая биопленка толщиной 2 мм |
33,5 |
7,32 |
0,52 |
цианобактерии Phormidium sp., Anaba-ena sp., Microcystis sp. |
Описание микробных матов. В зоне выходов и вниз по ручью исследуемого источника развивались микробные маты толщиной до 2 см, которые были представлены зоной оксигенного фотосинтеза с преобладающим развитием зеленых скоплений цианобактерий и зоной развития серных бактерий (табл. 1). На верхнем выходе Hg1 и выходе питьевого источника Hg3 развивались тонкие микробные маты зеленого цвета толщиной 1-2 мм, на выходе Hg2 микробный мат был толще – до 5 мм. Основу матов на выходах источников составляли цианобактерии Phormidium sp., Ana-baena sp., Microcystis sp. Спектры поглощения пигментов из микробных матов подтверждают преобладание цианобактерий, для которых характерно наличие хлорофилла α с максимумом при 675 нм (рис. 1-1).
По изливу минерального ручья на станциях Hg2-1, Hg2-2, Hg2-3 и Hg2-4 наблюдались микробные маты толщиной до 2 см, состоящие в основном из нитчатых цианобактерий и бесцветных серобактерий Thiothrix sp. Видовой состав цианобактерий увеличивается за счет появления Oscillatoria sp., Gloeocapsa magma и Synechococcus sp. Спектры поглощения пигментов из микробных матов показывают наличие цианобактерий с хлорофиллом α (максимум поглощения при 674 нм) и аноксигенных фототрофных бактерий, содержащих ответственные за поглощение света бактериохлорофиллы (рис. 1-2). Максимум инфракрасного поглощения в клетке при 745 нм характерен для бактериохлорофилла с , имеющегося у всех зеленых серобактерий класса Chlorobi и у некоторых нитчатых аноксигенных фототрофов класса Chloroflexia . Пики 805 нм и 875 нм на спектрах поглощения пигментов в клетке указывают на присутствие бактериохлорофилла а , преобладающего у большинства пурпурных фототрофных бактерий, у всех зеленых серобактерий и нитчатых аноксигенных фототрофных бактерий.
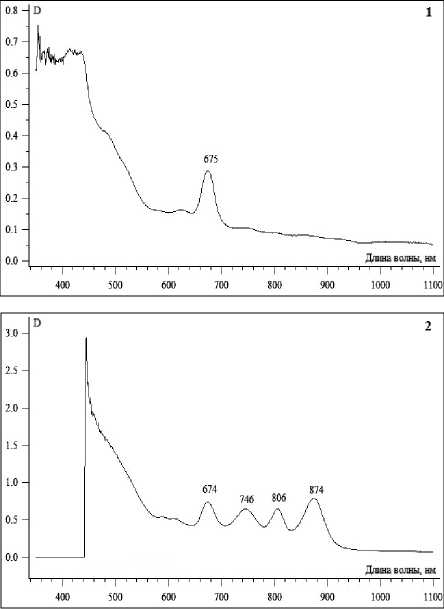
Рис. 1. Спектр поглощения микробного мата: 1 – со станции Hg2; 2 – со станции Hg2-1
Появлению в составе микробного мата бесцветных серобактерий Thiothrix sp. способствовало развитие мата в условиях проточной воды, что необходимо для создания градиента сероводорода и кислорода [19, с. 166-171]. На поверхности микробного мата формируются белые минеральные отложения. Результаты исследования элементного состава показали, что они состоят из элементной серы, содержание которой достигает 99% (рис. 2). Бесцветные серобактерии участвуют в аккумуляции и кристаллизации серы и играют важную роль в поведении системы в целом, так как в ночное время окисление соединений серы оказывается основной статьей расхода кислорода [20].

Рис. 2. Минеральные отложения: 1 – формирующиеся на поверхности микробного мата со станции Hg2-1;
2 – формирующихся на поверхности микробного мата
Интенсивность продукции и деструкции органического вещества в микробных матах. Скорость фотосинтеза в микробных матах была равна 0,17-7,61 мг С/(дм3∙сут) (табл. 2). Значительный вклад в осуществление процесса вносят аноксигенные фототрофы – скорость аноксигенного фотосинтеза составила 0,09-4,8 мгС/(дм3∙сут). Хемосинтез в микробных матах протекал со скоростью 0,05-1,43 мгС/(дм3∙сут), а гетеротрофная ассимиляция СО2 варьировала от 0,05 до 0,78 мгС/(дм3∙сут). Значения продукционных процессов исследуемого источника были ниже, чем в более высокотемпературных гидротермах [21, 22]. Были определены скорости сульфатредукции и метаногенеза, завершающие процесс анаэробной деструкции органического вещества. Скорость сульфатредукции в микробных матах исследуемого источника составила 0,04-0,93 мгS/(дм3∙сут) при расходе углерода на этот процесс 0,04-0,70 мгC/(дм3∙сут). В зеленых матах с преимущественным развитием цианобактерий, расход органического вещества на сульфатредукцию и метаногенез были примерно одинаковым. В мате с белыми обрастаниями, где происходит появление серобактерий, скорость сульфатредукции намного превышала интенсивность метаногенеза. Образование первичными анаэробами низкомолекулярных органических веществ, присутствие сульфатов способствуют активной деятельности сульфатредуцирующих бактерий.
Таблица 2. Скорость процессов продукции и деструкции в микробных матах источника Хойто-Гол
|
Процессы |
Hg1 |
Hg2 |
Hg 2-1 |
Hg2-2 |
Hg2-3 |
|
общий фотосинтез, мгС/(дм3∙сут) |
2,36 |
7,61 |
6,03 |
0,17 |
5,99 |
|
аноксигенный фотосинтез, мгС/(дм3∙сут) |
1,71 |
3,4 |
3,2 |
0,09 |
0,58 |
|
хемосинтез, мгС/(дм3∙сут) |
0,24 |
1,43 |
1,16 |
0,03 |
0,62 |
|
гетеротрофная ассимиляция СО 2 , мгС/(дм3∙сут) |
0,26 |
0,19 |
0,37 |
0,02 |
0,78 |
|
сульфатредукция, мгS/(дм3∙cут) |
0,04 |
0,28 |
0,42 |
0,93 |
0,27 |
|
расход С при сульфатредукции, мгС/(дм3∙cут) |
0,03 |
0,21 |
0,32 |
0,70 |
0,25 |
|
метаногенез, мгС/(дм3∙сут) |
0,02 |
0,06 |
0,001 |
- |
- |
|
расход С при метаногенезе, мгС/(дм3∙cут) |
0,10 |
0,23 |
0,005 |
- |
- |
Количественный учет различных физиологических групп микроорганизмов. Численность аноксигенных фототрофных бактерий, вклад которых в процесс фотосинтеза составляет около 50%, достигала 104-105 кл/см3. Кроме фототрофных бактерий, в продукции органического вещества в микробных матах участвуют также сероокисляющие бактерии, ассимилируя углекислый газ и используя энергию окисления сероводорода. Количество сероокисляющих бактерий варьировало в пределах 104-106 кл/см3. На начальных этапах деструкции главную роль играют бактерии-гидролитики, разлагающие полимерные соединения [23, с. 143-157]. Доминирующими были протеолитические бактерии, их численность достигала 108 кл/см3 в толстом продуктивном мате.
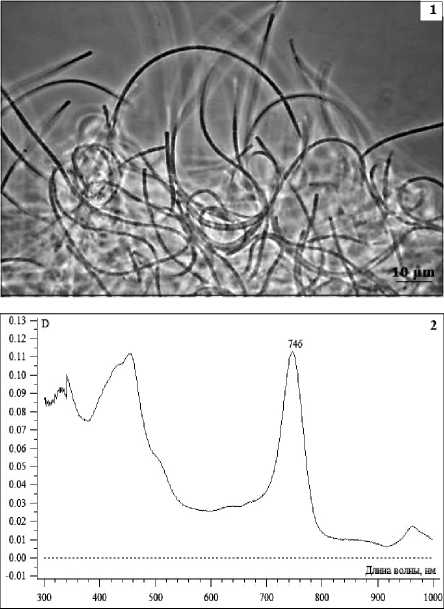
Рис. 3. 1 – морфология нитчатой аноксигенной фото-трофной бактерии Oscillochloris trichoides, изолированной из микробного мата Hg2; 2 – спектр поглощения клеток культуры Oscillochloris trichoides
Количество бактерий, разлагающих крахмал, варьировало от 105 до 107 кл/см3. Максимальная численность целлюлозоразлагающих бактерий достигала 107 кл/см3.Активная роль на конечных этапах деструкции органического вещества в микробных матах принадлежит сульфатредуцирующим бактериям, численность которых составляла 104–106 кл/см3 при использовании лактата натрия в качестве источника углерода и энергии.
Выделение и идентификация культур аноксигенных нитчатых фототрофных бактерий. Из микробных матов Hg2, Hg2-3 были выделены 2 монокультуры аноксигенных нитчатых фототрофных бактерий. На среде, содержащей сульфид, они образовывали колонии светло-зеленого цвета диаметром до 2 мм. Полученные культуры представляли собой тонкие нити с газовыми вакуолями толщиной до 5 мкм (рис. 31). В качестве основного пигмента бактерии содержали бактериохлорофилл с с максимумом поглощения в клетках при 746 нм (рис. 3-2). Филогенетический анализ, основанный на сравнении нуклеотидных последовательностей гена 16S рРНК, показал, что штаммы относятся к виду Oscillochloris trichoides (99% сходства).
Зеленые серобактерии. Были получены 3 культуры зеленых серобактерий, которые участвуют в окислении сульфида при фотосинтезе, с образованием элементной серы вне клеток. При росте на агаре они образовывали колонии темно-зеленого цвета, диаметром 1-2 мм. Морфологически бактерии представляли собой палочковидные клетки, формируя короткие ветвящиеся цепочки, и соответствовали видам рода Chlorobium (рис. 4-1). Основным пигментом у них был бактериохлорофилл с (максимум поглощения 742 нм) (рис. 4-2). При сравнении аминокислотной последовательности ФМО-протеина ( fmo A), полученной при трансляции in silico фрагмента гена fmo A, амплифицированно-го из выделенной нами культуры, с референтными последовательностями, было определено, что она наиболее близка к виду Chlorobium limicola.
Несерные пурпурные бактерии присутствовали в микробных матах во всех исследованных станциях. Было выделено 7 чистых культур несерных пурпурных бактерий, морфологически соответствующих родам Rhodobacter, Rhodopseudomonas и Rhodomicrobium. Несерные пурпурные бактерии рода Rhodobacter sp. морфологически были представлены короткими овальными палочками. В анаэробной среде образовывали колонии темно-коричневого цвета, а в аэробной среде бордового цвета. Бактерии рода Rhodomicrobium sp. представляли собой короткие овальные палочки, размножающиеся почкованием с образованием гифоподобных тонких нитей, что характерно для известного вида Rhodomicrobium vannielii. Данные филогенетического анализа подтвердили, что бактерия относится к виду Rhodomicrobium vannielii (99% сходства). Два остальных морфотипа выделенных несерных пурпурных бактерий филогенетически были близки к видам Rhodopseudomonas palustris и Rhodopseudomonas faecalis. Подвижные палочковидные бактерии, размножаются почкованием. В старых культурах образуют розеткоподобные кластеры.
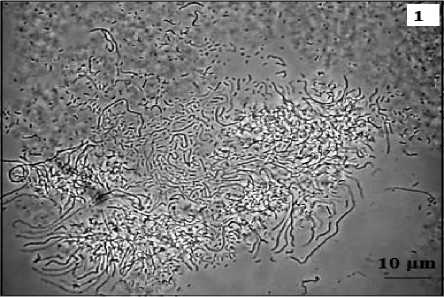
Рис. 4. 1 – морфология зеленой серобактерии Chlorobium limicola, выделенной из микробного мата станции Hg2-3; 2 – спектр поглощения клеток культуры Chlorobium limicola
Тионовые бактерии. Были получены 4 чистые культуры тионовых бактерий, которые были представлены подвижными одиночными и парными палочками длиной до 1,5 мкм. На основании данных нуклеотидных последовательностей гена 16S рРНК культуры соответствовали виду Thiobacillus thioparus, идентичность с которым составила 99%. При культивировании среда мутнела на 3-5 сутки, и на ее поверхности появлялась белая пленка. Результаты исследования элементного состава пленки показали, что она состоит из элементной серы, содержание которой достигает 100%.
Сульфатредуцирующие бактерии. Из микробных матов было выделено 2 чистые культуры суль-фатредуцирующих бактерий, которые представлены грамотрицательными вибрионами, подвижными за счет одного полярно расположенного жгутика. Филогенетический анализ, основанный на сравнении нуклеотидных последовательностей гена 16S рРНК, показал, что штаммы близки между собой и относятся к виду Desulfovibrio alcoholivorans (99% сходства).
Выводы: м инеральный источник Хойто-Гол относится к гидрокарбонатно-натриевому типу с наличием сероводорода. Экологические условия среды обитания микробных сообществ в исследуемом источнике являются благоприятными для развития и функционирования бактерий, участвующих в продукции и деструкции органического вещества. В микробных матах источника основными формообразующими бактериями являются цианобактерии Phormidium sp. и бесцветные серобактерии Thiothrix sp. В продукции органического вещества участвуют фототрофные бактерии, бесцветные серобактерии и тионовые бактерии. Отличительной особенностью микробных матов источника Хойто-Гол являлось доминирование и разнообразие бактерий цикла серы. Важная роль бактерий серного цикла в источнике Хойто-Гол подтверждается высокими численностями сульфатредуцирующих и тионовых бактерий, интенсивностями процессов сульфатредук-ции и аноксигенного фотосинтеза. Выделены чистые культуры пурпурных несерных бактерий ( Rhodopseu-domonas palustris , Rhodobacter capsulatus , Rhodomicrobium vannielii ), нитчатых аноксигенных бактерий ( Oscillochlo-ris trichoides ), зеленых серобактерий ( Chlorobium limicola), тионовых бактерий (Thiobacillus thioparus), сульфатредуцирующих бактерий (Desulfovibrio alcoholivorans) и показано их участие в цикле серы в микробных матах. Выделенные штаммы бактерий могут быть использованы в биотехнологии, в частности в процессах биоремедиации загрязненных территорий.
Работа выполнена в рамках бюджетного проекта VI.55.1.2. «Филогенетическое разнообразие и экологическая роль прокариот в экстремальных природных экосистемах». Отдельные этапы работы выполнены при финансовой поддержке грантов Министерства образования и науки РФ № 1990, РФФИ 15-04-01275-а, 15-44-04335-р_сибирь_a.
Список литературы Формирование и функционирование микробных матов минерального источника Хойто-Гол (Восточный Саян)
- Заварзин, Г.А. Лекции по природоведческой микробиологии. -М.: Изд-во «Наука», 2003. 348 с.
- Skirnisdottir, S. Influence of Sulfide and Temperature on Species Composition and Community Structure of Hot Spring Microbial Mats/S. Skirnisdottir, G.O. Hreggvidsson, S. Hjӧrleifsdottir et al.//Appl. Environ. Microbiol. 2000. V. 66. № 7. P. 2835-2841.
- Намсараев, З.Б. Микробные сообщества щелочных гидротерм/З.Б. Намсараев, В.М. Горленко, Б.Б. Намсараев, Д.Д. Бархутова. -Новосибирск: Изд-во СО РАН, 2006. 111 с.
- Ley, R.E. Unexpected diversity and complexity of the Guerrero Negro hypersaline microbial mat/R.E. Ley, J.K. Harris, J. Wilcox et al.//Appl. Environ. Microbiol. 2006. V. 72. № 5. P. 3685-3695.
- Калашников, А.М. Аноксигенные фототрофные бактерии микробных сообществ термального источника Горячинск (Прибайкалье)/А.М. Калашников, В.А. Гайсин, М.В. Сухачева М.В. и др.//Микробиология. 2014. Т. 83. № 4. С. 484-499.
- Gaisin, V.A. Filamentous anoxygenic phototrophic bacteria from cyanobacterial mats of Alla hot springs (Barguzin Valley, Russia)/V.A. Gaisin, A.M. Kalashnikov, M.V. Sukhacheva et al.//Extremophiles. 2015. V. 19. № 6. P. 1067-1076.
- Miller, S.R. Bar-coded pyrosequencing reveals shared bacterial community properties along the temperature gradients of two alkaline hot springs in Yellowstone National Park/S.R. Miller, A.L. Strong, K.L. Jones, M.C. Ungerer//Appl. Environ. Microbiol. 2009. V. 75. № 13. P. 4565-4572.
- Everroad, R.G. Diversification of Bacterial Community Composition along a Temperature Gradient at a Thermal Spring/R.G. Everroad, H. Otaki, K. Matsuura, S. Haruta//Microbes Environ. 2012. V. 27. № 4. P. 374-381.
- Данилова, Э.В. Влияние экологических условий на распределение функциональных групп микроорганизмов в минеральных источниках Хойто-Гол (Восточные Саяны)/Э.В. Данилова, Д.Д. Бархутова, А.В. Брянская//Сибирский экологический журнал. 2009. № 1. С. 45-53.
- Татаринов, А.В. Бактериальные сообщества термального источника Хойто-Гол (Восточные Саяны) и эколого-геологические условия их формирования/А.В. Татаринов, Э.В. Данилова, Л.И. Яловик и др.//Геохимия. 2010. № 2. С. 164-173.
- Цыренова, Д.Д. Влияние физико-химических условий на распространение цианобактерий в термальном источнике Хойто-Гол (Восточные Саяны)/Д.Д. Цыренова, Э.В. Данилова, В.В. Хахинов//Вестник Бурятского государственного университета. 2010. №3. С. 16-19.
- Намсараев, Б.Б. Полевой практикум по водной микробиологии и гидрохимии: методическое пособие/Б.Б. Намсараев, В.М. Горленко, З.Б. Намсараев, В.В. Хахинов. -М.-Улан-Удэ: Изд-во Бурятского госуниверситета, 2005. 87 с.
- Pimenov, N.V. In situ activities in thermal environments/N.V. Pimenov, E.A. Bonch-Osmolovskaya//In Methods in microbiology. Elsevier, London, United Kingdom. 2006. V. 35. Р. 29-53.
- Кузнецов, С.И. Методы изучения водных микроорганизмов/С.И. Кузнецов, Г.А. Дубинина. -М.: Изд-во «Наука», 1989. 288 с.
- Komàrek, J. Cyanoprokariota 1. Teil: Chroococcales//Süsswasserflora von Mitteleuropa/Eds. Ettl H., Gärtner G., Heynig H., Mollenhauer D./J. Komàrek, K. Anagnostidis. -Jena, Stuttgard, Lübeck, Ulm; G. Fischer, 1999. Bd. 19/1. 548 p.
- Komàrek, J. Cyanoprokariota 2. Teil: Oscillatoriales//Süsswasserflora von Mitteleuropa/J. Komàrek, K. Anagnostidis. -B. Büdel, G. Gärtner, L. Krienitz, M. Schagerl (Hrsg.), 2007. Bd. 19/2. 759 p.
- Wilson, K. Preparation of Geomic DNA from Bacteria//Curr. Protocols Mol. Biol. 2001. 00:2.4.1-2.4.5.
- Булыгина, Е.С. Изучение нуклеотидных последовательностей nifH генов у представителей метанотрофных бактерий/Е.С. Булыгина, Б.Б. Кузнецов, А.И. Марусина и др.//Микробиология. 2002. Т. 71. № 4. С. 500-508.
- Заварзин, Г.А. Литотрофные микроорганизмы. -М.: Изд-во «Наука», 1972. 323 с.
- Лазарева, Е.В. Исследование распределения элементов между цианобактериальным сообществом и карбонатной постройкой термального источника методом РФА СИ/Е.В. Лазарева, С.М. Жмодик, И.В. Петрова и др.//Поверхность. Рентгеновские, синхротронные и нейтронные исследования. 2012. Т. 5. С. 77-85.
- Горленко, В.М. Формирование микробных матов в горячих источниках и активность продукционных и деструкционных процессов/В.М. Горленко, Е.А. Бонч-Осмоловская//В кн. Кальдерные микроорганизмы. -М.: Изд-во «Наука», 1989. С. 53-64.
- Брянская, А.В. Биогеохимические процессы в альгобактериальных матах щелочного термального Уринского источника/А.В. Брянская, З.Б. Намсараев, О.М. Калашникова и др./Микробиология. 2006. Т. 75. № 5. С. 702-712.
- Намсараев, Б.Б. Геохимическая деятельность микроорганизмов гидротерм Байкальской рифтовой зоны/Б.Б. Намсараев, Д.Д. Бархутова, Э.В. Данилова и др. -Новосибирск: Академическое изд-во «Гео», 2011. 302 с.


