Формирование кардиоваскулярной токсичности у пациентов с хроническим миелолейкозом, получающих терапию ингибитором тирозинкиназы II поколения бозутинибом
Автор: Черенова С.Г., Рубаненко О.А., Рубаненко А.О., Ломаиа Е.Г., Туркина А.Г., Давыдкин И.Л.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 5 т.15, 2025 года.
Бесплатный доступ
Ингибиторы тирозинкиназы благоприятно влияют на прогноз и продолжительность жизни пациентов с хроническим миелолейкозом. В то же время, описано негативное влияние некоторых из них на сердечно-сосудистую систему. Исследование сократительной функции левого желудочка на основе продольной деформации является на сегодняшний день наиболее информативным методом отображения миокардиальной работы. Цель: проанализировать показатели, влияющие на развитие кардиотоксичности у пациентов с хроническим миелолейкозом, находящихся в процессе терапии бозутинибом в суточной дозировке 500мг. Материалы и методы. В исследование включено 47 человек (мужчин 30 (63,8%)/ женщин 17 (36,2%), медиана возраста 49,0 (46,5;53,0) лет с диагнозом хронический миелолейкоз перед началом терапии бозутинибом. Всем пациентам было проведено исследование стандартных клинических, лабораторных и инструментальных показателей, а также трансторакальная эхокардиография с определением глобальной продольной деформации левого желудочка. Результаты. Зафиксирована прогрессия артериальной гипертензии до 2 степени к 12 месяцу у 6 (12,8%) и формирование у 2 (4,25%) пациентов (р=0,112) стабильной стенокардии I ФК и ХСН I ФК (NYHA). Уровень общего холестерина увеличился (4,9 (4,36;5,31) ммоль/л до терапии против 4,91 (4,2;5,46) ммоль/л, < 0,001) к 12 месяцу терапии и ХС ЛПН (2,31 (1,76;3,04) ммоль/л до терапии против 2,3 (1,72;2,58) ммоль/л, p=0,009) к 6 месяцу. У всех пациентов к 12 месяцу выявлялось увеличение размеров (КДР 50,0 (46,0;51,0) мм и КСР 31,5 (30,0;34,0) мм до терапии против 53,0 (49,0;54,0) мм и 33,5 (32,0;36,0) мм, p < 0,001) и объема левого желудочка (КДО 111,0 (97,0;127,75) мл и КСО 57,0 (51,0;59,0) мл до терапии против 116,5 (98,75;130,0) мл и 58,0 (53,0;61,75) мл, p < 0,001). Снижение фракции выброса левого желудочка к 12 месяцу (60,0 (59,0;62,0) % до терапии против 59,0 (57,25;60,0) %, p < 0,001) расценивалось как нарушение систолической функции. К 12 месяцу у 5/47 (10,64%) было отмечено снижение глобальной продольной деформации 21,5(18,6;21,6) до терапии против 14,5(14,2;14,7), p < 0,001). Выводы. Проведенный анализ совокупности показателей, позволяет говорить о развитии кардиотоксичности у части пациентов 5/47 (10,64%) с хроническим миелолейкозом, находящихся на терапии бозутинибом, что подтверждается выявленным снижением глобальной продольной деформации левого желудочка. Полученные данные следует интерпретировать как необходимые для дальнейшего наблюдения и проведения своевременной коррекции.
Хронический миелолейкоз [D015464], бозутиниб [C471992], ингибиторы тирозинкиназы [D047428], кардиотоксичность [D066126], эхокардиография [D004452], функция левого желудочка [D016277], глобальная продольная деформация миокарда [D016277*], сердечная недостаточность [D006333]
Короткий адрес: https://sciup.org/143185337
IDR: 143185337 | УДК: 616.155.392.8 | DOI: 10.20340/vmi-rvz.2025.5.CLIN.14
Текст научной статьи Формирование кардиоваскулярной токсичности у пациентов с хроническим миелолейкозом, получающих терапию ингибитором тирозинкиназы II поколения бозутинибом
Согласно литературным данным, онкология является одной из главных социальных, медицинских и экономических проблем XXI века. [1]. Одной из причин неуклонного роста онкологических заболеваний является применение методов диагностики, позволяющих определить наличие заболевания на ранней стадии. [2]. Применение же современных способов лечения, таких как таргетные препараты, помимо увеличения выживаемости пациентов, коррелирует с развитием нежелательных явлений. [3]. К наиболее серьезным осложнениям противоопухолевой терапии можно отнести развитие нежелательных явлений со стороны сердечно-сосудистой системы, негативно влияющих как на прогноз заболеваемости, так и на качество жизни. [4].
Хронический миелоидный лейкоз составляет 0,5 % от всех новых случаев лейкозов в мире. Согласно данным отечественных и зарубежных исследователей, благодаря применению ингибито- ров тирозинкиназ у пациентов с хроническим миелолейкозом, за последнее 10-летие отмечается существенное увеличение продолжительности жизни – до 90% на 2024 год. [5]. Но, несмотря на этот, казалось бы, успех доказанным фактом является влияние ингибиторов тирозинкиназ на формирование нежелательных явлений со стороны сердечно-сосудистой системы. Накопленные данные свидетельствуют о том, что возникновение сердечно-сосудистых осложнений обусловлено сочетанием имеющихся факторов риска сердечнососудистых заболеваний у пациентов и побочных эффектов, связанных с применением ингибиторов тирозинкиназ. [6]. Учитывая имеющуюся информацию, стоит отметить, что раннее выявление осложнений со стороны сердечно-сосудистой системы у пациентов с хроническим миелолейкозом, находящихся в процессе терапии ингибиторами тиро-зинкиназ на сегодняшний день остается актуальной проблемой, в связи с чем необходимым является и своевременное назначение кардиопротективной терапии [7].
Под термином кардиоваскулярная токсичность, в настоящее время, понимают факт снижения фракции выброса левого желудочка более, чем на 10% от исходного уровня, что является проявлением снижения сократительной функции миокарда [8]. При этом ранние проявления кардиотоксичности не демонстрировали снижение ФВ ЛЖ, а выявление же значительного понижения данного параметра отображало уже позднюю стадию развития патологии со стороны сердечно-сосудистой системы, когда уже произошло истощение компенсаторных механизмов миокарда [9]. В этой связи, в настоящее время, для раннего выявления формирования кардиоваскулярной токсичности используется дополнительная ультразвуковая методика -“speckle tracking”, позволяющая проводить оценку сократительной функции миокарда в продольном, радиальном и циркулярном пространственных направлениях [10]. Ряд исследований показал, что GLS (global longitudinal strain) левого желудочка является ранним и независимым предиктором кардиотоксичности [11].
Цель исследования: проанализировать показатели, влияющие на развитие кардиотоксичности у пациентов с хроническим миелолейкозом, находящихся в процессе терапии бозутинибом в суточной дозировке 500мг.
Материал и методы
Для формирования группы участников в данное исследование было изучено 218 историй болезней пациентов с диагнозом хронический миелолейкоз, хроническая фаза, перед переходом на вторую линию терапии ИТК на базах ФГБОУ ВО СамГМУ Минздрава РФ (г. Самара), ФГБУ «НМИЦ Гематологии» Минздрава РФ (г. Москва) и ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава РФ (г. Санкт-Петербург). Диагноз хронический миелолейкоз был подтвержден наличием ph-хромосомы и гена BCR-ABL. Затем, в период с февраля 2022 по май 2023 года, из 218 человек в исследование было включено 47 пациентов, с назначенной терапией ИТК бозутинибом в суточной дозировке 500 мг. Исследование было проведено в соответствии с принципами Хельсинской Декларации, протокол одобрен этическим комитетом ФГБОУ ВО СамГМУ Минздрава России. Все пациенты подписали информированное добровольное согласие на участие в исследовании. Анализ и интерпретация полученных данных проводились на базе ФГБОУ ВО «Самарский государственный медицинский университет» МЗ РФ.
К критериям включения в исследование относились: больные с подтвержденным диагнозом хронический миелолейкоз, хроническая фаза, в возрасте от 40 до 60 лет до перевода на вторую линию терапии ингибитором тирозинкиназы II поколения бозутинибом в суточной дозе 500мг, а также наличие подписанного добровольного информированного согласия на участие в исследовании.
Обследование всех пациентов проводилось на четырех визитах - до начала терапии, через 3, 6 и 12 месяцев терапии ИТК бозутинибом. Помимо анализа клинико-демографических данных, всем пациентам проводилась оценка параметров липидного спектра, данных эхокардиографического исследования, включающих показатели трансторакальной эхокардиографии с определением глобальной продольной деформации левого желудочка (GLS), также учитывалось наличие сопутствующей сердечно-сосудистой патологии.
Статистическая обработка полученных значений проводилась с помощью программного пакета SPSS Statistics 25 PS for Windows 11 (IBM, USA). Соответствие нормальному закону проверяли с помощью критериев Колмогорова-Смирнова с поправкой Лилиефорса. Из-за несоответствия закону нормального распределения количественные показатели описывали медианой (Ме), 25 процентилем (Q1) и 75 процентилем (Q3). Для определения статистических различий для нескольких связанных групп применяли критерий Фридмана.
Категориальные данные описаны абсолютными величинами c указанием доли. Для определения различий качественных признаков использовали разные методы, в зависимости от количества наблюдений: при количестве 10 и более использовали критерий х2 Пирсона; 5 до 9 - использовали поправку Йетса на непрерывность; при количестве наблюдений в любой из ячеек менее 5 применяли точечный тест Фишера.
Для проведения анализа корреляционной взаимосвязи показателей липидного профиля и микроциркуляции рассчитывался коэффициент корреляции Спирмена (r xy ). Оценка силы связи определялась по шкале Чеддока.
Критическое значение уровня значимости (p) принимали с учётом метода применяемой статистики p<0,05.
Результаты
Пациенты, включенные в исследование, были сопоставимы по клинико-демографическим данным. Исследуемую группу составили 47 человек, из них (мужчин 30 (63,8%) / женщин 17 (36,2%)), медиана возраста 49,0 (46,5;53,0), медиана роста 170,0 (166,0;175,0) см, медиана веса 70,0 (68,0;75,0) кг, медиана индекса массы тела (ИМТ) 24,5 (23,7;25,2) кг/м2, положительный статус курения 5 (10,6%) пациентов.
При оценке сопутствующей патологии со стороны сердечно-сосудистой системы у 6 (12,8%) из 12 (25,5%) пациентов на момент включения в исследование к 12 месяцу зарегистрированы высокие цифры артериального давления, что явилось показанием к проведению дообследования - суточного мониторирования артериального давления. Интерпретация результатов позволила выявить прогрессию артериальной гипертензии до 2 степени. Также к 12 месяцу наблюдения на терапии бозутинибом у 1(2,13%) человека зарегистрировано развитие артериальной гипертензии 1 степени, также подтвержденное данными суточного мониторирования артериального давления, и у 2 (4,25%) пациентов - стабильной стенокардии напряжения I ФК, выставленного согласно данным опросника Роуза и результатам проведенной стресс-эхокардиографии и ХСН I ФК (NYHA). Подробная характеристика сопутствующей сердечно-сосудистой патологии исследуемой группы пациентов приведена в таблице 1.
При оценке липидного профиля исследуемой группы пациентов статистически значимое увеличение уровня общего холестерина было зарегистрировано к 12 месяцу наблюдения (4,9 (4,36;5,31) до терапии против 4,91 (4,2;5,46) ммоль/л, <0,001) и уровня липопротеидов низкой плотности к 6 месяцу терапии (2,31 (1,76;3,04) до терапии против 2,3
(1,72;2,58), p=0,003), в то же время значения вышеописанных параметров находились в пределах референтных. Анализ остальных показателей липидного профиля статистически значимых различий не выявил. Динамика показателей липидного обмена подробно представлены на рисунке 1.
Для оценки вероятности развития кардиотоксичности всем пациентам исследуемой группы проводилась трансторакальная эхокардиография с определением структурного состояния, систолической функции и глобальной продольной деформации левого желудочка. Полученные данные представлены в таблице 2.
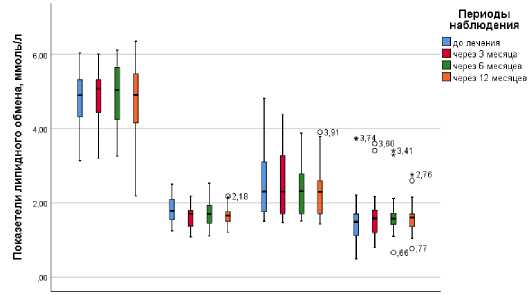
Общий ХС ЛНП ХС ЛВП Триглицериды холестерин
Рисунок 1. Динамика показателей липидного обмена
Figure 1. Dynamics of lipid metabolism indicators
Таблица 1. Характеристика исследуемой группы пациентов
Table 1. Characteristics of the study group of patients
|
Признак |
Исследуемые пациенты (n=47) |
р-значение |
|
АГ |
||
|
До терапии |
1 степени – 12 (25,5%) |
0,001 Для АГ 1 степени: р=0,009 между визитами до терапии, через 3 месяца, 6 месяцев и 12 месяцев, Для АГ 2 степени: р=0,003 между визитами до терапии, через 3 месяца, 6 месяцев и 12 месяцев |
|
Через 3 месяца |
1 степени – 12 (25,5%) |
|
|
Через 6 месяцев |
1 степени – 12 (25,5%) |
|
|
Через 12 месяцев |
1 степени - 7 (14,9%) 2 степени – 6 (12,8%) |
ИБС. ССН I ф.кл.
|
До терапии |
0 (0,00%) |
0,112 |
|
Через 3 месяца |
0 (0,00%) |
|
|
Через 6 месяцев |
0 (0,00%) |
|
|
Через 12 месяцев |
2 (4,25%) |
ХСН I ф.кл. (NYHA)
|
До терапии |
0 (0,00%) |
0,112 |
|
Через 3 месяца |
0 (0,00%) |
|
|
Через 6 месяцев |
0 (0,00%) |
|
|
Через 12 месяцев |
2 (4,25%) |
Примечание: р-значение – значимость отличий в показателях между исследуемыми пациентами в контрольных точках.
Сокращения: ИМТ – индекс массы тела, АГ – артериальная гипертензия, ИБС – ишемическая болезнь сердца, ССН – стабильная стенокардия напряжения, ХСН – хроническая сердечная недостаточность.
Таблица 2. Показатели эхокардиографии исследуемой группы пациентов
Table 2. Echocardiography results of the study group of patients
|
Признак |
Исследуемые пациенты (n=47) |
р-значение |
|
КДР, мм/ EDD, mm |
||
|
До терапии |
50,0 (46,0;51,0) |
|
|
Через 3 месяца |
51,5 (48,0;54,0) |
<0,001 |
|
Через 6 месяцев |
52,0 (48,25;54,75) |
|
|
Через 12 месяцев |
53,0 (49,0;54,0) |
|
|
КСР, мм/ ESD, mm |
||
|
До терапии |
31,5 (30,0;34,0) |
<0,001 |
|
Через 3 месяца |
32,5 (31,0;35,0) |
|
|
Через 6 месяцев |
33,0 (31,25;35,0) |
|
|
Через 12 месяцев |
33,5 (32,0;36,0) |
КДО, мл/ EDV, ml
|
До терапии |
111,0 (97,0;127,75) |
<0,001 |
|
Через 3 месяца |
114,5 (99,0;129,0) |
|
|
Через 6 месяцев |
116,5 (99,25;129,0) |
|
|
Через 12 месяцев |
116,5 (98,75;130,0) |
КСО, мл/ ESV, ml
|
До терапии |
57,0 (51,0;59,0) |
<0,001 |
|
Через 3 месяца |
57,5 (51,0;60,75) |
|
|
Через 6 месяцев |
59,0 (52,0;60,75) |
|
|
Через 12 месяцев |
58,0 (53,0;61,75) |
ФВ ЛЖ по Симпсону, %/ LVEF, %
|
До терапии |
60,0 (59,0;62,0) |
<0,001 |
|
Через 3 месяца |
60,0 (58,0;61,0) |
|
|
Через 6 месяцев |
59,5 (58,0;61,0) |
|
|
Через 12 месяцев |
59,0 (57,25;60,0) |
ЭхоКГ GLS LV, %/ GLSLV, %
|
До терапии |
21,5(18,6;21,6) |
<0,001 |
|
Через 3 месяца |
21,7(18,7;21,9) |
|
|
Через 6 месяцев |
20,6(18,7;21,1) |
|
|
Через 12 месяцев |
14,5(14,2;14,7) |
Примечание: р-значение – значимость отличий в показателях между исследуемыми пациентами в контрольных точках .
Сокращения: КДР – конечно-диастолический размер, КСР - конечно-систолический размер, КДО – конечно-диастолический объем, КСО – конечно-диастолический объем, ФВ ЛЖ – фракция выброса левого желудочка, GLS LV – глобальная продольная деформация левого желудочка.
Анализируя полученные эхокардиографические параметры исследуемой группы пациентов, следует отметить статистически значимые увеличения (p<0,001) конечно-диастолического и конечносистолического размера, а также конечносистолического и конечно-диастолического объема левого желудочка к 12 месяцу наблюдения. Также отмечается достоверное снижение фракции выброса левого желудочка. Также к 12 месяцу у части 5/47 (10,64%) пациентов в процессе терапии бозутини-бом отмечается снижение показателей глобальной продольной деформации левого желудочка, что следует расценивать как формирование кардиоваскулярной токсичности. Динамика показателя GLS в ходе наблюдения за пациентами исследуемой группы графически представлена на рисунке 2.
При проведении корреляционного анализа показателей липидного спектра и параметров эхо-кардиографиеческого исследования, в том числе данных продольной деформации левого желудочка было через 3 месяца не выявлено статистически значимых изменений. Через 6 месяцев продемонстрирована умеренная связь обратной силы между
GLS и ОХ (r xy =–0,497, р=0,003), умеренная связь прямой силы между ИММЛЖ и ОХ (r xy =0,358, р=0,038). Через 12 месяцев выявлена заметная связь обратной силы между GLS и ОХ (r xy =–0,596, р<0,001), умеренная связь обратной силы GLS и ХС ЛНП (r xy =–0,464, р=0,006), умеренная прямая связь между ИММЛЖ и ОХ (r xy =0,329, р=0,057), умеренная прямая связь между ИММЛЖ и ОХ (r xy =0,353, р=0,041).
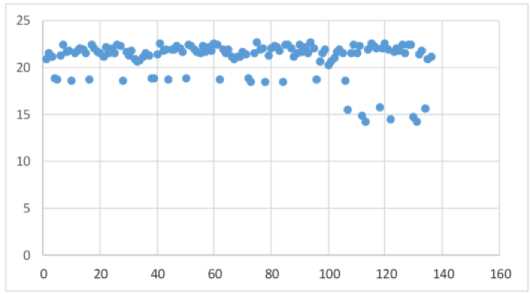
Рисунок 2. Динамика GLS в ходе наблюдения Figure 2. GLS dynamics during observation
Обсуждение
Анализ полученных результатов нашего исследования выявил факт прогрессии сопутствующих заболеваний со стороны сердечно-сосудистой системы. К 12 месяцу терапии исследуемым препаратом зарегистрировано развитие стабильной стенокардии напряжения I ФК и ХСН I ФК (NYHA) у 2 (4,25%) пациентов, а также артериальная гипертензия 1 степени у 1 (2,13%) и 2 степени у 6 (12,8%) из 12 (25,5%) пациентов. При обработке результатов показателей липидного профиля выявлено статистически значимое увеличение уровня общего холестерина к 12 месяцу, а также липопротеидов низкой плотности к 6 месяцу терапии бозутинибом. Показатели оставались в пределах референтных значений. Основываясь на полученных данных, следует говорить о необходимости продолжения наблюдения за целевой группой пациентов, как до смены линии терапии, так и в процессе лечения ИТК, проводя при необходимости своевременную кардиопротективную терапию.
Согласно литературным данным, снижение фракции выброса ЛЖ более, чем на 10% от исходной величины, а также снижение продольной глобальной дисфункции левого желудочка, более чем на 15% от ее величины до химиотерапии, следует расценивать как проявление субклинической дисфункции миокарда [12]. Доказано также, что фракция выброса ЛЖ снижается на поздних сроках химиотерапии, в то время как снижение GLS следует рассматривать в качестве независимого предиктора формирования кардиотоксичности [13]. Анализируя полученные параметры проведенного нами исследования необходимо подчеркнуть, что у 5/47 (10,64%) пациентов с хроническим миелолейкозом в процессе терапии ИТК II линии бозутинибом зафиксировано достоверное снижение глобальной продольной деформации левого желудочка. Выявленные изменения следует расценивать как проявление формирования кардиоваскулярной токсич- ности к 12 месяцу терапии ИТК у целевой группы пациентов, что согласуется с литературными данными [14].
Проведение корреляционного анализа выявило статистически значимую корреляцию между глобальной продольной деформацией ЛЖ и ИММЛЖ с показателями липидного спектра, что свидетельствует о структурных изменениях сердца при нарастании уровня ОХ и ХС ЛНП.
Учитывая проявления формирования кардиотоксичности в процессе терапии II линии терапии ИТК бозутинибом у части пациентов, следует более тщательно подходить к обследованию пациентов с хроническим миелолейкозом, как при смене препарата, так и в процессе длительного лечения. При выявлении субклинической дисфункции миокарда, следует проводить своевременную кардиопротек-тивную терапию под контролем профильных специалистов.
Заключение
Проанализировав совокупность полученных показателей, отражающий развитие кардиоваскулярной токсичности у пациентов с хроническим миелолейкозом, до начала и в процессе терапии ИТК бо-зутинибом в суточной дозе 500 мг на протяжении 12 месяцев, следует отметить факт формирования кардиотоксичности у части 5/47 (10,64%) пациентов, что подтверждается снижением уровня глобальной продольной деформации левого желудочка, а также совокупностью развития сопутствующих нежелательных явлений со стороны сердечно-сосудистой системы и показателями липидного профиля. Для снижения риска развития сердечно-сосудистых заболеваний и декомпенсации уже имеющихся, необходимо тщательно проработать алгоритм обследования пациентов на различных этапах применения исследуемого препарата и схемы своевременной кардиопротективной терапии.


