Фосфиновая модификация трипептида GPE и моделирование его свойств
Автор: Головаш С.Р., Винюков А.В., Рагулин В.В.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Химические науки
Статья в выпуске: 12-1 (51), 2020 года.
Бесплатный доступ
Поиск и получение новых физиологически-активных веществ для терапии нейродегенеративных нарушений является одной из самых важных задач для органической химии. Подход, основанный на замене пептидной связи в молекуле пептида структурно изостерным негидролизуемым метиленфосфорильным фрагментом, позволяет увеличить метаболическую стабильность пептидных молекул к разрушительному действию пептидаз. В настоящей работе нами была осуществлена модификация трипептида глицин-пролин-глутамат (GPE), обладающего нейропротекторными свойствами, путем замены пептидной связи C(O)NH в молекуле пептида структурно изостерным негидролизуемым метиленфосфорильным фрагментом P(O)CH2. Кроме того, посредством программ PASS и GUSAR были осуществлены прогноз и относительное сравнение биологической активности и токсичности исходного трипептида и его фосфинового аналога.
Аналоги переходного состояния, фосфиновые псевдо-пептиды, амидоалкилирование гидрофосфорильных соединений, изостеры аминокислот и пептидов
Короткий адрес: https://sciup.org/170190711
IDR: 170190711 | DOI: 10.24411/2500-1000-2020-11643
Текст научной статьи Фосфиновая модификация трипептида GPE и моделирование его свойств
Введение. Исследования, проведенные в 1989 году, выявили что Gly-Pro-Glu (GPE) находится в организме как часть инсулиноподобного фактора роста 1 и является новым нейроактивным пептидом с мощным действием на высвобождение ацетилхолина, а также играет роль в регуляции функций мозга [1]. В этих исследованиях было обнаружено, что GPE участвует в различных процессах в центральной нервной системе. GPE был синтезирован и показал, что ингибирует связывание глутамата с рецептором N-метил-D-аспартата (NMDA). Кроме того, GPE имел мощное стимулирующее действие на калий-индуцированное высвобождение ацетилхолина из срезов коры головного мозга крыс [2]. В дальнейшем было множество исследований посвященным нейропротек-торному и ноотропному действию Gly-Pro-Glu [3-9] и на данный момент GPE является одним из перспективных нейропротек- торных агентов. В настоящей работе осуществлялась модификация трипептида GPE путем замены одной пептидной связи C(O)NH в молекуле трипептида негидролизуемым метиленфосфорильным фрагментом P(O)(OH)CH2. Такой подход в последние несколько лет используется в качестве основного ключа для построения фосфиновых кислых изостеров пептидов и является достаточно успешным в плане поиска лекарственных средств противовирусного, противоопухолевого характера, средств против иммунодефицита [10] и ряда других болезней [11-13]. Фосфиновые кислотные псевдо-пептиды, у которых пептидная связь заменена на негидролизуемый метиленфосфорильный фрагмент, являются ингибиторами процессов, происходящих с гидролитическим или ферментативным расщеплением пептидной связи, что позволяет использовать псевдопептиды как соединения-имитаторы, для изучения и, главным образом, возможной регуляции ряда метаболически важных процессов. Эти предпосылки позволяют предполагать достаточно высокую степень сохранения свойств исходной молекулы в молекуле структурного фосфоизостера, что справедливо для какого-либо короткого пептида, свойства которого главным образом определяются конкретной аминокислотной последовательностью. Предлагаемая фосфиновая замена пептидной связи сохраняет исходную аминокислотную последовательность и увеличивает устойчивость псевдо-пептидной связи образовавшегося фосфоизостера к гидролитическому воздействию пептидаз на пути к биомишени, что и позволяет рассчитывать на повышение его эффективности в сравнении с исходной гидролитически лабильной молекулой.
Результаты. На первом этапе работы нами был осуществлен синтез фосфинового аналога дипептида псевдо-пролилглутамата Pro-[P(O)(OH)CH2]-Glu 1.1 [14] (рис. 1), с соответствующими защитными группами на атоме фосфора и карбоксильных концах, для дальнейшего использование в качестве N-компоненты в пептидном синтезе. Дальнейшая обработка фосфиновой кислоты 1.2 смесью адаман-тилбромида и оксида серебра в хлороформе позволили получить адамантиловый эфир фосфиновой кислоты 1.3 в соответствии с известной методологией защиты гидроксифосфорильной функции. После чего осуществлялось селективное снятие защитной группы с атома азота путем каталитического гидрирования (рис. 1).
Рис. 1. Синтез фосфинового P,С-защищенного пролилглутаматного блока
Далее нами был осуществлен успешный синтез модифицированного «псевдопептида» Gly-Pro-[P(O)(OH)CH2]-Glu (GPE(phos)) 2.1, фосфинового аналога GPE, путем присоединения N-Boc-защищенной аминокислоты глицина к фосфиновому P,С-защищенному пролилг- лутаматному блоку Pro-[P(O)(OH)CH2]-Glu 1.1, в соответствии с известными методиками пептидного синтеза (рис. 2). Препаративная очистка и анализ осуществлялись при помощи методов высокоэффективной жидкостной хроматографии и масс-спектрометрии.
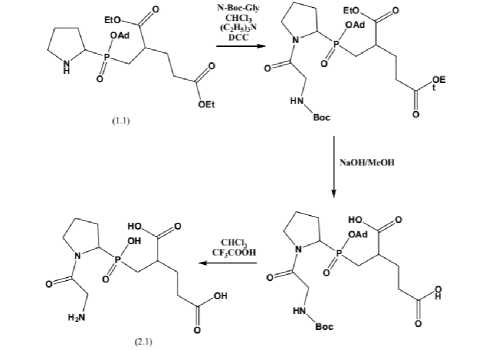
Рис. 2. Схема синтеза фосфинового «псевдо-пептида» Gly-Pro-[P(O)(OH)CH 2 ]-Glu
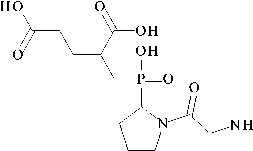
Прогноз биологических активностей исходного трипептида GPE (табл. 1) и его фосфинового аналога GPE(phos) (табл. 2) осуществлялся программой PASS (“Prediction of Activity Spectra for Substances”), разработанная в Институте биомедицинской химии им. В.Н. Ореховича РАМН. Она содержит более 250000 веществ с известной биологи- ческой активностью, включает более 3500 фармакологических эффектов и механизмов действия. Результаты прогноза биологической активности представлены в виде спектра биологической активности, включающих список активностей и вероятностей: Ра - «быть активным», Рi - «быть неактивным».
Таблица 1. Пр сходного трипептида GPE програм мой “Prediction of
NH
O
O
O
HN
OH
OH
|
0,905 |
0,004 |
e inhibitor |
|
0,898 |
0,004 |
or |
|
, |
, |
X-Pro dipeptidase inhibitor |
|
0,837 |
0,014 |
Methylenetetrahydrofolate reductase (NADPH) inhibitor |
|
0,835 |
0,002 |
Saccharolysin inhibitor |
|
0,819 |
0,005 |
Analeptic |
|
0,815 |
0,004 |
Antihypoxic |
|
0,804 |
0,032 |
Phobic disorders treatment |
|
0,800 |
0,009 |
Protein-disulfide reductase (glutathione) inhibitor |
|
0,774 |
0,004 |
Pyroglutamyl-peptidase II inhibitor |
|
0,763 |
0,020 |
Glutamate-5-semialdehyde dehydrogenase inhibitor |
|
0,756 |
0,007 |
Limulus clotting factor C inhibitor |
|
0,752 |
0,007 |
Methylamine-glutamate N-methyltransferase inhibitor |
|
0,728 |
0,003 |
Meprin A inhibitor |
|
0,727 |
0,022 |
Acylcarnitine hydrolase inhibitor |
|
0,721 |
0,004 |
Acrosin inhibitor |
|
0,712 |
0,003 |
Catalase inhibitor |
|
0,699 |
0,015 |
Dimethylargininase inhibitor |
|
0,698 |
0,023 |
Fibrinolytic |
|
0,682 |
0,010 |
Pyroglutamyl-peptidase I inhibitor |
|
0,659 |
0,003 |
Bontoxilysin inhibitor |
|
0,649 |
0,011 |
Renal tissue kallikrein inhibitor |
|
0,649 |
0,005 |
Tripeptidyl-peptidase I inhibitor |
|
0,646 |
0,057 |
Nootropic |
Таблица 2. Про стей фосфинового аналога GPE(phos) программой “Predictio ances”
|
0,851 |
0,010 |
ehyde dehydrogenase inhibitor |
|
0,734 |
0,005 |
Stroke treatment |
|
0,711 |
0,014 |
Immunostimulant |
|
0,690 |
0,056 |
CDP-glycerol glycerophosphotransferase inhibitor |
|
0,661 |
0,023 |
Phosphatase inhibitor |
|
0,614 |
0,001 |
N-Acetylated alpha-linked acidic dipeptidase inhibitor |
|
0,591 |
0,127 |
Phobic disorders treatment |
|
0,536 |
0,087 |
Antiischemic, cerebral |
|
0,514 |
0,033 |
Anticonvulsant |
Результаты прогноза биологической активности исходного трипептида GPE и его фосфинового аналога GPE(phos), осуществленного при помощи программного пакета PASS, показал заметное изменение биологической активности при замене пептидной связи в молекуле трипептида на метиленфосфорильный фрагмент.
Также была использована программа GUSAR (“General Unrestricted StructureActivity Relationships”), позволившая дать прогноз по острой токсичности для крыс (LD50 мг/кг) для полученного соединения GPE(phos) соединений по сравнению с исходным трипептидом GPE (табл. 3).
Таблица 3. Прогноз по острой токсичности для крыс (LD50 мг/кг) для полученного соединения GPE(phos) соединений по сравнению с исходным трипептидом GPE
|
ВБ LD50 (мг/кг) |
ВВ LD50 (мг/кг) |
ПО LD50 (мг/кг) |
ПК LD50 (мг/кг) |
|
|
GPE |
1340 |
1968 |
3894 |
1498 |
|
GPE(phos) |
456 |
732 |
2233 |
256,6 |
QSAR модели были разработаны для порядка 10000 соединений, протестированных на крысах по четырем видам токсичности – пероральной (ПО), внутривенной (ВВ), внутрибрюшинной (ВБ) и подкожной (ПК). Для оценки острой токсичности для описания структур химических соединений в программе используются дескрипторы многоуровневых атомных окрестностей (MNA – Multilevel Neighborhoods of Atoms) и количественных атомных окрестностей (QNA – Quantitative Neighborhoods of Atoms). В GUSAR для построения моделей используется алгоритм самосогласованной регрессии (SCR).
Согласно классификации острой токсичности Организации экономического сотрудничества и развития (OECD) оба соединения являются нетоксичными или малотоксичными по всем способам введения (4 и 5 классы токсичности). Однако важно отметить, что наблюдается некоторое увеличение токсичности GPE(phos) по всем способам введения.
Заключение. Таким образом основным результатом настоящей работы стала апробация нового синтетического подхода к получению физиологически активных веществ в ряду соединений пептидного характера, обладающих активностью, путем замены пептидной связи [C(O)NH] изо-стерным метиленфосфорильным фрагментом [P(O)CH 2 ] с обязательным сохранением исходной аминокислотной последовательности. В ходе настоящей работы был получен псевдо-пептид Gly-Pro-[P(O)(OH)CH 2 ]-Glu, фосфиновый аналог известного физиологически-активного трипептида Gly-Pro-Glu, а также были осуществлены прогноз и относительное сравнение биологической активности и токсичности исходного трипептида и его фосфинового аналога.
Список литературы Фосфиновая модификация трипептида GPE и моделирование его свойств
- Sara V.R., Carlsson-Skwirut C., Bergman T., Jörnvall H., Roberts P.J., Crawford M., Hakansson L.N., Civalero I., Nordberg A. Identification of Gly-Pro-Glu (GPE), the aminoterminal tripeptide of insulin-like growth factor 1 which is truncated in brain, as a novel neuroactive peptide. Biochem Biophys Res Commun. 1989 Dec 15;165(2):766-71.
- Nilsson-Håkansson L., Civalero I., Zhang X., Carlsson-Skwirut C., Sara V.R., Nordberg A. Effects of IGF-1, truncated IGF-1 and the tripeptide Gly-Pro-Glu on acetylcholine release from parietal cortex of rat brain. Neuroreport. 1993 Sep; 4(9): 1111-4.
- Saura J., Curatolo L., Williams C.E., Gatti S., Benatti L., Peeters C., Guan J., Dragunow M., Post C., Faull R.L., Gluckman P.D., Skinner S.J. Neuroprotective effects of Gly-Pro-Glu, the N-terminal tripeptide of IGF-1, in the hippocampus in vitro. Neuroreport. 1999 Jan 18; 10(1): 161-4.
- Aguado-Llera D., Martín-Martínez M., García-López M.T., Arilla-Ferreiro E., Barrios V. Gly-Pro-Glu protects beta-amyloid-induced somatostatin depletion in the rat cortex. Neuroreport. 2004 Aug 26; 15(12): 1979-82.
- Alonso De Diego S.A., Muñoz P., González-Muñiz R., Herranz R., Martín-Martínez M., Cenarruzabeitia E., Frechilla D., Del Río J., Jimeno M.L., García-López M.T. Analogues of the neuroprotective tripeptide Gly-Pro-Glu (GPE): synthesis and structure-activity relationships. Bioorg Med Chem Lett. 2005 May 2; 15(9): 2279-83.


