Фотодинамическая терапия в лечении рецидивных карцином полости носа и околоносовых пазух
Автор: Вусик М.В., Штин В.И., Черемисина О.В., Меньшиков К.Ю., Новиков В.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.23, 2024 года.
Бесплатный доступ
Цель исследования - оценить эффективность лечения рецидивных опухолей полости носа и придаточных пазух с использованием фотодинамической диагностики (ФД) и фотодинамической терапии (ФДТ). Материал и методы. В исследование включено 40 пациентов с местнораспространенными карциномами полости носа и околоносовых пазух, поступивших в клиники НИИ онкологии Томского НИМЦ с рецидивом рака полости носа. Пациенты были распределены на основную (n=20) и контрольную (n=20) группы, которые ранее получали комбинированное лечение в объеме химиолучевой терапии, химиотерапии с хирургическим лечением либо комбинации всех трех методов. Лечение пациентов включало в себя интраоперационное исследование края резекции с применением лазерной электронно-спектральной установки ЛЭСА-01 БИОСПЕК. Исследование проводилось после удаления опухоли в области ложа последней с целью выявления остаточной опухолевой ткани. Далее проводился сеанс фотодинамической терапии на ложе удаленной опухоли. Терапия проводилась с использованием препарата Фотодитазин на аппарате Латус - Т в дозе 300-350 Дж на поле, диаметр поля составлял от 1 до 2 см, плотность мощности варьировала от 0,4 Вт/см 2 до 0,5 Вт/см 2 .
Опухоли полости носа и придаточных пазух, рецидивы, фотодинамическая терапия, выживаемость
Короткий адрес: https://sciup.org/140307919
IDR: 140307919 | УДК: 616.213.6-006.6-036.65-08:615.831 | DOI: 10.21294/1814-4861-2024-23-5-26-34
Текст научной статьи Фотодинамическая терапия в лечении рецидивных карцином полости носа и околоносовых пазух
Синоназальные опухоли являются относительно редким заболеванием, на их долю приходится от 3 до 5 % злокачественных новообразований головы и шеи и от 0,2 до 0,8 % всех опухолей. Наиболее часто встречается плоскоклеточный рак, который составляет 54,8–92,8 % случаев. Абсолютное большинство больных (около 90 %) поступают на лечение с запущенными стадиями опухолевого процесса (III–IV стадия) [1–4]. Число распространенных и запущенных форм опухолей данной локализации за последние годы, к сожалению, не уменьшилось [5]. Среди причин запущенности следует отметить скрытое течение болезни, а также схожесть клинической симптоматики с воспалительными процессами в полости носа. В основе современной стратегии лечения местнораспространенных опухолей синоназальной области лежит междисциплинарный подход, включающий хирургическое вмешательство и лучевую терапию [6, 7], что обеспечивает пятилетнюю выживаемость у пациентов с III стадией опухолевого процесса в 35–59 % случаев, у больных с IV стадией – в 18–27 % [8]. Определяющим прогностическим фактором является степень радикальности операции. Близость полости носа и околоносовых пазух к критическим структурам лица приводит к высоким показателям рецидивов после радикальной операции, которые у этой категории пациентов составляют почти треть случаев. Рассматривая опухоли данной локализации как медицинскую и социальную проблему, необходимо отметить высокий уровень запущенности и, как следствие, низкую общую и безрецидивную выживаемость [1, 2].
Все вышеизложенное определяет актуальность проблемы лечения рецидивных опухолей полости носа и околоносовых пазух, а также необходимость поиска новых методов противоопухолевого воздействия для этой категории больных. В этом аспекте перспективным представляется метод лечения, включающий интраоперационную флуоресцентную диагностику (ФД) и фотодинамическую терапию (ФДТ) [9]. Флуоресцентная диагностика существенно превышает возможности других методов в выявлении скрытых форм предрака и раннего рака. Метод ФД основан на различиях в интенсивности и спектральном составе аутофлуоресценции здоровой и опухолевой ткани, а также на избирательности накопления фотосенсибилизатора в ткани злокачественного новообразования и возможности его обнаружения по характерной флуоресценции из освещаемой лазерным излучением области [3, 10, 11].
Основным механизмом действия ФДТ является выделение при воздействии источника света определенной длины волны синглетного кислорода в клетках опухоли, накопивших фотосенсибилизатор. Синглетный кислород способен непосредственно разрушать клетки мишени путем индукции некроза и/или апоптоза, а также вызывать разрушение сосудистой системы опухоли и способствовать развитию местной воспалительной реакции [11, 12]. Последняя инициирует окклюзию сосудов и индуцирует цитотоксическую активность нейтрофилов и дендритных клеток с последующим развитием специфического иммунного ответа. Таким образом, ФДТ сопровождается сложными воспалительными процессами, индуцирующими противоопухолевый иммунный ответ [13–17]. Технические особенности аппаратуры и методики ФДТ дают возможность повсеместного использования данного вида терапии.
С целью повышения эффективности лечения пациентов с резектабельными рецидивными опухолями полости носа и придаточных пазух в отделении опухолей головы и шеи совместно с эндоскопическим отделением НИИ онкологии разработана методика, сочетающая оперативное вмешательство с интраоперационной спектроскопией и фотодинамической терапией. Проводимое интраоперационное спектроскопическое исследование позволяет более точно определить границы опухолевого процесса, что позволяет хирургу провести радикальное хирургическое вмешательство. А дальнейшая фотодинамическая терапия, проводимая на ложе опухоли, позволяет провести разрушение остаточных микроскопических опухолевых клеток. Методика дает возможность провести подбор необходимых характеристик облучения, соответствующих особенностям облучаемых тканей, а также подвести адекватные дозы воздействия при труднодоступных локализациях и сложных геометрических поверхностях ложа опухоли. Использование современных фотосенсибилизаторов обеспечивает селективность воздействия на опухолевую ткань, без клинически значимой фотосенсибилизации всего организма.
Цель исследования – оценить эффективность лечения рецидивных опухолей полости носа и придаточных пазух с использованием фотодинамической диагностики и фотодинамической терапии.
Материал и методы
В исследование включено 40 пациентов с местнораспространенными карциномами полости носа и околоносовых пазух (ОНП), поступивших в НИИ онкологии Томского НИМЦ с продолженным ростом либо с рецидивом рака полости носа (та- блица). Пациенты были распределены на основную (n=20) и контрольную (n=20) группы Распределение пациентов по группам проводилось методом «случай-контроль»: в основной группе было 12 (60 %) мужчин и 8 (40 %) женщин; в контрольной – 11 (55 %) мужчин и 9 (45 %) женщин. Пациенты обеих групп находились в возрасте от 40 до 70 лет.
В обеих группах распространенность рецидивного опухолевого процесса в большинстве случаев соответствовала rТ3 – у 22 (55,0 %) и rТ4 – у 18 (45,0 %) больных. Все пациенты обеих групп ранее получали комбинированное лечение в объеме хи-миолучевой терапии, химиотерапии в комбинации с хирургическим лечением либо комбинации всех трех видов лечения. Во всех случаях установлен распространенный рецидивный процесс, поражающий области крылонебной ямки и основания черепа. Большинство пациентов обеих групп получили ранее химиолучевое либо лучевое лечение в радикальной дозе. В связи с этим единственно возможным вариантом помощи оставалось хирургическое вмешательство. В исследуемой группе проводилась оценка края резекции с применением лазерной электронно-спектральной установки ЛЭСА-01 БИОСПЕК. Исследование проводилось после удаления опухоли в области ложа последней с целью выявления остаточной опухолевой ткани. Измерение проводилось с шагом 1 мм от края предполагаемой опухолевой ткани в четырех точках, с контрольной точкой в центре. При выявлении повышенного накопления фотосенсибилизатора проводилась ререзекция измененных тканей с последующим гистологическим исследованием. Далее пациентам основной группы проводился се-
Таблица/table
Распределение пациентов в зависимости от локализации процесса, морфологического варианта опухоли и предшествующего лечения distribution of patients depending on the tumor localization, morphological type and previous treatment
|
Параметры/Parameters |
Группа 1/Group 1 (n=20) |
Группа 2/Group 2 (n=20) |
|
Локализация опухоли/Tumor location |
||
|
Верхнечелюстная пазуха/Maxillary sinus |
14 (70 %) |
12 (60 %) |
|
Полость носа/Nasal cavity |
3 (15 %) |
6(30 %) |
|
Клетки решетчатого лабиринта/Cells of the ethmoid labyrinth |
3 (15 %) |
2(10 %) |
|
Морфологический вариант/Morphological type |
||
|
Плоскоклеточный рак/Squamous cell carcinoma |
12 (60 %) |
14 (70 %) |
|
Аденокистозный рак/Adenocystic carcinoma |
6 (30 %) |
6 (30 %) |
|
Аденокарцинома/Adenocarcinoma |
2 (10 %) |
– |
|
Предшествующее лечение/Previous treatment |
||
|
Химиолучевая терапия/Chemoradiotherapy |
5 (25 %) |
5 (25 %) |
|
Химиотерапия + операция/Chemotherapy + surgery |
– |
4 (20 %) |
|
Лучевая терапия + операция/Radiation therapy + surgery |
4 (20 %) |
1 (5 %) |
|
Химиолучевая терапия + операция/Chemoradiotherapy + surgery |
1 (5 %) |
2 (10 %) |
|
Лучевая терапия/Radiotherapy |
4 (20 %) |
1 5 %) |
|
Химиотерапия/Chemotherapy |
6 (30 %) |
7 (35 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
анс фотодинамической терапии на ложе удаленной опухоли. Терапия проводилась с использованием препарата Фотодитазин в дозе 1 мг/кг массы тела. Облучение выполнялось на аппарате Латус – Т, с длиной волны 662 Нм, в дозе 300–350 Дж на поле, диаметр которого составлял от 1 до 2 см. Плотность мощности является расчетной величиной и может меняться в зависимости от параметров, используемых в методике применения ФДТ. В нашем исследовании плотность мощности варьировала от 0,4 до 0,5 Вт/см2 в зависимости от технических характеристик световода. После сеанса ФДТ для определения реализовавшегося эффекта фотобли-чинга повторно выполнялась лазерная спектроскопия тканей послеоперационной полости.
Все пациенты обеих групп проходили контрольное обследование, которое проводилось с применением эндоскопов Karl Storz 300и компьютерной томографии, выполняемой на аппарате Somatom Confidence 64. Первое контрольное обследование проводилось через 1 мес после оперативного вмешательства, затем каждые 3 мес в течение 1 года после лечения, далее каждые 6 мес. Исходя из конкретной ситуации, по показаниям эти сроки могли быть увеличены или сокращены. Эффективность лечения оценивалась на основании показателей общей и безрецидивной выживаемости в контрольной и исследуемой группе. Анализ выживаемости проводился методом Каплана–Майера с составлением кривых выживаемости. Для сравнения кривых выживаемости использовали непараметрический лог-ранговый критерий и критерий Гехана–Вилкоксона. Статистически значимым критерий считался при р<0,05. Помимо этого проводилась оценка течения репаративных процессов в послеоперационной полости.
Результаты
В ходе исследования были определены особенности проведения спектроскопии и ФДТ после удаления опухолей полости носа и ОНП. Данные отличия определяют совершенно иные подходы к проведению ФДТ по сравнению с остальными локализациями. Из-за обширности и выраженности кровоточивости раневой поверхности необходимо совмещение световода с аспиратором. Сложная геометрия раневой поверхности диктует необходимость проведения спектроскопии и ФДТ несколькими полями по всем «зонам опасности». Одновременное нахождение разнородных тканей (кость, мышцы, сосуды, нервы) в зоне исследования и проведения ФДТ предполагает разнородное накопление препарата, особенности флуоресценции и скорость его выгорания. В ходе спектрометрического исследования полученные путем точечных измерений спектры тканей центра ложа опухоли и предполагаемой зоны остаточной опухоли, периферии последней и визуально здоровых тканей анализировали по форме, величине и амплитуде сигнала. Интенсивность флуоресценции измерялась в условных единицах. В большинстве случаев были получены диаграммы с четким разделением уровней накопления препарата в здоровых тканях (c-d) и тканях ложа опухоли (a-b) (рис. 1).
Из участков тканей, над которыми проводилось спектроскопическое исследование, осуществлялся забор материала на гистологическое исследование. Это позволило объективизировать полученные данные. В 30 % случаев исследования тканей из ложа опухоли после спектроскопического исследования опухолевая ткань не выявлялась, что подтверждало накопление сенсибилизатора перитуморально в зонах наибольшей активности опухоли с воспалением. Как известно, именно в этих зонах вероятность рецидива наиболее высока. И дополнительное воздействие на эти зоны – в нашем случае проведение фотодинамической терапии – абсолютно оправдано.
Эндоскопическое наблюдение за раневой поверхностью в послеоперационном периоде
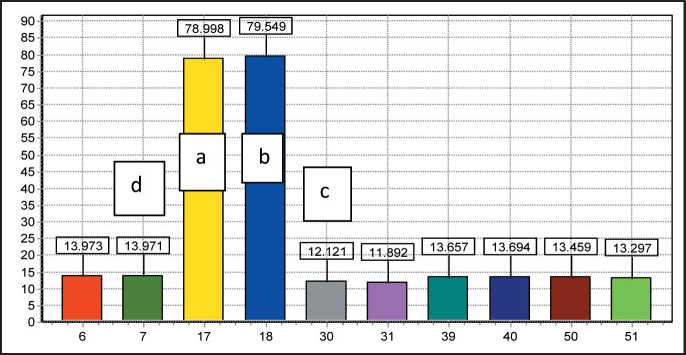
Рис. 1. Концентрации фотосенсибилизатора в области ложа опухоли на границе со здоровыми тканями. Плоскоклеточный умеренно дифференцированный рак. Примечание: диаграмма выполнена авторами Fig. 1. Photosensitizer concentrations in the area of the tumor bed at the border with healthy tissues.
Squamous cell moderately differentiated cancer. Note: created by the authors
позволило установить закономерности течения репаративных процессов и отличия последних в исследуемой и контрольной группе. Основная последовательность процессов заживления раны, как то: развитие отека тканей и очагов кровоизлияния, формирование струпа, развитие грануляционной ткани с последующим ростом эпителия и полной эпителизацией раневой поверхности – в группах была одинаковой. Отличия были выявлены в выраженности воспалительной реакции в области раневой поверхности и сроках заживления (рис. 2).
У больных, получавших ФДТ, наблюдалось сокращение времени эпителизации раневой по-
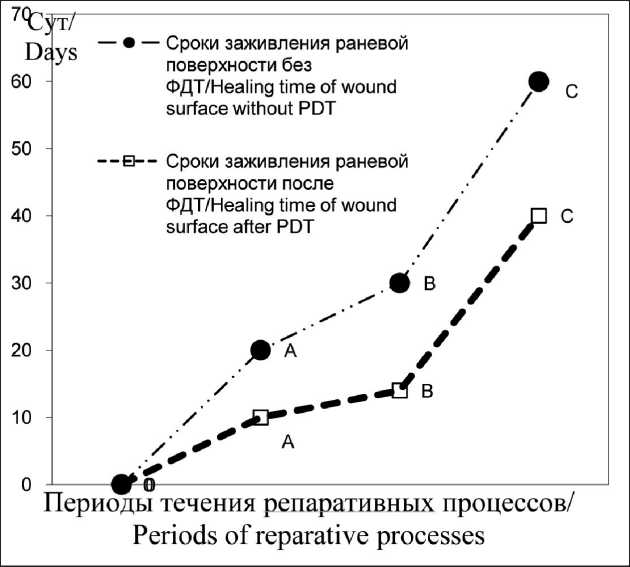
Рис. 2. Длительность процессов заживления раневой поверхности у пациентов исследуемой и контрольной групп: А – сроки отторжения струпа; В – сроки развития грануляционной ткани; С – сроки эпителизации Примечание: рисунок выполнен авторами
Fig. 2. Diagram of the duration of wound surface healing in patients of the study and control groups: A – time of scab rejection; B – time of development of granulation tissue; C – time of epithelialization. Note: created by the authors верхности до 40 сут, по сравнению с контрольной группой, в которой заживление наступало в среднем через 60 сут. В исследуемой группе заживление протекало более гладко, не было выраженных воспалительных явлений с некрозом тканей раневой поверхности. Благодаря высокой точности манипуляции предотвращается повреждение соседних структур, минимизируется реакция окружающих тканей на лазерное воздействие, отсутствует интенсивная воспалительная реакция в краевой зоне операционной раны, что способствует процессам быстрой и полноценной регенерации, предупреждению грубой рубцовой деформации.
В исследуемой группе лишь в 1 случае установлен ранний продолженный рост опухоли в сроки до 2 мес. Рецидивная опухоль поражала основание черепа в области средней черепной ямки, и ФДТ была проведена на костные структуры после удаления опухоли. Данный случай позволяет предположить неэффективность ФДТ при поражении опухолью костных структур и нуждается в дальнейшем изучении.
За период наблюдения смерть от прогрессирования заболевания наступила у 19 (47,5 %) пациентов из обеих групп, причем в 14 (70,0 %) случаях в контрольной группе и в 5 (25,0 %) случаях в исследуемой группе. Выявлены статистически значимые различия по непараметрическим критериям: по критерию Гехана–Вилкоксона – 3,11 (р=0,002), по Log-Rank –3,03 (p=0,002) (рис. 3). При оценке общей выживаемости завершенных случаев в контрольной группе было 10 (50,0 %), в исследуемой – 4 (20,0 %), цензурированных – 10 (50,0 %) и 16 (80,0 %) соответственно. Статистический критерий Гехана–Вилкоксона – -2,02 (p=0,04), Log-Rank критерий – 2,10 (p=0,04). Таким образом, по каждому из представленных критериев выявлены значимые различия между показателями контрольной и исследуемой групп (рис. 4).
С учетом приведенных данных можно сделать вывод,
что включение интраоперационной ФД и
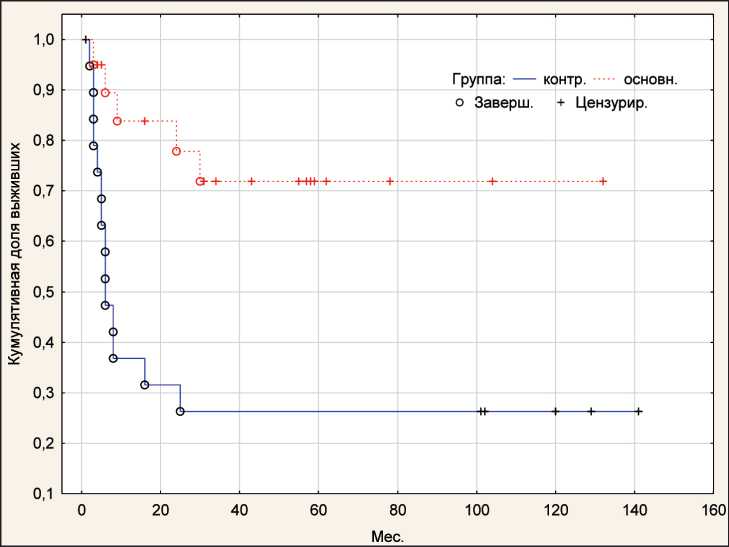
Рис. 3. Кривые безрецидивной выживаемости в основной и контрольной группах (метод Каплана–Мейера).
Примечание: рисунок выполнен авторами Fig. 3. Recurrence-free survival curves in the study and control groups (Kaplan–Meyer method). Note: created by the authors
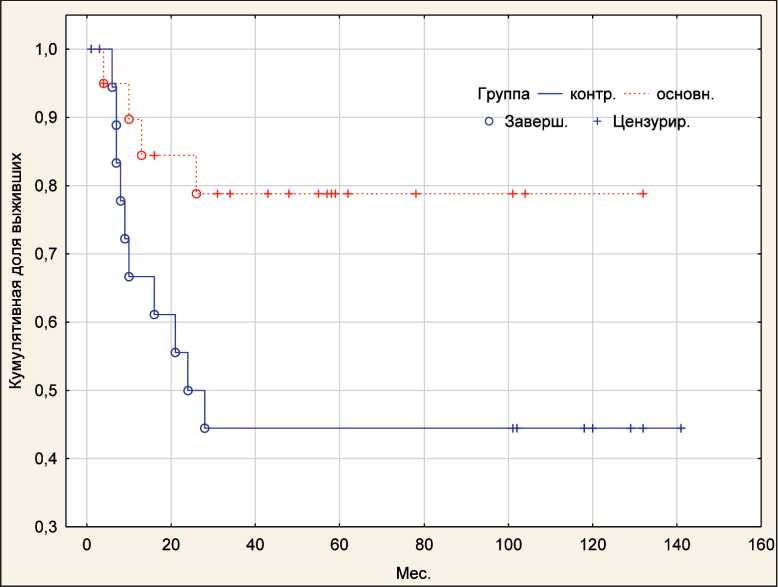
Рис. 4. Кривые общей выживаемости в основной и контрольной группах (метод Каплана–Мейера). Примечание: рисунок выполнен авторами Fig. 4. Curves of overall survival in the study and control groups (Kaplan-Meyer method).
Note: created by the authors
ФДТ в алгоритм лечения карцином полости носа и околоносовых пазух достоверно увеличивает медиану безрецидивной и общей выживаемости пациентов. Методика ФДТ показана при рецидивных опухолевых процессах в мягких тканях, а также при первичных опухолях, когда распространенность ставит под сомнение радикальность операции.
Обсуждение
Особое место среди всех онкологических процессов занимают опухоли полости носа и придаточных пазух. Злокачественные новообразования околоносовых пазух и слизистой оболочки полости носа составляют от 0,2 до 1,4 % всех злокачественных опухолей. Наиболее часто (60–65 % случаев) патологический процесс локализуется в верхнечелюстной пазухе. Реже поражаются решетчатый лабиринт (20–25 %), полость носа (12–15 %). По данным исследований нашего института, при данной патологии общая 3-летняя выживаемость составляет 78 %, а безрецидивная – 66 %. Несмотря на совершенствование методов комбинированного лечения, остается высокой частота местных рецидивов, которые в течение первых 2 лет наблюдаются в 50–80 % случаев. По общепринятым стандартам все пациенты с рецидивными опухолями переводятся в группу больных, подлежащих паллиативному лечению [1–3]. Паллиативные варианты лечения пациентов с синоназальным раком включают хирургические вмешательства, лучевую и химиотерапию. Методы паллиативной помощи способны облегчать симптомы, улучшать качество жизни пациентов и потенциально продлить ее продолжительность. Однако исследования по паллиативной помощи при синоназальном раке остаются немногочисленными, и большинство фактических данных поступает из серии случаев или ограниченных исследований с небольшими выборками [4, 5]. Все это определяет актуаль- ность внедрения новых подходов к лечению этой категории больных. В связи с этим представляется перспективным метод лечения, включающий интраоперационную фотодинамическую терапию и фотодиагностику. Оригинальная методика лечения, разработанная в нашем институте, включает оперативное вмешательство с интраоперационной спектроскопией и фотодинамической терапией с использованием фотосенсибилизатора фотодита-зина. Установлено, что спектроскопия позволяет более точно определить границы опухолевого процесса в условиях сложной анатомической конфигурации, а фотодинамическая терапия, проводимая на ложе опухоли, позволяет разрушить остаточные микроскопические опухолевые клетки. При анализе результатов получены диаграммы с четким разделением уровней накопления препарата в здоровых тканях и тканях ложа опухоли. В послеоперационном периоде при эндоскопическом исследовании наблюдалось сокращение времени эпителизации раневой поверхности до 40 сут, по сравнению с контрольной группой, в которой заживление наступало через 60 сут. В исследуемой группе не было выраженных воспалительных явлений с некрозом раневой поверхности.
В обеих группах удаление рецидивных опухолей проводилось в пределах видимо здоровых тканей. Но спектроскопическое исследование позволило выявить в исследуемой группе повышенное, относительно остальной поверхности края резекции, накопление фотосенсибилизатора у 7 пациентов, что потребовало ререзекции тканей с повышенным накоплением фотосенсибилизатора. Морфологический анализ операционного материала показал, что в тканях с повышенным накоплением ФС в 4 из 7 случаев получен микроскопически положительный край. ФДТ проводилась после ререзекции на ложе опухоли. При отсутствии очагов с повышенным содержанием ФС ФДТ проводилась на все ложе опухоли без забора тканей на гистологическое исследование после процедуры. В связи с тем, что у всех пациентов интраоперационно была выполнена ререзекция тканей, объем хирургического вмешательства можно считать радикальным. В группе контроля, по данным историй болезни, в 5 случаях получен микроскопически положительный край резекции.
Оценивая полученные данные, мы сделали вывод, что применение разработанного метода лечения с использованием фотодинамической диагностики и фотодинамической терапии достоверно увеличивает показатели безрецидивной и общей выживаемости у пациентов с рецидивными карциномами полости носа и околоносовых пазух.
Заключение
Применение ФДТ является перспективным методом лечения, позволяющим существенно повысить
Список литературы Фотодинамическая терапия в лечении рецидивных карцином полости носа и околоносовых пазух
- Болотина Л.В., Владимирова Л.Ю., Деньгина Н.В., Новик А.В., Романов И.С. Практические рекомендации по лечению злокачественных опухолей головы и шеи. Злокачественные опухоли. 2021; 11(3s2-1): 91–106. [Bolotina L.V., Vladimirova L.Yu., Dengina N.V., Novik A.V., Romanov I.S. Practical recommendations for the treatment of malignant tumors of the head and neck. Malignant tumors. 2021; 11(3s2-1): 91–106. (in Russian)]. doi: 10.18027/2224-5057-2021-11-3s2-06.
- Состояние онкологической помощи населению России в 2019 году. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М., 2020. 239 с. [Cancer care for the population of Russia in 2019. Ed. by A.D. Kaprin, V.V. Starinsky, A.O. Shakhzadova. Moscow, 2020. 239 p. (in Russian)].
- Donohoe C., Senge M.O., Arnaut L.G., Gomes-da-Silva L.C. Cell death in photodynamic therapy: From oxidative stress to anti-tumor immunity. Biochim Biophys Acta Rev Cancer. 2019; 1872(2). doi: 10.1016/j.bbcan.2019.07.003.
- Dutta R., Dubal P.M., Svider P.F., Liu J.K., Baredes S., Eloy J.A. Sinonasal malignancies: A population-based analysis of site-specific incidence and survival. Laryngoscope. 2015; 125(11): 2491–7. doi: 10.1002/lary.25465.
- Shah J.P., Patel S.G., Singh B., Wong R. Head and Neck Surgery and Oncology. Elsevier, 2019. 896 p.
- Кит О.И., Решетов И.В., Енгибарян М.А. Инновационный подход к хирургическому лечению местнораспространенного рака околоносовых пазух и полости носа. Вестник РАМН. 2021; 76(3): 317–23. [Kit O.I., Reshetov I.V., Engibaryan M.A. Innovative Approach to Surgical Treatment for Locally Advanced Cancer of Paranasal Sinus and Nasal Cavity. Annals of the Russian academy of medical sciences. 2021; 76(3): 317–23. (in Russian)]. doi: 10.15690/vramn1393.
- Кульбакин Д.Е., Чойнзонов Е.Л., Мухамедов М.Р., Гарбуков Е.Ю., Штин В.И., Хавкин Н.М., Васильев Р.В. Реконструктивно-пластические операции в комбинированном лечении больных местнораспространенными опухолями головы и шеи. Вопросы онкологии. 2017; 63(6): 862–66. [Kulbakin D.E., Choinzonov E.L., Mukhamedov M.R., Garbukov E.Yu., Shtin V.I., Khavkin N.M., Vasiliev R.V. Reconstructive plastic surgery in combined treatment of patients with locally advanced head and neck tumors. Problems in Oncology. 2017; 63(6): 862–66. (in Russian)].
- Новиков В.А., Васильев Р.В., Чойнзонов Е.Л., Лисин В.А., Мусабаева Л.И., Грибова О.В., Суркова П.В., Штин В.И., Рябова А.И. Интраоперационная лучевая терапия: реальность и перспектива. Злокачественные опухоли. 2017; 7(3s1): 35–40. [Novikov V.A., Vasiliev R.V., Choynzonov E.L., Lisin V.A., Musabaeva L.I., Gribova O.V., Surkova P.V., Shtin V.I., Ryabova A.I. Intraoperative radiation therapy: reality and prospects. Malignant tumors. 2017; 7(3s1): 35–40. (in Russian)]. doi: 10.18027/2224-5057-2017-7-3s1 35-40.
- Черемисина О.В., Вусик М.В., Солдатов А.Н., Рейнер И.В. Современные возможности эндоскопических лазерных технологий в клинической онкологии. Сибирский онкологический журнал. 2007; (4): 5–11. [Cheremisina O.V., Vusik M.V., Soldatov A.N., Reiner I.B. Endoscopic laser technologies in clinical oncology. Siberian Journal of Oncology. 2007; (4): 5–11. (in Russian)].
- Castano A.P., Mroz P., Hamblin M.R. Photodynamic therapy and anti-tumour immunity. Nat Rev Cancer. 2006; 6(7): 535–45. doi: 10.1038/nrc1894.
- Коршунова О.В., Плехова Н.Г. Фотодинамическая терапия в онкологии: настоящее и будущее. Тихоокеанский медицинский журнал. 2020; (4): 15–19. [Korshunova O.V., Plekhova N.G. Photodynamic therapy in oncology: Present and future. Pacific Medical Journal. 2020; (4): 15–19. (in Russian)]. doi: 10.34215/1609-1175-2020-4-15-19.
- Сажнев Д.И., Андреев А.А., Остроушко А.П. Фотодинамическая терапия в хирургической практике. Вестник экспериментальной и клинической хирургии. 2019; 12(2): 141–46. [Sazhnev D.I., Andreev A.A., Ostroushko A.P. Photodynamic Therapy in Surgical Practice. Journal of experimental and clinical surgery. 2019; 12(2): 141–46. (in Russian)]. doi: 10.18499/2070-478X-2019-12-2-141-146.
- Истомин Ю.П., Артемьева Т.П., Церковский Д.А. Клиническое применение фотодинамической терапии в онкологии. Здравоохранение (Минск). 2016; 10: 54–58. [Istomin Yu.P., Artsemyeva T.P., Tserkovsky D.A. Photodynamic therapy clinical appliance in oncology. Healthcare (Minsk). 2016; 10: 54–58. (in Russian)].
- Филоненко Е.В., Трушина О.И., Новикова Е.Г., Зароченцева Н.В., Ровинская О.В., Иванова-Радкевич В.И., Каприн А.Д. Фотодинамическая терапия в лечении интраэпителиальных неоплазий шейки матки, вульвы и влагалища. Biomedical Photonics. 2020; 9(4): 31–39. [Filonenko E.V., Trushina O.I., Novikova E.G., Zarochentseva N.V., Rovinskaya O.V., Ivanova-Radkevich V.I., Kaprin A.D. Hotodynamic therapy in the treatment of intraepithelial neoplasia of the cervix, vulva and vagina. Biomedical Photonics. 2020; 9(4): 31–39. (in Russian)]. doi: 10.24931/2413-9432-2020-9-4-31-39.
- Касымов Б.Г., Шаназаров Н.А., Муратов Т.М., Даниярова Г.Д., Жумакаев А.М., Кызласов П.С., Кажера А.А., Cлесаревская М.Н., Кузьмин И.В., Аль-Шукри С.Х. Фотодинамические методы лечения немышечно-инвазивного рака мочевого пузыря. Урологические ведомости. 2021; 11(4): 355–63. [Kasymov B.G., Shanazarov N.A., Muratov T.M., Daniyarova G.D., Zhumakayev A.M., Kyzlasov P.S., Kazhera A.A., Slesarevskaya M.N., Kuzmin I.V., Al-Shukri S.K. Photodynamic methods of treatment of nonmuscular-invasive bladder cancer. Urology Reports. 2021; 11(4): 355–63. (in Russian)]. doi: 10.17816/uroved90554.
- Мартусевич А.К. Механизмы лечебного эффекта фотодинамической терапии. Биорадикалы и Антиоксиданты. 2021; 8(3): 4–17. [Martusevich A.K. Mechanisms of the therapeutic effect of photodynamic therapy. Bioradicals and Antioxidants. 2021; 8(3): 4–17. (in Russian)].
- Панасейкин Ю.А., Филоненко Е.В., Севрюков Ф.Е., Капинус В.Н., Полькин В.В., Исаев П.А., Каприн А.Д., Иванов С.А. Возможности фотодинамической терапии при лечении злокачественных опухолей полости рта. Biomedical Photonics. 2021; 10(3): 32–38. [Panaseykin Y.A., Filonenko E.V., Sevrukov F.E., Kapinus V.N., Polkin V.V., Isaev P.A., Kaprin A.D., Ivanov S.A. Possibilities of photodynamic therapy in the treatment of malignant tumors of the oral cavity. Biomedical Photonics. 2021; 10(3): 32–38. (in Russian)]. doi: 10.24931/2413-9432-2021-10-3-32-38.


