Фотофизические процессы в бис-цианинах
Автор: Кашапова Э.Р., Артюхов В.Я., Майер Г.В.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 4-2 т.13, 2011 года.
Бесплатный доступ
С использованием полуэмпирического метода частичного пренебрежения дифференциальным перекрыванием (ЧПДП) со специальной спектроскопической параметризацией определены энергия и природа электронно возбужденных состояний, сила осциллятора, поляризация переходов, дипольные моменты, рассчитаны константы скоростей фотофизических процессов, оценен квантовый выход флуоресценции из нижнего флуоресцентного состояния в молекулах мономера индокарбоцианина и его бис производных. На примере мономера цианина показано, как влияет перестройка геометрии в ходе процесса трансцис фотизомеризации на дезактивацию энергии S1 состояния. Установлено, что уменьшение квантового выхода флуоресценции в циклических бис цианинах происходит за счет уменьшения константы скорости радиационного распада на два порядка и роста константы скорости внутренней конверсии. Для ангулярных бис цианинов предложена наиболее вероятная ориентация связанных мономеров.
Бис-цианины, спектрально-люминесцентные свойства, фотофизические процессы, квантово-химический расчет, транс-цис-фотоизомеризация
Короткий адрес: https://sciup.org/148205535
IDR: 148205535 | УДК: 541.65/.654
Текст научной статьи Фотофизические процессы в бис-цианинах
Майер Георгий Владимирович, доктор физико-математических наук, профессор кафедры оптики и спектроскопии физического факультета.
за различия чисел агрегации и потому что в растворе равновесие существует между агрегатами различных составов, включающих их с мономерами. Бис-хромофоры, которые присутствуют в их мономерных формах в достаточно разбавленных растворах, свободны от этих недостатков [5].
Цель данной работы – установление влияния структуры мономера цианина и его бис-производных на спектрально-люминесцентные свойства и фотофизические процессы, протекающие в молекулах.
В качестве объектов исследования выбраны мономер индокарбоцианина (1,1',3,3,3',3'-гексаме-тилиндокарбоцианин тетрафторборат, A-1) и его бис-производные, в которых два хромофора связаны одной (А-2, А-3 - ангулярные ) и двумя (А-4, А-5 - циклические) цепочками, состоящими из различного числа метиленовых групп. Структура исследованных соединений представлена на рис. 1.
Расчеты электронной структуры и спектров выполнены с использованием пакета программ, в основе которого лежит квантово-химический полуэмпирический метод частичного пренебрежения дифференциальным перекрыванием (ЧПДП) с параметризацией [7]. Важным преимуществом данного пакета программ перед существующими вариантами полуэмпирических и ab initio методов расчета, широко используемых многими исследователями, является возможность расчета констант скоростей всех фото-физических процессов (радиационных переходов, внутренней и интеркомбинационной конверсий).
Выбор геометрии молекул для модельных расчетов основывался на рентгеноструктурных данных для сходного класса соединений [8]. Но
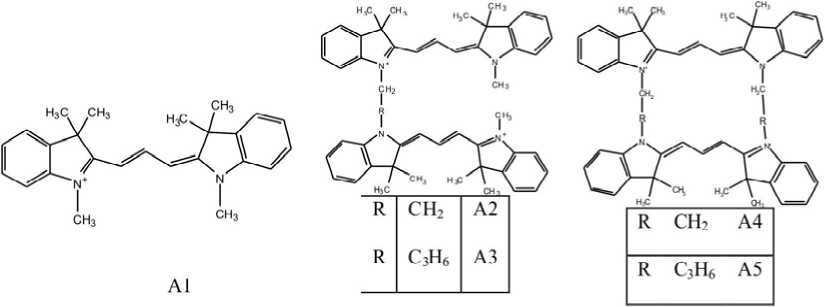
Рис 1. Структура исследованных соединений
окончательным критерием выбора геометрии являлось наилучшее совпадение рассчитанных и полученных из эксперимента спектральнолюминесцентных характеристик молекул. Во всех исследуемых молекулах длины С-Н связей в аром o атических циклах были взяты равными 1.08 Α . В метильных СН3-группах длины связей С-Н равна 1.09 Α , валентные углы Н-С-Н = 109.5°. В невозбужденном состоянии в расчетах приняты длины углерод-углеродных связей в шестичленных кольцах равные 1.4 Α , а все валентные углы – по 120°. Оба фрагмента плоские.
Молекулы цианинов могут быть представлены двумя доминантными резонансными формами с положительными зарядами на противоположных концах полиметиной цепи (ПЦ). Сле- довательно, каждая С-С-связь может быть охарактеризована как одиночная связь в одной форме и двойная связь в другой, что приводит к формированию неальтернированной структуры, в которой каждая связь рассматривается как полуторная вместо одиночной или двойной. Исследование структуры методом РСА подтвердило предсказанное выравнивание длин С-С-связей [9]. Поэтому в расчетах спектров поглощения исследуемых молекул длины связей С – С ПЦ взяты выровненными и равными 1.40 Α . При этом атомы углеродов ПЦ поочередно, сохраняя симметрию молекулы, выводились из этой плоскости таким образом, чтобы из двух соседних атомов углерода один был над, а другой – под плоскостью молекулы. Предпосылкой к этому
Таблица 1. Теоретические и экспериментальные данные для спектров поглощения. λ abs [нм] – длина волны, E [см-1] – энергия состояния, µ [ D ]-дипольный момент , ε [M-1·см-1] – молярный коэффициент экстинкции, P – поляризация перехода
В табл. 1 приведены теоретические и экспериментальные данные для спектров поглощения всех исследованных соединений. Спектр поглощения индокарбоцианина (А1) в растворе при комнатной температуре характеризуется интенсивным главным пиком и относительно слабым плечом при меньших длинах волн (табл. 1), которые приписываются переходам, соответствующим полностью транс-изомерам мономерных цианиновых красителей [5]. Установлено, что длинноволновая полоса поглощения мономера образованна электронным переходом с верхней занятой молекулярной орбитали (ВЗМО) на нижнюю вакантную молекулярную орбиталь (НВМО). Обе молекулярные орбитали локализованы на атомах углерода полиметиновой цепи. В случае циклических бис-цианинов нижнее S1 состояние образовано электронным переходом с ВЗМО на НСМО, локализованных на атомах углерода ПЦ одного хромофора, и электронным переходом с ВЗМО-1 на НСМО+1, локализованных на атомах углерода ПЦ другого хромофора (рис. 2).
Для двух бис-цианинов с открытой цепочкой (А2, А3) новая характерная полоса появляется с меньшей интенсивностью, чем полоса главного поглощения. Спектры А2 и А3 только незначительно отличаются от спектра мономера индокарбоцианина А1, в то время как спектры А4 и А5 отличаются сильно, так как их главный максимум сдвинут в коротковолновую область
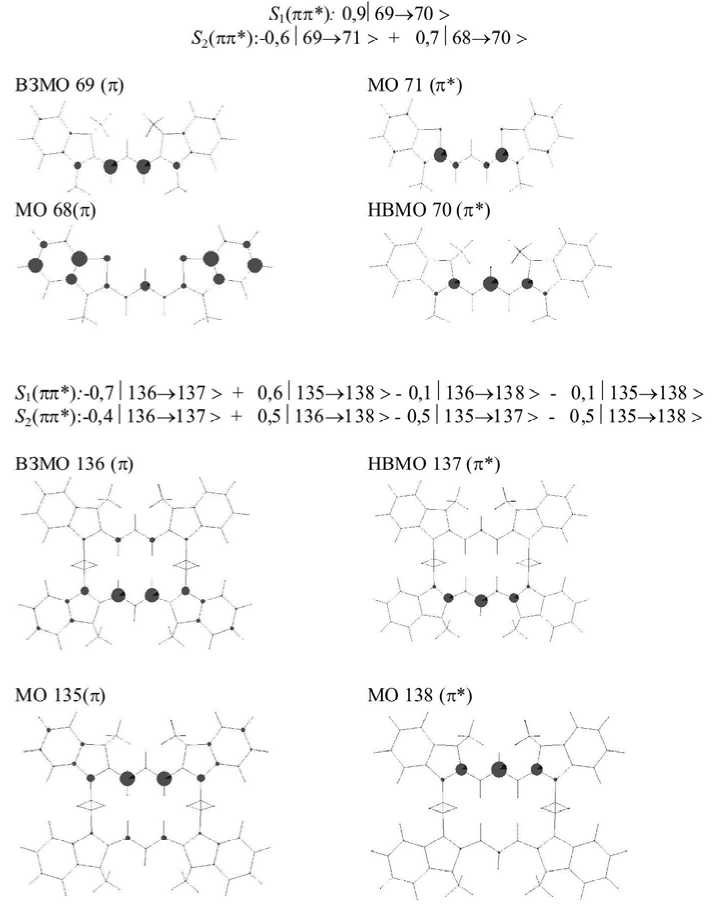
Рис. 2. Локализация МО и природа электронно-возбужденных состояний молекул мономера А1 и циклического бис-цианина А4
(табл. 1). Кроме того, ε ( λ аbs ) связанных соединений значительно больше, например, в три раза для А4 относительно А1.
Так как для ангулярных бис-цианинов А2 и А3 возможны различные ориентации соседних хромофоров, были исследованы конформации с различными углами двух связанных мономеров. При сопоставлении с экспериментальными данными, предположена наиболее оптимальная конфигурация, когда два хромофора находятся под углом 180о друг к другу, при этом хромофоры могут отклоняться от параллельной ориентации плоскостей. Данный результат согласуется с наличием двух полос поглощения, наблюдаемых в эксперименте [5]. Таким образом, сопоставление экспериментальных и теоретических данных говорит об их удовлетворительном соответствии как по положению полосы поглощения, так и по распределению интенсивности.
После поглощения кванта света в молекуле протекают релаксационные процессы, приводящие к изменению ее структурных параметров. Проявлением такой перестройки является, например, стоксов сдвиг спектра флуоресценции молекулы по отношению ее спектра поглощения. Иными словами, геометрия молекулы во флуоресцентном состоянии может заметно отличаться от геометрии молекулы в основном состоянии. Не учет этого факта может приводить к несовпадению экспериментальных и теоретических выводов о свойствах молекулы. Экспериментальное определение изменений геометрических параметров молекулы во флуоресцентном состоянии возможно, но не является прямым, а поэтому оказывается не всегда точным.
Для учета изменения геометрии молекул во флуоресцентном состоянии использовалось линейное соотношение между заселенностью химической связи А–В ( Р АВ), рассчитанной по Малликену, и ее длиной:
Δ RАВ ≈ – k Δ Р, где Δ RАВ и Δ РАВ – изменение длины и заселен- ности (электронной плотности) химической связи при возбуждении молекулы, соответственно.
Квантовый выход флуоресценции рассчитывался по формуле:
Ф f = k r / ( k r + k ВК + k ST ) , где k r – константа скорости радиационного распада, k ВК – константа скорости внутренней конверсии, k ST – константа скорости интерсистемной конверсии.
В табл. 2 приведены теоретические и экспериментальные данные для положения полосы флуоресценции, квантового выхода флуоресценции, а также рассчитанные значения для констант скоростей фотофизических процессов. Из табл. 2 видно, что Фfl существенно зависит от температуры: с понижением температуры квантовый выход флуоресценции приближается к 100% для А1, А2, А3, А5. Что касается А4, то для данного соединения квантовый выход также возрастает с понижением температуры, но составляет всего 18%. Следует обратить внимание, что наибольший стоксов сдвиг наблюдается именно для А4, то есть при электронном возбуждении в данном соединении происходят значительные структурные изменения, которые не были учтены в расчете. Необходимо отметить, что расчетные данные для положения нижнего триплетного состояния являются заниженными по энергии, что могло привести к недооценке константы скорости интерсистемной конверсии.
Так как для мономеров цианинов основном каналам дезактивации энергии S 1-состояния яв-
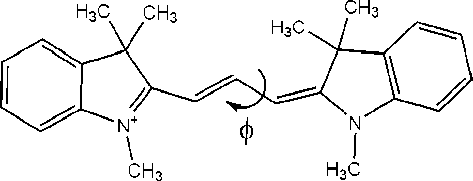
Рис 3. Моделирование процесса транс-цисфотоизомеризации на примере молекулы А1
Таблица 2. Теоретические и экспериментальные данные для спектров флуоресценции исследованных соединений
|
λ exp[5]/ λ теор, нм |
k r , с-1 |
k S0S1 , с-1 |
k ST , с-1 |
Ф fl (теор) |
Ф fl_exp (297 К)/ Ф fl_exp (77 К)[5] |
|
|
А1 |
565 ; 603 / 567.4 |
2.5×108 |
3.6×107 |
7.7×102 |
0.875 |
0.042 / 0.94 |
|
А2 |
580 (624) / 571.9 |
4.8×108 |
8.4×107 |
8.8×102 2.7×10 |
0.850 |
0.019 / 0.96 |
|
А3 |
568; 612 / 563.7 |
4.5×108 |
7.6×107 |
3.9×102 3.2×10 |
0.855 |
0.036 / 0.91 |
|
А4 |
580; 675; 720 / 552 ; 678 |
1.4×106 |
4.4×108 |
2×102 3.3×104 |
0.003 |
0.018 / 0.18 |
|
А5 |
584 ; 629 / 575 ; 632.2 |
8.5×106 |
2.7×108 |
1.8×104 103 |
0.031 |
0.071 / 0.88 |
Таблица 3. Зависимость квантового выхода флуоресценции А1 от угла между концевыми фрагментами.
Установлено, что существенное уменьшение квантового выхода флуоресценции имеет место при повороте в области 75о-105о. При повороте на 90о, когда фрагмент ПЦ полностью выведен из п -сопряжения системы, константа скорости интерсистемной конверсии возрастает, а константа скорости радиационного распада и внутренней конверсии падают на несколько порядков по сравнению с транс-изомером, что приводит к значительному падению квантового выхода флуоресценции по сравнению с транс-изомером. При вращении концевых фрагментов вплоть до 75о происходит постепенное уменьшение константы скорости радиационного распада на порядок и увеличение константы скорости внутренней конверсии между основным и S 1 состояниями также на порядок (табл. 3). Когда концевые фрагменты находятся под углом 75о друг к другу, имеет место значительное увеличение константы скорости интерсистемной конверсии ( k T =8.3 х 10 7 с-1), что позволяет данному каналу распада конкурировать с каналом распада, связанным с константой скорости внутренней конверсии.
Таким образом, в результате проведенного теоретического исследования были определены спектрально-люминесцентные свойства мономера цианина и его бис-производных. Результаты расчета находятся в удовлетворительном соответствии с экспериментальными данными. Установлено, что уменьшение квантового выхода флуоресценции в бис-цианинах А4 и А5 происходит за счет уменьшения константы скорости радиационного распада на два порядка и роста константы скорости внутренней конверсии, константа скорости интерсистемной конверсии возрастает по сравнению с этой же величиной для мономера, но по прежнему не может конкуриро- вать с константой скорости внутренней конверсии. На примере мономера А1 показано, как влияет перестройка геометрии в ходе процесса транс-цис-фотизомеризации на дезактивацию энергии S1 состояния. Для ангулярных бис-циа-нинов предложена наиболее вероятная ориентация связанных мономеров.
Работа выполнена при поддержке ФЦП “Научные и научно-педагогические кадры инновационной России” на 2009-2013 годы (госконтракты № П 1128, мероприятие 1.2.1 и № 02.740.11.0444, мероприятие 1.1) и гранта Президента РФ для государственной поддержки ведущих научных школ РФ (НШ-4297.2010.2).
Список литературы Фотофизические процессы в бис-цианинах
- Cyanines during the 1990s: A Review/A. Mishra, R. K. Behera, P. K. Behera, B. K. Mishra, G. B. Behera//Chem. Rev.2000. №100. P. 1973-2011.
- Functional Dyes/Ed. by Sung_Hoon Kim. Elsevier B.V., 2006. 266 p.
- Ищенко А.А. Строение и спектрально-люминесцентные свойства полиметиновых красителей. Киев: Наукова думка, 2005. 296 с.
- Джеймс Т.Х. Теория фотографического процесса. Л.: Химия, 1980. 672 с.
- Photorelaxation Processes in Covalently Linked Indocarbocyanine and Thiacarbocyanine Dyes/A. K.Chibisov, G. V.Zakharova, H Gerner. et al.//J. Phys. Chem. 1995. № 99. P. 886-893.
- Чибисов А. К. Фотоника димеров цианиновых красителей//Химия высоких энергий. 2007. Т. 41, №3. С. 1-10.
- Электронно-возбужденные состояния и фотохимия органических соединений/Г.В. Майер, В.Я.Артюхов, О.К. Базыль и др. Новосибирск: Наука, 1997, 232 с.
- Строение органического вещества. Данные структурных исследований. 1971-1973/А.И. Китайгородний, Н.М. Зоркий, А.И. Бельский. М.: Наука, 1982. 511 с.
- Dahne S., Kulpe S. Structural Principles of Unsaturated Organic Compounds. With special reference to X-ray structure analysis of coloured substances. Berlin: Abhandlungen der Wissenschaften, Abteilung Mathematik, Naturwissenschaften Academie-Verlag, 1977. 128 p.
- Электронная структура и внутримолекулярные фотофизические процессы катионов симметричных индополикарбоцианиновых красителей/О. К. Базыль, В.А. Светличный, В.Я. Артюхов, А.А. Ищенко//Оптика и спектроскопия. 2008. №3. С. 370-379.
- Шведов С.В., Чибисов А.К. Конформационные превращения дикарбоцианиновых красителей. Результаты полуэмпирических квантово-химических расчетов и спектрально-кинетических измерений//Журн. науч. и прикл. фотографии. 2000. Т.45, № 6. С. 35-42.


