Фотофизические свойства производных циклоалкил- и циклоалкенилтиофенов и 2, 2'-битиофенов
Автор: Мешковая В.В., Юдашкин А.В., Климочкин Ю.Н.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 6-1 т.13, 2011 года.
Бесплатный доступ
В статье рассмотрены спектры поглощения и люминесценции тиофенов и 2,2'-битиофенов, содержащих циклоалкильные фрагменты, проведен анализ зависимости «структура - люминесцентные свойства
Спектры поглощения, спектры люминесценции, циклоалкил-2, 2'-битиофены
Короткий адрес: https://sciup.org/148200517
IDR: 148200517 | УДК: 539.22
Текст научной статьи Фотофизические свойства производных циклоалкил- и циклоалкенилтиофенов и 2, 2'-битиофенов
Люминесцентные вещества и материалы находят широкое применение в качестве добавок в ткани, пластики, чернила, лазерных красителей широкого диапазона действия, биологических маркеров [1]. Особый интерес представляют ди-замещенные 2,2’-битиофены, обладающие интенсивной люминесценцией. Разнообразные производные олиготиофенов, проявляющие полупроводниковые и электролюминесцентные свойства, применяются в электронных устройствах как хранители энергии и переносчики электронных импульсов [2]. Наличие в структуре 2,2’-битиофена в положениях 5 и 5’, характеризующие наиболее длинную цепь р-сопряжения молекулы и максимальный батохромный сдвиг, различных по электронной природе электронодонорных и электроноацепторных заместителей увеличивает фотостабильность системы и интенсивность люминесценции и повышению квантового выхода [3].
Конструирование новых органических люминофоров с использованием молекулы 2,2’-би-тиофена показал наибольшую активность атомов С5 и С5’, которые являются концевыми в нераз-ветвленной линейной цепочке, включающей четыре двойные связи [4]. Введение электронодонорного или гетероциклического и электроноа-цепторного заместителей в эти положения должно привести к появлению значительного дипольного момента в S0 и S1 π - π * состояниях и внутримолекулярного переноса заряда, увеличению силы осциллятора и батохромному сдвигу S0 и S1 π - π * перехода.
Известно, что молекула 2,2’-битиофена находится в двух конформациях – s-цис- и s-транс-, при этом показано, что s-транс-конформер обладает большим дипольным моментом. Для молекул с возможным внутренним вращением необходимо, чтобы при S0 и S1 π - π * переходе порядки межциклических связей возрастали, т.е. в S1 π - π * состоянии молекула должна быть более плоской по сравению с S0 состоянием. Это увеличивает «жесткость» молекулы и уменьшает вероятность энергетических потерь за счет внутреннего вращения. Интерес представляют производные 2,2’-битиофена, содержащие циклоалкильный либо каркасный заместитель. Реакцией Гриньяра взаимодействием 2-тиенилмагнийбромида или 5-(2,2’-битиенил)магнийбромида с циклическими кетонами получены соответствующие третичные спирты и циклоалкены, которые проформилиро-ваны в условиях реакции Вильсмейера-Хаака.
При возбуждении молекулы происходит частичная фиксация конформации циклического фрагмента, либо в виде кресла, либо в виде ванны. С уменьшением количества метиленовых групп в циклоалкильном фрагменте становится затруднительным изменение конформации, что отмечено увеличением длины волны максимума люминесценции у соединения БТ-1, по сравнению с БТ-2 и БТ-4. Наличие в соединении БТ-3 двойной С=С-связи увеличивает цепь сопряжения и смещает максимум длины волны люминесценции на 2 нм, по сравнению с третичным спиртом БТ-2.
Отмечено, что 2,2’-битиофен, содержащий адамантановый фрагмент обладает наименьшим максимумом длины волны поглощения (313,5 нм) и люминесценции (461 нм) и значительным стоксовым сдвигом. Наличие 2,2’-битиофенового фрагмента во втором положении адамантанола приводит к образованию в возбужденном состоянии внутримолекулярной водородной связи атома серы с водородом гидроксигруппы. В спектре
Схема 1. Циклоалкилтиофены и 2,2’-битиофены
поглощения соединения БТ-7 наблюдается смещение полосы на 10,5 нм по сравнению с 2,2’-би-тиофеном, что объясняется наличием адамантанового заместителя. Возникновение интенсивной люминесценции в области 487 нм. Длина волны люминесценции 2-(2,2’-битиенил-5)адамантола-2 смещена на 80 нм в батохромную область, по сравнению с циклоалкил-2,2’-битиофенами (БТ-2 – БТ-6), что объясняется конформационной стабильностью адамантанового каркаса.
Исследования показали, что в соединениях, содержащих альдегидную группу (Т6-T9) про- исходит перенос заряда существующих состояний, вовлекающий электронный переход ароматических π-электронов в π*-антисвязывающую орбиталь в формильной группе. Введение альдегидной группы смещает длину волны поглощения исходного 5-(2-гидроксиадамантил-2)-2,2’-битиофена (БТ-7) на 51 нм, а длина волны максимума люминесценции смещается на 46 нм.
Введение адамантанового фрагмента приводит к увеличению стабильности молекулы [5]. Ароматические системы, содержащие 1-адаман-тильный фрагмент, имеют незначительный кван-
Таблица 1. Характеристики поглощения и люминесценции соединений.
|
Соединение |
λ погл. [нм ] |
λ люм. [нм] |
Стоксов сдвиг [нм] |
Соединение |
λ погл. [нм] |
λ люм. [нм] |
Стоксов сдвиг [нм] |
φ |
|
Т-1 |
281 |
346 |
65 |
БТ-1 |
323 |
426 |
103 |
|
|
T-2 |
279 |
346 |
67 |
БТ-2 |
341 |
408 |
69 |
|
|
T-3 |
283 |
344 |
61 |
БТ-3 |
316 |
424 |
108 |
|
|
Т-4 |
279 |
344 |
65 |
БТ-4 |
338 |
432 |
94 |
|
|
Т-5 |
236 |
346 |
110 |
БТ-5 |
340 |
410 |
70 |
|
|
Т-6 |
260, 286 |
434 |
148 |
БТ-6 |
341 |
408 |
67 |
|
|
Т-7 |
334 |
406 |
72 |
БТ-7 |
313.5 |
461, 487 |
147.5 |
|
|
Т-8 |
334 |
410 |
76 |
БТ-8 |
396 |
518 |
122 |
0.37 |
|
БТ-9 |
385 |
515 |
130 |
0.35 |
||||
|
БТ-10 |
392 |
500 |
107 |
0.43 |
||||
|
БТ-11 |
390 |
497 |
107 |
0.42 |
||||
|
БТ-12 |
364.5 |
507, 532 |
142.5 |
|||||
|
БТ-13 |
341 |
406 |
65 |
|||||
|
БТ-14 |
389 |
502 |
113 |
0.34 |
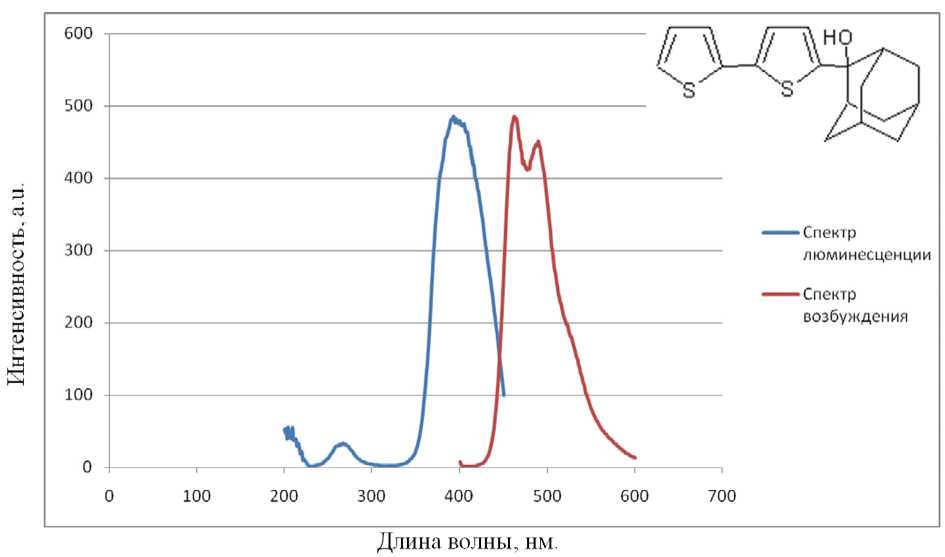
Рис. 1. Спектр возбуждения и люминесценции соединения БТ-7
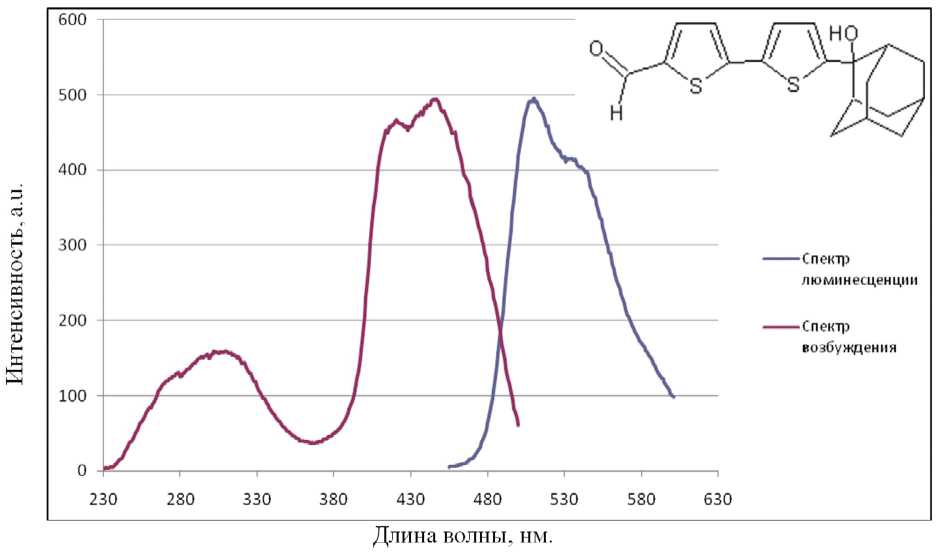
Рис. 2. Спектр возбуждения и люминесценции соединения БТ-12
товый выход люминесценции. Отмечено, что 2,2’-битиофен, содержащий адамантановый фрагмент обладает наименьшим максимумом длины волны поглощения (313,5 нм) и люминесценции (461 нм), и аномально большим стоксовым сдвигом, что говорит о стабильности молекулы. Возможно, в данном случае наличие ароматического заместителя во втором положении адамантанового каркаса способствует стабилизации системы и возникновению интенсивной люминесценции. Введение альдегидной группы смещает длину волны поглощения исходного адамантил-2,2’-битиофена на 51 нм, а длина волны максимума люминесценции смещается на 46 нм. Наблюдается большой Стоксов сдвиг у соединения БТ-13, который объясняется большой потерей энергии из-за происходящего выброса энергии во время возбуждения и объясняется взаимодействием между флуорофором и молекулами растворителя, соответственно, изменением диполя молекулы и образованием заряженных комплексов.
Спектры поглощения измерены на приборе Shimadzu UV-mini, спектры люминесценции измерены на приборе Cary Eclipse в 95% этаноле в кварцевых кюветах (l 1 см). В качестве стандарта для измерения квантового выхода использовался 9,10-дифенилантрацен, ширина щели 2,5 нм [6].
Работа выполнена при финансовой поддержке ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007-2013 г.» (ГК № 11.519.11.2012) с использованием научного оборудования ЦКП СамГТУ «Исследование физикохимических свойств веществ и материалов».
Список литературы Фотофизические свойства производных циклоалкил- и циклоалкенилтиофенов и 2, 2'-битиофенов
- Batista R.M.F., Costa S.P.G., Raposo M.M.M. Synthesis of new fluorescent 2-(2',2"-bithienyl)-1,3-benzothiazoles//Tetrahedron letters. 2004. V. 45. P. 2825-2828.
- Raposo M.M.M., Fonseca A.M.C., Kirsch G. Synthesis of donor acceptor substituted oligothiophenes by Stille coupling//Tetrahedron. 2004. V. 60. P. 4071-4078.
- Юдашкин А.В. Синтез и строение ацил и нитропроизводных 5-N-ацетиламино и 5-метил 2,2'-битиофенов: Автореферат дисс. … канд. хим. наук. Москва, 1983. 16 с.
- Игнатов В.Ф. Электронное строение, спектрально-люминесцентные и генерационные свойства произ водных 2,2'-битиофена -нового класса органических люминофоров и лазерных красителей: Автореферат дисс. … канд. физ. мат. наук. Москва, 1982. 22 с.
- Shen X. M., Jiang X. L., Huang C. C., Zhang H. H., Huang J. D. Highly photostable silicon(IV) phthalocyanines containing adamantane moieties: synthesis, structure, and properties//Tetrahedron. 2010. V. 66. P. 9041-9048.
- Fery Forgues S., Lavabre D. Are fluorescence quantum yields so tricky to measure? A demonstration using familiar stationery products//Journal of Chemical Education. 1999. V. 76. N. 9. P. 1260-1264.


