Фотофосфорилирование, структура хлоропластов и аминокислотный состав запасного белка в зерне ячменя и пшеницы при обработке растений N,N-дифенилмочевиной
Автор: Татаринцев Н.П., Семенова Г.А., Креславский В.Д.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биологически активные соединения
Статья в выпуске: 3 т.48, 2013 года.
Бесплатный доступ
Имеющиеся в специальной литературе данные свидетельствуют о большой роли фитогормонов, в частности цитокининов, в регуляции роста и развития растений. Цитокинины стимулируют деление клеток, участвуют в их дифференциации и других физиологических процессах. На растениях ячменя ( Hordeum vulgare L.) сортов Трумпф и Одесский 100, а также пшеницы ( Triticum aestivum L.) сортов Московская 35 и Тулунская, выращенных от всходов до созревания в открытом грунте в сосудах без дна, мы изучили влияние природного соединения — N,N-ди-фенилмочевины (ДФМ), обладающей цитокининовой активностью, на скорость фотофосфорилирования и структуру клеток мезофилла и хлоропластов в фазу молочной спелости, а также на аминокислотный состав запасного белка зерна. Обработка растений злаковых культур ДФМ изменяла соотношение скорости циклического и нециклического фотофосфорилирования в препаратах тилакоидных мембран, выделенных из флагового листа, и вызывала деструктивные изменения хлоропластов. В запасном белке было обнаружено изменение процентного соотношения ряда аминокислот, в частности увеличение содержания пролина. Модификации в клетках мезофилла хлоропластов при обработке ДФМ свидетельствуют, что воздействие этого природного соединения в начале фазы молочной спелости ускоряет процесс старения растений, тогда как применение препарата в начале фазы цветения, как мы предполагаем, приводит к обратному эффекту. Сделан вывод, что ДФМ регулирует энергетический обмен в листьях и белковый обмен в зерне у растений пшеницы и ячменя.
Аминокислотный состав белка зерна, дифенилмочевина, фотофосфорилирование
Короткий адрес: https://sciup.org/142133414
IDR: 142133414 | УДК: 633.1:577.175.14:576.311.342:581.132/.134
Текст научной статьи Фотофосфорилирование, структура хлоропластов и аминокислотный состав запасного белка в зерне ячменя и пшеницы при обработке растений N,N-дифенилмочевиной
Имеющиеся в специальной литературе данные свидетельствуют о большой роли фитогормонов в онтогенезе растений (1). Так, цитокинины стимулируют деление клеток и участвуют в регуляции их роста, дифференциации и других физиологических процессах (1-3). Обработка злаков цитокининами в фазу кущения приводит к изменению обмена веществ в уже завершивших рост органах. Кинетин, например, задерживает процессы старения и распада. Установлено (в частности, у злаковых культур) влияние цитокининов на синтез белков и энергетический обмен на уровне как целого растения, так и хлоропластов (2-5).
Ранее мы обнаружили, что воздействие Х,Х-дифенилмочевиной (ДФМ) — природным соединением, обладающим цитокининовой активностью, увеличивало скорость циклического (ЦФФ) и нециклического фотофосфорилирования (НФФ) в хлоропластах и изменяло пул индолов во флаговых листьях у растений пшеницы, обработанных в начале фазы цветения (6). Однако механизм действия Х,Х-дифенилмочевины на энергетический и аминокислотный обмен в различные фазы онтогенеза злаковых во многом остается неясным.
Целью настоящей работы стало изучение влияния Х,Х-дифенил-мочевины на скорость циклического и нециклического фотофосфорилирования в тилакоидных мембранах хлоропластов из листьев растений и состав запасных белков семян.
Методика . Растения ячменя ( Hordeum vulgare L.) сортов Трумпф и Одесский 100, а также пшеницы ( Triticum aestivum L.) сортов Московская 35 66
и Тулунская выращивали в открытом грунте от всходов до созревания (Московская обл.) в сосудах без дна размером 0,5 м*0,5 м, наполненных серой лесной почвой. Перед посевом вносили удобрения — мочевину, двойной суперфосфат и K2SO4 в дозе 8 мг/100 г почвы для каждого элемента питания (N, P, K). Образцы выращивали в период с мая по сентябрь и обрабатывали раствором ДФМ (0,2 мг/м2) с помощью пульверизатора в начале фаз цветения и молочной спелости. Опыты проводили в течение 3 лет. Растительный материал отбирали утром (900-1000).
Тилакоидные мембраны хлоропластов выделяли из флаговых листьев согласно описанию (7). Скорость циклического и нециклического фотофосфорилирования (в присутствии экзогенного ферредоксина и соответственно восстановленного или окисленного НАДФ + ) определяли в реакционной среде объемом 1 мл, содержащей Трицин-буфер (20 мМ, рН 7,8), KCl (20 мМ), MgCl2 (5 мМ), АДФ (3 мМ), KH2PO4 (3 мМ), НАДФ •Н или НАДФ + (5 мМ), 60 мкг ферредоксина из листьев гороха. Объем добавленной суспензии хлоропластов по количеству материала был эквивалентен 30 мкг хлорофилла. Реакционную смесь освещали белым светом с интенсивностью 300 Вт/м2 в течение 3 мин. Выход образованного АТФ измеряли биолюминесцентным методом с исползованием АТФ-метра (опытное производство Института фундаментальных проблем биологии) по свечению люциферин-люциферазной системы (8).
Структуру хлоропластов в фазу молочно-восковой спелости исследовали с помощью электронной микроскопии (JM 100B, Япония) (9). Для этой цели аликвоту их суспензии фиксировали с 2,5 % глутаровым альдегидом в фосфатном буфере (рН 7,4) с последующей фиксацией в 1 % растворе OsO4, затем образцы обезвоживали в спирте и ацетоне и заполняли эпоном 812. Ультратонкие срезы окрашивали уранилацетатом и цит ратом свинца.
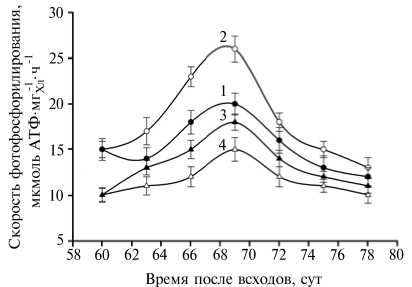
Рис. 1. Влияние N,N-дифенилмочевины (ДФМ) на скорость циклического (ЦФФ) и нециклического (НФФ) фотофосфорилирования в препаратах тилакоидных мембран, выделенных из листьев растений ячменя ( Hordeum vulgare L.) сорта Трумпф в фазу молочной спелости (60-80-е сут после всходов) : 1 — ЦФФ (контроль), 2 — ЦФФ (+ ДМФ), 3 — НЦФФ (контроль), 4 — НЦФФ (+ ДФМ). Растения обрабатывали ДФМ в начале фазы молочной спелости (60-е сут после всходов).
Состав запасного белка в зерне определяли на аминокислотном анализаторе LC-6000 («Bi-otronic», Германия).
Эксперименты проводили в 3 биологических и 4-5 аналитических повторностях. Представлены среднеарифметические результаты типичного опыта и их стандартные отклонения.
Достоверность различий определяли по / -критерию Стьюдента при P = 0,95.
Результаты. Уже на 2-е сут после обработки растений ДФМ, проведенной в начале фазы молочной спелости, наблюдалось увеличение скорости циклического фотофосфорилирования, тогда как скорость нециклического фотофосфорилирования изменялась незначительно (рис. 1). При этом максимальная разница между опытом и контролем достигалась к середине фазы молочной спелости. Согласно нашим данным по влиянию умеренного теплового стресса на фотохимическую активность и скорость фотофосфорилирования, полученным на про- ростках пшеницы (10), такая разница между циклическим и нециклическим фотофосфорилированием может объясняться проявлением умеренного окислительного стресса, индуцированного экстремальным воздействием. За счет развития окислительного стресса усиливается ЦФФ и снижается НФФ. Мы предположили, что обработка ДФМ аналогичным образом индуцирует развитие слабого окислительного стресса во флаговом листе, что приводит к усилению циклического фотофосфорилирования. В клетках контрольных (необработанных) растений даже в конце фазы молочно-восковой спелости явных деструктивных изменений матрикса и элементов цитоплазмы и хлоропластов не наблюдалось (рис. 2, А). Однако высокая электронная плотность матрикса цитоплазмы и стромы хлоропластов, а также наличие большого числа липидных глобул свидетельствовали об их старении (см. рис. 2, Б).
А
Б
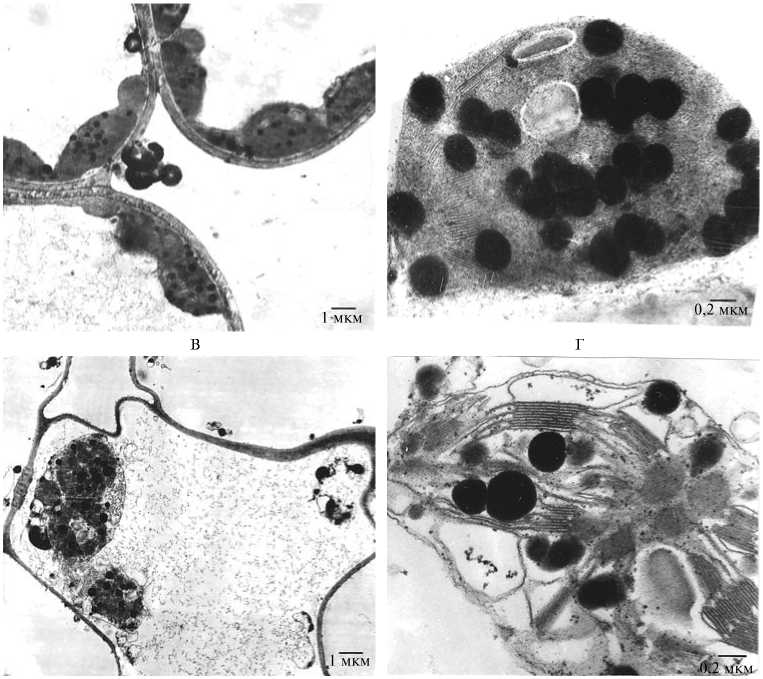
Рис. 2. Общий вид клетки (А, В) и хлоропласта (Б, Г) из мезофилла флагового листа у необработанных (А, Б) и обработанных N,N-дифенилмочевиной (В, Г) растений ячменя ( Hordeum vul-gare L.) сорта Трумпф.
Глубокие деструктивные модификации можно видеть в клетках мезофилла обработанных ДФМ растений (см. рис. 2, В). Цитоплазма полностью отсутствовала, хлоропласты потеряли оболочку и строму, число липидных капель значительно уменьшилось, осталась лишь выраженная система тилакоидных мембран (см. рис. 2, Г).
Обработка ДФМ приводила также к существенному изменению баланса аминокислот и суммарного белка в зерне. У растений ячменя, подвергшихся воздействию ДФМ в начале фазы цветения, увеличивалась уро- жайность (табл. 1), но уменьшалось содержание суммарного белка в зерне (табл. 2). Противоположный эффект отмечали при обработке образцов обеих культур в начале фазы молочной спелости (см. табл. 2, 3). В этом случае происходило увеличение как процентного содержания целого ряда аминокислот, так и суммарного содержания запасного белка.
-
1. Показатели продуктивности у растений ячменя ( Hordeum vulgare L.) при обработке N,N-дифенилмочевиной (ДФМ) в начале фазы цветения (вегетационный опыт, Московская обл.)
-
2. Содержание аминокислот в зерне (на сухую массу, %) у растений ячменя ( Hordeum vulgare L.) после обработки N,N-дифенилмочевиной (ДФМ) в фазу цветения и в фазу молочной спелости (вегетационный опыт, Московская обл.)
Аминокислота
Сорт Трумпф
Сорт Одесский 100
контроль
ДФМ
контроль
ДФМ
Обработка в
фазу цветения
Аспарагин
0,98
0,82
0,90
0,80
Треонин
0,79
0,68
0,55
0,55
Серин
0,68
0,65
0,59
0,55
Глутамин
3,17
3,97
3,41
2,80
Пролин
1,24
1,59
1,77
1,23
Глицин
0,72
0,70
0,65
0,55
Аланин
0,78
0,72
0,71
0,60
Валин
0,99
0,94
0,90
0,82
Метионин
0,45
0,26
0,26
0,22
Изолейцин
0,85
0,79
0,77
0,51
Лейцин
1,09
1,07
1,05
0,91
Тирозин
0,78
0,61
0,59
0,52
Фенилаланин
0,90
0,81
0,82
0,73
Гистидин
0,66
0,50
0,50
0,48
Лизин
0,85
0,66
0,69
0,64
Аргинин
1,15
1,05
0,92
0,88
Сумма
16,08
15,82
15,08
12,79
Обработка в фазу
молочной спелости
Аспарагин
0,98
1,21
0,90
1,15
Треонин
0,79
0,68
0,55
0,55
Серин
0,68
0,75
0,59
0,79
Глутамин
3,17
3,41
3,41
3,55
Пролин
1,24
2,27
1,77
2,03
Глицин
0,72
0,80
0,65
0,70
Аланин
0,78
0,86
0,71
0,75
Валин
0,99
1,09
0,90
1,02
Метионин
0,45
0,32
0,26
0,27
Изолейцин
0,85
0,92
0,77
0,80
Лейцин
1,09
1,30
1,05
1,08
Тирозин
0,78
0,74
0,59
0,65
Фенилаланин
0,90
1,09
0,82
0,86
Гистидин
0,66
0,57
0,50
0,69
Лизин
0,85
0,80
0,69
0,78
Аргинин
1,15
1,26
0,92
1,14
Сумма
16,08
18,07
15,08
16,78
Примечание. Погрешность измерений не превышала 5 %.
3. Содержание аминокислот в зерне
(на сухую массу, %)
у растений пшеницы (
Triticum aestivum
L.) после обработки N,N-дифенилмочевиной
(ДФМ)
в фазу молочной спелости
(вегетационный опыт, Московская обл.)
|
Показатель |
Сорт Трумпф |
Сорт Одесский 100 |
||
|
контроль | ДФМ |
контроль | ДФМ |
|||
|
Масса зерна с 10 колосьев, г (при 14 % влажности) |
13,60 |
13,98 |
14,12 |
14,86 |
|
Масса 1000 зерен, г (при 14 % влажности) (ГОСТ 10842-89) |
33,63 |
33,82 |
34,19 |
35,11 |
Примечание. Погрешность измерений не превышала 5 %.
Считается, что пролин служит маркером развития стресса в растениях (11). Было обнаружено значительное возрастание содержания пролина в обработанных растениях у ячменя сорта Трумпф (см. табл. 2), что согласуется с идеей развития умеренного ОС в их флаговом листе.
Увеличение скорости циклического фотофосфорилирования в хлоропластах после обработки ДФМ в начале фазы молочной спелости (см. рис. 1) свидетельствует о влиянии регулятора роста на энергетический об- мен. Максимальную активацию циклического фотофосфорилирования в хлоропластах наблюдали в середине фазы молочной спелости. При этом, как показано ранее в наших работах (5, 6), в листьях злаков изменяется содержание индолов и фенолов и, соответственно, соотношение цитокининов и ауксинов. Как уже отмечалось, обработка растений ячменя в начале фазы цветения, когда формируется колос, приводила к увеличению урожайности (см. табл. 1) и снижению процентного содержания запасного белка в зерне (см. табл. 2). В литературе имеются сведения о том, что после обработки злаков цитокининами в фазу колошения число зерен в колосе и урожайность растений возрастают (12). На основе полученных нами результатов и данных литературы можно предположить, что под влиянием ДФМ изменяется скорость поступления метаболитов аминокислотного обмена в репродуктивные органы и накопление этих веществ за вегетационный период.
|
Аминокислота |
Сорт Московская 35 |
Сорт Тулунская |
||
|
контроль I |
ДФМ |
контроль I |
ДФМ |
|
|
Аспарагин |
0,78 |
0,83 |
0,76 |
0,86 |
|
Треонин |
0,48 |
0,69 |
0,64 |
0,70 |
|
Серин |
0,70 |
0,79 |
0,67 |
0,74 |
|
Глутамин |
5,02 |
5,49 |
4,29 |
5,04 |
|
Пролин |
1,63 |
2,56 |
1,43 |
1,99 |
|
Глицин |
0,69 |
0,71 |
0,64 |
0,68 |
|
Аланин |
0,68 |
0,70 |
0,63 |
0,66 |
|
Валин |
0,88 |
0,94 |
0,77 |
0,83 |
|
Метионин |
0,26 |
0,31 |
0,26 |
0,32 |
|
Изолейцин |
0,89 |
0,75 |
0,68 |
0,70 |
|
Лейцин |
1,06 |
1,18 |
0,93 |
1,13 |
|
Тирозин |
0,60 |
0,68 |
0,54 |
0,61 |
|
Фенилаланин |
0,78 |
0,85 |
0,70 |
0,80 |
|
Гистидин |
0,57 |
0,59 |
0,51 |
0,52 |
|
Лизин |
0,56 |
0,51 |
0,51 |
0,52 |
|
Аргинин |
0,98 |
1,00 |
0,92 |
0,97 |
|
Сумма |
16,56 |
18,58 |
14,88 |
17,07 |
|
Примечание. Погрешность измерений не превышала 5 %. |
||||
Обработка растений ДФМ в начале фазы молочной спелости, когда колос полностью сформирован, вызывала увеличение содержания запасного белка в зерне, что также связано со скоростью поступления продуктов белкового обмена хлоропластов в репродуктивные органы. Известно (13), что стимуляция процесса старения за счет более длительного темнового периода выращивания вызывает протеолиз РДФ-карбоксилазы и других белков в листьях, в результате чего в них значительно возрастает содержание таких аминокислот, как аспарагин и серин. Из полученных нами данных (см. табл. 2, 3) следует, что в запасном белке зерна у растений ячменя и пшеницы, обработанных ДФМ в начале фазы молочной спелости, процентное содержание упомянутых и целого ряда других аминокислот тоже увеличивалось по сравнению с контролем. Эти результаты также свидетельствуют об усилении транспорта аминокислот из листьев в зерно, что обусловило повышение содержания в нем запасного белка при обработке ДФМ. Наличие глубоких деструктивных изменений в клетках мезофилла хлоропластов у обработанных растений по сравнению с контрольными (см. рис. 2, В) подтверждало, что воздействие ДФМ в начале фазы молочной спелости ускоряет процесс старения растений. Мы предполагаем, что обработка растений ДФМ в начале фазы цветения приводит к обратному эффекту — замедлению старения и, как видно из представленных данных (см. табл. 2), к уменьшению доли аспарагина и серина, а также ряда других аминокислот в запасном белке по сравнению с контролем.
Таким образом, обработка растений злаковых культур N,N-дифе-нилмочевиной (ДФМ) изменяла соотношение скорости циклического и нециклического фотофосфорилирования в препаратах тилакоидных мембран, выделенных из флагового листа, и вызывала деструктивные изменения в хлоропластах. В запасном белке зерна было обнаружено варьирование процентного соотношения ряда аминокислот, в частности увеличение содержания пролина. Изменения хлоропластов в клетках мезофилла при обработке ДФМ свидетельствуют, что воздействие этого природного соединения в начале фазы молочной спелости ускоряет процесс старения растений, тогда как применение препарата в начале фазы цветения, как мы предполагаем, приводит к обратному эффекту. Полученные результаты подтверждают факт регуляции энергетического и аминокислотного обмена N,N-дифенилмочевиной, обладающей цитокининовым эффектом, направленность действия которой зависит от фазы онтогенеза злаков.


