Фотосенсибилизатор диметиловый эфир хлорина Е6 для фотодинамической терапии саркомы М-1 крыс
Автор: Абрамова О.Б., Каплан М.А., Южаков В.В., Дрожжина В.В., Чурикова Т.П., Козловцева Е.А., Бандурко Л.Н., Яковлева Н.Д., Севанькаева Л.Е., Цыганова М.Г., Иванов С.А., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 2 т.31, 2022 года.
Бесплатный доступ
Фотодинамическая терапия (ФДТ) является локальной формой лечения солидных злокачественных новообразований. В данной работе изучали эффективность ФДТ положительной по мутантному гену р53 саркомы М-1 с использованием фотосенсибилизатора (ФС) диметилового эфира хлорина е6 (ДМЭ Хе6). Исследовали кинетику распределения ФС в опухолях и окружающих тканях бедра для определения оптимального времени проведения лазерного облучения. При оценке ответа опухолевых узлов на ФДТ использовали следующие показатели: индекс торможения роста опухолей (%), их полная регрессия (%), коэффициент абсолютного прироста (К) у крыс с ростом опухолей и увеличение продолжительности жизни особей в опытных группах в сравнении с контролем, которым служили крысы-опухоленосители без воздействия, критерий излечения - отсутствие признаков рецидивирования опухоли в течение 90 сут после терапии. Эффективность ФДТ по девитализации опухолевых клеток определяли путём исследования зон воздействия лазерным излучением на 21 сут после лечения с помощью гистологического анализа. Полученные результаты показали, что ДМЭ Хе6 обладает высокой противоопухолевой активностью для терапии саркомы М-1. Проведение лечения в оптимальные сроки после введения ФС с определёнными параметрами лазерного воздействия позволяет достичь максимального ингибирующего эффекта на злокачественные новообразования после ФДТ. При патоморфологическом исследовании в зонах фотодинамического воздействия выживших опухолевых клеток с экспрессией мутантного белка р53 не обнаружено.
Саркома, фотосенсибилизатор, динамика накопления, индекс контрастности, фотодинамическая терапия, патоморфология, девитализация опухолевых клеток, иммуногистохимия, мутантный белок р53, диметиловый эфир хлорина е6
Короткий адрес: https://sciup.org/170195062
IDR: 170195062 | УДК: 616-006.6:615.831]-092.9 | DOI: 10.21870/0131-3878-2022-31-2-151-161
Текст научной статьи Фотосенсибилизатор диметиловый эфир хлорина Е6 для фотодинамической терапии саркомы М-1 крыс
Одним из эффективных методов лечения злокачественных новообразований является фотодинамическая терапия (ФДТ), в основе которой лежит усиление цитотоксичности веществ, известных как фотосенсибилизаторы (ФС), под действием излучения оптического диапазона, подходящего для активации данного препарата и в присутствии кислорода тканей, что приводит к развитию фотохимической реакции, продукты которой разрушают клетки опухоли и вызывают выделение медиаторов, провоцирующих местную воспалительную реакцию. В результате фототерапии происходит окклюзия сосудов опухоли и индуцированная цитотоксическая активность клеток воспаления в отношении опухолевых клеток [1-6]. Деструкция сосудов ткани новообразования под воздействием ФДТ приводит к нарушению кровоснабжения и некрозу опухоли с постепенной последующей резорбцией и замещением её соединительной тканью [7]. Считается, что одну из ключевых ролей в механизме программируемой гибели клеток играет нормальный – «дикий» (wild type) ген-онкосупрессор p53 и кодируемый им транскрипционный фактор, регулирующий клеточный цикл, – белок р53. Он контролирует состояние ДНК в сверочных точках клеточного цикла. Согласно исследованиям в клинике, мутантный (mt) р53 в злокачественных опухолях
Абрамова О.Б.* – зав. лаб., к.м.н.; Каплан М.А. – зав. отделом, д.м.н., проф.; Южаков В.В. – зав. лаб., к.м.н.; Дрожжина В.В . – н.с.; Чурикова Т.П . – м.н.с.; Козловцева Е.А. – м.н.с.; Бандурко Л.Н. – в.н.с., к.м.н.; Яковлева Н.Д. – в.н.с., к.б.н.; Севанькаева Л.Е. – с.н.с.; Цыганова М.Г. – н.с.; Иванов С.А. – директор, д.м.н., проф. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Каприн А.Д. – ген. директор, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
встречается более чем у 50% онкобольных. Полагают, что статус р53 может быть важным для выбора стратегии лечения онкологических больных [8].
Поиск новых фотоактивных препаратов является одной из приоритетных задач для повышения эффективности ФДТ [9, 10]. К числу перспективных ФС относятся хлорины. Разработка метода ФДТ с высокой степенью поражения сосудистой системы патологически изменённых тканей связана с поиском ФС с повышенным сродством к эндотелию сосудов. C этой целью в данной работе при проведении сеанса ФДТ использовали 13(1)-15(2) диметиловый эфир хлорина е6 (ДМЭ Хе6). ДМЭ Хе6 – это ФС с определённым направленным действием, для которого характерны высокие скорости накопления в компонентах кровеносной системы и который демонстрирует максимальную, среди производных хлорина е6, эффективность фотоиндуцированного повреждения клеток крови и васкулярной системы [11-15].
Цель проведённого исследования – изучение динамики накопления ДМЭ Хе6 в опухоли и эффективности ФДТ с применением данного ФС на параметры регрессии и морфологические характеристики соединительнотканной перевиваемой опухоли крыс саркомы М-1 с верифицированным мутантным онкопротеином р53.
Материал и методы
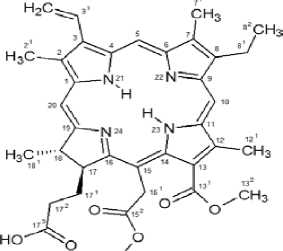
Фотосенсибилизатор: 131-152 диметиловый эфир хлорина е6 (производство Республика Беларусь) – формула на рис. 1.
H3Cis'
Рис. 1. Структурная формула 131, 152 диметилового эфира хлорина е6.
Работа выполнена с соблюдением этических норм по проведению медико-биологических исследований на 67 беспородных крысах. В качестве экспериментальной модели использовали саркому М-1, которую перевивали под кожу в область бедра в виде кусочков опухоли донора. На 7-9-й день, при достижении опухолевыми узлами диаметра 0,8-1,0 см, животных разделили на 5 групп – четыре опытные и одну контрольную.
Определение динамики накопления ФС в тканях in vivo и индекса контрастности необходимы для установления оптимального времени между введением препарата и облучением лазером [16, 17]. Локализацию и накопление ФС в опухоли и окружающих тканях изучали методом лазерной спектрометрии с помощью установки ЛЭСА-01-Биоспек, Россия. Характеристики процессов накопления ФС в опухолевой и окружающих тканях бедра определяли на основании измерений интенсивности флуоресценции (усл. ед.) и селективности накопления ФС – по расчёту индекса контрастности (опухоль/окружающая ткань). Для изучения динамики накопления ФС вводили внутрибрюшинно в дозе 5,0 мг/кг. Первое измерение проводили до введения препарата (0 ч), а затем через: 0,5; 1,0; 1,5; 2,0; 2,5; 3,0; 3,5; 4,0; 4,5 и 24 ч. Полупроводниковый лазерный аппарат «Аткус-2» (ЗАО «Полупроводниковые приборы», Санкт-Петербург) с длиной волны излучения 662±1 нм служил источником лазерного излучения. Животные во время облучения находились под общим тиопенталовым наркозом (0,2 мл 2,5% раствора на 100 г массы животного). Облучение проводили с плотностью энергии лазерного излучения (Е) – 150 Дж/см2, плотностью мощности (Ps) – 0,25 Вт/см2, диаметр светового пятна составлял 1,5 см. ФС в разных дозах вводили особям опытных групп интраперитонеально. Крысы-опухоленосители контрольной группы не подвергались каким-либо воздействиям.
Объёмы опухолевых узлов измеряли до проведения терапии (V 0 ) и на 3, 7, 10, 14 и 21 сут (V t ) после ФДТ. Оценку противоопухолевой эффективности проводили, используя следующие показатели [17]: коэффициент абсолютного прироста опухоли (К); торможение роста новообразования (ТРО, %); процент животных в группе с полной регрессией (ПР, %) неоплазии (К=-1); критерий из-леченности животных – отсутствие признаков рецидивирования опухоли в течение 90 сут после терапии; средняя продолжительность жизни (СПЖ, сут); увеличение продолжительности жизни (УПЖ, %) относительно контрольных особей (значимое – УПЖ ≥50%).
Для гистологических исследований животных выводили из опыта в контрольной группе на 29 сут после перевивки; в опытных группах на тот же срок перевивки и через 21 сут после ФДТ (три опытных группы: 1, 2 и 3) с полной регрессией опухоли. Исследуемые ткани опухолевых узлов фиксировали в кислой жидкости Буэна. После стандартной гистологической проводки ориентированные фрагменты опухолей и тканей в зоне лазерного воздействия заключали в парафиновую среду «Гистомикс». Для морфологических исследований срезы толщиной 5 мкм, полученные на микротоме Leica RM2235, после депарафинирования окрашивали гематоксилином и эозином (БиоВитрум). Методы исследования включали иммуноокрашивание на белок р53. Иммуногистохимические исследования проводили с использованием поликлональных кроличьих антител к р53 (FL393, «Santa Cruz», 1:50) [8] и набора для выявления кроличьих первичных антител (EnVision+System-HRP, «Dako»). Субстратную пероксидазу проявляли диаминобензидином (Liquid DAB+, «Dako»). Гистологические срезы изучали под микроскопом Leica DM 1000 с микрофотосъёмкой на цифровую камеру Leica ICC50 HD. Сканированные изображения препаратов получали на цифровом сканере «Nikon Super Coolscan 8000 ED».
Статистическую обработку полученных результатов для независимых групп выполняли с использованием программ Statistica 6.0. Параметры описательной статистики представлены в виде среднего арифметического значения и стандартной ошибки среднего (M±m). Для оценки значимости межгрупповых различий полученных показателей использовали U-критерий Манна-Уитни с уровнем значимости p<0,05.
Результаты и обсуждение
I. Изучение кинетики накопления ФС в опухоли и окружающих тканях
ДМЭ Хе6 имеют характерные для соединений хлоринового ряда спектры флуоресценции с максимумом в области 660 нм (рис. 2).
Оценка биораспределения ДМЭ Хе6 показала, что максимальная концентрация препарата в опухоли определялась через 2,5-3,0 ч после введения, но самый высокий индекс контрастности отмечался через 2 ч, когда уровень накопления ФС в опухоли был в 1,4 раза выше, чем в окружающей ткани (рис. 3).
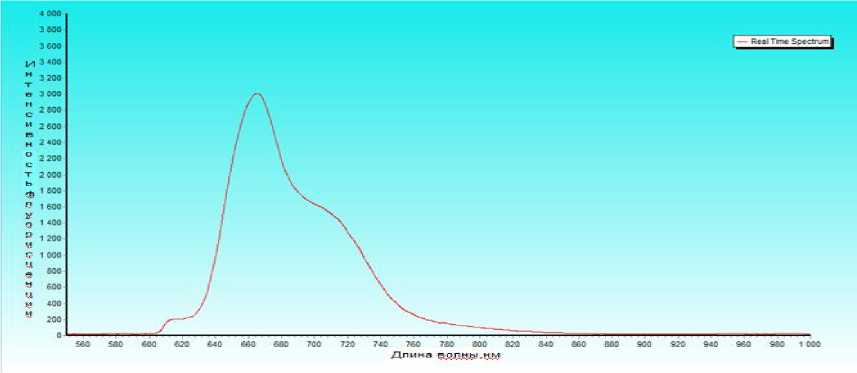
Рис. 2. Спектр флуоресценции диметилового эфира хлорина е6.
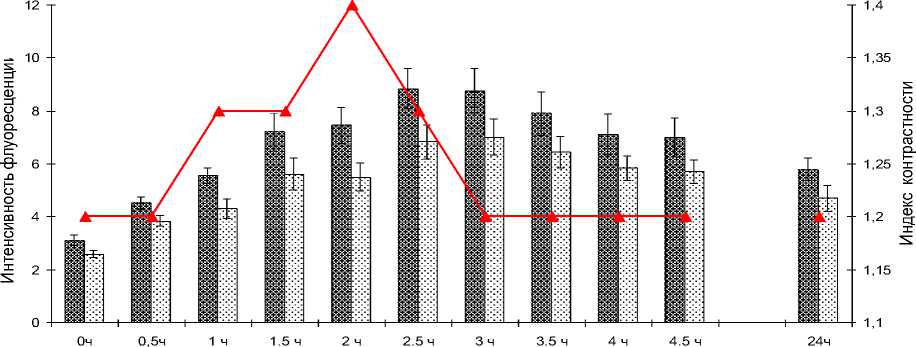

Рис. 3. Динамика накопления ДМЭ Хе6 в опухоли и окружающей ткани бедра крыс после интраперитонеального введения в дозе 5,0 мг/кг.
По оси абсцисс – срок после введения ФС; по оси ординат: слева интенсивность флуоресценции, справа – индекс контрастности (красные линии на графиках).
На основании полученных данных было определено оптимальное время проведения лазерного облучения – 2 ч после введения ФС. Это обеспечивало щадящий режим для здоровых тканей.
II. Изучение противоопухолевой эффективности ФДТ
В ходе экспериментальных исследований на 14 сут после сеанса терапии у 20% крыс с дозой ФС 0,75 мг/кг (группа 1) возобновился рост опухоли, причём коэффициент абсолютного прироста был значительно выше по сравнению с контролем.
Также на 21 сут после лечения у одного животного с дозой 1,25 мг/кг (группа 2) наблюдался рецидив опухоли. У остальных животных полная регрессия опухоли отмечалась до 21 сут исследования. При увеличении дозы ФС усиливался ингибирующий эффект, и с дозами ДМЭ Хе6 2,5 и 5,0 мг/кг (группы 3 и 4) полная регрессия опухоли наблюдалась у 100% животных до 21 сут после терапии (табл. 1). У крыс контрольной группы наблюдался прогрессирующий рост опухолей.
Таблица 1
Показатели противоопухолевой эффективности ФДТ саркомы М-1 крыс с интраперитонеальным введением фотосенсибилизатора ДМЭ Хе6 в разных дозах при параметрах воздействия лазерным излучением Е=150 Дж/см 2 ; Ps=0,25 Вт/см 2
|
№ гр. |
Доза ФС, мг/кг |
Срок наблюдений, сут |
|||||
|
3 |
7 |
10 |
14 |
21 |
90 |
||
|
1 |
0,75 |
(4) 100 |
|
|
- |
||
|
2 |
1,25 |
(4) 100 |
|
(5) 70,1% |
|||
|
3 4 |
2,5 5,0 |
(4) 100 (4) 100 |
(5) 85,7% (5) 100% |
||||
|
Контроль |
V 1,2 ± 0,2 K 3,0 ± 0,4 |
2,7 ± 0,5 9,1 ± 1,4 |
7,7 ± 1,4 20,1 ± 2,8 |
10,2 ± 2,1 42,1 ± 7,4 |
17,1 ± 4,2 83,8 ± 24,9 |
- |
|
Примечание: (1) - объём опухоли (V, см 3 ); (2) - коэффициент прироста опухоли у животных с продолженным ростом (К); (3) - торможение роста опухоли (ТРО,%); (4) - процент животных с полной регрессией опухоли (ПР); (5) - процент излеченных животных; * р<0,05 по сравнению с контролем.
На 21 сут после ФДТ часть животных из 1-3 групп выводилась из опыта для проведения патоморфологических исследований, а другая часть и особи 4-й группы были оставлены для дальнейшего наблюдения: определение СПЖ и УПЖ, регистрация возможных рецидивов опухоли и определение процента излеченных животных на 90 сут после терапии (табл. 1,2).
Таблица 2
Средняя продолжительность жизни (СПЖ) и увеличение продолжительности жизни (УПЖ) после ФДТ саркомы М-1 крыс в сравнении с контролем
|
№ группы |
Доза ФС, мг/кг |
СПЖ, сут |
УПЖ, % |
|
1 |
0,75 |
- |
- |
|
2 |
1,25 |
62,3 ± 3,7 |
67,9 * |
|
3 |
2,5 |
65,4 ± 4,1 |
76,3* |
|
4 |
5,0 |
> 90 |
> 100* |
|
Контроль |
Без воздействия |
37,1 ± 2,2 |
— |
Примечание: * - статистически значимое увеличение продолжительности жизни по сравнению с контролем (УПЖ >50%).
Таким образом, результаты показали, что проведение ФДТ саркомы М-1 с ФС в дозе 5,0 мг/кг после облучения (Е=150 Дж/см2, Ps=0,25 Вт/см2 - группа 4) приводит к полному излечению животных. Противоопухолевый эффект сохраняется в течение 3-х месяцев после терапии (табл. 1, 2).
III. Изучение патоморфологической оценки эффективности ФДТ
Контрольная группа. У двух особей наблюдался мультифокальный рост опухолей (рис. 4а). У всех опухоленосителей саркома прорастала до бедренной кости. Подвздошные лимфатические узлы были значительно увеличены. Гистологический рисунок саркомы М-1 на 29 сут роста показан на рис. 4б. Жизнеспособная паренхима располагалась, в основном, в виде солид- ных тяжей неравномерной ширины по периферии опухолевых узлов. Зоны солидного строения представлены полиморфными опухолевыми клетками с крупными ядрами и базофильной цитоплазмой (рис. 4в). При иммуноокрашивании в ядрах опухолевых клеток определялся мутантный белок р53 (рис. 4г). В поле зрения были видны фигуры митоза и немногочисленные клетки, погибающие путём апоптоза. В перитуморальной области венозные сосуды были паретически расширены (рис. 4д). От венул в паренхиму саркомы врастали капиллярные петли. У одной особи регионарный лимфоузел практически полностью замещён крупным метастазом (рис. 4е).
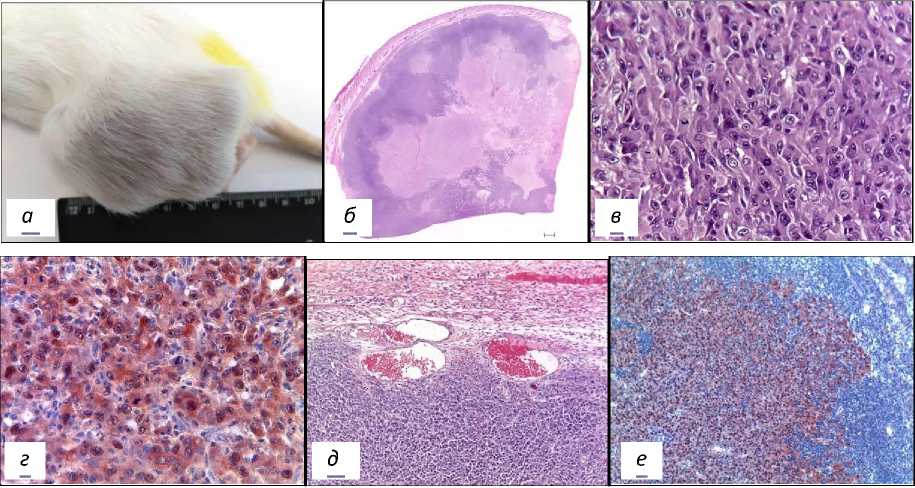
Рис. 4. Морфология саркомы М-1 в контроле на 29 сутки после имплантации.
а – макрофото саркомы М-1; б – гистологический рисунок саркомы М-1, скан; в – зона солидного строения саркомы, Об. х 40; г - иммуногистохимическое окрашивание ядер опухолевых клеток с антителами к р53;
д - перитуморальная зона саркомы М-1, Об. х 10; е - иммуноокрашивание метастаза в лимфатическом узле у крысы контрольной группы на онкопротеин р53, Об. х 10.
1-я опытная группа. Доза ФС 0,75 мг/кг, Е=150 Дж/см2, Ps=0,25 Вт/см2. На 21 сут после ФДТ в зоне облучения на повреждённой поверхности кожи видны язвы (рис. 5а). Подвздошные лимфатические узлы увеличены. При микроскопическом исследовании в зоне ФДТ отмечались очаги деструкции тканей кратерообразной формы глубиной до 4 мм, окружённые лейкоцитарным валом (рис. 5б). Краевая эпителизация тканевых дефектов была выражена слабо. В зонах фотодинамического воздействия погибшие ткани замещались соединительной тканью, инфильтрированной клетками воспалительного инфильтрата (рис. 5в). По данным иммуноокрашивания на мутантный белок р53 опухолевые клетки не обнаружены (рис. 5г). Подвздошные лимфатические узлы увеличены. Однако метастазы саркомы М-1 в лимфатических узлах у особей этой группы не выявлены.
2-я опытная группа. Доза ФС 1,25 мг/кг, Е=150 Дж/см2, Ps=0,25 Вт/см2. На 21 сут после ФДТ в зоне воздействия лазерным излучением отмечались более значительные, чем в первой опытной группе, повреждения кожи (рис. 6а). При микроскопическом исследовании тканей бедра у особей этой группы опухолевые клетки не обнаружены. В зоне фотодинамического воздействия наблюдалось отграничение некротизированных тканей воспалительным инфильтратом. У неко- торых мышей эпителизация зон повреждения выражена слабо (рис. 6б, в). Участки деструкции замещались разрастающейся соединительной тканью и регенерирующими мышечными волокнами (рис. 6г). Метастазы саркомы М-1 в лимфатических узлах не выявлены.
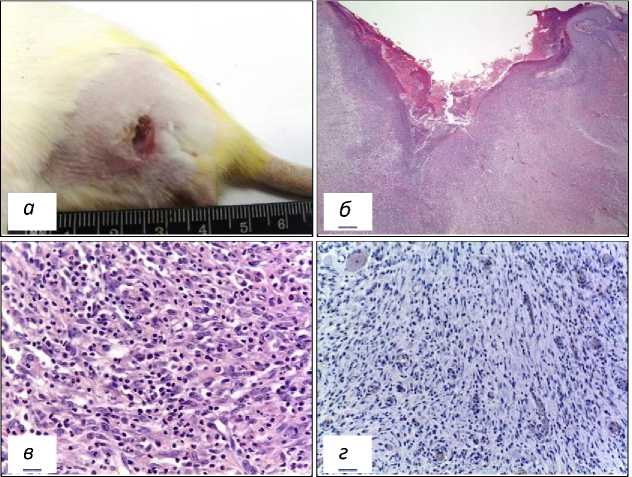
Рис. 5. Морфология зоны воздействия лазерным излучением на саркому М-1 у крысы 1-й опытной группы на 21 сутки после ФДТ.
а - макрофото саркомы М-1 на 24 сутки после ФДТ; б - очаг деструкции тканей бедра, Об. х 2,5;
в - замещение зон фотодеструкции соединительной тканью, Об. х 40; г - отсутствие положительной реакции ядер опухолевых клеток при иммуноокрашивании на онкопротеин р53 на 24 сутки после ФДТ у особи 1-й опытной группы, Об. х 20.
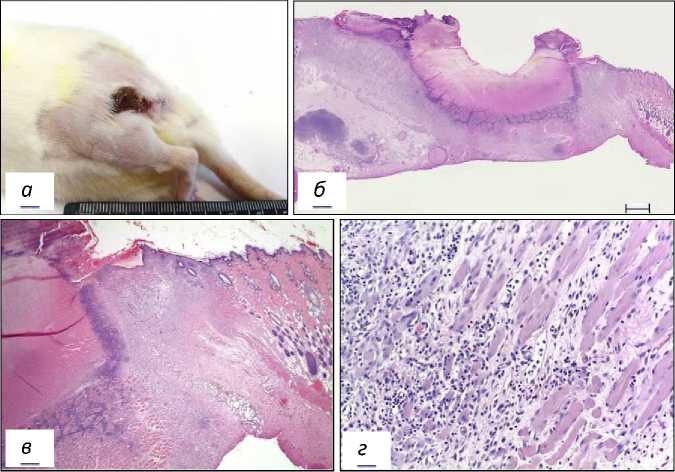
Рис. 6. Морфология зоны воздействия лазерным излучением на саркому М-1 у крысы 2-й опытной группы на 21 сутки после ФДТ.
а – макрофото саркомы М-1 на 24 сутки после ФДТ; б – зона фотодинамического повреждения тканей бедра, скан; в - фрагмент рисунка б, Об. х 2,5; г - замещение зоны фотодинамического повреждения соединительной тканью у крысы 2-й опытной группы, Об. х 20.
3-я опытная группа. Доза ФС 2,5 мг/кг, Е=150 Дж/см2, Ps – 0,25 Вт/см2. При выведении крыс из опыта на 21 сут после фотодинамического воздействия на коже выявлялись глубокие язвы, частично покрытые струпами (рис. 7а). Края язв были приподняты, уплотнены. Регионарные лимфатические узлы увеличены. У всех крыс этой группы в зоне лазерного воздействия отмечались деструкция и некроз тканей до бедренной кости (рис. 7б, в, г). При микроскопическом исследовании тканей опухолевые клетки не обнаружены. Метастазы саркомы М-1 в подвздошных лимфатических узлах не выявлены.
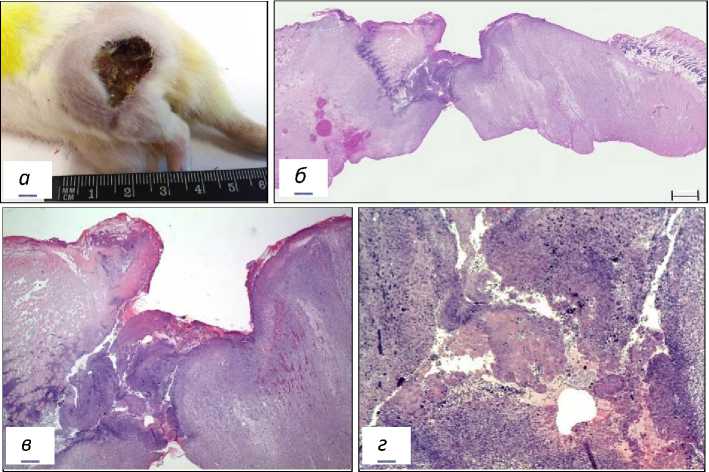
Рис. 7. Морфология зоны воздействия лазерным излучением на саркому М-1 у крысы 3-й опытной группы на 21 сутки после ФДТ.
а – макрофото саркомы М-1; б – деструкция и некроз тканей в зоне ФДТ, скан;
в - фрагмент рисунка б, Об. х2,5; г - фрагмент рисунка в, Об. х10.
Заключение
Результаты проведённых комплексных исследований показали, что фотосенсибилизатор ДМЭ Хе6 обладает высокой противоопухолевой активностью in vivo при проведении ФДТ положительной по мутантному гену р53 саркомы М-1 у крыс. Исследования биораспределения ДМЭ Хе6 показали, что ФС быстро и с высокой избирательностью накапливается в опухолевых тканях. По данным иммуногистохимического анализа на 21 сут после ФДТ с ФС в дозах 0,75; 1,25 и 2,5 мг/кг в зонах воздействия лазерным излучением (Е=150 Дж/см2, Ps=0,25 Вт/см2), выживших опухолевых клеток с экспрессией мутантного белка р53 не обнаружено. Проведение сеанса ФДТ с ФС в дозе 5,0 мг/кг с теми же параметрами фотодинамического воздействия (E=150 Дж/см2, Ps=0,25 Вт/см2) позволяет достичь 100% полной регрессии опухолевых узлов и отсутствия их рецидивирования на протяжении трёх месяцев наблюдений.
Список литературы Фотосенсибилизатор диметиловый эфир хлорина Е6 для фотодинамической терапии саркомы М-1 крыс
- Абрамова О.Б., Южаков В.В., Каплан М.А., Дрожжина В.В., Береговская Е.А., Чурикова Т.П., Севанькаева Л.Е., Фомина Н.А., Цыганова М.Г., Иванов С.А., Каприн А.Д. Фотодинамическая терапия саркомы М-1 крыс с фотосенсибилизатором Фоторан еб //Бюллетень экспериментальной биологии и медицины. 2020. T. 170, № 10. С. 492-498.
- Каплан М.А., Капинус В.Н., Попучиев В.В., Романко Ю.С., Ярославцева-Исаева Е.В., Спиченкова И.С., Шубина А.М., Боргуль О.В., Горанская Е.В. Фотодинамическая терапия: результаты и перспективы //Радиация и риск. 2013. Т. 22, № 3. С. 115-123.
- Церковский Д.А., Протопович Е.Л., Козловский Д.И., Суслова В.А. Противоопухолевая эффективность контактной лучевой терапии в комбинации с фотосенсибилизатором хлоринового ряда в эксперименте //Biomedical Photonics. 2021, V. 10. N 2. P. 25-33.
- Филоненко Е.В. Клиническое внедрение и научное развитие фотодинамической терапии в России в 2010-2020 гг. //Biomedical Photonics. 2021. V. 10. N 4, P. 4-22.
- Абакушина Е.В., Романко Ю.С., Каплан М.А., Каприн А.Д. Противоопухолевый иммунный ответ и фотодинамическая терапия //Радиация и риск. 2014. Т. 23, № 4. С. 92-98.
- Меерович И.Г., Казачкина Н.И., Савицкий А.П. Изучение проявлений фотоиммунного отклика при фотодинамической терапии //Российский биотерапевтический журнал. 2014. Т.13, № 1. С. 110.
- Южаков В.В., Романко Ю.С., Каплан М.А., Галкин В.Н., Мажуга А.Г., Грин М.А., Бурмистрова Н.В., Фомина Н.К., Бандурко Л.Н., Севанькаева Л.Е., Яковлева Н.Д., Ингель И.Э., Мозеров С.А., Старовойтова А.В. Действие фотодинамической терапии с производным бактериохлорофилла A на рост и функциональную морфологию саркомы М-1 крыс //Альманах клинической медицины. 2017. Т. 45, № 4. С. 333-347. DOI: 10.18786/2072-0505-2017-45-4-333-347.
- Zhu J., Sammons M.A., Donahue G., Dou Z., Vedadi M., Getlik M., Barsyte-Lovejoy D., Al-awar R., Katona B.W., Shilatifard A., Huang J., Hua X., Arrowsmith CH., Berger S.L. Gain-of-function p53 mutants co-opt chromatin pathways to drive cancer growth //Nature. 2015. V. 525, P. 206-211.
- Zhang J., Jiang C., Figueiró Longo J.P., Ricardo B.A., Zhang H., Muehlmann L.A. An updated overview on the development of new photosensitizers for anticancer photodynamic therapy //Acta Pharm. Sin. B. 2018. V. 8, N 2. P. 137-146.
- Абрамова О.Б., Дрожжина В.В., Береговская Е.А., Чурикова Т.П., Каплан М.А. Изучение динамики накопления фотосенсибилизатора - липосомального борированного хлорина Еб - в экспериментальных опухолях различных морфологических типов //Радиационная биология. Радиоэкология. 2021. Т. б1. № 5. С. 4б0-470.
- Зорин В.П., Хлудеев И.И., Зорина Т.Е. Распределение порфириновых сенсибилизаторов между белковыми и клеточными элементами крови //Биофизика. 2000. Т. 45, вып. 2. С. 313-319.
- Зорина Т.Е, Янковский И.В., Кравченко И.Е., Шман Т.В., Белевцев М.В., Зорин В.П. Оценка фото-и цитотоксичности этерифицированных производных хлорина еб и их липосомальных форм //Биофизика. 2015. Т. б0, вып. 5. C. 922-930.
- Каплан М.А., Зорин В.П., Малыгина А.И., Каширцева И.В., Архипова Л.М. Оценка противоопухолевой эффективности применения диметилового эфира хлорина еб при фотодинамической терапии //Фотодинамическая терапия и фотодиагностика. 2014. № 2. С. 8-11.
- Федорук С.Л., Трухачева Т.В., Истомин Ю.П., Церковский Д.А., Протопович Е.Л., Фроленков К.А, Соколов С.Н., Хейдоров В.П. Изучение противоопухолевой активности лекарственных форм на основе ДМЭ Хеб и хлорина еб //Вестник фармации. 2017. № 1 (75). С. 72-77.
- Мачинская Е.А., Иванова-Радкевич В.И. Обзор механизмов селективного накопления фотосенсибилизаторов различной химической структуры в опухолевой ткани //Фотодинамическая терапия и фотодиагностика. 2013. № 4. С. 28-32.
- Лощенов В.Б., Линьков К.Г., Савельева Т.А., Лощенов М.В., Модель С.С., Бородкин А.В. Аппаратурное и инструментальное обеспечение флюоресцентной диагностики и фотодинамической терапии //Фотодинамическая терапия и фотодиагностика. 2013. № 3. С. 17-25.
- Абрамова О.Б., Дрожжина В.В., Чурикова Т.П., Козловцева Е.А., Архипова Л.М., Каплан М.А., Иванов С.А., Каприн А.Д. Фотодинамическая терапия экспериментальных опухолей различных морфологических типов с липосомальным борированным хлорином еб //Biomedical Photonics. 2021. Т. 10. № 3. С. 12-22.


