Фотосинтетические пигменты и СО2-газообмен водных макрофитов в подзоне средней тайги
Автор: Дымова О.В., Далькэ И.В.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Биологические науки
Статья в выпуске: 1 (25), 2016 года.
Бесплатный доступ
Обобщены данные по пигментному комплексу и впервые дана характеристика параметров СО2-газообмена представителей гидрофильной флоры водоёмов в окрестностях г.Сыктывкар. По сравнению с погруженными в воду макрофитами, листья прибрежно-водных растений накапливали больше каротиноидов, характеризовались более высокой скоростью СО2-газообмена и устойчивостью к высокой инсоляции. Содержание хлорофиллов, квантовый выход видимого фотосинтеза, дыхательные затраты в процессе ассимиляции СО2 и накопление сухой массы листьев макрофитов разных экологических групп практически сходны. Перспективно использование видов гидрофильной флоры для оценки баланса углерода и общей продуктивности водных ценозов.
Макрофиты, хлорофилл, каротиноиды, со2-газообмен, бореальная зона
Короткий адрес: https://sciup.org/14992806
IDR: 14992806 | УДК: 581.526.3-117.511:581.121:581.132(1-924.82)
Текст научной статьи Фотосинтетические пигменты и СО2-газообмен водных макрофитов в подзоне средней тайги
Высшие водные и прибрежно-водные растения, по мнению ведущих гидроботаников мира [1– 3], играют важную роль в формировании наиболее продуктивных растительных сообществ умеренных широт и являются участниками биологических процессов в водных экосистемах. Под флорой водоёмов (водотоков) понимается совокупность видов водных и береговых растений, закономерно встречающихся в водоёме (водотоке) [4]. В связи с большой площадью водных объектов Северо-Востока европейской части России растительность многих водоемов изучена недостаточно полно. К настоящему времени исследован видовой состав макрофитов водоемов Республики Коми.
Водно-болотные экосистемы Севера являются чувствительными к небольшим сдвигам регулирующих абиотических факторов среды. По данным [5], в пределах одной прибрежной зоны различия по нетто-экосистемному балансу углерода в разные годы могут достигать 4–6 моль СО2/м2. В бореальной зоне литораль (береговая линия) малых водоёмов (озёр) является источником аллохтонного и автохтонного углерода. Поступление органического вещества из прибрежной зоны способствует повышению эвтрофикации водоёмов и их биологической продуктивности. Количественная оценка составляющих баланса углерода на основе изучения CO2-газообмена в естественных условиях у некоторых типичных представителей арктической флоры приведена в работе [6]. Моделированием продуктивно- сти водных растений активно занимаются за рубежом [7, 8].
В водных и прибрежно-водных зонах в качестве предикторов ассимиляционной способности могут выступать факторы среды (освещенность, температура, количество биогенных элементов, др.), структура ценоза (число побегов, пространственное распределение листовой поверхности), биологические характеристики видов. Согласно данным [5], в середине летнего периода при световом насыщении (более 500 мкмоль/м2с ФАР) скорость гросс-фотосинтеза в моновидовых зарослях тростника ( Phragmites australis ), кубышки желтой ( Nuphar lutea ) достигает 3 мкмоль СО 2 /с в расчете на 1 кв м фитоценоза. В затапливаемой прибрежной зоне на лугах (доминанты: злаки, осоки – Cala-magrostis canescens , Carex aquatilis , Potentilla palus-tris ), болотах (доминанты: Alisma plantago-aquatica , Calla palustris , Carex aquatilis , C. rostrata , Cicuta vi-rosa , Lysimachia thyrsiflora , Potentilla palustris , Warn-storfia exannulata ) гросс-фотосинтез варьировал от 15 до 25 мкмоль СО 2 /м2 ценоза с-1. Доля суммарного экосистемного дыхания в зависимости от видового состава и водного режима ценоза составляла от 10 до 80 % от величины гросс-фотосинтеза.
Функциональный подход в изучении макрофитов позволяет определить адаптационный потенциал растений и их индикационные свойства, оценить пригодность использования физиолого-биохимических признаков для классификации жизненных форм и экологических групп [9]. Пигменты играют центральную роль в фотофизических и фотохимических реакциях фотосинтеза, обеспечивая поглощение, запасание и превращение световой энергии. Параметры пигментного комплекса и СО 2 -газообмена служат важными биоиндикаторами изменяющихся условий и могут быть использованы для диагностики функционального состояния растений. Структурно-функциональные особенности фотосинтетического аппарата (ФСА) макрофитов обусловлены разной степенью контакта листьев с водной средой и развитием экологической гетерофилии [10]. Большинство работ проведено на гидрофитах, выросших в условиях вегетационных опытов с контролируемым уровнем основных факторов, что не позволяет выявить приспособления ассимиляционной деятельности растений ко всему комплексу условий в естественных местообитаниях. Знание эколого-функциональных особенностей ФСА водных макрофитов позволит выявить адаптационные возможности растительных сообществ малых водоёмов.
В литературе сведения о пигментном составе большого числа прибрежно-водных и водных растений немногочисленны [11–13], а детальные исследования пигментного комплекса выполнены на ограниченном числе наиболее распространенных видов гидрофитов [14]. Величины по нетто-фо-тосинтезу листьев гидрофитов приведены, в основном, в работах зарубежных авторов [5, 15, 16]. Специальных работ по изучению СО2-газообмена и состоянию пигментного комплекса листьев прибрежно-водных и водных растений подзоны сред- ней тайги европейского Северо-Востока практически не проводилось. Это определяет актуальность и значимость данных исследований.
Цель настоящей работы – изучить пигментный комплекс и СО 2 -газообмен представителей гидрофильной флоры водоёмов окрестностей г.Сыктыв-кара и дать характеристику структурно-функциональных показателей ассимиляционного аппарата макрофитов бореальной зоны.
Материал и методы
Сбор материала проводили в 2010-2014 гг. в водоёмах окрестностей г. Сыктывкара (61067’ с.ш., 50077’ в.д.) в бассейне р. Сысола. В летние периоды (июнь, июль) были обследованы пять водоемов (1 – водоем на территории Ботанического сада Сыктывкарского государственного университета (СыктГУ), 2 - в местечке Дырнос, 3 – в районе Орбита, 4 - озеро Выльты (пос. Краснозатонский), 5 – озеро Еляты (с. Выльгорт). Водоёмы имеют удлиненную форму, в них преобладают илистые или илисто-песчаные донные субстраты. Глубина водоёмов варьирует в диапазоне 0.5–6.0 м, прозрачность составляет 0.2–1.0 м. По уровню жёсткости и pH воды водоёмы можно отнести к мягким и нейтрально-щелочным (pH=6.5–7.5). По ионному составу они практически однотипны, относятся к гид-рокарбонатно-кальциевым. Показатели ионов растворенных в воде веществ не превышали предельно допустимых концентраций (ПДК) (по СанПиН 2.1.4.1074-01).
Исследованиями были охвачены растения, входящие в обводненную зону, зону уреза воды (береговая линия) и переувлажненных берегов. Согласно экологической классификации [17], изученные виды разделили на группы экотипов: 1) водные растения с листьями, погруженными в толщу воды или плавающими на её поверхности; 2) прибрежно-водные и заходящие в воду береговые растения, чьи листья могут функционировать в воздушной и водной среде. По отношению к фактору увлажнения в водоемах преобладают гигрофиты (свыше 50%) и гелофиты (около 15%). Для всех видов указаны латинские названия по систематической сводке С.К.Черепанова [18].
Исследования пигментного комплекса листьев были проведены на 44 видах макрофитов из 27 семейств. Образцы листьев для определения содержания пигментов отбирали с 15–20 растений в трех–пятикратной биологической повторности. Для анализа использовали функционально зрелые листья, собранные в период цветения - плодоношения растений. Навеску свежего растительного материала (150–200 мг) фиксировали жидким азотом и хранили при -760С. Содержание пигментов в ацетоновых экстрактах определяли спектрофотометрически на приборе UV-1700 («Shimadzu», Япония) при длинах волн 662 и 644 нм (хлорофиллы а и b ) и 478 нм (каротиноиды) с поправками в максимумах поглощения [19].
В летний период (июль) у листьев 14 видов макрофитов определяли СО2-газообмен при разной интенсивности ФАР (от 0 до 1800 мкмоль/м2с) и температуре листа 20 °С. В этот период средняя температура воздуха составила 19 °С, относительная влажность воздуха – 71 %. В лабораторных условиях измеряли нетто-фотосинтез отделенных листьев макрофитов с помощью ИК-газоанализа-тора Li-7000 (Li-cor Inc., США), подключенного по дифференциальной схеме. Камеру с листом освещали лампой LRF 400W (Polamp, Польша), температуру в камере поддерживали с помощью термостата LT-300 (Loip, Россия). Для измерений использовали листья, плавающие на поверхности воды (у водных гидрофитов) и находящиеся в воздушной среде (у гелофитов и гигрофитов). Во время экспозиции листья были хорошо увлажнены.
Содержание азота и углерода определяли в высушенном размолотом материале с помощью элементного СHNS-O анализатора (ЕА-1110, Италия) по сертифицированной методике в аккредитованной экоаналитической лаборатории в трех биологических и двух аналитических повторностях.
Данные обрабатывали статистически с использованием однофакторного дисперсионного анализа ANOVA. В таблицах и на рисунках приведены средние величины со стандартной ошибкой. Сравнение выборок проводили с помощью t-теста, статистическую значимость оценивали при уровне значимости α 0.05.
Результаты и обсуждение
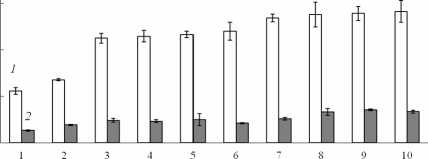
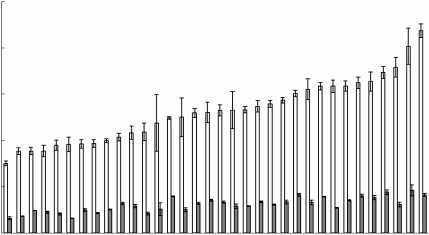
Установлено, что содержание хлорофиллов a + b в листьях 10 видов высших водных и 34 видов прибрежно-водных и заходящих в воду береговых растений варьировало в широких пределах, от 3.4 до 13.2 мг/г сухой массы (рис. 1). Содержание каротиноидов было в четыре–шесть раз ниже, чем хлорофиллов. Среди водных видов растений наибольшим содержанием хлорофиллов (в расчете на сухую массу листьев) характеризовались Utricularia vulgaris , Potamogeton perfoliatus , Numphar lutea (в среднем 8.4 мг/г), среди прибрежно-водных и заходящих в воду береговых растений – Galium palustre, Alisma plantago-aquatica , Týpha latifolia , Myosotis palustris (10–13 мг/г). Сравнительно низкое накопление пигментов было отмечено у Lemna minor (3.4 мг/г) и Carex globularis (4.5 мг/г). Выявлена положительная статистически значимая корреляция между содержанием хлорофиллов и каротиноидов в обеих группах (рис. 2).
Несмотря на то, что листья прибрежно-водных и заходящих в воду береговых растений незначительно превышали группу водных гидрофитов по накоплению хлорофиллов a + b и величине их соотношения, достоверных различий по этим показателям для изученных нами групп макрофитов выявлено не было (таблица). Это согласуется с данными, полученными в работе [15], для водных и заходящих в воду наземных растений, произрастающих в озёрах Дании. Характерное для большинства изученных нами водных гидрофитов ( Ceratophyllum demersum, Stratiotes aloides, Lemna minor и L. trisulca, Elodea canadensis, Hydrocharis morsus-ranae ) низкое соотношение хлорофиллов a / b (2.4– 2.8) означает, что значительная часть хлорофиллов
11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 4142 43 44
Номер вида
Рис. 1. Содержание хлорофиллов (светлые столбцы) и каротиноидов (темные столбцы) в листьях макрофитов. Водные растения (А) : 1) Lemna minor (Пл), 2) Nymphaea candida (Пл), 3) Lemna trisulca (Гд), 4) Ceratophyllum demersum (Гд), 5) Hydrocharis mor-sus-ranae (Пл), 6) Stratiotes aloides (Гд) , 7) Elodea canadensis (Гд), 8) Utricularia vulgaris (Гд), 9) Po-tamogeton perfoliatus (Гд), 10) Numphar lutea (Пл). Прибрежноводные и береговые, заходящие в воду растения (Б) : 11) Carex globularis (ГМ), 12) Equise-tum palustre (Гл), 13) Naumburgia thyrsiflora (МГг), 14) Salix triandra (Гг), 15) Comarum palustre (Гг), 16) Polygonum amphilium (Гг), 17) Sparganium emersum (Гл), 18) Juncus filiformis (Гл), 19) Juncus nodulosus (Гл), 20) Carex acuta (Гг), 21) Sagittaria sagittifolia (Гл), 22) Carex vesicaria (Гл), 23) Eleo-charis palustris (Гг), 24) Thalictrum flavum (М), 25) Hippuris vulgaris (Гл), 26) Menyanthes trifoliata (Гг), 27) Carex cinerea (МГг), 28) Bistorta officinalis (Гг), 29) Carex nigra (Гг), 30) Rorippa palustris (МГг), 31) Agrostis stolonifera (М), 32) Ranunculus repens (ГМ), 33) Carex rostrata (Гл), 34) Calla palus-tris (Гл), 35) Epilobium palustre (Гг), 36) Lythrum salicaria (Гг), 37) Equisetum fluviatile (Гл), 38) Stachys palustris (МГг), 39) Sium latifolium (Гл), 40) Scirpus lacustris (Гл), 41) Galium palustre (Гг), 42) Alisma plantago-aquatica (Гл), 43) Typha latifolia (Гг), 44) Myosotys palustris (Гг). Экотипы: Гл – гелофиты, Гг – гигрофиты, Гд – гидатофиты (гигрофиты погруженные), Пл – плейстофиты (гидрофиты) с плавающими листьями, МГг – мезогигрофит, ГМ – гигромезофит, М – мезофит.
принадлежит светособирающему комплексу (ССК) фотосистем. Доля хлорофиллов, локализованных в ССК, превышала 55% от общего фонда хлорофиллов (таблица). Повышенное содержание антенного хлорофилла компенсирует низкий уровень накопления зеленых пигментов [20]. Благодаря высокой
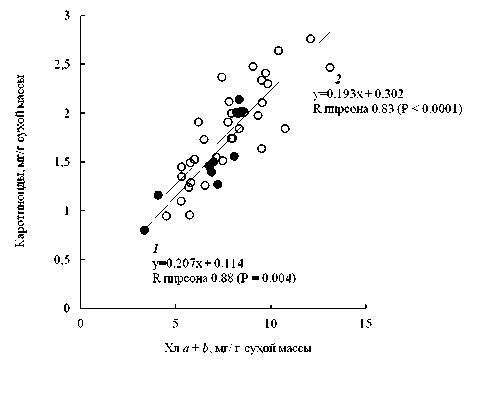
Рис. 2. Связь между содержанием хлорофиллов и каротиноидов в листьях макрофитов: 1 – водные, 2 – прибрежно-водные и заходящие в воду береговые растения.
для исследованных нами двух групп макрофитов не обнаружено. Средняя величина удельной поверхностной плотности листа (УППЛ) составила около 0.5 г сухой массы на 1 кв. дм листовой поверхности. Величина УППЛ отрицательно коррелировала с количеством хлорофиллов. По-видимому, у надводных и плавающих видов гидрофитов [22], как и у наземных растений [23], изменения содержания пигментов в единице массы связаны с различным соотношением фотосинтезирующих и нефотосинтезирующих тканей.
Листья прибрежно-водных видов ( Alisma plan-tago-aquatica , Calla palustris , Carex rostrata , Myoso-tys palustris , надводные листья Sium latifolium ) фотосинтезировали со скоростью до 15 мг СО 2 / г сухой массы ч и выше. В расчёте на площадь листовой поверхности эта величина составила около 3 мкмоль СО 2 /м2с. Водные гидрофиты с погружёнными ( Cera-tophyllum demersum , Elodea сanadensis ) и плавающими ( Hydrocharis morsus-ranae, Numphar lutea) листьями и подводные листья Sium latifolium усту-
Структурно-функциональная характеристика листьев и ассимиляционного аппарата макрофитов разных экологических групп из водоемов бореальной зоны (Республика Коми)
|
Показатели |
Водные растения |
Прибрежно-водные и заходящие в воду береговые растения |
P – величина для t-критерия |
|
Содержание углерода, мг/г сухой массы |
376 ± 47 18 |
430 ± 5 4 |
0.013 |
|
Содержание общего азота, мг/г сухой массы |
25.4 ± 8.4 47 |
30.5 ± 2.4 28 |
0.460 |
|
Удельная поверхностная плотность листьев, г/дм2 |
0.63 ± 0.28 76 |
0.48 ± 0.07 45 |
0.447 |
|
Хлорофиллы а + b , мг / г сухой массы |
6.7 ± 0.6 28 |
7.8 ± 0.3 27 |
0.172 |
|
Каротиноиды, мг / г сухой массы |
1.4 ± 0.1 25 |
1.8 ± 0.1 26 |
0.023 |
|
Соотношение Хл а / b |
3.0 ± 0.3 27 |
3.3 ± 0.1 12 |
0.821 |
|
Доля Хл в ССК, % |
58 ± 3 14 |
52 ± 1 10 |
0.008 |
|
Нетто-фотосинтез, мг СО 2 /г сухой массы ч |
9.0 ± 2.9 73 |
15.0 ± 2.6 50 |
0.148 |
|
Нетто-фотосинтез, мкмоль СО 2 / м2 с |
3.1 ± 0.1 7 |
4.4 ± 0.5 32 |
0.156 |
|
Ассимиляционное число, мг СО 2 /мг Хл ч |
1.2 ± 0.4 80 |
1.7 ± 0.4 59 |
0.370 |
Примечание: в числителе – среднеарифметическое значение ± стандартная ошибка среднего значения, в знаменателе – коэффициент вариации, %. Сравнение выборок проводили с помощью t-теста, статистическую значимость оценивали при уровне значимости α 0.05.
доле хлорофиллов в ССК листья погруженных гидрофитов способны осуществлять ассимиляционную деятельность при дефиците света и недостатке СО 2 , имеющего низкий коэффициент диффузии в воде [21]. Надводные листья прибрежно-водных видов и плавающие листья водных гидрофитов ( Numphar lutea, Nymphaea candida ) способны функционировать в воздушной среде при высокой освещенности.
Листья прибрежно-водных и заходящих в воду береговых растений содержали больше углерода, чем листья водных растений (таблица). По содержанию азота и величине удельной поверхностной плотности листа статистически значимых различий пали группе прибрежно-водных видов по фотосинтетической способности в расчете на сухую массу и площадь листа в 1,5 раза. Темновое дыхание листьев растений в обеих группах не превышало 13 % от максимальных значений видимого поглощения СО2.
У погруженных и плавающих на воде листьев величина светового компенсационного пункта СО 2 -газообмена была ниже, и скорость фотосинтеза достигала насыщения при меньшем освещении (150 – 400 мкмоль/м2с ФАР), чем у надводных листьев. В листьях, находящихся в воздушной среде или на границе воздух–вода, насыщение фотосинтеза светом наступало при ФАР более 500
мкмоль/м2с. У некоторых видов ( Numphar lutea , Sium latifolium , Hydrocharis morsus-ranae ) повышение ФАР до 1800 мкмоль/м2с приводило к снижению скорости видимого фотосинтеза на 20 – 50 % от максимальной скорости поглощения СО 2 . Квантовый выход видимого фотосинтеза у листьев макрофитов разных экологических групп составлял около 0.03. Эффективность использования азота в процессе нетто-фотосинтеза для групп водных и прибрежно-водных растений составила 0.35 и 0.49 мг СО 2 /(мг N ч) соответственно. Межвидовая вариабельность величины скорости фотосинтеза в расчете на содержание хлорофиллов a + b была высокой, значения изменялись на порядок от 0.3 – 0.5 ( Elodea canadensis , Carex rostrata , Numphar lutea ) до 3 – 4 мг СО 2 /(г Хл ч) ( Hydrocharis morsusranae , Naumburgia thyrsiflora , Carex rostrata, надводные листья Sium latifolium ).
По имеющимся в литературе данным [11], размах скорости ассимиляции СО 2 у водных растений меньше на порядок (0.6–4.5 ммоль С/м2ч), чем для наземных (2.0–157.0 ммоль С/м2ч). Водные растения способны ассимилировать с высокой скоростью, если часть их листового аппарата находится в воздушной среде (явление гетерофилии). Так, инвазивные в водоемах Европы растения Ludwigia grandiflora (людвигия крупноцветковая) и Hydro-cotyle ranunculoides (щитолистник лютиковидный) способны поглощать до 3.5 ммоль СО 2 / г сухой массы ч [24]. Это в 6–10 раз больше, чем фотосинтетическая способность изученных нами водных и прибрежно-водных растений в бореальной зоне. По нашим данным, скорость ассимиляции СО 2 в группах водных и прибрежно-водных гидрофитов в пересчете на углерод составила в среднем 3.0 и 4.3 ммоль С/м2ч соответственно. Эти значения близки к величинам, приведенным в работе [11], для водных видов и вдвое выше для группы периодически затопляемых береговых растений, произрастающих в водоёмах Дании. Полученная нами средняя величина нетто-фотосинтеза (около 3–4 мкмоль СО 2 /м2с) сопоставима с данными других авторов [5, 15, 16].
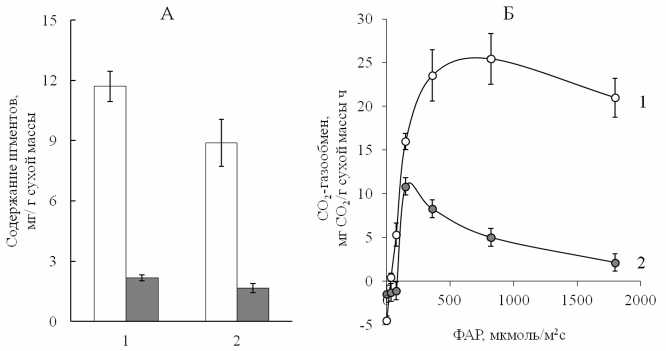
Рис. 3. Содержание хлорофиллов (светлые столбцы), каротиноидов (темные столбцы) (А) и световая зависимость СО2-газообмена (Б) надводных (1) и погружённых (2) в воду листьев Sium latifolium при температуре 20 ° С (июль).
На примере модельного растения Sium lati-folium L., имеющего и надводные, и погруженные листья, выявлены различия между разными типами листьев по ряду функциональных характеристик (рис. 3). Получающие меньше света погруженные в толщу воды листья отличались более низким содержанием хлорофиллов и характеризовались высокой долей хлорофилла b в ССК (63%). Структура пигментного комплекса погруженных листьев в значительной степени направлена на усиление светособирающей функции в условиях ослабления и изменения спектрального состава проникающего в толщу воды света. Такие же результаты были получены ранее [14] для пигментного аппарата погруженных листьев трех видов Potamogeton по мере естественного снижения освещенности с увеличением глубины. Из рис. 3 видно, что надводные листья Sium latifolium способны поглощать СО 2 со скоростью до 25 мг / г сухой массы ч. Погруженные в воду листья Sium latifolium в 2.5 раза уступали воздушным по скорости ассимиляции углекислоты и характеризовались более низкой эффективностью использования света. В воздухе насыщение нетто-фотосинтеза наступало при интенсивности ФАР 200–300 мкмоль/м2с, а устойчивое поглощение СО 2 наблюдалось в диапазоне от 500 до 1000 мкмоль/ м2с ФАР. В воде насыщение и максимум нетто-фотосинтеза происходило при освещении до 200 мкмоль/м2с, с повышением интенсивности освещения скорость нетто-фотосинтеза быстро снижалась до 20% от максимального значения. Интенсивность дыхания воздушных и водных листьев не превышала 17 % от максимума видимого поглощения СО 2 . Динамика изменения СО 2 -газообмена листьев разного типа Sium latifolium сохранялась и в расчете на единицу площади листа, так как по величине УППЛ листья практически не отличались. Величина этого показателя характеризует отношение биомассы листа к его площади. У надводных листьев Sium latifolium она составляла 0.40±0.01 г/дм2, у подводных - 0.43±0.06 г/дм2. Надводные листья характеризовались высокой фотосинтетической способностью. По ассимиляционной способности они в 2.5 раза превышали средние значения, полученные для наземных многолетних трав в бореальной зоне [25]. Экологическая гетерофилия обеспечивала устойчивую работу ассимиляционного аппарата Sium latifolium в воздушной среде и толще воды.
У обеих рассмотренных групп макрофитов (водных и прибрежно-водных с заходящими в воду береговыми растениями) интенсивность фотосинтеза зависела от содержания пигментов в расчёте на единицу сухой массы листа. Макрофиты с высокой ассимиляционной спо- соб-ностью накапливают в листьях от 12 до 20 мг Хл а+b/г сухой массы [24], минимальный уровень нако-пления хлорофиллов - 4 мг Хл а+b / г сухой массы [11]. В бореальной зоне у макрофитов, при-урочен-ных к водной среде и береговой зоне, содержание пигментов в листьях составляло около 7– 8 мг Хл а+b / г сухой массы и характеризовалось средней вариабельностью (коэффициент вариации ниже 30%). Для некоторых изученных нами гидрофитов (Calla palustris, Hydrocharis morsus-ranae, Lemna tri-sulca, Lemna minor, Numphar lutea, Elodea cana-densis, Polygonum amphibium) характерно по-нижен-ное содержание хлорофиллов (4–13 мг/г сухой массы) по сравнению с одноименными гидрофитами из рек Свердловской области (5–17 мг/г сухой массы) [16] и малых водоёмов Дании (8–22 мг/г сухой массы) [11, 15]. Величина ассимиляционного числа (количество СО2, фиксируемого фото-трофным органом в расчете на единицу содержания хлорофилла) у изученных нами видов составляла 1.2 - 1.7 мг СО2 / (мг Хл ч), что эквивалентно примерно 0.034 ммольС/ (мг Хл ч). У прибрежноводных (воздушных) и погруженных макрофитов северо-западных водоемов Европы (Дания) ассимиляционное число варьировало в широком диапазоне от 0.006 до 1.2 ммольС/мг Хл ч, что было обусловлено как межвидовыми различиями, так и степенью контакта ассимилирующих органов растений с водной и/или воздушной средой [11].
Заключение
Итак, анализ пигментного комплекса 44 представителей гидрофильной флоры водоемов окрестностей г. Сыктывкара показал, что в листьях прибрежно-водных видов накапливалось больше каротиноидов (в среднем до 2 мг/г сухой массы), чем у водных растений. При этом листья двух изученных групп макрофитов практически не различались по содержанию хлорофиллов. Отмеченная нами высокая доля хлорофилла в светособирающем комплексе хлоропластов водных гидрофитов свидетельствует о теневыносливости и приспособленности к дефициту света в воде. На примере Sium latifolium L. показано, что у погруженных листьев относительно большое содержание хлорофилла b обеспечивает эффективный светосбор в условиях низкой освещенности в толще воды. Макрофиты бореальной зоны не уступают наземным травянистым многолетникам по скорости поглощения СО 2 и эффективности использования азота в процессе фотосинтеза.
Виды гидрофильной флоры перспективны для оценки накопления углерода и общей продуктивности водных ценозов. На основе данных мониторинга процессов фотосинтеза и дыхания растений можно рассчитать такие балансовые показатели, как брутто-продуктивность и нетто-продукцию ценоза. Согласно полученным нами данным, скорость видимого фотосинтеза листьев Numphar lutea достигала 4–5 мг СО 2 /дм2ч. Исходя из этой величины, в подзоне средней тайги за период с июля по август первичная нетто-продукция зарослей (в виде монослоя листьев) N. lutea составит до 160–200 г С/м2.
Наши результаты сопоставимы с данными [26] по продуктивности этого вида, рассчитанными путём прямых количественных измерений размеров, фитомассы растений и их прироста, в малых реках Ярославской области.
Список литературы Фотосинтетические пигменты и СО2-газообмен водных макрофитов в подзоне средней тайги
- Распопов И.М. Фитомасса и продукция Онежского озера//Микробиология и первичная продукция Онежского озера. Л.: Наука, 1973. С.123-142.
- Распопов И.М. Высшая водная растительность больших озер Северо-Запада СССР. Л.: Наука, 1985. 200 с.
- Westlake D.F., Kvet J., Szczepanski A. The production ecology of wetlands. Cambridge: Cambridge Univ. Press, 1998. 568 p.
- Папченков В.Г., Щербаков А.В., Лапиров А.Г. Рекомендуемые для использования общие понятия гидроботаники//Гидроботаника 2005: Материалы VI Всероссийской школы-конференции по водным макрофитам. Рыбинск, 2006. С. 377-378.
- Larmola T., Alm J., Juutinen S., Martikainen P. J., Silvola J. Ecosystem CO2 exchange and plant biomass in the littoral zone of a boreal eutrophic lake//Freshwater Biology. 2003. Vol.48. № 8. P.1295-1310.
- Назаров С.К., Сивков М.Д., Некучаева Е.В. Фотосинтез и баланс углерода у гидрофильных арктических растений. Сыктывкар, 1991. 23 с. (Серия препринтов «Научные доклады»/Коми научный центр УрО АН СССР; Вып. 261).
- Bartleson R.D., Kemp W.M., Stevenson J.C. Use of a simulation model to examine effects of nutrient loading and grazing on Potamogeton perfoliatus L. communities in microcosms//Ecol. Modelling. 2005. Vol.185. P.483-512.
- Zimmerman R.C., Cabello-Pasini A., Alberte R.S. Modelling daily production of aquatic macrophytes from irradiance measurements: a comparative analyses//Mar. Ecol. Prog. Ser. 1994. Vol.114. P.185-196.
- Вейсберг Е.И. Жизненные формы и экологические группы макрофитов предгорных озёр Южного Урала (Челябинская область)//Известия Челябинского научного центра. 2004. Вып.3 (24). С.111-116.
- Ронжина Д.А. Структурно-функциональная организация фотосинтетического аппарата листьев высших водных растений: Автореф. дис.. канд. биол. наук. СПб., 2003. 17 с.
- Nielsen S.L. A comparison of aerial and submerged photosynthesis in some Danish amphibious plants//Aquatic Botany. 1993. Vol.45. №.1. P.27-40.
- Ронжина Д.А., Некрасова Г.Ф., Пьянков В.И. Сравнительная характеристика пигментного комплекса надводных, плавающих и погруженных листьев гидрофитов//Физиология растений. 2004. Т.51. №1. С.27-34.
- Новаковская Т.В., Дымова О.В. Видовое разнообразие и пигментный комплекс макрофитов водоёмов окрестностей г. Сыктывкара (Республика Коми)//Вестник Нижегородского университета им. Н.И.Лобачевского. 2012. № 5(1). С.127-134.
- Шерстнева О.А. Пигментный комплекс подводных листьев некоторых видов Potamogeton (Potamogetonaceae) в разных условиях освещенности//Ботанический журнал. 2004. Т.89. №5. С.821-829.
- Nielsen S., Sand-Jensen K. Regulation of photosynthetic rates of submerged rooted macrophytes//Oecologia. 1989. Vol. 81. № 3. P. 364-368.
- Ribaudo C., Bartoli M., Longhi D., Castaldi S., Neubauer S.C., Viaroli P. CO2 and CH4 fluxes across a Nuphar lutea (L.) Sm. Stand//J. Limnol. 2012. Vol.71. № 1. P. 200-210.
- Папченков В.Г. О классификации макрофитов водоёмов и водной растительности//Экология. 1985. № 6. С.8-13.
- Черепанов С.К. Сосудистые растения России и сопредельных государств. СПб.: Мир и семья, 1995. 992 с.
- Маслова Т.Г., Попова И.А., Попова О.Ф. Критическая оценка спектрофотометрического метода количественного определения каротиноидов//Физиология растений. 1986. Т.39. Вып. 6. С. 615-619.
- Maslova T.G., Popova I.A. Adaptive Properties of the Pigment Systems//Photosynthetica. 1993. Vol. 29. P. 195-203.
- Smith F.A., Walker N.A. Photosynthesis by Aquatic Plants: Effects of Unstirred Layers in Relation to Assimilation of CO2 and HCO3 Isotopic Discrimination//New Phytol. 1981. Vol. 86. P. 245-259.
- Pyankov V., Kondratchuk A., Shipley B. Leaf structure and specific leaf mass: the alpine desert plants of the Estern Pamirs, Tadjikistan//New Phytol. 1999. Vol.143. P.131-142.
- Слемнев Н.Н. О взаимосвязи между интенсивностью фотосинтеза, концентрацией хлорофилла и структурой листьев растений Монголии//Факторы среды и организация первичных процессов фотосинтеза/Ред. Л.К.Островская. Киев: Наукова Думка, 1989. С.137-143.
- Hussner A. Growth and photosynthesis of four invasive aquatic plant species in Europe//Weed Research. 2009. Vol. 49. № 5. P.506-515.
- Далькэ И.В. Физиология и экология фотосинтеза растений бореальной зоны//Фундаментальные и прикладные проблемы современной экспериментальной биологии растений: Материалы Всероссийской научной конференции с международным участием и школы для молодых ученых, посвященной 125-летию Института физиологии растений им. К.А. Тимирязева РАН. М.: ИФР РАН, 2015. С. 195-199.
- Чернова А.М. Сезонная динамика продуктивности кубышки жёлтой Nuphar lutea (L.) Smith (Nymphaeaceae) в малой реке Ильдь (Ярославская область)//Биология внутренних вод. 2015. №2. С.60-68. 1991. Issue 261. 23 p.


