Фотосинтез и азотный метаболизм в листьях пшеницы при низкой концентрации СО2 в атмосфере
Автор: Иванов Анатолий Алексеевич
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Физико-химическая биология
Статья в выпуске: 4 (165), 2017 года.
Бесплатный доступ
Целью данного исследования было изучение изменений параметров фотосинтеза, активности ферментов метаболизма азота и содержания пролина у растений пшеницы (Triticum aestivum L.) после их инкубации при низкой концентрации СО2 в герметичной камере в течение 10 дней. Снижение концентрации СО2 в атмосфере сопровождалось изменением ряда фотосинтетических параметров при использовании СО2 в качестве акцептора электронов в фотосистеме I. Наблюдалось уменьшение скорости газообмена на плато световой кривой, величины светового компенсационного пункта и интенсивности света при насыщении световой кривой. При использовании NO2- в качестве акцептора электронов фотосинтетические параметры при анализе световых кривых выделения О2 менялись незначительно как в условиях естественной, так и низкой концентрации СО2. При дефиците СО2 возрастало значение NO2- как акцептора фотосинтетических электронов, что могло привести к изменению C/N-баланса в сторону усиления азотного метаболизма в клетках растений. Об этом также свидетельствовало увеличение активности глутаминсинтетазы, ключевого фермента данного пути. Увеличение активности ферментов азотного метаболизма при дефиците углеродных скелетов могло привести к избытку азотистых соединений и необходимости вывода их из сферы метаболических реакций. В результате наблюдалось накопление пролина в качестве условно запасного вещества, предельная концентрация которого тем не менее зависела от активности пролиндегидрогеназы.
Концентрация со2, фотосинтез, ферменты азотного обмена, пролин, альтернативные акцепторы электронов
Короткий адрес: https://sciup.org/14751191
IDR: 14751191 | УДК: 581.132
Текст научной статьи Фотосинтез и азотный метаболизм в листьях пшеницы при низкой концентрации СО2 в атмосфере
Воздействие различного рода стрессовых факторов приводит к ряду негативных изменений внутри растения, результатом которых может быть нарушение физиологических и биохимических процессов. Реакция растений в неблагоприятных условиях во многом связана с работой механизмов, компенсирующих отрицательные последствия действия абиотических факторов. Так, при ряде стрессов наблюдается закрытие устьиц с целью предотвращения обезвоживания организма. Однако с уменьшением устьичной проводимости снижается также и доступность углекислоты, основного субстрата для биосинтетических реакций в хлоропластах. Результатом этого является уменьшение видимого фотосинтеза листьев и ингибирование роста растений, зависимого, главным образом, от скорости синтеза углеродных скелетов в процессе фотосинтетической фиксации углекислоты. Однако, несмотря на снижение концентрации СО2 в межклетниках листьев, активность фотосинтетического аппарата, определяемая по выделению кислорода, остается на достаточно высоком уровне [10].
Наряду со снижением скорости ряда метаболических процессов при водно-солевом стрессе, в растении активируются специфические био
химические механизмы, одним из которых является накопление пролина как осмотически активного вещества, поддерживающего водный баланс клеток. Накопление больших количеств пролина, особенно в условиях дефицита углеродных соединений, возникающего вследствие уменьшения фиксации углекислоты при стрессе, означает изменение C/N-баланса в растении в сторону накопления азотистых веществ. Основным источником азота для растения являются нитраты. Цикл азота включает в себя как поглощение нитрата из почвы, так и гидролиз соединений запасного азота, а также реассимиляцию аммиака, выделяемого в процессе фотодыхания. Нитраты, поглощаемые из почвы с помощью NO3--транспор-теров, восстанавливаются до аммония в последовательных реакциях с помощью нитратредуктазы в цитозоле и нитритредуктазы в хлоропластах. Аммоний преобразуется сначала до глютамина с помощью глутаминсинтетазы (ГС), а затем до глутамата посредством глутаматсинтетазы (ГОГАТ) [21], [31].
Комбинированное действие ГС и ГОГАТ – это основной путь для ассимиляции аммиака. Аминокислоты, нуклеиновые кислоты и практически все соединения азота синтезируются из глутамина и глутамата. С другой стороны, аммоний может непосредственно включаться в глутамат в реакции аминирования с участием глутаматдегидрогеназы (НАДН-ГлДГ), особенно при высоких концентрациях NH4+, но ее функция является предметом дебатов [31]. Поскольку ГлДГ обратимо дезаминирует глутамат (НАД-ГлДГ), физиологическая роль этого фермента в естественных условиях может состоять в получении 2-оксоглутатата и восстановительных эквивалентов для использования их в других метаболических процессах [21].
Координация C и N обмена веществ, обеспечивающая их оптимальное функционирование, играет ключевую роль в жизни растений. C-метаболизм обеспечивает доступную энергию (АТФ) и C-скелеты для восстановления NO3-и последующего синтеза аминокислот. В то же время N-метаболизм конкурирует с C-метаболизмом за НАДН и НАДФ, а также некоторые промежуточные продукты, полученные на стадии фотореакции, особенно при ограничении CO2-ассимиляции [23]. Кроме того, повышенное содержание углеводов может увеличивать активность ферментов, связанных с N-метаболизмом, способствуя NH4+-ассимиляции [30]. Таким образом, существует множество точек взаимного контроля между С- и N-метаболизмами, в том числе на уровне экспрессии генов и активности ферментов [5].
Процессы ассимиляции CO2 и NO2- взаимодействуют на уровне фотосинтетического транспорта электронов. Контрольной точкой для их взаимной регуляции является ферредоксин, входящий в редуцирующий сайт ФСI [6]. При линейном транспорте электронов от H2O до НАДФ, перенос 4 электронов (2 НАДФ) вместе с 12 H+ поддерживает синтез 3 АТФ. Этого достаточно для ассимиляции одной молекулы СО2 в цикле Кальвина – Бенсона. Синтез дополнительного количества АТФ для вторичного метаболизма может происходить путем переноса электронов на акцепторы, отличные от CO2, с включением метаболических путей с меньшим потреблением ATФ в расчете на электрон [6]. В качестве альтернативного акцептора электронов может выступать NO2-, фотовосстановление которого приводит к производству дополнительного АТФ при сокращении поглощения CO2 [18].
К сожалению, практически отсутствуют исследования, посвященные изучению метаболизма растений в условиях дефицита углекислоты как основного источника углерода, необходимого для роста растений. Поэтому целью данной работы являлось определение активностей фотосинтетического аппарата и ключевых ферментов азотного метаболизма, а также накопления пролина в листьях пшеницы в условиях пониженного содержания СО 2 в окружающей среде, что может служить одним из подходов для выяснения механизмов регулирования C/N-баланса в клетках.
МАТЕРИАЛ И МЕТОДЫ
Семена пшеницы ( Triticum aestivum L.) проращивали в 0,5 л сосудах, содержащих в качестве субстрата речной песок. Растения выращивали в контролируемых условиях под белыми люминесцентными лампами при 12 ч фотопериоде, температуре 24/20 °С (день/ночь), относительной влажности воздуха 60–80 %, освещенности 400 мкмоль фотонов м-2 с-1. Проводили ежедневный полив питательным раствором Хьюитта [9] до полной влагоемкости субстрата. Питательный раствор содержал сверхоптимальное количество N, чтобы исключить возможное изменение активности фотосинтеза, связанное с N-лимитированием.
Часть сосудов с 10-дневными проростками пшеницы помещали в герметическую камеру (13,6 л), где в результате естественного поглощения углекислоты растениями концентрация СО2 в воздухе снижалась до компенсационной точки через 3 суток инкубации (–CO 2 ), что контролировали с помощью ИК-газоанализатора. Другую часть сосудов оставляли при естественной концентрации углекислоты в качестве контроля (+CO 2 ). Через 10 суток инкубации камеру открывали и определяли скорость фотосинтеза и активности ферментов у 2-го листа растений в контроле и растущих при пониженной концентрации СО 2 как сразу после открытия камеры, так и в течение последующих 2 дней для выяснения изменения ферментативных активностей после возвращения растений в условия нормальной концентрации CO 2 .
Измерение O2-газообмена проводили с помощью полярографа в 5 мл термостатированной ячейке со стандартным платиновым электродом Кларка при интенсивности света 1200 мкЕ м-2 с-1 и температуре 28 °C в 50 мМ К-фосфатном буфере (рН 7,5) [4]. Перед началом измерений в буферный раствор ячейки добавляли избыточное количество бикарбоната натрия (10 мМ NaHCO3), достаточное для насыщения фотосинтеза источником углерода. При необходимости вместо NaHCO3 в ячейку добавляли 10 мМ KNO2 в качестве альтернативных акцепторов электронов. Фотосинтетическое выделение O2 вычисляли с учетом темнового дыхания после 15 мин инкубации образцов в темноте.
Получение экстрактов ферментов для определения нитратредуктазы (НР) проводили согласно Абд-эль-Баки и др. [1]; для нитритредуктазы (НиР), глутаминсинтетазы (ГС) и НАД-зависи-мой глутаматдегидрогеназы (НАД-ГлДГ) – Ро-бредо и др. [21]; для пролиндегидрогеназы (ПДГ) – Ли и др. [15].
Для определения активностей ферментов использовали методы: Абд-эль-Баки и др. – для НР [1]; Фри и др. – для НиР [7]; Ла-куэста и др. – для ГС по оптической плотности γ-глутамилгидроксамат-Fe3+-комплекса (γ-ГГМ)
[14]; Турано и др. – для НАД-ГлДГ [28]; Ли и др. – для ПДГ [15].
Определение количества свободного пролина проводили по методу Бейтс и др. [2].
Опыты проводили в 3 биологических повторностях. Результаты представлены в виде средних значений и их стандартных отклонений 3 независимых измерений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При нормальной концентрации СО 2 основной поток поглощенной энергии света направлен на восстановление соединений углерода, несмотря на равное распределение потоков электронов и энзиматические способности к фотовосстановлению NO 2 - и CO 2 [6]. Соответственно и скорость CO 2 -ассимиляции заметно превышает скорость фотовосстановления NO2- (рис. 1А). Доминирование восстановления CO 2 объясняется тем, что при отсутствии дефицита доступных субстратов для фотоассимиляции каждой молекулы NO2- в глутарат требуется 8 электронов по сравнению с 4 электронами для ассимиляции СО 2 [20].
После инкубации растений при низкой концентрации СО 2 резко снижалась скорость ассимиляции СО 2 (рис. 1Б). Однако скорость светозависимого восстановления NO2- оставалась неизменной. Следовательно, при замедлении процессов углеродного метаболизма успешно продолжает функционировать путь утилизации электронов из фотосинтетической электрон-
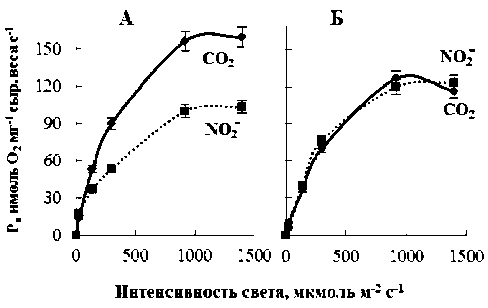
Рис. 1. Световые кривые О2-газообмена листьев пшеницы после инкубации растений в условиях нормальной (А) и низкой (Б) концентрации углекислоты в атмосфере при использовании CO2 и NO2- в качестве акцепторов электронов из фотосинтетической электрон-транспортной цепи транспортной цепи, направленный на первичную ассимиляцию азота. Эти данные подтверждаются тем, что активность нитритредуктазы (НиР) мало менялась после инкубации растений при низкой концентрации СО2 (рис. 2Б). Кратковременное увеличение активности фермента на второй день после открытия камеры инкубации может быть связано с интенсификацией углеродного метаболизма при повышении внутриклеточной концентрации СО 2 . Однако в дальнейшем активность фермента возвращалась к первоначальному уровню, скорее всего, благодаря работе механизмов, поддерживающих постоянство С/N-баланса.
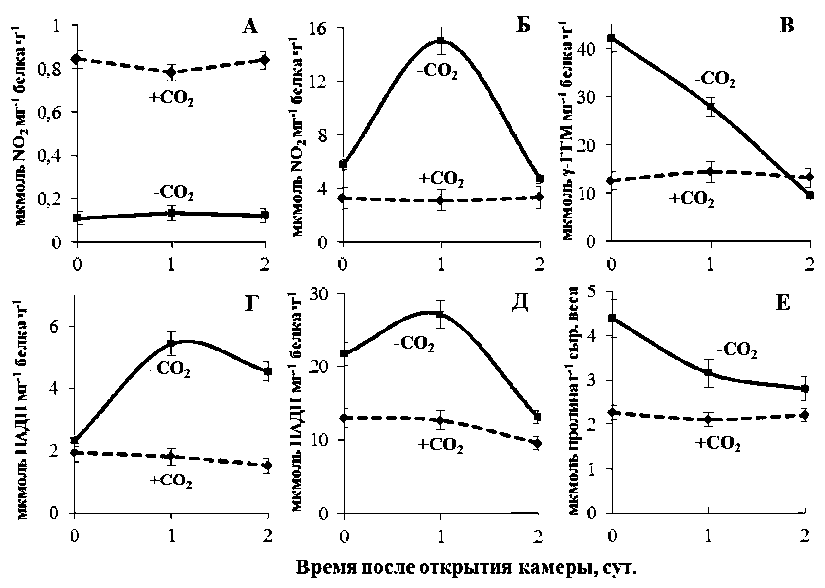
Рис. 2. Активности основных ферментов азотного метаболизма и содержание пролина в листьях пшеницы в нормальных условиях (+СО2) и после инкубации растений при низкой концентрации CO2 (–СО2), сразу после открытия камеры (0 сут.) и в течение последующих 2 дней. А – активность НР, Б – НиР, В – ГС, Г – НАД-ГлДГ, Д – ПДГ,
Е – содержание пролина
Таким образом, в условиях дефицита СО 2 избыточная энергия света, поглощаемая хлорофиллом, частично может быть рассеяна в виде тепла, но также может быть перенаправлена для восстановления NO2-, выступающего в качестве альтернативного акцептора электронов [6]. С одной стороны, это позволяет утилизировать избыточную энергию поглощаемого солнечного света, с другой стороны, таким образом может осуществляться регулирование C/N-метаболи-ческого баланса.
Способность использовать энергию света для восстановления NO2- осуществляется в ферре-доксинзависимой НиР-реакции с образованием NH 3 . В этой реакции в качестве редокс-фактора используется восстановленный ферредоксин, интегрированный в электрон-транспортную цепь ФС I. Поскольку как NO2-, так и CO2 конкурируют за один и тот же пул восстановителя с аналогичными свойствами [6], ферредоксин формирует узловые точки азотного и углеродного метабо-лизмов, распределяя фотосинтетически сгенерированные электроны в различные метаболические процессы.
Реакция растений на дефицит СО 2 сопровождается изменением активности основных ферментов азотного метаболизма (см. рис. 2). После инкубации растений при концентрации СО2, близкой к углекислотному компенсационному пункту, наблюдалось снижение активности нитратредуктазы (НР) в листьях (рис. 2А). Ранее было показано [12], что освещение листьев в атмосфере без СО2 приводит к ингибированию НР-активности, которая вновь увеличивается при добавлении СО 2 . Время для 50 % изменения активности фермента составляло 30 мин. Это подразумевает наличие механизма быстрой инактивации/активации НР в листьях и тесной взаимосвязи фермента с фотосинтетическими процессами. Однако, согласно нашим данным, после длительной инкубации растений в условиях дефицита СО2 для восстановления активности НР до исходного уровня требуется время, по крайней мере, большее, чем 3 суток от момента открытия камеры.
Ингибирование активности НР может происходить на разных уровнях регулирования. Прежде всего, это регулирование экспрессии генов фермента, индуцируемое как светом, так и сахарами [11]. С другой стороны, активность фермента может снижаться под влиянием активных форм кислорода или в результате работы специфических протеаз, а также при совместном действии этих двух факторов, усиливающих действие друг друга [13]. В нашем случае, учитывая длительный период восстановления активности фермента, скорее всего, имеет место ингибирование экспрессии фермента в условиях недостатка углеводов, наблюдаемого при дефиците СО 2 .
В наших экспериментах активность глута-минсинтетазы сильно возрастала при дефиците СО2 в сравнении с контрольными растениями, но затем постепенно снижалась до уровня контроля в атмосфере с нормальной концентрацией СО 2 (рис. 2В).
ГС занимает центральное место на пути как первичной ассимиляции азота, так и реассимиляции NH4+, производимого при фотодыхании, и является началом пути синтеза различных N-со-держащих соединений, например аминокислот. Активность ГС зависит от окружающей среды и метаболического статуса тканей растения, которые могут колебаться в течение дня [26]. При физиологической концентрации CO2 Рубиско катализирует две реакции, в которых CO 2 и O 2 конкурируют за один активный сайт фермента с образованием 3-фосфоглицерата и фосфогликолата соответственно. При дефиците СО2 возрастает значение оксигеназной функции фермента, то есть усиливается процесс фотодыхания, в результате которого образуется избыточное количество аммиака со скоростью, на порядок более высокой, чем при восстановлении NO3- в освещенных листьях. Для поддержания азотного баланса листа необходима рефиксация генерируемого при фотодыхании NH3, в противном случае концентрация NH3 может увеличиваться до токсичных уровней [19]. NH 3 , образующийся в процессе фотодыхания в митохондриях клеток листа, рефиксируется в хлоропластах при помощи ГС/ГОГАТ-системы, но не глутаматдегидрогеназы [19], [29]. При этом потребление дополнительной энергии, необходимой для NH3-рециркуляции в фотодыхании, относительно мало влияет на стехиометрию АТФ/ НАДФН и скорость электрон-транспортной цепи [19]. Поскольку хлоропластная ГС является основным сайтом реассимиляции NH3 [29], усиление ее активности при дефиците СО2 в условиях нашего эксперимента кажется вполне оправданным (см. рис. 2В).
Наряду с указанными выше ферментами ключевую роль в поддержании баланса углерода и азота играет также глутаматдегидрогеназа, осуществляющая дезаминирование аминокислот. В клетке растений формируется ГлДГ-шунт для возвращения углерода аминокислот обратно в реакции углеродного обмена и цикл трикарбоновых кислот. При этом значение ГлДГ-шунта возрастает, когда растение лимитировано по углероду. Существуют убедительные доказательства того, что функционирование ГлДГ не направлено в сторону ассимиляции NH 3 [16]. Более вероятно, что ГлДГ является стресс-реактивным белком, который может отражать альтернативный ГС/ ГОГАТ-системе путь ассимиляции аммиака в условиях внутриклеточной гипераммониемии [25].
После инкубации растений в условиях дефицита СО2 в наших экспериментах не наблюдалось изменения активности НАД-ГлДГ (рис. 2Г)
и, следовательно, не происходило усиления дезаминирования глутамата, который в данном случае мог бы использоваться для синтеза, например, пролина, концентрация которого увеличивалась (рис. 2Е). Напротив, активность НАД-ГлДГ увеличивалась только в условиях нормальной концентрации СО2 после открытия камеры. В данном случае, скорее всего, усиливался распад основного субстрата для синтеза пролина – глутамата, как поступающего от ГС/ ГОГАТ, так и возвращаемого в хлоропласты из пролин/Δ1-пирролин-5-карбоксилатного цикла (пролин/П5К цикл) [3]. Данный процесс совпадал с наблюдаемым нами уменьшением концентрации пролина в листьях в течение нескольких суток после открытия камеры (см. рис. 2Г).
В наших экспериментах в условиях дефицита СО2 действительно наблюдалось увеличение концентрации пролина в листьях (см. рис. 2Г). При этом следует особо подчеркнуть, что величина накопления пролина не зависела от времени инкубации растений при пониженной СО2 (7, 10 или 14 суток, данные не показаны). Следовательно, в данном случае следует говорить не об аккумуляции пролина, а о поддержании пула его концентрации. Данное утверждение подкрепляется наблюдаемым увеличением активности пролиндегидрогеназы (рис. 2Д).
В растениях метаболизм пролина основан на существовании пролин/П5К-цикла, функционирование и значение которого подробно описаны в статье Миллер и др. [17]. Накопление пролина зависит как от активации его биосинтеза, так и торможения деградации [3]. Биосинтез пролина происходит в цитозоле клеток растений, однако в стрессовых условиях его синтез возможен и в хлоропластах [27]. При осмотическом стрессе пролин синтезируется главным образом из глутамата. На этом пути бифункциональная П5К-син-тетаза восстанавливает глутамат до глютамил-5-семиальдегида, который спонтанно превращается в П5К. П5К восстанавливается до пролина при помощи П5К-редуктазы. Деградация пролина происходит в митохондриях в результате последовательных реакций ПДГ и П5К-дегидрогеназы. Ключевыми точками, лимитирующими скорость биосинтеза и деградации пролина, являются активности П5К-синтетазы и ПДГ соответственно [3].
Синтез пролина и его использование в качестве конечного акцептора электронов фотосинтетической электрон-транспортной цепи может снизить использование O2 вместо НАД(Ф) в качестве акцептора электронов при фотосинтезе и, таким образом, снизить производство активных форм кислорода и обеспечить некоторую защиту от фотоингибирования при неблагоприятных условиях [8].
Метаболизм пролина напрямую связан с НАД(Ф)Н/НАД(Ф) окислительно-восстанови- тельным балансом, а сам пролин может выполнять функцию редокс-переносчика [3], [23]. Поэтому увеличение синтеза пролина при стрессе может быть частью механизма, поддерживающего редокс-потенциал клетки на уровне, приемлемом для метаболизма [8]. Закрытие устьиц во время осмотического стресса ограничивает поглощение углерода, что впоследствии приводит к снижению потребления НАДФН в цикле Кальвина. Использование НАД(Ф)Н для синтеза пролина во время стресса, возможно, увеличивает соотношение НАД(Ф)/НАД(Ф)Н в клетке. Поскольку показано, что в условиях стресса пролин может быть синтезирован из глутамата в хлоропластах [27], регулирование НАД(Ф)/НАД(Ф)Н-отношения может образовать связь между биосинтезом пролина и восстановлением НАД(Ф) с участием двух дегидрогеназокислительного пен-тозо-фосфатного пути (ОПФП), контролирующих преобразование глюкозо-6-фосфата в рибулозо-5-фосфат. В этом случае генерация CO2, образующегося при синтезе рибулозо-5-фосфата, может позволить продолжить процесс восстановления углерода в условиях дефицита экзогенного CO2, а НАД(Ф)Н может использоваться в биосинтезе пролина, предотвращая фотоингибирование и производство избытка активных форм кислорода в хлоропласте [3], [24].
С другой стороны, в нефотосинтетических пластидах окисление глюкозо-6-фосфа-та через ОПФП обеспечивает электроны для НиР и ферредоксин-ГОГАТ. В этом случае ферредоксин:НАДФ+-оксидоредуктаза (ФНР) опосредует восстановление ферредоксина посредством НАДФН, поступающего от ОПФП. Таким образом, ферредоксин и ФНР играют центральную роль при распределении редокс-эквивалентов в обоих типах пластид. Поскольку ФНР является изопротеином, переносящим электроны от НАДФН на нефотосинтический тип ферредоксина, редокс-эквивалент поставляется на восстановление нитрата, по крайней мере, частично через ОПФП даже в фотосинтетических органах [22].
ЗАКЛЮЧЕНИЕ
Таким образом, углеродный и азотный мета-болизмы тесно взаимосвязаны. При дефиците СО2 активация азотного метаболизма может привести к дисбалансу системы, для предотвращения которого в первую очередь ингибируется НР с целью уменьшения количества субстрата для светозависимой метаболизации NO2-. Утилизация уже поглощенного NO3- происходит по глутаматному пути синтеза пролина, который в данном случае выступает в качестве побочного продукта «отвода» избыточной энергии поглощенных фотонов при фотосинтезе, а также запасания избыточного азота в метаболически относительно нейтральных веществах цикла пролина. То есть образование пролина при стрессе имеет не целенаправленный характер, а служит средством детоксикации клеток от избытка азота, что согласуется с сообщением о возможности синтеза пролина из глутамата в хлоропластах [27]. В бесстрессовых условиях пролиновый цикл работает на «холостом ходу», но при стрессе цикл разрывается за счет ингибирования пролиндегидрогеназы. В результате наблюдается накопление пролина. При этом меняются также назначение и функции данной аминокислоты. Эти функции зависят от баланса пространственного и временного регулирования синтеза и катаболизма пролина, связывания или освобождения восстановителя и энергии в нужном месте и времени для удовлетворения потребностей растения, что не подчиняется теории «чем больше, тем лучше» при накоплении пролина [24].
Список литературы Фотосинтез и азотный метаболизм в листьях пшеницы при низкой концентрации СО2 в атмосфере
- Abd-El Baki G. K., Siefritz F., Man H. M., Weiner H., K aldenho f f R., Kaiser W. M. Nitrate reductase in Zea mays L. under salinity//Plant Cell Environ. 2000. Vol. 23. P. 515-521.
- Bates L. S., Waldren R. P., Teare I. D. Rapid determination of free proline for water stress studies//Plant Soil. 1973. Vol. 39. № 1. P. 205-207.
- Ben Rejeb K., Abdelly C., Savourt A. How reactive oxygen species and proline face stress together//Plant Physiol. Biochem. 2014. Vol. 80. P. 278-284.
- Bil’ K. Y., Fomina I. R., Tsenova E. N. Effects of nitrogen nutrition on photosynthetic enzyme activities, type of photosynthates and photosystem 2 activity in maize leaves//Photosynthetica. 1985. Vol. 19. № 2. P. 216-220.
- Commichau F. M., Forchhammer K., Stülke J. Regulatory links between carbon and nitrogen metabolism//Curr. Opin. Microbiol. 2006. Vol. 9. № 2. P. 167-172.
- Eichelmann H., Oja V., Peterson R. B., Laisk A. The rate of nitrite reduction in leaves as indicated by O2 and CO2 exchange during photosynthesis//J. Exp. Bot. 2011. Vol. 62. № 6. P. 2205-2215.
- Fry I. V., Cammack R., Hucklesby D. P., Hewitt E. J. Kinetics of leaf nitrite reductase with Methyl Viologen and ferredoxin under controlled redox conditions//Biochem. J. 1982. Vol. 205. P. 235-238.
- Hare P. D., Cress W. A., Van Staden J. Dissecting the roles of osmolyte accumulation during stress//Plant Cell Environ. 1998. Vol. 21. P. 535-553.
- Hewitt E. J. Sand and water culture methods used in the study of plant nutrition. 2nd ed. London: Commonwealth Agricultural Bureau, 1966. 547 p.
- Ivanov A. A. Response of wheat seedlings to combined effect of drought and salinity//Stress Responses in Plants. Mechanisms of Toxicity and Tolerance. Springer International Publishing, 2015. P. 159-199.
- Jonassen E. M., Sandsmark B. A. A., L i 11 o C. Unique status of NIA2 in nitrate assimilation: NIA2 expression is promoted by HY5/HYH and inhibited by PIF4//Plant Signal Behav. 2009. Vol. 4. P. 1084-1086.
- Kaiser W. M., Förster J. Low CO2 prevents nitrate reduction in leaves//Plant Physiol. 1989. Vol. 91. P. 970-974.
- Kenis J. D., Rouby M. B., Edelman M. O., Silvente S. T. Inhibition of nitrate reductase by water stress and oxygen in detached oat leaves: A possible mechanism of action//J. Plant Physiol. 1994. Vol. 144. P. 735-739.
- Lacuesta M., Gonzá1ez-Moro B., González-Murua C., Muñoz-Rueda A. Temporal study of the effect of phosphinothricin on the activity of glutamine synthetase, glutamate dehydrogenase and nitrate reductase in Medicago sativa L.//J. Plant Physiol. 1990. Vol. 136. P. 410-414.
- Li X., Yang Y., Jia L., Chen H., Wei X. Zinc-induced oxidative damage, antioxidant enzyme response and proline metabolism in roots and leaves of wheat plants//Ecotoxicol. Environ. Safety. 2013. Vol. 89. P. 150-157.
- Magalhaes J. R., Ju G. C., Rich P. J., Rhodes D. Kinetics of Nitrogen-15-labeled ammonium ion assimilation in Zea mays. Preliminary studies with a glutamate dehydrogenase GDH1 null mutant//Plant Physiol. 1990. Vol. 94. P. 647-656.
- Miller G., Honig A., Stein H., Suzuki N., Mittler R., Zilberstein A. Unraveling A1-pyrroline-5-carboxylate-proline cycle in plants by uncoupled expression of proline oxidation enzymes//J. Biol. Chem. 2009. Vol. 284. P. 26482-26492.
- Noctor G., Foyer C. H. A re-evaluation of the ATP: NADPH budget during C3 photosynthesis: a contribution from nitrate assimilation and its associated respiratory activity?//J. Exp. Bot. 1998. Vol. 49. P. 1895-1908.
- Osmond C. B. Photorespiration and photoinhibition. Some implications for the energetics of photosynthesis//Biochim. Biophys. Acta. 1981. Vol. 639. P. 77-98.
- Robinson J. M. Carbon dioxide and nitrite photoassimilatory processes do not intercompete for reducing equivalents in spinach and soybean leaf chloroplasts//Plant Physiol. 1986. Vol. 80. P. 676-684.
- Robredo A., Pirez-Lypez U., Miranda-Apodaca J., Lacuesta M., Mena-Petite A., Mueoz-Rueda A. Elevated CO2 reduces the drought effect on nitrogen metabolism in barley plants during drought and subsequent recovery//Environ. Exp. Bot. 2011. Vol. 71. P. 399-408.
- Sakakibara H. Differential response of genes for ferredoxin and ferredoxin: NADP+ oxidoreductase to nitrate and light in maize leaves//J. Plant Physiol. 2003. Vol. 160. P. 65-70.
- Sänchez-Rodrnguez E., Rubio-Wilhelmi M. M., Rios J. J., Blasco B., Rosales M. A., Melgarejo R., Romero L., Ruiz J. M. Ammonia production and assimilation: its importance as a tolerance mechanism during moderate water deficit in tomato plants//J. Plant Physiol. 2011. Vol. 168. P. 816-823.
- Sharma S., Villamor J. G., Verslues P. E. Essential role of tissue-specific proline synthesis and catabolism in growth and redox balance at low water potential1 essential role of tissue-specific proline synthesis and catabolism in growth and redox balance at low water potential//Plant Physiol. 2011. Vol. 157. P. 292-304.
- Skopelitis D. S., Paranychianakis N. V., Paschalidis K. A., Pliakonis E. D., Delis I. D., Yakoumakis D. I., Kouvarakis A., Papadakis A. K., Stephanou E. G., Roubelakis-Angelakis K. A. Abiotic stress generates ROS that signal expression of anionic glutamate dehydrogenases to form glutamate for proline synthesis in tobacco and grapevine//The Plant Cell. 2006. Vol. 18. P. 2767-2781.
- Stitt M., Müller C., Matt P., Gibon Y., Carillo P., Morcuende R., Scheible W-R., Krapp A. Steps towards an integrated view of nitrogen metabolism//J. Exp. Bot. 2002. Vol. 53. P. 959-970.
- Székely G., Abraham E., Cséplo A., Rigу G., Zsigmond L., Csiszar J., Ayaydin F., Strizhov N., Jasik J., Schmelzer E., Koncz C., Szabados L. Duplicated P5CS genes of Arabidopsis play distinct roles in stress regulation and developmental control of proline biosynthesis//Plant J. 2008. Vol. 53. P. 11-28.
- Turano F. J., Dashner R., Upadhyaya A., Caldwell C. R. Purification of mitochondrial glutamate dehydrogenase from dark-grown soybean seedlings//Plant Physiol. 1996. Vol. 112. P. 1357-1364.
- Wallsgrove R. M., Keys A. J., Eea P. J., Mieein B. J. Photosynthesis, photorespiration and nitrogen metabolism//Plant Cell Environ. 1983. Vol. 6. № 4. P. 301-309.
- Zhang Y. H., Zhang G., Liu L. Y., Zhao K., Wu L. S., Hu C. X., Di H. J. The role of calcium in regulating alginate-derived oligosaccharides in nitrogen metabolism of Brassica campestris L. var. Tsen et Lee//J. Plant Growth. Regul. 2011. Vol. 64. № 2. P. 193-202.
- Ziegler C., Feraud M., Jouglet T., Viret L., Spampinato A., Paganelli V., Hammouda M. B., Suzuki A. Regulation of promoter activity of ferredoxin-dependent glutamate synthase//Plant Physiol. Biochem. 2003. Vol. 41. P. 649-655.


