Фракционный состав белков и молекулярные формы некоторых дегидрогеназ микросообществ модельных гидроэкосистем
Автор: Агапов А.И., Шаталаев Н.И., Воронин А.В., Шаталаев И.Ф.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Мониторинг окружающей среды
Статья в выпуске: 1-6 т.11, 2009 года.
Бесплатный доступ
Приведены данные исследований фракционного состава белков, активности молекулярных форм глюкозо-6-фосфатдегидрогеназы, сукцинатдегидрогеназы микросообществ модельных гидроэкосистем по фазам развития и при действии ряда токсикантов. Показана возможность применения полученных результатов для биомониторинга гидроэкосистем.
Микросообщества, биомониторинг гидроэкосистем, токсиканты
Короткий адрес: https://sciup.org/148198447
IDR: 148198447 | УДК: 547:661.52:576.8
Текст научной статьи Фракционный состав белков и молекулярные формы некоторых дегидрогеназ микросообществ модельных гидроэкосистем
Шаталаев Иван Федорович, доктор биологических наук, профессор, заведующий кафедрой химии фармацевтического факультета
Сукцинатдегидрогеназа (СДГ) занимает одно из ключевых положений в обменных процессах микросообществ активного ила, поэтому данные об активности фермента позволяют судить о скорости функционирования цикла Кребса. В доступной литературе практически отсутствует информация по использованию данных о динамике активности и структурной организации СДГ в мониторинге экосистем. Эти данные могут быть использованы в качестве интегрального показателя оценки физиологического и функционального состояния микросообществ модельных и природных гидроэкосистем. Высокая чувствительность СДГ к действию ксенобиотиков может быть положена в основу одного из методов биомониторинга последних [6].
Цель настоящей работы — исследование фракционного состава белков, структурных особенностей, динамики относительной активности молекулярных форм Гл-6-ФД и СДГ гидроэкосистем активного ила по фазам развития, при моделировании залповых сбросов сточных вод и их компонентов.
Материал и методы исследования. В качестве модельных гидроэкосистем использовали активный ил регенераторов сооружений биологической очистки нефтеперерабатывающего завода. После удаления фоновых загрязнений ил помещали в аэратор периодического действия, исходная концентрация биомассы составляла 0,8-1,0 г/л. Источником углерода в среде являлась глюкоза в концентрации 1 г/л. Фазы развития экосистемы контролировали по показателям оптической плотности и сухому остатку биомассы. На разных фазах имитировали залповые сбросы сточных вод и их компонентов. Получение ферментных образцов, электрофорез, определение молекулярной массы белковых фракций, выявление МФ Гл-6-ФД и СДГ, определение их активности проводили по методикам, описанным в литературе [6].
Результаты и их обсуждение. На всех фазах развития модельной гидроэкосистемы были выявлены три основные фракции белка: первая — «быстромигрирующая» с молекулярной массой 14500-15000; а также две фракции — 43000-50000 и 58000-60000. Из литературных источников известно, что молекулярная масса белков большинства бактерий имеет сравнительно малую величину — до 90000-100000, что согласуется с полученными нами данными. Было отмечено значительное уменьшение количества белка во всех фракциях от фазы адаптации к фазе лог-роста и стационарной фазе — до 70% от первоначальной величины в фазе адаптации.
Необходимо отметить, что в фазе лог-роста происходило увеличение активности неспецифических дегидрогеназ — в 2,5-3,0 раза по сравнению с фазой адаптации. Очевидно, что такие изменения в составе фракций белка обусловлены интенсивным синтезом специфических ферментов в фазе лог-роста и на переходе стационарной фазе. На всем протяжении стационарной фазы и до фазы заката экосистемы количество белка в трех фракциях оставалось на уровне количества фазы лог-роста. В таблице 1 представлены данные о фракционном составе белков микросообществ модельной гидроэкосистемы при имитации залповых сбросов сточных вод нефтехимических производств, их компонентов и соединений Pb, Zn.
Таблица 1. Фракционный состав белков микросообществ модельных гидроэкосистем
|
Сточные воды, компоненты |
Биомасса: сточная вода; концентрация мг/ г биомассы |
Контроль |
Опыт |
||
|
общий белок, % |
количество фракций белка |
общий белок, % |
количество фракций белка |
||
|
сточные воды НПЗ |
1:10 |
8,32 |
3 |
8,12 |
- |
|
производство СЖК |
1:20 |
7,31 |
3 |
8,05 |
- |
|
производство АСП |
1:20 |
7,31 |
3 |
7,10 |
2 |
|
производство карбамида |
1:20 |
7,31 |
3 |
7,60 |
- |
|
СМС «Прогресс» |
50,0 |
7,62 |
3 |
7,63 |
3 |
|
100,0 |
7,62 |
3 |
7,92 |
1 |
|
|
150,0 |
7,62 |
3 |
7,56 |
- |
|
|
углеводороды |
150,0 |
8,32 |
3 |
8,16 |
1 |
|
диизобутил-п-крезол |
200,0 |
8,32 |
3 |
7,85 |
3 |
|
гидрохинон |
18,0 |
6,18 |
3 |
6,30 |
2 |
|
о-крезол |
100,0 |
6,18 |
3 |
6,05 |
2 |
|
фенол |
100,0 |
6,18 |
3 |
6,25 |
2 |
|
диизобутил-п-крезол + СМС «Прогресс» |
200,0+150,0 |
8,32 |
3 |
8,00 |
1 |
|
свинца ацетат |
11,0-19,0 |
6,92 |
3 |
6,54 |
- |
|
цинка ацетат |
18,0-32,0 |
6,92 |
3 |
7,00 |
- |
Примечание: НПЗ — нефтеперерабатывающий завод; СЖК — синтетические жирные кислоты; АСП — алкилсалицилатные присадки
Действие синтетического моющего средства «Прогресс» в интервале концентраций 50,0-150,0 мг/г биомассы вызывало «уход» всех трех фракций белка с электрофореграмм, при этом общее количество белка сохранялось на одинаковом уровне. Аналогичные результаты были получены при имитации залповых сбросов сточных вод цехов производства синтетических жирных кислот и карбамида. Действие солей металлов: свинца и цинка нитрата в концентрациях 11,019,0 и 18,0-32,0 мг/г биомассы соответственно при экспозиции 60 мин вызывало эффект «ухода» белковых фракций с электрофореграмм.
Аэробная стабилизация гидроэкосистемы в течение 24-72 ч после мощного действия токсичных соединений сопровождалась выявлением на электрофореграммах до семи фракций белка с молекулярной массой от 5000 до 20000. Полученные данные подтверждают выводы других авторов о синтезе низкомолекулярных белков в ответ на действие стрессовых концентраций токсикантов.
Представляются интересными качественные и количественные изменения белковых фракций при воздействии на модельную гидроэкосистему диизобутил-п-крезола, который является пищевым и техническим антиоксидантом. Экспозиция 1 час с вышеуказанным соединением приводила к увеличению количества белка во всех фракциях до 40% по сравнению с контролем. Совместное действие диизобутил-п-крезола с СМС «Прогресс» в концентрации 150,0 мг/г биомассы не вызывало уменьшения количества общего белка, однако обнаруживалась только одна белковая фракция.
С увеличением концентрации токсичных компонентов в гидроэкосистемах белки гидробионтов постепенно теряют способность фиксировать специфические красители, что является следствием глубоких изменений структуры белка, величины заряда. Эти данные могут быть положены в основу метода биотестирования токсичности сточных вод промышленных производств.
В фазе адаптации модельных гидроэкосистем активного ила Гл-6-ФД представлена четырьмя активными зонами, причем в третьей зоне выявлено две МФ. В начале фазы лог-роста установлено пять активных зон фермента, при этом количество МФ возрастает с пяти до девяти со следующим распределением по зонам: первая зона — две МФ, вторая — одна, третья — три, четвертая — две и пятая зона активности — одна МФ. В стационарной фазе число МФ составляет семь и остается без изменения вплоть до фазы отмирания (рис. 1).
В водной среде моделей экосистем в фазе адаптации Гл-6-ФД не обнаруживается. В начале фазы лог-роста и до фазы замедленного роста выявлено до семи экзогенных зон вышеуказанного фермента. Наиболее выражена активность низкомолекулярных форм. К стационарной фазе число экзогенных МФ фермента уменьшается до шести, а в конце стационарной фазы выявлено только три МФ Гл-6-ФД. По электрофоретической подвижности экзогенные МФ Гл-6-ФД соответствуют значениям электрофоретической подвижности эндоферментов. Необходимо отметить, что в водной среде на протяжении всего цикла развития экосистемы не выявлена пятая зона активности.
Полученные данные подтверждают наличие пентозофосфатного пути окисления гексоз в моделях микросообществ гидроэкосистем, интенсивность которого возрастает по мере развития экосистемы до стационарной фазы. Изофермент-ный профиль Гл-6-ФД, изменение его гетерогенности и выявление в фазе лог-роста дополнительной зоны активности позволяют предположить наличие механизмов «тонкой» регуляции пентозофосфатного цикла, осуществляемых наиболее динамичными в развивающейся экосистеме низкомолекулярными формами фермента. Максимальная гетерогенность Гл-6-ФД наблюдается в фазе лог-роста. Это может быть объяснено нарастанием разнообразия метаболитов в данной фазе, достижением гомеостаза экосистемы и подготовкой к ее стабилизации.
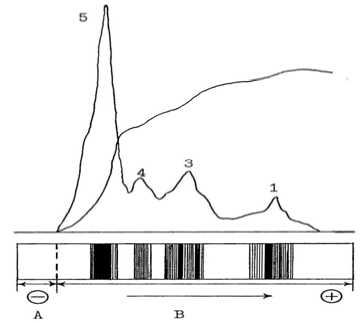
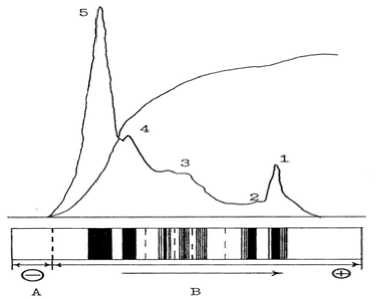
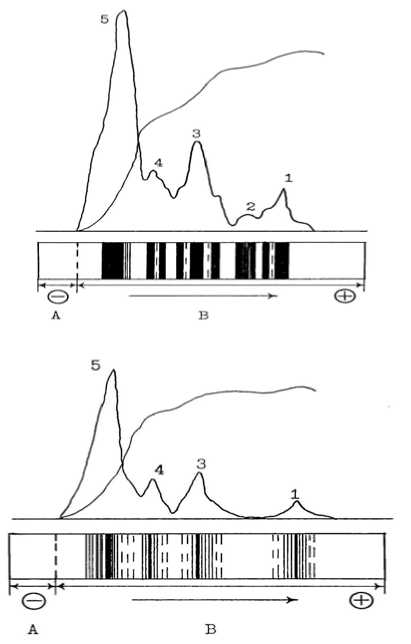
Рис. 1. Электрофореграммы МФ ГЛ-6-ФД микросообществ модельных гидроэкосистем по фазам развития. Слева направо: фаза адаптации, фаза лог-роста, стационарная фаза, фаза отмирания.
А — концентрирующий гель; В — разделяющий гель; 1-5 — зоны активности
Небезынтересен факт выявления низкомолекулярных форм фермента в водной среде. Наибольшее их число и максимальная активность установлены в фазе лог-роста, затем с развитием экосистемы и переходом в стационарную фазу, активность снижается, также уменьшается и количество экзогенных МФ. Пока преждевременно утверждать истинные ли это экзогенные формы или результат автолиза клеток. Однако отсутствие в водной среде высокомолекулярной формы
Гл-6-ФД-5 позволяет предположить первое. К тому же пик активности МФ ферментов приходится на фазу лог-роста, в которой клетки практически не подвергаются автолизу.
Одним из основных механизмов адаптации гидробионтов к действию стрессоров может быть избирательный синтез МФ ключевых ферментов метаболизма. Наши исследования полностью подтверждают указанный механизм. Моделирование залповых сбросов сточных вод НПЗ и их компонентов приводило к частичному или полному блокированию пентозофосфатного цикла. Реанимация и аэробная стабилизация в течение 24-72 ч сопровождалась синтезом множества низкомолекулярных активных фракций фермента. Наиболее вероятной стрессовой ситуацией для гидроэкосистем является внезапное уменьшение концентрации кислорода в водной среде. Серия экспериментов по установлению изменения гетерогенности МФ Гл-6-ФД в условиях лимитирования экосистемы кислородом показала следующее (табл. 2).
Полученные данные однозначно указывают на увеличение гетерогенности МФ Гл-6-ФД микросообществ гидроэкосистем в условиях лимитирования кислородом, причем, увеличение числа МФ фермента достигается за счет низкомолекулярных форм. Отмечено некоторое снижение относительной активности Гл-6-ФД-4 и Гл-6-ФД-5 по сравнению с контролем при одновременном увеличении таковой у низкомолекулярных форм в первые 3-4 ч после прекращения аэрации. Такое изменение соотношения активности МФ фермента в целом не приводит к снижению эффективности пентозофосфатного цикла. Далее с уменьшением содержания кислорода в экосистеме активность МФ Гл-6-ФД уменьшается, заметны деструктивные процессы в составе зон фермента.
Таблица 2. МФ Гл-6-ФД по фазам развития в условиях лимитирования гидроэкосистемы кислородом
|
Фазы развития |
Количество МФ в зонах активности |
|||||
|
Гл-6-ФД-1 |
Гл-6-ФД-2 |
Гл-6-ФД-3 |
Гл-6-ФД-4 |
Гл-6-ФД-5 |
||
|
адаптация |
контроль |
1 |
- |
2 |
1 |
1 |
|
опыт |
1 |
2 |
2 |
1 |
1 |
|
|
лог-рост |
контроль |
2 |
1 |
3 |
2 |
1 |
|
опыт |
2 |
2 |
3 |
2 |
1 |
|
|
стабилизация |
контроль |
1 |
1 |
3 |
1 |
1 |
|
опыт |
3 |
3 |
3 |
1 |
1 |
|
СДГ в фазе адаптации модельных гидроэкосистем представлена в составе шести МФ, основная активность фермента локализована в зонах СДГ-2 и СДГ-6. Переход экоситемы в фазу лог-роста сопровождается увеличением числа МФ до семи, также выявляется минорная МФ в области СДГ-6. С переходом в стационарную фазу активность минорной флормы становится незначительной и число МФ становится равным шести. Следует отметить значительные изменения в активности МФ с переходом в стационарную фазу — двухкратное увеличение активности в СДГ-2 и уменьшение таковой в зоне СДГ-6
более чем в 2,5 раза. В стационарной фазе и фазе заката экосистемы активность СДГ-6 достигала уровня активности в фазе адаптации и лог-роста.
Установлены резкие изменения в активности низкомолекулярных форм фермента к завершению стационарной фазы: десятикратная инактивация СДГ-2 и увеличение активности в зонах СДГ-3 и СДГ-4 в 2-3,5 раза. В фазе отмирания вся активность локализуется в области СДГ-3 и СДГ-4 — относительная активность составляет 26,76 и 65,69% соответственно; а число МФ уменьшается до пяти (табл. 3).
Таблица 3. Состав и активность МФ СДГ модельных гидроэкосистем по фазам развития
|
Адаптация |
Лог-рост |
Стационарная |
Отмирание |
||||||||
|
МФ |
ОЭП |
ОА,% |
МФ |
ОЭП |
ОА,% |
МФ |
ОЭП |
ОА,% |
МФ |
ОЭП |
О А, % |
|
1 |
0,95 |
6,26 |
1 |
0,96 |
7,80 |
1 |
0,96 |
8,08 |
1 |
0,98 |
1,67 |
|
2 |
0,93 |
26,35 |
2 |
0,92 |
38,87 |
2 |
0,89 |
3,10 |
2 |
0,93 |
2,68 |
|
3 |
0,62 |
6,03 |
3 |
0,61 |
9,22 |
3 |
0,60 |
10,64 |
3 |
0,59 |
26,76 |
|
4 |
0,51 |
5,52 |
4 |
0,48 |
5,47 |
4 |
0,47 |
14,85 |
4 |
0,36 |
65,69 |
|
5 |
0,38 |
8,59 |
5 |
0,36 |
5,95 |
5 |
0,41 |
7,16 |
5 |
- |
- |
|
6 |
0,22 |
47,25 |
6 |
0,21 |
31,18 |
6 |
0,26 |
58,85 |
6 |
- |
- |
|
7 |
- |
7 |
0,10 |
1,52 |
7 |
- |
7 |
0,12 |
3,21 |
||
Примечание: ОЭП — относительная электрофоретическая подвижность; ОА — относительная активность
Полученные данные подтверждают наличие цикла трикарбоновых кислот (ЦТК) и электрон-транспортной цепи (ЭТЦ) в микросообществах активного ила модельных гидроэкосистем, интенсивность которых возрастает по мере развития последних. Изоферментный профиль, изменение гетерогенности и активности МФ позволяют предположить наличие тонких механизмов регуляции данных обменных циклов. Максимальная гетерогенность СДГ установлена в фазе лог-роста и на переходе в стационарную фазу, что может быть объяснено нарастанием разнообразия метаболитов в этих фазах, достижением гомеостаза и подготовкой экосистемы к стабилизации.
В водной среде моделей экосистем фермент не обнаружен в фазах адаптации и лог-роста, в стационарной фазе выявлены зоны активности в области СДГ-2 и СДГ-3. В фазе отмирания выявлена одна зона активности в СДГ-2. Выявление в водной среде МФ СДГ может быть объяснено или автолизом клеток микросообщества экосистемы или транспортом низкомолекулярных форм фермента через клеточную стенку.
Отсутствие высокомолекулярных форм СДГ в водной среде на всех фазах развития позволяет предположить второе.
В сериях экспериментов по моделированию залповых сбросов сточных вод нефтеперерабатывающего производства, а также солей свинца полностью подтвердили механизм адаптации микросообществ гидроэкосистем — синтез стрес-сзависимых белков. Моделирование залповых сбросов сточных вод приводило к частичному или полному блокированию ЦТК и ЭТЦ. Реанимация и аэробная стабилизация гидроэкосистем в течение 24-72 ч сопровождалась синтезом множества низкомолекулярных форм СДГ. Моделирование залпового сброса сточных вод, содержащих свинца ацетат в концентрации 3-5 мг/г биомассы приводило к блокированию ЦТК. Реанимация и аэробная стабилизация гидроэкосистемы в течение 48 ч сопровождалось синтезом множества МФ СДГ, однако исходная эффективность ЦТК не была восстановлена. Действие фенола в концентрации 20 мг/г биомассы приводило почти к 2-х-кратной активации фермента. Установленный факт может объясняться дегидрированием фенола в аэробных условиях и образованием п-бензохинона, являющегося акцептором электронов в реакции окисления сукцината. Лимитирование экосистем кислородом приводило к частичной деструкции фракций фермента, значительному снижению активности высокомолекулярных форм СДГ и в целом к снижению эффективности ЦТК.
Список литературы Фракционный состав белков и молекулярные формы некоторых дегидрогеназ микросообществ модельных гидроэкосистем
- Руднева, И.И. Антропогенное изменение белкового состава у морских организмов//Доклады АН СССР. -1983. -271, № 2. -С. 502-505.
- Кудрявцева, Г.В. Эколого-физиологические особенности и роль пентозофосфатного пути обмена углеводов в адаптациях гидробионтов. -Дисс. на соиск. уч. степ. д. биол. н.//Ленинград. -1989. -385 c.
- Белобров, П.И. Изучение взаимодействия ферментов в системе: гексокиназа-глюкозо-6-фосфат-дегидрогеназа-оксиредуктаза-люцифераза/П.И. Белобров, В.А. Воеводин, В.А. Кратасюк//Люминесцентный анализ в медико-биологических исследованиях. -Рига, 1986. -С. 72-77.
- Загурский, А.А. Механизм постсинтетической модификации глюкозо-6-фосфатдегидрогеназы в клет-ках человека, культивируемых in vitro.//Биохимия. -1983. -48, №12. -C. 1970-1976.
- Anderson, A.Y. Regulation of glucose-6-phosphatedehydrogenase in Zymomonas mobilis CP 4/A.Y. Anderson, E.A. Dawes//FEMS Microbiol. Lett. -2005. -27, № 1. -p. 23-27.
- Шаталаев, И.Ф. Молекулярные формы малатдегидрогеназы активного ила в процессе очистки сточных вод на городских станциях аэрации./И.Ф. Шаталаев, М.М. Телитченко//Химия и технология воды. -1992. -Т. 14, №9. -С. 132-138.


