Фундаментальные аспекты биохимии селена и селенопротеинов: прикладное значение в онкологии
Автор: Станоевич И.В., Хвостовой В.В., Петроченко Д.В., Саламатина А.Ю., Иоутси В.А., Фурман Ю.В., Лысоволенко Н.Л., Ермилов И.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 т.23, 2024 года.
Бесплатный доступ
Цель исследования - провести систематический анализ данных, имеющихся в современной литературе об эссенциальности селена в биологических системах и значении селенопротеинов в онкогенезе. Материал и методы. При подготовке обзора проведен поиск публикаций в информационных базах Scopus (415), PubMed (521), Web of Science (139), eLibrary.ru (240). Для получения полнотекстовых документов использованы электронные ресурсы PubMed Central (PMC), Science Direct, Research Gate, eLibrary.ru.
Селен, селенопротеины, онкогенез, опухоль, химиотерапия
Короткий адрес: https://sciup.org/140307914
IDR: 140307914 | УДК: 616-006:577.112 | DOI: 10.21294/1814-4861-2024-23-5-157-169
Текст обзорной статьи Фундаментальные аспекты биохимии селена и селенопротеинов: прикладное значение в онкологии
Представления о роли селена (34Se) в живых системах после его открытия в 1817 г. шведским химиком Й.Я. Берцелиусом претерпели кардинальные изменения: от рассмотрения данного микроэлемента как исключительно токсичного до осознания его незаменимой роли в ключевых гомеостатических механизмах млекопитающих [1]. Se входит в активные центры ряда ферментов, структурных и транспортных белков представителей различных видов одноклеточных и многоклеточных организмов. Несмотря на широкий спектр оказываемых эффектов – от антиоксидантных до противовоспалительных свойств (особенно семейства глутатионпероксидаз (GPxs) и тиоредоксинредуктаз (TrxR), – функция некоторых селенопротеинов продолжает уточняться. В настоящее время уже проведено большое количество исследований, посвященных вопросам взаимосвязи Se, селенопротеинов и различных заболеваний, в том числе онкологических, однако результаты их неоднозначны. Мнения исследователей относительно влияния концентрации Se в организме на риск развития и смертность от злокачественных опухолей в зависимости от локализации, его роли в профилактике рака и модуляции токсических эффектов противоопухолевого лечения значительно расходятся, включая обратные, прямые ассоциации, а также их отсутствие. Однако большинство экспертов согласны с необходимостью инициации дальнейших эпидемиологических исследований с целью разрешения спорных вопросов и минимизации ограничений уже полученных данных. Таким образом, не вызывает сомнений значение органических и неорганических соединений Se в онкогенезе как типовом свойстве многоклеточных живых систем [2], причем негативные последствия может иметь как субоптимальное, так и избыточное его поступление.
Селенопротеины возможно условно подразделить на три группы: первая группа – содержащие Se в составе селеноцистеина (Sec), вторая группа – белки, в которых Se ошибочно заменил серу в сульфогруппе ввиду схожести их химических свойств, и третья группа – белки с не установленным точно механизмом присоединения Se – селеносвязывающий протеин 1-го типа (SBP1), содержащий химическую связь Se-S в 57 позиции цистеина [3, 4].
Имеющийся на данный момент объем знаний в различных фундаментальных и прикладных науках заставляет еще раз обратиться к анализу накопленных данных для выбора наиболее перспективных аспектов изучения Se и селенопротеинов в онкологии.
Распространение селена в неживой природе. Поступление селена в живые системы. Субоптимальное потребление селена у жителей России
Концентрация Se в продуктах питания и воде определяется геохимическими особенностями региона и антропогенными факторами, связанными с использованием минеральных удобрений и кормовых добавок в сельском хозяйстве, поступлением неорганического Se в окружающую среду при добыче серы и медной руды. Среднее содержание Se в земной коре и мировом океане неравномерное, что обусловливает существование селенодефицитных регионов [5]. Основные черты гео- и биохимии рассматриваемого халькогена определяются близостью его ионного радиуса к ионному радиусу серы.
Бо́льшая часть территории России характеризуется субоптимальным природным содержанием селена в почве и воде, а ряд областей – крайне низким, что в совокупности с его низкой биодоступностью для растений на кислых и болотистых почвах приводит к высокой распространенности недостаточности (до 80 % ) данного микроэлемента среди населения нашей страны. Среднее потребление селена в России составляет 15–130 мкг/сут, что реализуется в средней концентрации в сыворотке крови 67–106 мкг/л [6]. Другими причинами, приводящими к недостатку Se в организме, могут быть названы заболевания печени, дисбиоз желудочно-кишечного тракта, интоксикация органическими веществами, мышьяком, металлами, полное парентеральное питание или по-лусинтетические диеты, не содержащие природных белков, а также однообразное питание [7, 8].
Клинические проявления недостаточности поступления (Se) (восприимчивость к инфекционным заболеваниям, признаки кардиомиопатии, мышечная слабость, эндокринные расстройства, снижение фертильности) зависят от ее степени и сочетания с дефицитом других микроэлементов, а также от генетических особенностей индивида. Недостаточность Se устанавливается при снижении его концентрации в сыворотке крови ниже 60 мкг/л [9, 10].
Номенклатура и краткая функциональная характеристика селенопротеинов
Значительный интерес исследователей к изучению различных аспектов биохимии, молекулярной биологии, эволюционной генетики белковых соединений Se привел к разработке и утверждению Номенклатуры генов селеносодержащих белков [11]. Селенопротеины с установленной ферментативной активностью называются соответственно катализируемым реакциям: тиоредоксинредуктаза (TXNRD) 1, 2 и 3-го типа; глутатионпероксидаза (GPX) 1, 2, 3, 4 и 6-го типа; дейодиназа (DIO) 1, 2 и 3-го типа; метионин сульфоксидредуктаза В1 (MSRB1); селенофосфатсинтетаза 2-го типа (SPHS2). Селенопротеины с не уточненными функциями в соответствии с утвержденной унифицированной номенклатурой имеют буквенное обозначение, которое следует за обобщающим термином SELENO (Sel) [12]. Краткая функциональная характеристика селенопротеинов человека представлена на рис. 1.
Основная функция селена в животных клетках
Синтез cеленоцистеина
В настоящее время основной ролью Se в животном мире рассматривается его участие в поддержании редокс-статуса клеток в составе неклассической аминокислоты селеноцистеина (Sec) – важной структурной единицы активного центра оксидоредуктаз, а также тиреоидного статуса за счет тканевого метаболизма тироксина под действием селеносодержащих дейодиназ [13]. Se в составе GPX выступает синергистом витамина Е по ограничению окисления липидов. Исследования на животных показывают, что Se и витамин Е, как правило, взаимно дополняют друг друга, так что селен может предотвратить некоторые повреждения, вызванные дефицитом витамина Е, в моделях окислительного стресса [14, 15]. Кроме того, TRXRD поддерживают антиоксидантную функцию витамина С за счет активизации его регенерации из окисленной формы – дегидроа-скорбиновой кислоты [16].
В обычных условиях основным источником Se для человека и травоядных является растительная пища. Растения аккумулируют Se из почвы и, в отличие от животных, способны синтезировать селенометионин (SelMet), который, поступая в организм человека, включается в синтез белков при трансляции тРНК на рибосомах [1].
Синтез Sec de novo у животных приобретает большое значение и подразумевает строгую специфичность его встраивания в пептидную цепочку будущего зрелого белка. Sec кодируется стоп-кодоном UGA, а его «прочтение» как «селеноцистеина» обеспечивается SECIS-элементом (Selenocystein insertion sequence) мРНК, локализованным у эукариот в 3'-нетранслируемой области мРНК [17].
К еще одним облигатным факторам биосинтеза селенопротеинов относятся селеноцистеин-тРНК[Ser]Sec (Sec-тРНК[Ser]Sec), Sec-специфичный фактор элонгации (EFsec) и Sec-связывающий белок 2-го типа (SBP2). Биомолекулярных участников сложной цепочки синтеза селенопротеинов возможно рассматривать в качестве потенциальных мишеней противоопухолевой терапии или преодоления ее токсичности ввиду чрезвычайно высокой метаболической активности опухолевых клеток по
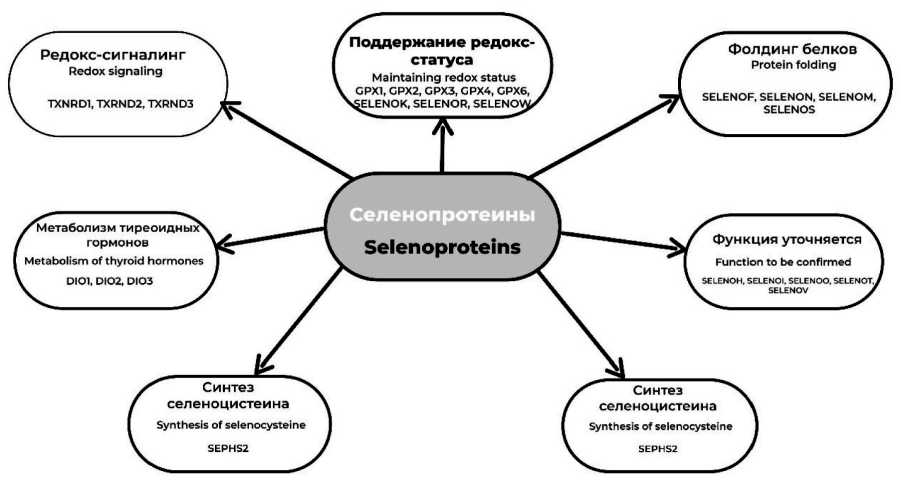
Рис. 1. Селенопротеины человека (по W.B. Minich, 2022) [5]. Примечание: рисунок выполнен авторами Fig. 1. Human selenoproteins (according to W.B. Minich, 2022) [5]. Note: created by the authors
мере увеличения пролиферации, что закономерно приводит к активации перекисного окисления липидов и необходимости постоянного эффективного преодоления окислительного стресса, который может как усиливать онкогенез из-за нестабильности генома и мутаций, так и индуцировать, в конечном счете, гибель опухолевых клеток при избыточном накоплении продуктов окисления [17].
Химические свойства селена как основа его эссенциальности в биологических системах. Механизмы всасывания, транспорта и выведения
Se – микроэлемент со свойствами неметалла и металла, относящийся к группе халькогенов; в зависимости от внешних условий легко изменяющий аллотропные модификации, весьма реакционноспособный и проявляющий преимущественно степени окисления (-2), + 4, + 6. Данные химические особенности Se определяют его двоякое биологическое действие: выраженные токсические свойства его соединений даже в умеренных концентрациях и эссенциальность для значительного количества биохимических реакций ввиду вхождения в активные центры специализированных ферментов [18].
Всасывание Se происходит преимущественно в верхних отделах тонкой кишки, причем механизм всасывания его органических и неорганических соединений различается: так, селеносодержащие аминокислоты абсорбируются с помощью Na+ – зависимого канала, селенаты – через Na+/K+/ Cl- -зависимый, а селениты – путем пассивной диффузии. Под действием тиоредоксина поступающие с пищей селенат- и селенит-анионы быстро восстанавливаются до селеноводорода. Необходимым кофактором данного процесса является восстановленный глутатион, возможно, в виде селенодиглутатиона [19]. Небольшой пул селеноводорода связывается со специфическим селен-связывающим белком, а несвязанный – медленно подвергается ферментативному метилированию с образованием метанселенола, диметилселенида и катиона триметилселенония [5]. Данные соединения Se экскретируются с мочой, а диметилселенид – в больших количествах также и с потом. Строго определенное количество Se, входящего в состав пула селеноводорода, через стадию селенофосфата включается в высокоспецифический процесс синтеза селенопротеинов. При избыточном поступлении в организм в форме неорганических соединений Se в форме свободного гидроселенид аниона кумулируется в тканях, оказывая выраженное токсическое действие [20].
Основным транспортным белком Se служит SelP плазмы крови, который секретируется печенью и составляет около 80 % селена плазмы. Его средняя концентрация колеблется около 5,6 мг/л. В качестве рецепторов SelP в тканях выступает рецептор аполипопротеина Е (АРО-Е), экспрессируемый преимущественно в клетках центральной нервной системы и яичках, а также мегалин (также рецептор липопротеинов), обнаруженный в проксимальных почечных канальцах. В эксперименте на мегалин-нокаутированных мышах показана его функция – предотвращение потери Se с мочой [21]. Транспорт Se возможен и с помощью малых молекул, однако в подобном случае он носит неселективный характер. Экспрессия SelP подавляется инсулином через PI3K/Akt/FoxO1a – сигнальный путь, в то время как глюкокортикоиды повышают его экспрессию посредством активации PGC-1α [22]. Описанные особенности экспрессии SelP служат одним из объяснений связи между нарушением толерантности к глюкозе, гиперинсулинемией и повышением концентрации основной транспортной молекулы Se в крови, а также повышенным риском сахарного диабета 2-го типа при назначении добавок Se [23].
Роль оптимального потребления селена в профилактике злокачественных новообразований
Генетический полиморфизм селенопротеинов, пол, особенности пищевого поведения и регион проживания показали связь с риском онкогенеза [24]. Индивиды с аллельными вариантами определенных селенопротеинов, таких как SelP, SelF, GPХ4 и GPХ1 и др., на фоне субоптимального потребления Se с пищей демонстрируют повышенный риск развития злокачественных новообразований. В качестве основных механизмов действия Se, тормозящих онкогенез, рассматривались эпигенетические механизмы, блокада клеточного цикла, стимуляция апоптоза, повышение активности GPХ и TRХRD, модуляция ответа на повреждение эндоплазматического ретикулума, стимуляция репарации ДНК, участие в основных процессах онтогенеза и иммунного ответа [3, 14, 16, 25–30]. Механизмы эпигенетической регуляции экспрессии генов с участием Se включают метилирование ДНК, посттрансляционные модификации гистонов и регуляцию синтеза малых некодирующих РНК. Se оказывает свой эпигенетический эффект через метионин-гомоцистеиновый цикл, зависящий от потребления фолатов и цианкобаламина [18].
По данным метаанализа А. Kuria et al. (2020), регулярное потребление Se в дозе более 55 мкг в день уменьшает риск злокачественных новообразований (ОР=0,94; 95 % ДИ 0,90–0,98). Селеносодер- жащие пищевые добавки оказывают протективный эффект в дозе не ниже 55 мкг в день (ОР=0,89; 95 % ДИ 0,82–0,97). Обнаружена обратная нелинейная связь (уровень значимости р=0,020) между потреблением Se и общим онкологическим риском с поправкой на возраст, индекс массы тела, курение, что свидетельствует о неодинаковой силе защитного эффекта для различных типов неоплазий [31].
По данным зонтичного обзора метаанализов P. Wang et al. (2023), направленного на оценку уровня достоверности, валидности, предвзятости исследований по оценке связи между уровнем потребления Se и исходами, связанными со здоровьем, большинство исследований классифицированы как низкой степени доказательности. По результатам исследования, добавки Se не рекомендованы к использованию в общей популяции и у лиц, чей селеновый статус уже достиг нормативных показателей. Таким образом, становится очевидным клинический вывод о необходимости исследования селенового статуса у групп риска, например, у пациентов онкологического профиля с диагностированной нутриционной недостаточностью [9].
При субоптимальном поступлении Se доставляется в клетки центральной нервной системы, эндокринных органов, гонад и направляется на синтез строго определенных селенопротеинов (например, GPX4, TRXRD1, SelW и SelT) за счет подавления трансляции мРНК другим фактором eIF4a3 [5, 32]. Концентрация Se в сыворотке крови ниже 45 мкг/л считается предрасполагающим фактором развития неоплазий, а селенизация продуктов питания рассматривается как важный элемент первичной профилактики [33–36]. Примером популяционной профилактики злокачественных новообразований на государственном уровне является законодательно введенная в Финляндии в 1984 г. селенизация хлебобулочных изделий [5].
Se проявляет свой химиопрофилактический эффект в основном благодаря селенопротеинам GPXs, TRXRs и SelP, предотвращая окислительный мутагенный стресс ДНК и обеспечивая безошибочный фолдинг белков [37]. Однако, с другой стороны, обнаружена способность GPX2 поддерживать пролиферацию и метастазирование опухоли [38]. Подобная способность обнаружена и у SelH как in vitro , так и in vivo . SelH в своем составе имеет ДНК-связывающий домен и избирательно стимулирует экспрессию генов синтеза глутатиона и ферментов II фазы детоксикации. Его экспрессия чувствительна к уровню потребления Se, а также повышается при увеличении концентрации меди. SelH отводится регуляторная роль в ответе на изменения редокс-статуса [39].
В 1966 г. R.J Shamberger, G. Rudolph показали, что селенид натрия значительно уменьшает частоту развития индуцированного рака кожи у мышей [40]. На мышиной модели развития рака пищевода китайские исследователи пришли к заключению, что положительный эффект Se при данной неоплазии связан со стимулированием апоптоза, ингибированием пролиферации клеток, предотвращением окислительного стресса и уменьшением количества воспалительных Т-клеток (CD45, CD4, CD8). Впервые показано, что Se замедляет прогрессирование рака пищевода за счет уменьшения воспаления и окислительного повреждения ДНК [41].
Крупное многоцентровое слепое плацебо-контролируемое исследование L.C. Clark et at. (1996), посвященное изучению роли добавок Se в профилактике рака кожи и включившее 1 312 пациентов с немеланомными опухолями, выявило, что назначение 200 мкг Se в сут не снижает риск развития базальноклеточного (ОР=1,10; 95 % ДИ 0,95–1,28) и плоскоклеточного рака (ОР=1,14; 95 % ДИ 0,93–1,39), однако снижает общую смертность (ОР=0,83; 95 % ДИ 0,63–1,08), смертность от злокачественных новообразований (ОР=0,5; 95 % ДИ 0,31–0,80), общую онкологическую заболеваемость (ОР=0,63; 95 % ДИ 0,47–0,85), а также заболеваемость раком легких, предстательной железы и толстой кишки [41].
Польское исследование, проведенное в группе из 671 пациента с колоректальным раком, обнаружило снижение риска смерти от аденокарциномы толстой кишки в группе с более высоким потреблением Se с пищей (≥48,8 мкг/день, среднее значение для группы – 63,9 мкг/день) по сравнению с более низким потреблением Se с пищей (<48,8 мкг/день, среднее значение – 38,5 мкг/день) (ОР=0,73; 95 % ДИ 0,54–0,98) [35].
Недавний метаанализ 18 исследований случай-контроль, включивший 3 374 больных раком молочных желез и 3 582 здоровые женщины, показал, что концентрация Se в тканях отрицательно коррелировала с риском рака молочных желез [43]. В этом контексте исследование, посвященное раку молочных желез при сопутствующем ожирении, показало, что сниженный уровень селенопротеинов в жировой ткани приводил к развитию и поддержанию провоспалительной реакции, ассоциированной с промоцией онкогенеза [44].
После предварительного определения средних сывороточных концентраций Se, меди методом масс-спектрометрии с индуктивно связанной плазмой и их соотношения у 480 здоровых представителей польской популяции исследователи сравнили данные показатели у 100 пациентов с раком поджелудочной железы и 100 здоровых лиц, проживающих в одном регионе. Ввиду полученных различий в средних показателях содержания Se, меди и их соотношения между группами (снижение Se и повышение меди) авторы пришли к заключению об участии данных микроэлементов в патогенезе рака поджелудочной железы. Получены данные, свидетельствующие о положительном влиянии более высоких концентраций Se в сыворотке крови на выживаемость [33]. Метаанализ китайских ученых, включивший 1 424 больных, показал снижение риска развития аденокарциномы поджелудочной железы при более высоком потреблении Se по сравнению с недостаточным (6 исследований, n=1 424; ОР=0,659; 95 % ДИ 0,489–0,889) [45]. Помимо этого, более высокие уровни Se оказались защитными для протоковой аденокарциномы поджелудочной железы как с «диким», так и мутантным геном KRAS [46].
В исследовании «случай-контроль», включившем 306 женщин (153 больных раком эндометрия и 153 здоровых), обнаружены более низкие концентрации Se в основной группе, чем в контрольной (60,63 vs 78,74 мкг/л соответственно). Авторы предлагают использовать оценку сывороточной концентрации Se для формирования групп риска по раку эндометрия с проведением соответствующих диагностических мероприятий [47].
Таким образом, на данный момент нет единого мнения и достоверных данных о необходимости назначения добавок селена даже при его выявленном низком содержании в крови. В то же время его нормальные или даже повышенные значения за счет SelP не говорят об отсутствии органного дефицита. Требуется проведение дополнительных исследований с учетом полиморфизмов селенопротеинов, энзимов антиоксидантной системы, а также в совокупности других микроэлементов, участвующих в клеточной защите от окислительного стресса, и целого ряда других факторов для решения вопроса о роли Se в профилактике рака и его влиянии на прогноз онкологических заболеваний.
Тканевая и субклеточная специфичность селенопротеинов и их роль в онкогенезе Наряду с SelP еще одним плазменным селенопротеином является GPX3, продуцируемая клетками проксимальных собирательных канальцев нефрона. Подавление экспрессии GPX3 наблюдается при многих злокачественных новообразованиях [1]. В отличие от GPX3 GPX1, 2 и 4 являются клеточными глутатионпероксидазами. На мышиных моделях показано, что выключение экспрессии GPX1 приводит к повышенной чувствительности печени и легких к оксидативному стрессу [48]. Другое исследование показало вовлеченность GPX1 в активацию аутофагии в клетках протоковой аденокарциномы поджелудочной железы на фоне субстратной гипоксии [49]. Синтез GPX2 повы- шен при колоректальном раке (КРР), пищеводе Барретта, клетках плоскоклеточного рака in vitro, аденокарциноме легких у курильщиков [1]. Мышиные модели с совместным подавлением экспрессии генов GPX1 и GPX2 используются для изучения спонтанного колита и ассоциированного с ним канцерогенеза [48]. GPX4 может быть представлена одной из трех изоформ: цитоплазматической, митохондриальной и ядерной (в сперматозоидах) и обеспечивает защиту липидных мембран от перекисного окисления, а также выступает в качестве структурного белка мужских половых клеток.
Основная функция TXNRD – восстановление окисленного тиоредоксина, однако данная группа ферментов может использовать в качестве субстрата перекись водорода, селиниты, липоевую и аскорбиновую кислоту, убихинон.
SelF выступает в качестве сигнального пептида эндоплазматического ретикулума (ЭПР). Данные по изменению данного селенопротеина в опухолях различной локализации носят неоднозначный характер: так, гепатоцеллюлярный рак и рак предстательной железы характеризуются снижением его экспрессии, обратные данные получены при КРР. Более того, целенаправленное подавление его экспрессии в клетках аденокарциномы толстой кишки приводило к угнетению опухолевого роста [1].
К селенопротеинам ЭПР также относят SelS, SelК и SelN. Функция SelS детально не установлена, однако описана его преимущественная экспрессия в клетках иммунной системы. SelN, наряду с SelW и SelV, участвует в антиоксидантной защите мышечных клеток. У SelK in vitro обнаружено свойство подавлять клетки хорионкарциномы человека благодаря негативной регуляции экспрессии β-субъединицы хорионического гонадотропина, что позволяет рассматривать данный селенопротеин в качестве перспективной молекулярной мишени при данной неоплазии [50].
Важными селеносодержащими белками являются SBP1 и SBP2. SBP2 выступает как элемент собственно биосинтеза и ауторегуляции синтеза селенопротеинов. Обнаружено, что селен в составе SBP1 обеспечивает его взаимодействие с ферментом VDU1, регулирующим убиквитинизацию-деубиквитинизацию белков, необходимую для их протеосомной деградации и детоксикации. Обнаружены реципрокная связь между экспрессией SBP1 и ферментативной активностью GPX1 в HCT116-клеточной линии колоректального рака, человеческих клетках печени и простаты, что указывает на их непосредственное химическое взаимодействие [3]. Сниженная экспрессия SBP1 ассоциирована с ухудшением показателей выживаемости больных. Некоторые авторы предлагают использовать количественную оценку белка SBP1 как предиктивный и прогностический маркер опухолевого роста и прогрессирования [51, 52]. Исследование китайских ученых осветило роль
SBP1 в управлении микроокружением клеток через регуляцию концентрации внеклеточного глутатиона. Выключение SBP1 с помощью микроРНК приводило к увеличению чувствительности к Se через повышение внеклеточной концентрации глутатиона, который обеспечивал захват и высокоаффинный транспорт Se. В исследовании продемонстрирована цитотоксичность супрафи-зиологических доз Se на клетки опухоли, в том числе химиорезистентные [3].
Группа европейских исследователей впервые оценила экспрессию 17 селенозависимых генов попарно у 167 пациентов из Чехии и Ирландии: ткань неоплазии – окружающая ткань без признаков опухолевого роста, в зависимости от обеспеченности Se. Неопластическая ткань была представлена колоректальной аденомой или аденокарциномой. GPX2 и TXNRD3 продемонстрировали повышение экспрессии, а GPX3, SelP, SelS и SEPHS2 ее снижение в аденомах и аденокарциномах. У пациентов из Чехии наблюдались повышение GPX1, SelH, SOD2 и снижение SBP1, SelN и SelK. В ирландской группе больных проведена оценка корреляции экспрессии генов с селеновым статусом, оцениваемым по содержанию Se и SelP: SelF, SelK и TXNRD1 положительно коррелировали с концентрацией Se, TXNRD2 и TXNRD3 отрицательно – с SelP. Cox-регрессионный анализ данных чешской группы пациентов показал связь между повышением экспрессии SelF и ухудшением общей и безрецидивной выживаемости больных. Ряд селенопротеинов характеризовались отличиями уровня экспрессии между неопластическими и окружающими тканями [52].
На примере рака мочевого пузыря показана новая функция белка SBP1: Р53-независимая транскрипционная индукция экспрессии Р21 посредством ослабления фосфорилирования c-Jun и STAT1, что приводит к остановке клеточного цикла G0/G1 [53].
Потенциал соединений селена и их биологических антагонистов в качестве химиотерапевтических средств Сведения об использования Se или селеносодержащих молекул в лечении злокачественных новообразований преимущественно основаны на его прооксидантной активности в супрафизиоло-гических дозах. Например, в группе из 45 женщин с диагнозами рака яичников, маточных труб или мезотелиомы брюшины пациентки получали Se в виде селенистой кислоты в дополнение к химиотерапии карбоплатином и паклитакселом. Безопасная и хорошо переносимая доза до 5 000 мкг рекомендована для II фазы клинических испытаний. Высказано предположение, что Se в указанной дозе может выступать синергистом с цитотоксическими препаратами, обычно используемыми в качестве химиотерапевтических средств [54]. Кроме того, некоторые исследователи выявили уменьшение тяжести нефро- и гематологической токсичности препаратов платины на фоне дополнительного назначения препаратов Se [55].
Ряд исследований продемонстрировали повышение радиационной устойчивости нормальных клеток без снижения чувствительности неопластических в процессе лучевой терапии на фоне использования производных Se, что в клиническом аспекте проявляется лучшими гематологическими показателями токсичности и меньшей потребностью в использовании колониестимулирующих средств. Более того, за счет взаимодействия с глутатионом Se способен предотвращать развитие химиорезистентности [56].
Перспективным противоопухолевым соединением Se является метилселеновая кислота (МСК). Ее основными эффектами рассматриваются ингибирование ангиогенеза за счет подавления b-3-интегрина, ингибирование JAK/STAT3-сигнального пути, HIF-1a и 2а, подавление образования дисульфидных связей на поверхности опухолевых клеток, активация глутатион-зависимого перекисного окисления липидов, дифференцированное влияние на экспрессию селенопротеинов ЭПР, активация каспазозависимого апоптоза, подавление активности деацитилазы и ДНК-метилтрансферазы. Отечественные ученые продемонстрировали дифференцированный эффект применения МСК в отношении экспрессионного профиля селенопротеинов эндоплазматического ретикулума на клеточных линиях рака предстательной железы (DU145), молочных желез (MCF7) и фибросаркомы (HT-1080). МСК вызывала стимуляцию апоптоза во всех клеточных линиях. Обнаружены разнонаправленные эффекты соединения на экспрессию SelM и SelT/SelF; стимуляция экспрессии DIO2, SelN, SelK и SelS при применении наибольших концентраций МСК [57].
Ряд опухолей, например рак яичников, характеризуются резистентностью к одному из механизмов запуска апоптоза – ферроптозу. Данная способность реализуется через увеличение поглощения Se, высокий уровень экспрессии фермента поддержания редокс-статуса клетки – GPX4, а также рецептора SelP – АРО Е (синоним – LRP8) и цистеин-глутаматного антипортера – хСТ (синоним – SLC7A11), снижение активности GPX и TXNRD. В нормальных клетках ферроптоз запускается при накоплении продуктов перекисного окисления липидов (ПОЛ), в то время как имеющие более высокий уровень оксидативного стресса опухоли увеличивают экспрессию различных селеносодержащих участников антиоксидантного каскада, противостоящих клеточной гибели [58]. Схематично механизм развития резистентности к ферроптозу в клетках злокачественных опухолей и основные селенопротеины, участвующие в данном процессе, показаны на рис. 2. В ситуациях
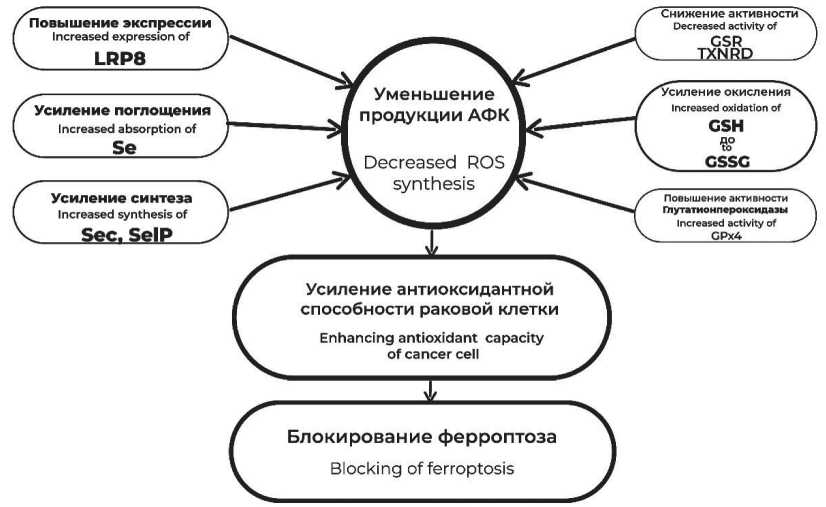
Рис. 2. Механизм развития резистентности к ферроптозу в клетках злокачественных опухолей. Примечания: GSR – глутатионре-дуктаза; TXNRD – тиоредоксинредуктаза; Sec – селеноцистеин; LRP8 – протеин 8, связанный с рецептором ЛПНП; SelP – селенопротеин P; GSH – глутатион, GSSG – дисульфид глутатиона; АФК – активные формы кислорода; рисунок выполнен авторами Fig. 2. Mechanism of ferroptosis resistance in cancer cells. Notes: GSR – glutathione reductase; TXNRD – thioredoxin reductase;
Sec – selenocysteine; LRP8 – LDL receptor-related protein 8; SelP – selenoprotein P; GSH – glutathione, GSSG – glutathione disulfide;
ROS – reactive oxygen species; created by the authors
с раковыми клетками с подобной перестройкой метаболизма дополнительное назначение добавок селена или изначально высокое его содержание в организме несет пациенту скорее «зло», чем пользу, и может выступать одним из вероятных факторов прогрессирования онкологического заболевания.
Таким образом, существуют два направления преодоления подобной резистентности. Первое – ингибирование хСТ эрастином в условиях интенсификации дыхания; второе – ингибирование поступления субстратов путем использования антагонистов GLUT1 (мембранный переносчик глюкозы 1-го типа), PDK4 (пируватдегидрогеназа 4-го типа) или глютаминазы, что в идеале требует оценки метаболомного профиля опухоли с целью персонификации терапии [59]. Кроме того, непосредственное подавление синтеза или ингибирование GPX4 с целью активации ферроптоза также рассматривается некоторыми авторами перспективным направлением фармакологических изысканий [60]. K.R. Sekhar et al. (2022) на клеточных линиях дифференцированного рака щитовидной железы (K1, MDA-T68, MDA-T32, TPC1) продемонстрировали подавляющий эффект низкомолекулярного ингибитора GPX4 – (1S,3R)-RSL3. Авторами обнаружено резкое увеличение концентрации свободных радикалов, усиление ферроптоза, подавление миграции клеток и сигнального пути mTOR, а также активация репарации ДНК, что делает (1S,3R)-RSL3 перспективной субстанцией для изучения при распространенном раке щитовидной железы [61].
Еще одной молекулярной мишенью в терапии злокачественных неоплазий рассматривается TXNRD1 ввиду повышенной экспрессии данного селенопротеина в ряде опухолей [62] и корреляции с плохим прогнозом при первичном раке печени, легких и молочных желез благодаря обеспечению оптимального редокс-статуса в клетках [63]. Среди исследованных ингибиторов TXNRD1 – аурано-фин, сантамирин и цинаропикрин [58].
Помимо прямого ингибирования TXNRD1, внимание исследователей направлено на изучение положительного регулятора его экспрессии Nrf2 (nuclear factor erythroid 2-related factor 2). В клетках гепатоцеллюлярной карциномы обнаружена повышенная экспрессия одного из ферментов глюконеогенеза – фосфоленолпируваткарбокси-киназы, что приводит к активации свободнорадикальных реакций со стимуляцией экспрессии Nrf2 и TXNRD1 [64]. Клетки немелкоклеточного рака легких с повышенным ядерным накоплением Nrf2 характеризуются стимуляцией экспрессии TXNRD1, развитием химиорезистентности и плохим прогнозом заболевания [65]. Таким образом, Nrf2-зависимая экспрессия TXNRD1 служит еще одной перспективной мишенью противоопухолевой терапии. Однако, несмотря на значительное количество молекул, обладающих необходимыми свойствами, разработка и применение лекарственного средства затруднительны ввиду отсутствия средств адресной доставки в неопластические клетки [66].
Заключение
Благодаря своим химическим свойствам Se входит в состав многих ферментов поддержания окислительно-восстановительного статуса клеток, структурных белков, а также дейодиназ, что обусловливает его эссенциальность и несколько «степеней защиты от потерь» в случае недостаточного потребления. Концентрация Se в сыворотке крови ниже 45 мкг/л считается предрасполагающим фактором развития неоплазий, а селенизация продуктов питания рядом авторов рассматривается как важный элемент первичной профилактики рака. В то же время необходимость применения соединений селена с целью профилактики и лечения новообразований неоднозначна, что требует дальнейшего углубленного изучения вопроса при злокачественных опухолях различного гистогенеза, что может внести существенный вклад в понимание эпидемиологии опухолей, вариантов течения и прогрессирования.
Также на современном этапе накоплены достоверные данные о возможности применения Se на различных этапах комбинированного и комплексного лечения онкологических пациентов: в определенной дозе он может выступать синергистом с цитотоксическими химиопрепаратами, увеличивая их эффективность. В ряде случаев Se может выступать как модификатор биологических реакций и радиопротектор – уменьшать тяжесть не-фро- и гематологической токсичности препаратов платины, повышать радиационную устойчивость нормальных клеток без снижения чувствительности неопластических в процессе лучевой терапии. За счет взаимодействия с глутатионом Se способен предотвращать развитие химиорезистентности опухолей. Некоторых биомолекулярных участников сложной цепочки синтеза селенопротеинов можно рассматривать в качестве потенциальных мишеней противоопухолевой терапии или преодоления ее токсичности ввиду чрезвычайно высокой метаболической активности опухолевых клеток по мере увеличения пролиферации, что закономерно приводит к активации перекисного окисления липидов и необходимости постоянного эффективного преодоления окислительного стресса.
Таким образом, необходимо продолжать комплексные молекулярные исследования биоорга-нических соединений Se на морфологическом, ультраструктурном и биохимическом уровне при опухолях различных локализаций в зависимости от генетических особенностей изучаемой популяции и геохимических характеристик региона.
Список литературы Фундаментальные аспекты биохимии селена и селенопротеинов: прикладное значение в онкологии
- Kurokawa S., Berry M.J. Selenium. Role of the essential metalloid in health. Met Ions Life Sci. 2013; 13: 499-534. https://doi.org/10.1007/978-94-007-7500-8_16.
- Kozlov A.P. Evolution by Tumor Neofunctionalization: the role of tumors in the origin of new cell types, tissues and organs. Amsterdam, Boston, Heidelberg, London, New York, Oxford, Paris, San Diego, San Francisco, Singapore, Sydney and Tokyo: Academic Press/Elsevier; 2014. 248 p.
- Elhodaky M., Diamond A.M. Selenium-Binding Protein 1 in Human Health and Disease. Int J Mol Sci. 2018; 19(11): 3437. https://doi.org/10.3390/ijms19113437.
- Ying Q., Ansong E., Diamond A.M., Yang W. A Critical Role for Cysteine 57 in the Biological Functions of Selenium Binding Protein-1. Int J Mol Sci. 2015; 16(11): 27599-608. https://doi.org/10.3390/ijms161126043.
- Minich W.B. Selenium Metabolism and Biosynthesis of Selenoproteins in the Human Body. Biochemistry (Mosc). 2022; 87(s1). https://doi.org/10.1134/S0006297922140139.
- Avtsyn A.P., Zhavoronkov A.A., Rish M.A., Strochkova L.S. Mikroelementozy cheloveka. M., 1991. S. 126-44.
- Kieliszek M. Selenium. Chapter Eleven. Advances in food and nutrition research. 2021; 96: 417-29. https://doi.org/10.1016/bs.afnr.2021.02.019.
- Baranovskii A.Yu. Dietologiya. 5-e izdanie. SPb., 2017. 1104 s.
- Wang P., Chen B., Huang Y., Li J., Cao D., Chen Z., Li J., Ran B., Yang J., Wang R., Wei Q., Dong Q., Liu L. Selenium intake and multiple health-related outcomes: an umbrella review of meta-analyses. Front Nutr. 2023; 10. https://doi.org/10.3389/fnut.2023.1263853.
- Rayman M.P. Selenium in cancer prevention: a review of the evidence and mechanism of action. Proc Nutr Soc. 2005; 64(4): 527-42. https://doi.org/10.1079/pns2005467.
- Povey S., Lovering R., Bruford E., Wright M., Lush M., Wain H. The HUGO Gene Nomenclature Committee (HGNC). Hum Genet. 2001; 109(6): 678-80. https://doi.org/10.1007/s00439-001-0615-0.
- Gladyshev V.N., Arnér E.S., Berry M.J., Brigelius-Flohé R., Bruford E.A., Burk R.F., Carlson B.A., Castellano S., Chavatte L., Conrad M., Copeland P.R., Diamond A.M., Driscoll D.M., Ferreiro A., Flohé L., Green F.R., Guigó R., Handy D.E., Hatfeld D.L., Hesketh J., Hoffmann P.R., Holmgren A., Hondal R.J., Howard M.T., Huang K., Kim H.Y., Kim I.Y., Köhrle J., Krol A., Kryukov G.V., Lee B.J., Lee B.C., Lei X.G., Liu Q., Lescure A., Lobanov A.V., Loscalzo J., Maiorino M., Mariotti M., Sandeep Prabhu K., Rayman M.P., Rozovsky S., Salinas G., Schmidt E.E., Schomburg L., Schweizer U., Simonović M., Sunde R.A., Tsuji P.A., Tweedie S., Ursini F., Whanger P.D., Zhang Y. Selenoprotein Gene Nomenclature. J Biol Chem. 2016; 291(46): 24036-40. https://doi.org/10.1074/jbc.M116.756155.
- Golubkina N.A., Papazyan T.T. Selen v pitanii: rasteniya, zhivotnye, chelovek. M., 2006. 254 s.
- Sword J.T., Pope A.L., Hoekstra W.G. Endotoxin and lipid peroxidation in vitro in selenium- and vitamin E-defcient and -adequate rat tissues. J Nutr. 1991; 121(2): 258-64. https://doi.org/10.1093/jn/121.2.258.
- Shreenath A.P., Hashmi M.F., Dooley J. Selenium Defciency. 2023. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024.
- Burk R.F., Olson G.E., Hill K.E. Deletion of selenoprotein P gene in the mouse. Selenium: its molecular biology and role in human health. Eds D.L. Hatfield, M.J. Berry, V.N. Gladyshev. 2nd ed. N.Y.: Springer, 2006. P. 111-122.
- Varlamova E.G., Gol'tyaev M.V., Novoselov S.V., Novoselov V.I., Fesenko E.E. Biosintez i mekhanizm vstraivaniya selenotsisteina v sinteziruemye belki. Molekulyarnaya biologiya. 2013; 47(4): 558-67. https://doi.org/10.7868/S0026898413040137.
- Genchi G., Lauria G., Catalano A., Sinicropi M.S., Carocci A. Biological Activity of Selenium and Its Impact on Human Health. Int J Mol Sci. 2023; 24(3): 2633. https://doi.org/10.3390/ijms24032633.
- Seko Y., Saito Y., Kitahara J., Imura N. Active Oxygen Generation by the Reaction of Selenite with Reduced Glutathione in Vitro. In: Selenium in Biology and Medicine. Eds. Wendel A. Heidelberg. Springer, 1989: 70-73.
- Kudrin A.V., Gromova O.A. Mikroelementy v immunnologii i onkologii. M., 2007. 544 s.
- Chiu-Ugalde J., Theilig F., Behrends T., Drebes J., Sieland C., Subbarayal P., Köhrle J., Hammes A., Schomburg L., Schweizer U. Mutation of megalin leads to urinary loss of selenoprotein P and selenium defciency in serum, liver, kidneys and brain. Biochem J. 2010; 431(1): 103-11. https://doi.org/10.1042/BJ20100779.
- Rusetskaya N.Yu. Gipoteticheskaya svyaz' mezhdu metabolizmom selena i uglevodnym obmenom. Sovremennye problemy nauki i obrazovaniya. 2014; (2): 488.
- Vinceti M., Filippini T., Del Giovane C., Dennert G., Zwahlen M., Brinkman M., Zeegers M.P., Horneber M., D’Amico R., Crespi C.M. Selenium for preventing cancer. Cochrane Database Syst Rev. 2018; 1(1). https://doi.org/10.1002/14651858.CD005195.pub4.
- Kadkol S., Diamond A.M. The Interaction between Dietary Selenium Intake and Genetics in Determining Cancer Risk and Outcome. Nutrients. 2020; 12(8): 2424. https://doi.org/10.3390/nu12082424.
- Ursini F., Heim S., Kiess M., Maiorino M., Roveri A., Wissing J., Flohé L. Dual function of the selenoprotein PHGPx during sperm maturation. Science. 1999; 285(5432): 1393-6. https://doi.org/10.1126/science.285.5432.1393.
- Mustacich D., Powis G. Thioredoxin reductase. Biochem J. 2000; 346 Pt 1(Pt 1): 1-8.
- Bianco A.C., Larsen P.R. Selenium, deiodinases and endocrine function. Selenium: Its Molecular Biology and Role in Human Health. Eds D.L. Hatfield, M.J. Berry, V.N. Gladyshev. 2nd ed. N.Y.: Springer, 2006. P. 207-219. https://doi.org/10.1007/0-387-33827-6_19.
- Arteel G.E., Briviba K., Sies H. Protection against peroxynitrite. FEBS Lett. 1999; 445(2-3): 226-30. https://doi.org/10.1016/s0014-5793-(99)00073-3.
- Kioussi C., Whanger P.D. Selenoprotein W in development and oxidative stress. Selenium: Its Molecular Biology and Role in Human Health. Eds D.L. Hatfield, M.J. Berry, V.N. Gladyshev. 2nd ed. N.Y.: Springer, 2006. P. 135-140.
- Gu Q.P., Beilstein M.A., Vendeland S.C., Lugade A., Ream W., Whanger P.D. Conserved features of selenocysteine insertion sequence (SECIS) elements in selenoprotein W cDNAs from fve species. Gene. 1997; 193(2): 187-96. https://doi.org/10.1016/s0378-1119(97)00113-3.
- Kuria A., Fang X., Li M., Han H., He J., Aaseth J.O., Cao Y. Does dietary intake of selenium protect against cancer? A systematic review and meta-analysis of population-based prospective studies. Crit Rev Food Sci Nutr. 2020; 60(4): 684-94. https://doi.org/10.1080/10408398.2018.1548427.
- Bösl M.R., Takaku K., Oshima M., Nishimura S., Taketo M.M. Early embryonic lethality caused by targeted disruption of the mouse selenocysteine tRNA gene (Trsp). Proc Natl Acad Sci USA. 1997; 94(11): 5531-34. https://doi.org/10.1073/pnas.94.11.5531.
- Lener M.R., Scott R.J., Wiechowska-Kozłowska A., SerranoFernández P., Baszuk P., Jaworska-Bieniek K., Sukiennicki G., Marciniak W., Muszyńska M., Kładny J., Gromowski T., Kaczmarek K., Jakubowska A., Lubiński J. Serum Concentrations of Selenium and Copper in Patients Diagnosed with Pancreatic Cancer. Cancer Res Treat. 2016; 48(3): 1056-64. https://doi.org/10.4143/crt.2015.282.
- Jiang Z., Chi J., Li H., Wang Y., Liu W., Han B. Efect of chitosan oligosaccharide-conjugated selenium on improving immune function and blocking gastric cancer growth. Eur J Pharmacol. 2021; 891. https://doi.org/10.1016/j.ejphar.2020.173673.
- Augustyniak M., Galas A. Selenium dietary intake and survival among CRC patients. Int J Vitam Nutr Res. 2023; 93(6): 518-28. https://doi.org/10.1024/0300-9831/a000768.
- Wang Y., Fang W., Huang Y., Hu F., Ying Q., Yang W., Xiong B. Reduction of selenium-binding protein 1 sensitizes cancer cells to selenite via elevating extracellular glutathione: a novel mechanism of cancerspecifc cytotoxicity of selenite. Free Radic Biol Med. 2015; 79: 186-96. https://doi.org/10.1016/j.freeradbiomed.2014.11.015.
- Radomska D., Czarnomysy R., Radomski D., Bielawska A., Bielawski K. Selenium as a Bioactive Micronutrient in the Human Diet and Its Cancer Chemopreventive Activity. Nutrients. 2021; 13(5): 1649. https://doi.org/10.3390/nu13051649.
- Brigelius-Flohé R., Kipp A.P. Glutathione Peroxidase 2, a Selenoprotein Exhibiting a Dual Personality in Preventing and Promoting Cancer. In Selenium. Its Molecular Biology and Role in Human Health, 4th ed. Springer International Publishing: New York, NY, USA, 2016; Chapter 38; P. 451-462. https://doi.org/10.1007/978-3-319-41283-2_38.
- Bertz M., Kühn K., Koeberle S.C., Müller M.F., Hoelzer D., Thies K., Deubel S., Thierbach R., Kipp A.P. Selenoprotein H controls cell cycle progression and proliferation of human colorectal cancer cells. Free Radic Biol Med. 2018; 127: 98-107. https://doi.org/10.1016/j.freeradbiomed.2018.01.010.
- Shamberger R.J., Rudolph G. Protection against cocarcinogenesis by antioxidants. Experientia. 1966; 22(2): 116. https://doi.org/10.1007/BF01900187.
- Clark L.C., Combs G.F. Jr., Turnbull B.W., Slate E.H., Chalker D.K., Chow J., Davis L.S., Glover R.A., Graham G.F., Gross E.G., Krongrad A., Lesher J.L. Jr., Park H.K., Sanders B.B. Jr., Smith C.L., Taylor J.R. Effects of selenium supplementation for cancer prevention in patients with carcinoma of the skin. A randomized controlled trial. Nutritional Prevention of Cancer Study Group. JAMA. 1996; 276(24): 1957-63.
- Zyambo K., Kelly P., Kayamba V. Evaluation of the association between gastric cancer and plasma selenium in Zambian adults: a casecontrol study. Ecancermedicalscience. 2022; 16: 1351. https://doi.org/10.3332/ecancer.2022.1351.
- Zhu X., Pan D., Wang N., Wang S., Sun G. Relationship Between Selenium in Human Tissues and Breast Cancer: a Meta-analysis Based on Case-Control Studies. Biol Trace Elem Res. 2021; 199(12): 4439-46. https://doi.org/10.1007/s12011-021-02574-9.
- Bevinakoppamath S., Saleh Ahmed A.M., Ramachandra S.C., Vishwanath P., Prashant A. Chemopreventive and Anticancer Property of Selenoproteins in Obese Breast Cancer. Front Pharmacol. 2021; 12. https://doi.org/10.3389/fphar.2021.618172.
- Wang L., Wang J., Liu X., Liu Q., Zhang G., Liang L. Association between selenium intake and the risk of pancreatic cancer: a metaanalysis of observational studies. Biosci Rep. 2016; 36(5). https://doi.org/10.1042/BSR20160345.
- Gómez-Tomás Á., Pumarega J., Alguacil J., Amaral A.F.S., Malats N., Pallarès N., Gasull M., Porta M.; PANKRAS II Study Group. Concentrations of trace elements and KRAS mutations in pancreatic ductal adenocarcinoma. Environ Mol Mutagen. 2019; 60(8): 693-703. https://doi.org/10.1002/em.22296.
- Janowska M., Potocka N., Paszek S., Skrzypa M., Wróbel A., Kluz M., Baszuk P., Marciniak W., Gronwald J., Lubiński J., Zawlik I., Kluz T. An Assessment of Serum Selenium Concentration in Women with Endometrial Cancer. Nutrients. 2022; 14(5): 958. https://doi.org/10.3390/nu14050958.
- Yang W., Diamond A.M. Selenium-binding protein 1 as a tumor suppressor and a prognostic indicator of clinical outcome. Biomark Res. 2013; 1(1): 15. https://doi.org/10.1186/2050-7771-1-15.
- Meng Q., Xu J., Liang C., Liu J., Hua J., Zhang Y., Ni Q., Shi S., Yu X. GPx1 is involved in the induction of protective autophagy in pancreatic cancer cells in response to glucose deprivation. Cell Death Dis. 2018; 9: 1187. https://doi.org/10.1038/s41419-018-1244-z.
- Li M., Cheng W., Nie T., Lai H., Hu X., Luo J., Li F., Li H. Selenoprotein K mediates the proliferation, migration, and invasion of human choriocarcinoma cells by negatively regulating human chorionic gonadotropin expression via ERK, P38 MAPK, and Akt signaling pathway. Biol. Trace Elem. Res. 2018; 184(1): 47-59. https://doi.org/10.1007/s12011-017-1155-3.
- Zhang X.Y., Gao P.T., Yang X., Cai J.B., Ding G.Y., Zhu X.D., Ji Y., Shi G.M., Shen Y.H., Zhou J., Fan J., Sun H.C., Yang L.X,. Huang C. Reduced selenium-binding protein 1 correlates with a poor prognosis in intrahepatic cholangiocarcinoma and promotes the cell epithelial-mesenchymal transition. Am J Transl Res. 2018; 10(11): 3567-78.
- Hughes D.J., Kunická T., Schomburg L., Liška V., Swan N., Souček P. Expression of Selenoprotein Genes and Association with Selenium Status in Colorectal Adenoma and Colorectal Cancer. Nutrients. 2018; 10(11): 1812. https://doi.org/10.3390/nu10111812.
- Wang Y., Zhu W., Chen X., Wei G., Jiang G., Zhang G. Seleniumbinding protein 1 transcriptionally activates p21 expression via p53- independent mechanism and its frequent reduction associates with poor prognosis in bladder cancer. J Transl Med. 2020; 18(1): 17. https://doi.org/10.1186/s12967-020-02211-4.
- Song M., Kumaran M.N., Gounder M., Gibbon D.G., NievesNeira W., Vaidya A., Hellmann M., Kane M.P., Buckley B., Shih W., Caffrey P.B., Frenkel G.D., Rodriguez-Rodriguez L. Phase I trial of selenium plus chemotherapy in gynecologic cancers. Gynecol Oncol. 2018; 150(3): 478-86. https://doi.org/10.1016/j.ygyno.2018.07.001.
- Hu Y.J., Chen Y., Zhang Y.Q., Zhou M.Z., Song X.M., Zhang B.Z., Luo L., Xu P.M., Zhao Y.N., Zhao Y.B., Cheng G. The protective role of selenium on the toxicity of cisplatin-contained chemotherapy regimen in cancer patients. Biol Trace Elem Res. 1997; 56(3): 331-41. https://doi.org/10.1007/BF02785304.
- Lanfear J., Fleming J., Wu L., Webster G., Harrison P.R. The selenium metabolite selenodiglutathione induces p53 and apoptosis: relevance to the chemopreventive efects of selenium? Carcinogenesis. 1994; 15(7): 1387-92. https://doi.org/10.1093/carcin/15.7.1387.
- Goltyaev M.V., Maltseva V.N., Varlamova E.G. Expression of ERresident selenoproteins and activation of cancer cells apoptosis mechanisms under ER-stress conditions caused by methylseleninic acid. Gene. 2020; 755. https://doi.org/10.1016/j.gene.2020.144884.
- Shimada B.K., Swanson S., Toh P., Seale L.A. Metabolism of Selenium, Selenocysteine, and Selenoproteins in Ferroptosis in Solid Tumor Cancers. Biomolecules. 2022; 12(11): 1581. https://doi.org/10.3390/biom12111581.
- Kobayashi H., Yoshimoto C., Matsubara S., Shigetomi H., Imanaka S. A comprehensive overview of recent developments on the mechanisms and pathways of ferroptosis in cancer: the potential implications for therapeutic strategies in ovarian cancer. Cancer Drug Resist. 2023; 6(3): 547-66. https://doi.org/10.20517/cdr.2023.49.
- Li Z., Ferguson L., Deol K.K., Roberts M.A., Magtanong L., Hendricks J.M., Mousa G.A., Kilinc S., Schaefer K., Wells J.A., Bassik M.C., Goga A., Dixon S.J., Ingolia N.T., Olzmann J.A. Ribosome stalling during selenoprotein translation exposes a ferroptosis vulnerability. Nat Chem Biol. 2022; 18(7): 751-61. https://doi.org/10.1038/s41589-022-01033-3.
- Sekhar K.R., Hanna D.N., Cyr S., Baechle J.J., Kuravi S., Balusu R., Rathmell K., Baregamian N. Glutathione peroxidase 4 inhibition induces ferroptosis and mTOR pathway suppression in thyroid cancer. Sci Rep. 2022; 12(1). https://doi.org/10.1038/s41598-022-23906-2.
- Santesmasses D., Gladyshev V.N. Selenocysteine Machinery Primarily Supports TXNRD1 and GPX4 Functions and Together They Are Functionally Linked with SCD and PRDX6. Biomolecules. 2022; 12(8): 1049. https://doi.org/10.3390/biom12081049.
- Fu B., Meng W., Zeng X., Zhao H., Liu W., Zhang T. TXNRD1 Is an Unfavorable Prognostic Factor for Patients with Hepatocellular Carcinoma. BioMed Res. Int. 2017. https://doi.org/10.1155/2017/4698167.
- Tuo L., Xiang J., Pan X., Gao Q., Zhang G., Yang Y., Liang L., Xia J., Wang K., Tang N. PCK1 Downregulation Promotes TXNRD1 Expression and Hepatoma Cell Growth via the Nrf2/Keap1 Pathway. Front. Oncol. 2018; 8: 611. https://doi.org/10.3389/fonc.2018.00611.
- Delgobo M., Gonçalves R.M., Delazeri M.A., Falchetti M., Zandoná A., Nascimento das Neves R., Almeida K., Fagundes A.C., Gelain D.P., Fracasso J.I., Macêdo G.B., Priori L., Bassani N., Bishop A.J.R., Forcelini C.M., Moreira J.C.F., Zanotto-Filho A. Thioredoxin reductase-1 levels are associated with NRF2 pathway activation and tumor recurrence in non-small cell lung cancer. Free Radic Biol Med. 2021; 177: 58-71. https://doi.org/10.1016/j.freeradbiomed.2021.10.020.
- Robledinos-Antón N., Fernández-Ginés R., Manda G., Cuadrado A. Activators and Inhibitors of NRF2: A Review of Their Potential for Clinical Development. Oxid Med Cell Longev. 2019. https://doi.org/10.1155/2019/9372182.


