Функциональная идентификация Cl-/ H+- антипортера в мембранной фракции клеток корня галофита Suaeda altissima (L.) Pall
Автор: Шувалов Алексей Витальевич, Орлова Юлия Викторовна, Мясоедов Николай Александрович, Беляев Денис Вадимович, Халилова Людмила Абдулгадиевна, Андреев Игорь Михайлович, Балнокин Юрий Владимирович
Журнал: Труды Московского физико-технического института @trudy-mipt
Рубрика: Молекулярная и биологическая физика
Статья в выпуске: 3 (15) т.4, 2012 года.
Бесплатный доступ
На выделенном из корней галофита Suaeda altissima мембранном препарате, обогащенном плазмалеммой, показано функционирование Cl−/H+-антипортера. Идентификацию Cl−/H+-антипортера и исследование свойств осуществляемого им Cl−/H+-обмена проводили с помощью оптических зондов (акридиновый оранжевый, пиранин и сафранин О), позволяющих регистрировать изменения pH внутри везикул и изменения электрического трансмембранного потенциала, которые происходят при наложении на мембрану концентрационного градиента Cl−. Предполагается, что физиологическая роль Cl−/H+-антипортера состоит в поддержании концентраций Cl− в цитоплазме на нетоксическом уровне в условиях засоления.
Галофит suaeda altissima, мембранная фракция, плазмалемма, cl−/h+-антипортер, cl− гомеостаз
Короткий адрес: https://sciup.org/142185854
IDR: 142185854
Текст научной статьи Функциональная идентификация Cl-/ H+- антипортера в мембранной фракции клеток корня галофита Suaeda altissima (L.) Pall
Исследование механизмов, лежащих в основе устойчивости растений к высоким концентрациям солей в почве, является одной из актуальных проблем современной биологии растений. При высоких концентрациях NaCI в почве равновесный электрический потенциал С1- на плазмалемме (ПМ) клеток корня может быть более отрицательным, чем трансмембранный электрический потенциал, т.е. возможна ситуация, при которой ионы С1- поступают из экстраклеточной среды в цитоплазму по градиенту электрохимического потенциала [1]. Пассивный транспорт С1- внутрь предполагает наличие активного транспорта С1-, направленного обратно в экстраклеточную среду или в вакуоль.
Механизмы экспорта С1- из цитоплазмы растительных клеток, в отличие от механиз мов экспорта Ха+. слабо изучены. Известно, что в трапемембраппый перенос С1-вовлечепы мембранные белки семейства. CLC, которое включает анионные каналы и анион/протонные антипортеры. Гены семейства CLC и их продукты обнаружены у бактерий, животных и растений [2; 3]. К представителям этого семейства относятся С1-/Н+-антипортеры, которые осуществляют вторично активный транспорт С1- в обмен на Н+, используя энергию градиента, электрохимического потенциала, протонов. Такой переносчик мог бы транспортировать С1- из цитоплазмы растительных клеток обратно в апопласт или в вакуоль.
Функционирование С1-/Н+-антипортера продемонстрировано в плазмалемме прокариот [4, 5] и внутренних мембранах клеток животных [6; 7]. Несмотря на то, что гены семейства CLC обнаружены у нескольких растений [8], сведения о С1-/Н+-антипортерах растительного происхождения крайне скудны. Имеется лишь одна, работа, свидетельствующая о функционировании такого переносчика, названного AtCLCc, в клетках растений [9]. Показано, что продукт гена AtCLCc локализован в тонопласте замыкающих клеток устьиц Arabidopsis thaliana, где он вовлечен в накопление С1- вакуолями. Выключение гена AtCLCc посредством вставки Т-ДНК привело к нарушению транспорта С1- через тонопласт этих клеток и к нарушению работы устьичного аппарата.
Мы предположили, что С1-/Н+-антипортер выполняет функцию поддержания концентраций С1- в цитоплазме на нетоксическом уровне в клетках галофитов — растений, обитающих на засоленных почвах. Настоящая работа посвящена функциональной идентификации С1-/Н+-антипортера в выделенной из клеток корня S. altissima мембранной фракции, обогащенной везикулами плазмалеммы.
Материалы и методы
Семена Suaeda altissima (L.)Pall. проращивали во влажном песке при комнатной температуре, на пятнадцатые сутки проростки пересаживали на аэрируемый раствор Робинсона и Даунтона [10], в который был добавлен NaCI в конечной концентрации 100 мМ. Дальнейший рост S. altissima осуществляли в факторостатной камере при 24 °C в условиях водной культуры. Растения освещали натриевыми лампами высокого давления Reflux, ДНаЗ-400 (Россия) 12 часов в сутки при интенсивности света 150 вт/м2.
Мембранную фракцию из клеток корней, обогащенную везикулами плазмалеммы, получали путем центрифугирования суспензии микросом в ступенчатом градиенте плотности сахарозы по модифицированной методике [11]. Модификации состояли в применении сахарозных градиентов иных профилей (см. подписи к рис.) и во введении в среды, использовавшиеся при выделении мембран, дополнительно 5 мМ /3-меркаптоэтанола. Содержание плазмалеммы и тонопласта в выделенной мембранной фракции оценивали по чувствительности АТФ-зависимого закисления везикулярного люмена к ингибитору Н+-АТФазы плазмалеммы ортованадату и ингибитору Н+-АТФазы тонопласта нитрату.
О функционировании С1-/Н+-антипортера судили по ДрСГзависимому переносу Н+ через мембрану, а также по генерации трансмембранного электрического потенциала ( Дф) при наложении на везикулярную мембрану концентрационного градиента С1 -.
Перенос Н+через мембрану регистрировали двумя методами: по изменению дифференциальной абсорбции (ДА492-54о) ДрН-индикатора акридинового оранжевого (АО) [12] и по изменению параметров флуоресценции pH-индикатора пиранина ( Хех = 405 нм, Хех = 463 нм, Хет = 510 нм), находящегося внутри везикул [13]. Пиранин загружали в везикулы с помощью гипоосмотического шока, ресуспендируя выделенные мембранные везикулы в содержащих пиранин средах низкой осмолярности. Снижение осмолярности среды приводило к разрыву и последующему замыканию везикул, которое сопровождалось захватом «загрузочной» среды. Пиранин удаляли из среды, пропуская суспензию везикул через колонку с сефадексом G-50.
Генерацию Дф со знаком «минус» внутри везикул регистрировали как увеличение разности поглощения (А554—А524) потенциал-чувствительного индикатора сафранина О [14].
Разность поглощения АО и сафранина О регистрировали с помощью двухволнового спектрофотометра «Hitachi 557». Для измерения параметров флуоресценции пиранина использовали спектрофлуориметр «Hitachi 850».
Результаты
При внесении С1- в суспензию везикул протоны транспортировались наружу, и происходило защелачивание везикулярного люмена. Один из экспериментов, демонстрирующих трансмембранный С1-/Н+обмен, показан на рис. 1. Выделенные везикулы содержали ионы Ха+. которые попадали в везикулярный люмен на начальной стадии процедуры выделения везикул при гомогенизации корней. Встраивающийся в мембрану экзогенный Na+/Н+ — антипортер, моненсин, вызывал обмен содержащихся внутри ионов Na+ на наружные протоны и приводил к генерации ДрН с более кислым значением pH внутри везикул, чем в среде. Генерацию ДрН такой направленности регистрировали как снижение дифференциальной абсорбции АО. Последующее внесение в суспензию С1- (в форме холинхлорида)
вызывало диссипацию предварительно созданного АрН (возрастание дифференциальной абсорбции АО). Проникающий через мембрану липофильный катион тетрафенилфосфоний (ТФФ+) ускорял диссипацию АрН.
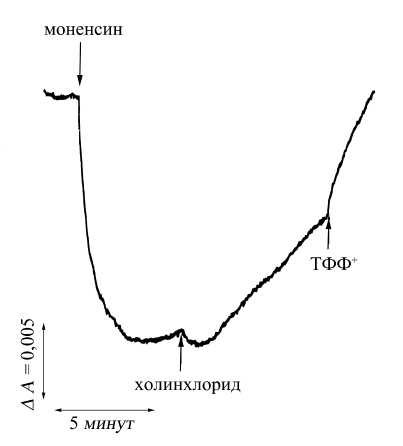
Рис. 1. АрС1-зависимая диссипация АрН с более кислым pH внутри везикул чем в наружной среде (эксперимент с АрН-индикатором акридиновым оранжевым). Мембраны выделяли в сахарозном градиенте плотности (25/34%), отбирая везикулы на границе двух слоев. Реакцию проводили в среде следующего состава (в мМ): 500 сахарозы; 20 BTP-MES, pH 7,5; 2 MgSO4, 2,5 EGTA. АрН на мембране был предварительно создан путем внесения Na + /Н+-антипортера моненсина в суспензию везикул, содержащих Na +. Исходные концентрации Na+ и С1- в везикулярном люмене составляли 20 и 50 мМ соответственно. Липофильный катион ТФФ + ускорял АрС1-зависимую диссипацию АрН. Вещества вносили в суспензию в следующих концентрациях: моненсин — 10 мкМ, холинхло-рид - 200 мМ, ТФФ + - 1 мМ
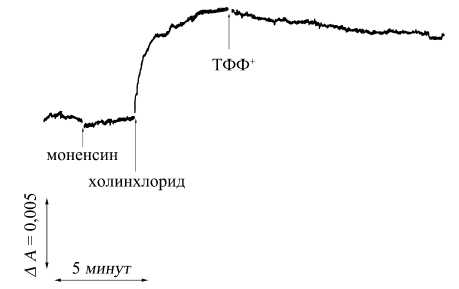
Рис. 2. АрС1-зависимая генерация Аф на везикулярной мембране (эксперимент с Аф-индикатором сафранином О). ТФФ + приводил к медлеиной диссипации Аф. Условия проведения эксперимента такие же, как указано в подписи к рис. 1
Использование Аф-индикатора сафранина О выявил о электрогенный характер Cl-/ Н+ обмена (рис. 2). Последовательность добавок к суспензии везикул была такой же, как в эксперименте, представленном на рис. 1. Внесение в суспензию моненсина не обнаружило заметного изменения Аф, поскольку этот ионофор осуществляет электронейтральный Na +/Н+-обмен. Однако последующее добавление холинхлорида приводило к генерации Аф со знаком «минус» внутри везикул (возрастание дифференциальной абсорбции сафранина О). Добавление тфф + вызывало медленную диссипацию сформированого в присутствии С1 - трансмембранного электрического потенциала (Аф), что регистрировалось как сниже- ние дифференциальной абсорбции сафранина О.
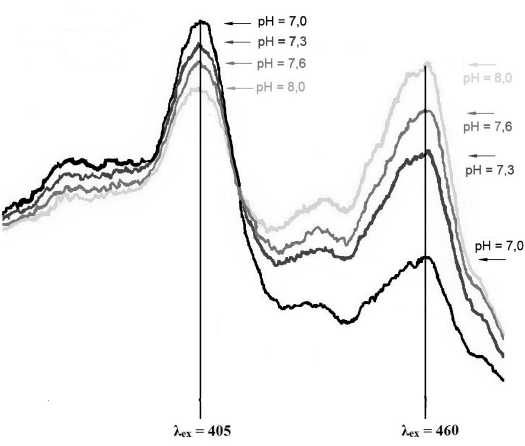
Рис. 3. Спектр возбуждения флуоресценции пиранина при разных значениях pH раствора, Хет = 510 нм
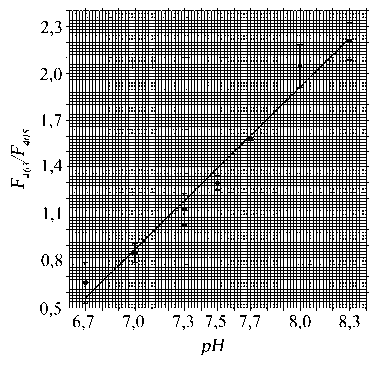
Рис. 4. Зависимость отношений интенсивностей флуоресценции пиранина, загруженного в везикулы, при Хех = 463 нм и Хех = 405 нм (Хет = 510 нм) от pH в везикулярном люмене. Мембраны выделяли в сахарозном градиенте плотности (34/64 %), отбирая везикулы на границе двух слоев. Везикулы загружали буферными растворами (20 мМ BTP-MES) с разными pH, содержащими 200 мкМ пиранина. Загрузку производили гипоосмотическим шоком (см. раздел «Материалы и методы»). Спектры возбуждения флуоресценции пиранина, загруженного в везикулы при разных pH, регистрировали в средах следующего состава (в мМ): 100 сахароза, 20 BTP-MES с pH, соответствующих их внутривезикулярным значениям
Использование флуоресцентного pH-индикатора, пиранина, который загружали в везикулы, также показало наличие ApCl-зависимого транспорта Н+ через мембрану. Применение этого индикатора, в отличие от АО, не требует предварительной генерации на мембране АрН. С помощью пиранина можно количественно определять изменения pH внутри везикул. Спектр возбуждения флуоресценции пиранина, записанный при постоянном значении длины волны эмиссии (Хет = 510 нм) имеет два характерных пика при Хех = 405 нм и Хех = 463 нм (рис. 3). При защелачивании раствора интенсивность флуоресценции пиранина при Хех = 405 нм снижается, а при Хех = 463 нм возрастает. На рис. 4 показана зависимость отношения интенсивностей флуоресценции пиранина при двух указанных длинах волн в спектре возбуждения флуоресценции от pH везикулярного люмена. В этом эксперименте везикулы загружали растворами пиранина с разными значениями pH. В последующих экспериментах полученную зависимость использовали как калибровочную кривую для определения pH внутри везикул.
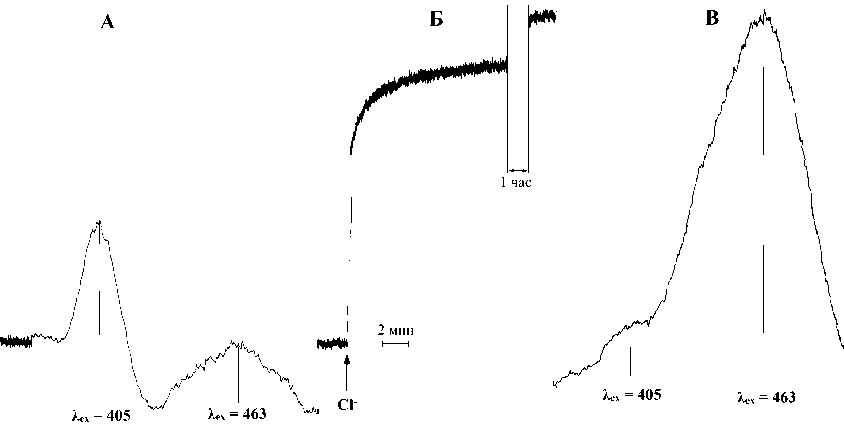
Рис. 5. Защелачивание везикулярного люмена в ответ на внесение в суспензию везикул С1- (эксперимент с рЯ-индикатором пиранином, загруженным в везикулы). Везикулы выделяли и загружали пиранином как указано в подписи к рис. 4. Исходная концентрация хлорида в везикулярном люмене 2 мМ, pH 6,8 (20 мМ BTP-MES). Реакцию проводили в среде следующего состава: 100 мМ сахароза, 20 мМ BTP-MES, pH 7,2. А — спектр возбуждения флуоресценции пиранина до внесения С1- в суспензию; Б — кинетика изменения флуоресценции пиранина после внесения С1-в суспензию в концентрации 200 мМ (Аеж = 463, Ает = 510 нм); В — спектр возбуждения флуоресценции пиранина после внесения в суспензию С1- и достижения состояния равновесия. Конечное значение pH в везикулярном уровне 8,2
Рис. 5 демонстрирует защелачивание везикулярного люмена в ответ на внесение С1 -в среду. На рис. 5а показан спектр возбуждения флуоресценции пиранина при исходном значении pH везикулярного люмена, равном 6,8 и концентрации С1 - в люмене 2 мМ. На рис. 56 — кинетика изменения флуоресценции пиранина при Аеж = 460 нм и Ает = 510 нм после внесения в суспензию С1 - в конечной концентрации 200 мМ, на рис. 5в — спектр возбуждения флуоресценции пиранина после достижения состояния равновесия. Конечное значение pH внутри везикул составило 8,2.
Следующий эксперимент показал, что С1 --опосредованньш транспорт Н+ зависит от трансмембранного электрического потенциала. Электрический потенциал той или иной величины задавали, поддерживая на мембране соответствующий диффузионный калиевый потенциал. Для этой цели помимо пиранина везикулы нагружали ионами К + в разных концентрациях. Концентрации К + варьировали также в наружной среде. При разных отношениях концентраций К + снаружи и внутри везикул в присутствии калиевого ионофора валиномицина на мембране генерировались разные диффузионные потенциалы К +. В трех вариантах эксперимента наружные и внутренние концентрации К +([К+о] / [К+^Д), выраженные в мМ, были следующими: 50/5, 50/50, 5/50. При этом диффузионный потенциал описывается уравнением Нернста
. , RT, [ ^ + ]
△ ^дифф.К + р ln
где R,T и F имеют обычные термодинамические значения. Согласно уравнению Нернста (1), для этих вариантов эксперимента диффузионный калиевый потенциал на мембране должен составить +58, 0, и -58мВ соответственно.
При трех заданных значениях электрического потенциала и разных отношениях концентраций С1- снаружи и внутри везикул по изменению отношения интенсивности флуоресценции пиранина при Аеж = 405 и 463 нм (Ает = 510 нм) определяли изменение внутри-везикулярного pH (рис. 6). Можно видеть, что (1) изменение внутривезикулярного pH, а именно защелачивание, тем больше, чем больше концентрационный градиент С1- на мембране, (2) защелачивание больше при положительном значении электрического потенциала и оно снижается по мере смещения потенциала в отрицательную область, (3) не было обнаружено реверсии транспорта Н+через мембрану. Вход Н+ внутрь везикул (закисление везикулярного люмена) не наблюдался ни при каких условиях данного эксперимента.
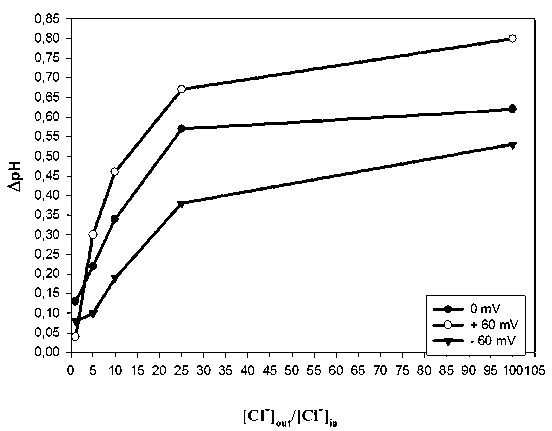
Рис. 6. Защелачивание везикулярного люмена в ответ на создание на везикулярной мембране концентрационного градиента С1- при разных значениях электрического потенциала. Везикулы выделяли и загружали пиранином, как указано в подписи к рис. 4. Исходная концентрация С1- в везикулах 2 мМ, pH 7,5. Различные концентрационные градиенты С1- на мембране создавали путем изменения концентрации этого иона в наружной среде Электрический потенциал задавали, поддерживая на мембране соответствующий диффузионный калиевый потенциал
Обсуждение результатов
Одним из наиболее продуктивных подходов в идентификации ионных транспортеров мембраны является исследование транспорта ионов на выделенных мембранных везикулах. Получаемые препараты ПМ обычно более чем наполовину состоят из инвертированных везикул, т.е. мембранных пузырьков, обращенных цитоплазматической стороной наружу. В некоторых случаях это создает определенные удобства, в частности, при исследовании функций локализованных в плазмалемме АТФаз. Поскольку активные центры АТФаз находятся на цитоплазматической стороне мембраны, то при работе на выделенных везикулах можно инициировать транспорт иона через ПМ, добавляя АТФ в суспензию везикул. Этот подход был использован нами для оценки содержания везикул плазмалеммы и тонопласта в полученной фракции. Н+-АТФаза плазмалеммы растительных клеток специфически подавляется ортованадатом — ингибитором АТФаз P-типа и не чувствительна к нитрату, тогда как Н+-АТФаза вакуолярной мембраны, наоборот, подавляется нитратом и не чувствительна к ортованадату. В наших экспериментах АТФ-зависимый транспорт Н + через мембрану ингибировался ортованадатом и практически не подавлялся нитратом, что говорит о преимущественном содержании в препарате везикул ПМ (данные не приведены).
Основной результат, полученный в настоящей работе, состоит в демонстрации ДрС1-зависимого защелачивания везикулярного люмена (рис. 1, 5, 6). Наблюдавшееся защелачивание не может быть объяснено транспортом Н + по градиенту электрохимического по- тенциала. Во всех проведенных экспериментах исходное значение pH внутри везикул было таким же, как в среде. Внесение С1- в суспензию везикул в форме холинхлорида могло приводить к генерации электрического потенциала на мембране со знаком «минус», но не «плюс» внутри везикул, поскольку мембраны в гораздо большей степени проницаемы для С1-. чем для холина. Перенос С1- внутрь везикул посредством С1- Н+-аитипортера. также осуществляет генерацию электрического потенциала со знаком «минус» внутри. Эксперименты с Аф-индикатором сафранином О (рис. 2) прямо указывают на генерацию электрического потенциала со знаком «минус» внутри после добавления к суспензии везикул С1-. Таким образом, пассивное движение Н+ в этих условиях возможно лишь внутрь везикул. Однако при создании на мембране концентрационного градиента С1-, направленного внутрь везикул, мы наблюдали защелачивание, но не закисление внутривезикуляр-ного люмена. Полученный результат прямо указывает на функционирование в ПМ клеток корня S. altissima Cl-/Н+-антипортера. Перенос С1-внутрь везикул и перенос Н+ в противоположном направлении обеспечивают перенос отрицательных зарядов внутрь везикул. Электрогенный обмен двух ионов должен зависеть от электрического потенциала на мембране, что нашло подтверждение в экспериментах с разным диффузионным калиевым потенциалом на мембране (рис. 6). При отрицательных значениях электрического потенциала («минус» внутри везикул) защелачивание было слабее, чем при нулевом значении потенциала. Смещение потенциала к положительным значениям усиливало защелачивание. Представленное ниже уравнение (2), описывающее работу С1-/Н+-антипортера [4], связывает равновесный трансмембранный потенциал (Еец), т.е. потенциал, при котором отсутствует движение С1- и Н+через мембрану, с концентрационными градиентами С1- и Н+'.
(n + 1)Афе,F = -nRTln -И- + RT ln Л0], (2) V^UnJ [rrjnJ где n — стехиометрия обмена, т.е. число обмениваемых ионов С1- на 1Н+.
Проведенные нами эксперименты не позволяют произвести расчеты по уравнению (2), однако его анализ показывает, что при отрицательных значениях Аф и градиентах С1- на мембране небольшой величины должно происходить обращение направления транспорта Н+и С1-, и защелачивание везикулярного люмена должно сменяться закислением. Однако закисления не наблюдалось ни при каких условиях данного эксперимента (рис. 6). Наиболее вероятной причиной этого является наличие на мембране других процессов (наряду с С1-/Н+-обменом), связанных с переносом протонов и приводящих к защелачиванию везикулярного люмена. Не исключено также, что полученные нами везикулы не являются идеальной системой, способной поддерживать трансмембранный электрический потенциал (диффузионный калиевый потенциал) в соответствии с заданными по уравнению (1) значениями. Например, из-за высокой протонной проводимости мембраны возможен пассивный транспорт протона из среды в везикулярный люмен и смещение благодаря этому Аф к более положительным значениям.
Физиологическая роль обнаруженного нами С1-/Н+-антипортера ПМ, по-видимому, состоит в выведении С1- из цитоплазмы в апопласт в условиях засоления среды. Функционирование С1-/Н+-антипортера в клетках сопровождается деполяризацией ПМ. Это в свою очередь должно приводить к стимуляции работы Н+-АТФазы и снижению движущей силы пассивного транспорта Na+ из наружной среды в клетку.
Дальнейшие исследования С1-/Н+-антипортера ПМ клеток корня S. altissima будут направлены на получение мембранных препаратов более высокого качества, дающих возможность произвести расчеты ион-транспортных параметров С1-/Н+-антипортера в соответствии с уравнением (2) и определить стехиометрию С1-/Н+-обмена.
Работа поддержана грантом РФФИ № 09-04-00-709-а.
Список литературы Функциональная идентификация Cl-/ H+- антипортера в мембранной фракции клеток корня галофита Suaeda altissima (L.) Pall
- Teakle N.L., Tyerman S.D. Mechanisms of Cl-transport contributing to salt tolerance//Plant, Cell and Environment. -2010. -V. 33, I. 4. -P. 566-589.
- Marmagne A., Vinauger-Douard M., Monachello D., Falcon de Longevialle A., Charon C., Allot M., Rappaport F., Wollman F.A., Barbier-Brygoo H., Ephritikhine G. Two members of the Arabidopsis CLC (Chloride Channels) family, AtCLCe and AtCLCf, are associated with thylakoid and Golgi membranes respectively//Journal of Experimental Botany. -2007. -V. 58. -P. 3385-3393.
- Jentsch T.J. CLC Chloride Channels and Transporters: From Genes to Protein Structure, Pathology and Physiology//Crit. Rev. Biochem. Mol. Biol. -2008. -V. 43, N. 1. -P. 3-36.
- Accardi A., Miller C. Secondary active transport mediated by a prokaryotic homologue of CLC Cl-channels//Nature. -2004. -V. 427. -P. 803-807.
- Jayaram H., Accardi A., Wu F., Williams C., Miller C. Ion permeation through a Cl-selective channel designed from a CLC Cl-/H+ exchanger//PNAS. -2008. -V. 105, N. 32. -P. 11194-11199.
- Graves A.R., Curran P.K., Smith C.L., Mindell, J.A. The Cl-/H+ antiporter CLC-7 is the primary chloride permeation pathway in lysosomes//Nature. -2008. -V. 453. -P. 788-792.
- Pusch M., Zifarelli G. It's the proton also in ClC-2//Journal of Physiology. -2009. -V. 587, I. 7. -P. 1379-1380.
- de Angeli A., Thomine S., Frachisse J.M., Ephritikhine G., Gambale F., Barbier-Brygoo H. Anion channels and transporters in plant cell membranes//FEBS Letters. -2007. -V. 581, I. 12. -P. 2367-2374.
- Jossier M., Kroniewitcz, L., Dalmas, F., Le Thiec, D., Ephritikhine, G., Thomine, S., Barbier-Brygoo, H., Vavasseur, A., Filleur, S., and Leonhardt, N. The Arabidopsis vacuolar anion transporter, AtCLCc, is involved in the regulation of stomatal movements and contributes to salt tolerance//Plant Journal. -2010. -V. 64, I. 4. -P. 563-576.
- Robinson S.P., Downton W.J.S. Potassium, Sodium and Chloride Ion Concentration in Leaves and Isolated Chloroplasts of the Halophyte Suaeda australis R. Br.//Aust. J. Plant Physiol. -1985. -V. 12. -P. 471-478.
- Луньков Р.В., Андреев И.М., Мясоедов Н.А., Хайлова Г.Ф., Куркова Е.Б., Балнокин Ю.В. Функциональная идентификация Н+-АТФазы и Na+/H+ антипортера в плазма-тической мембране, выделенной из клеток корня соленакапливающего галофита Suaeda altissima//Физиология растений. -2005. -Т. 52. -С. 717-725.
- Palmgren M.G. Acridine orange as a probe for measuring pH gradients across membranes mechanism and limitations//Anal. Biochem. -1991. -V. 192, I. 2. -P. 316-321.
- Overly C.C., Lee K.D., Berthiaume E., Hollenbeck P.J. Quantitative measurement of intraorganelle pH in the endosomal-lysosomal pathway in neurons by using ratiometric imaging with pyranine//PNAS. -1995. -V.92, I. 8. -P. 3156-3160.
- Akerman K.E., Wikstrцm M.K. Safranine as a probe of the mitochondrial membrane potential//FEBS Letters. -1976. -V. 68, I. 2. -P. 191-197.


