Функциональное состояние Saccaromices Cerevisae после фемтосекундного лазерного излучения
Автор: Долгова Динара Ришатовна, Абакумова Татьяна Владимировна, Фомина Анастасия Владимировна, Воронова Ольга Сергеевна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Фундаментальная биология и медицина
Статья в выпуске: 2, 2014 года.
Бесплатный доступ
В работе рассмотрено влияние фемтосекундного лазерного излучения (ФСЛИ) на параметры системы «перекисное окисление липидов - антиоксиданты» клеток Saccaromices Cerevisae. Выявлено дозозависимое изменение уровня МДА, каталазы, потенциала GSH/GSSG после ФСЛИ. Методом атомно-силовой микроскопии выявлено статистически значимое снижение ригидности мембраны дрожжевых клеток после воздействия ФСЛИ.
Фемтосекундное лазерное излучение, перекисное окисление липидов, антиоксиданты, ригидность
Короткий адрес: https://sciup.org/14112988
IDR: 14112988 | УДК: 579.22:53.047
Текст научной статьи Функциональное состояние Saccaromices Cerevisae после фемтосекундного лазерного излучения
Введение. ∗ Изучение влияния различных физических факторов на биологическую активность ценных микроорганизмов, таких как дрожжи, имеет большое теоретическое и практическое значение. Дрожжи (Saccaromi-ces Cerevisae) являются удобной моделью, применяющейся при многочисленных фотобиологических исследованиях в качестве альтернативы клеточным культурам и экспериментальным животным [13, 14]. Различают 2 основные группы способов активации дрожжевых клеток: химические (антимикробные и ферментные препараты; минеральные вещества Zn, Fe, Cu, Se) и физические (температура, оптическое излучение, ультрафиолет; комплексная обработка дрожжей молекулярным кислородом и магнитным полем и др). В серии экспериментальных работ по облучению S. Cerevisae доказано, что эффект
∗ Работа поддержана грантом государственного задания Минобрнауки России.
лазерного воздействия на дрожжевые клетки неоднозначен, зависит от дозы, времени облучения и температурных режимов [5, 6]. В работах Ж.К. Усембаевой установлено, что лазерное излучение с длиной волны 632,8 нм может служить фактором оптимизации в управлении процессами метаболизма [4]. Э.Ш. Исмаиловым исследовано влияние лазерного излучения на рост, развитие и продуктивность дрожжевых микроорганизмов. Показано, что при определенных параметрах лазерное излучение оказывает стимулирующее, благоприятное воздействие, которое выражается в увеличении биомассы дрожжей и повышении их энергии брожения при выращивании на жидких питательных средах [2]. Актуальным является изучение возможности использования фемтосекундных лазерных импульсов (ФСЛИ) в биомедицинских исследованиях ввиду предполагаемого отсутствия термического эффекта, высокой пиковой мощности (кВт) при низкой средней (мВт).
Исследований по изучению влияния фемтосекундных лазеров на морфофункциональное состояние S. Cerevisae в доступной нам литературе не найдено.
Цель исследования. Оценка влияния фемтосекундного лазерного излучения на морфофункциональное состояние S. Cerevisae.
Материалы и методы. В исследовании использована суточная культура Saccaromi-ces Cerevisae. Жидкая питательная среда для культивирования клеток состояла из 2 % сахарозы, 2 % пептона и 1 % дрожжевого экстракта. Характеристики используемого фемтосекундного лазера: длительность импульса – 82·10-15 с; частота следования импульсов – (200–250)·10-15 с-1, средняя мощность – 1,26 мВт; пиковая мощность – 6 кВт; длина волны – 1550 нм. Облучение проводилось в пластиковых чашках Петри диаметром 35 мм на расстоянии 7 см от световода лазера. Интенсивность облучения составила 0,82 Вт/см2. Плотность потока энергии при этом составила 0,49, 0,74, 1,47, 2,95 Дж/см2 при экспозиции соответственно 10, 15, 30, 60 мин. Интенсивность перекисного окисления липидов (ПОЛ) оценивали по уровню вторичного продукта – малонового диальдегида (МДА) в тесте с тиобарбитуровой кислотой спектрофотометрически при 535 нм [1]. Активность каталазы определяли по А.И. Карпищенко [3]. Для определения соотношения глутатиона окисленного и восстановленного использовали спектрофотометрический метод, основанный на окислении GSH 2-нитро-5-ти-обензойной кислотой [10]. Для оценки топологии и ригидности мембраны S. Cerevisae использован метод сканирующей зондовой микроскопии (SolverPro, NT-MDT, Россия). Применялись фирменные кремниевые зонды с жесткостью 0,2 Н/м, радиус закругления кончика составлял 10 нм. Дрожжевые клетки сканировались в полуконтактном режиме. Ригидность мембран оценивалась по модулю Юнга, который рассчитывали согласно теории Герца [8].
Статистическая значимость полученных результатов оценивалась с помощью непараметрического критерия Манна–Уитни, коэффициента корреляции Спирмена с применением программы Stata 6.0.
Результаты и обсуждение. Реакции биологической системы на лазерное излучение в видимой и ближней ИК-областях связаны с физическими и химическими модификациями в фотоакцепторных молекулах, компонентах дыхательной цепи [9]. Такие изменения могут быть следствием изменений окислительно-восстановительных свойств и ускорения переноса электрона, изменения биохимической активности из-за переходного локального нагрева хромофоров, одноэлектронного автоокисления. Для достижения фотобиологических макроэффектов могут быть активированы различные пути протекания реакций. Каскад клеточных биохимических реакций, следующих за основными физическими и/или химическими изменениями, индуцируется светом в фотоакцеп-торных молекулах, которые не требуют добавочного света для активации. Эти эффекты связаны с изменениями гомеостаза клетки. Кроме того, важными являются окислительно-восстановительные процессы: увеличение окисления связано с увеличением жизнеспособности клетки, а снижение окисления – с торможением. Клетки с более низким рН, при котором окислительно-восстановительный статус снижается, более чувствительны к возбуждающему действию света, чем клетки с нормальными параметрами.
С химической точки зрения, оксидатив-ный стресс представляет собой значительное увеличение клеточного редокс-потенциала или существенное снижение восстановительной способности клеточных редокс-пар, таких как окисленный/восстановленный глутатион [7].
Данные, представленные в табл. 1, свидетельствуют о дозозависимом увеличении содержания продукта ПОЛ – малонового диальдегида, которое наблюдается только при 1,47 и 2,95 Дж/см2. При небольших значениях плотности потока энергии (0,49 и 0,74 Дж/см2) данные статистически значимо от контроля не отличаются.
Изучение активности фермента эндогенной антиоксидантной системы – каталазы – в культуральной среде S. Cerevisae после воздействия ФСЛИ показало, что наблюдается незначительное снижение активности иссле- дуемого фермента, наиболее выраженное при 1,47 Дж/см2 (табл. 1). Таким образом, возрастание уровня МДА при одновременном снижении активности каталазы позволяет предполагать возникновение оксидативного стресса при ФСЛИ в дозах 1,47 и 2,95 Дж/см2. ФСЛИ стимулирует ПОЛ только при накоплении определенной дозы световой энергии.
Данные, представленные на рис. 1, свидетельствуют о статистически значимом снижении ригидности и, соответственно, об увеличении упругих свойств мембраны клеток S. Cerevisae после ФСЛИ. Изменения наблюдаются при всех изученных плотностях потока энергии.
Таблица 1
Параметры системы «перекисное окисление липидов – антиоксиданты» в культуре S. Cerevisae после ФСЛИ при разных плотностях потока энергии
|
Параметр |
Контроль |
Плотность потока энергии, Дж/см2 |
|||
|
0,49 |
0,74 |
1,47 |
2,95 |
||
|
Каталаза, ммоль/мин/л |
0,560±0,061 |
0,480±0,043 |
0,450±0,047 |
0,370±0,041* |
0,390±0,044* |
|
МДА, мкмоль/л |
9,68±0,43 |
9,74±0,50 |
9,57±0,49 |
14,06±1,25* |
13,36±0,98* |
Примечание. * – данные статистически значимо отличаются от контрольных.
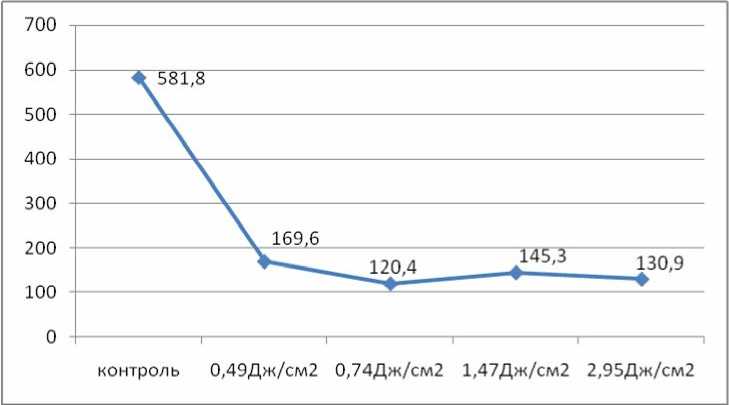
Рис. 1. Ригидность мембраны S. Cerevisae после различных доз ФСЛИ
Изучение окислительно-восстановительного потенциала клеток S. Сerevisae по уровню GSSG/GSH показало, что наиболее выраженные изменения наблюдаются при 0,49 Дж/см2 – 0,204±0,058 и при 1,47 Дж/см2 – 0,198±0,070, что статистически значимо ниже контрольных данных – 0,341±0,090. Таким образом, изменение окислительно-восстановительного потенциала S. сerevisae после воздействия ФСЛИ свидетельствует о снижении уровня восстановленного глутатиона, что ряд авторов связывает с развитием окси-дативного стресса [11, 12].
Анализ корреляционных связей между уровнем GSSG/GSH и процентом делящихся клеток после различных доз ФСЛИ показал, что накопление GSSG и снижение GSH, свидетельствующие о возникновении оксида- тивного стресса, наиболее выражены при ФСЛИ в дозах 0,49 и 1,47 Дж/см2 и коррелируют со снижением процента делящихся дрожжевых клеток.
Заключение. Таким образом, можно предполагать возможность изменения морфофункционального состояния дрожжевых клеток при воздействии ФСЛИ в диапазоне использованных доз.
radiation on yeast cell suspensions / S. Anghel [et al.] // Proc. of SPIE. – 2000. – Vol. 4068. – P. 758–764.
-
7. Friedmann H. SPIE Proceedings / H. Friedmann, R. Lubart // Effects of Low-Power Light on Biological Systems. – 1996. – Vol. 2630. – P. 60–64.
-
8. Henderson R. M. Pushing, pulling, dragging, and vibrating renal epithelia by using atomic force microscopy / R. M. Henderson, H. Oberleithner // Am. J. Physiol. Renal Physiol. – 2000. – Vol. 278 (5). – Р. 689–701.
-
9. Karu T. I. Biophysical basis of low-power-laser effects / T. I. Karu // Proceedings of SPIE. – 1996. – Vol. 2802. – P. 142–151.
-
10. Khramtsov V. V. Esr study of proton transport across phospholipid vesicle membranes / V. V. Khramtsov, M. V. Panteleev, L. M. Weiner // J. Bioch. Biophys. Methods. – 1989. – Vol. 18. – P. 237–246.
-
11. Shackelford R. E. Oxidative stress and cell cycle checkpoint function / R. E. Shackelford, W. K. Kaufmann, R. S. Paules // Free Radic. Biol. Med. – 2000. – Vol. 28 (9). – P. 1387–1404.
-
12. Shapira M. Disruption of yeast forkhead-associated cell cycle transcription by oxidative stress / M. Shapira, E. Segal, D. Botstein // Mol. Biol. Cell. – 2004. – Vol. 15 (12). – P. 5659–5669.
-
13. Stаnеscu C. Competing phenomena in laser effects on the growth of yeast cell colonies / C. Stа-nescu, S. Anghel // J. of Optoelectronics and Advanced Material. – 2002. – Vol. 4, № 1. – Р. 129–134.
-
14. Tashiro H. Yeast, a convenient model system to study the biological effects of laser irradiation / H. Tashiro, G. Lazarova // Focused on Microbial Diversity. – 1993. – Vol. 3. – Р. 37–38.
FUNCTIONAL STATE OF SACCAROMICES CEREVISAE AFTER FEMTOSECOND LASER IRRADIATION
D.R. Dolgova, T.V. Abakumova, A.V. Fomina, O.S. Voronova
Ulyanovsk State University
Список литературы Функциональное состояние Saccaromices Cerevisae после фемтосекундного лазерного излучения
- Андреева Л. И. Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой/Л. И. Андреева, Л. А. Кожемякин, А. А. Кишкун//Лаб. дело. -1988. -№ 11. -С. 41-43.
- Действие лазерного излучения на биотехнологические свойства дрожжей/Э. Ш. Исмаилов [и др.]//Вестн. Дагестанского научного центра. -2007. -№ 29. -С. 44-46.
- Карпищенко А. И. Медицинские лабораторные технологии и диагностика: справочник: в 2 т./А. И. Карпищенко. -СПб.: Интермедика, 1999. -532 c.
- Усембаева Ж. К. Действие низкоинтенсивного лазерного излучения на свойства дрожжей/Ж. К. Усембаева. -URL: http://skutis.ucoz.ru/publ/26-1-0-16.
- Федорова Н. Н. Лазерная активация хлебопекарных дрожжей/Н. Н. Федорова, Ж. К. Усеембаева, А. Н. Нусупкулова//Электронная обработка материалов. -1970. -№ 3 (33). -С. 31-32.
- Biostimulation effects of low-energy laser radiation on yeast cell suspensions/S. Anghel [et al.]//Proc. of SPIE. -2000. -Vol. 4068. -P. 758-764.
- Friedmann H. SPIE Proceedings/H. Friedmann, R. Lubart//Effects of Low-Power Light on Biological Systems. -1996. -Vol. 2630. -P. 60-64.
- Henderson R. M. Pushing, pulling, dragging, and vibrating renal epithelia by using atomic force microscopy/R. M. Henderson, H. Oberleithner//Am. J. Physiol. Renal Physiol. -2000. -Vol. 278 (5). -Р. 689-701.
- Karu T. I. Biophysical basis of low-power-laser effects/T. I. Karu//Proceedings of SPIE. -1996. -Vol. 2802. -P. 142-151.
- Khramtsov V. V. Esr study of proton transport across phospholipid vesicle membranes/V. V. Khramtsov, M. V. Panteleev, L. M. Weiner//J. Bioch. Biophys. Methods. -1989. -Vol. 18. -P. 237-246.
- Shackelford R. E. Oxidative stress and cell cycle checkpoint function/R. E. Shackelford, W. K. Kaufmann, R. S. Paules//Free Radic. Biol. Med. -2000. -Vol. 28 (9). -P. 1387-1404.
- Shapira M. Disruption of yeast forkhead-associated cell cycle transcription by oxidative stress/M. Shapira, E. Segal, D. Botstein//Mol. Biol. Cell. -2004. -Vol. 15 (12). -P. 5659-5669.
- Stаnеscu C. Competing phenomena in laser effects on the growth of yeast cell colonies/C. Stаnescu, S. Anghel//J. of Optoelectronics and Advanced Material. -2002. -Vol. 4, № 1. -Р. 129-134.
- Tashiro H. Yeast, a convenient model system to study the biological effects of laser irradiation/H. Tashiro, G. Lazarova//Focused on Microbial Diversity. -1993. -Vol. 3. -Р. 37-38.


