Функциональное состояние системы глутатиона в жировой ткани крыс при метаболическом синдроме
Автор: Ю.Г. Бирулина, В.В. Иванов, Е.Е. Буйко, О.В. Воронкова
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.38, 2023 года.
Бесплатный доступ
Цель исследования: изучить функциональное состояние компонентов глутатион-зависимой антиоксидантной системы в жировой ткани крыс при экспериментальном метаболическом синдроме (МС). Материал и методы. Модель МС была воспроизведена на крысах-самцах линии Wistar с использованием высоко- жировой и высокоуглеводной диеты (ВЖВУД). У животных измеряли массу тела и жировой ткани. В сыворотке крови оценивали содержание глюкозы, инсулина, лептина, триацилглицеролов, холестерола. В эпидидимальной жировой ткани определяли уровень активных форм кислорода (АФК) флуоресцентным методом, концентрацию восстановлен- ного (GSH) и окисленного (GSSG) глутатиона, активность ферментов глутатионредуктазы, глутатионпероксидазы и глутатион-S-трансферазы оценивали спектрофотометрически. Результаты. Установлено, что ВЖВУД приводила к увеличению массы тела, ожирению, гипергликемии, инсулинорези- стентности, дислипидемии, лептинемии у крыс опытной группы. Повышение массы жировой ткани имело положитель- ную взаимосвязь с увеличением концентрации глюкозы, лептина в сыворотке крови и уровня АФК в эпидидимальной жировой ткани крыс с МС. Обнаружено, что уровень общего глутатиона в жировой ткани крыс опытной группы снижал- ся главным образом за счет уменьшения содержания GSH. У крыс, получавших ВЖВУД, также отмечалось снижение активности глутатионпероксидазы и глутатион-S-трансферазы, но повышение глутатионредуктазной активности. Заключение. Ожирение как ключевой компонент МС является триггером развития инсулинорезистентности, хронического воспаления и окислительного стресса. В исследовании показано, что при МС и ожирении происходит сдвиг редокс-баланса адипоцитов в сторону прооксидантной активности, что выражается в уменьшении отношения GSH/ GSSG и снижении активности глутатион-зависимых ферментов антиперекисной защиты.
Глутатион, активные формы кислорода, окислительный стресс, метаболический синдром, ожирение
Короткий адрес: https://sciup.org/149141586
IDR: 149141586 | УДК: 616-008.9:577.121.7:611.018.26]-092.9 | DOI: 10.29001/2073-8552-2023-38-1-99-105
Текст научной статьи Функциональное состояние системы глутатиона в жировой ткани крыс при метаболическом синдроме
Как известно, метаболический синдром (МС) характеризуется комплексом клинико-лабораторных маркеров, ассоциированных с инсулинорезистентностью и ожирением [1–3]. Одним из основных проявлений дисфункции клеточных элементов жировой ткани (адипоцитов и клеток стромально-сосудистой фракции) при ожирении является нарушение их секреторной активности, которое характеризуется усилением наработки провоспалитель-ных и снижением продукции противовоспалительных факторов [4]. Существует прямая связь между хроническим воспалением, индуцированным клетками жировой ткани, и развитием окислительного стресса [5, 6]. Исследования подтверждают тот факт, что медиаторы хронического воспаления формируют и усиливают реакции окислительного стресса, что делает его неотъемлемым патогенетическим фактором ожирения и его возможных осложнений, таких как сахарный диабет 2-го типа, сердечно-сосудистые заболевания [7].
Несмотря на то, что активные формы кислорода (АФК) выполняют важную роль регуляторов в многочисленных межклеточных сигнальных каскадах, их высокая концентрация может опосредовать повреждение клеточных компонентов и вызвать нарушение внутриклеточного метаболизма [8]. Поддержание на определенном уровне внутриклеточных механизмов антиоксидантной защиты обеспечивает динамическое равновесие системы генерации свободных радикалов [9, 10]. Одним из них является система глутатиона, включающая восстановленную (GSH) и окисленную (GSSG) формы трипептида, а также антиоксидантные ферменты (глутатионредуктазу, глутатионпероксидазу, глутатион-S-трансферазу) [11]. Сведения о ее роли в контролировании окислительно-восстановительного равновесия в клетках жировой ткани немногочисленны и главным образом сводятся к изучению активности отдельных антиоксидантных ферментов [12, 13].
Цель исследования: изучение функционального состояния компонентов глутатион-зависимой антиоксидантной системы в жировой ткани крыс при экспериментальном МС.
Материал и методы
Модель диет-индуцированного МС была воспроизведена на 12 крысах-самцах аутбредной линии Wistar (масса – 242,3 ± 38,5 г; возраст – 6 нед. на начало исследования) в течение 12 нед. по ранее описанной методике [14]. В контрольную группу было включено 11 крыс, сопоставимых по массе и возрасту, которые в течение всего эксперимента находились на стандартном лабораторном корме со свободным доступом к пище и воде. Исследования были выполнены с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации, одобрены Комиссией по контролю содержания и использования лабораторных животных (IACUC) ФГБОУ ВО СибГМУ Минздрава России (протокол № 1 от 25.04.2022 г.).
Спустя 12 нед. животных выводили из эксперимента СО2-эвтаназией. Выполняли забор крови из сердца, которую затем центрифугировали 10 мин при 2000 g для получения сыворотки. Извлекали и взвешивали висцеральную жировую ткань (мезентериальную, эпидидимальную и забрюшинную жировую клетчатку), фрагменты эпидидимальной жировой ткани замораживали в жидком азоте. Полученные аликвоты сыворотки крови и образцы жировой ткани хранили при температуре не выше –70 °С.
В сыворотке крови определяли концентрацию глюкозы (набор Glucose-TR, Chronolab, Испания), триацилгли-церолов, холестерола (наборы Триглицериды, Холестерин, Ольвекс Диагностикум, РФ), инсулина (Insulin Rat ELISA Kit, Thermo Fisher Scientifiс, США) и лептина (Rat Leptin ELISA Kit, ELK Biotechnology, КНР). Индекс HOMA-IR (Homeostasis Model Assessment of Insulin Resistance) рассчитывали как (сывороточный инсулин) × (сывороточная глюкоза) / 22,5.
Содержание АФК в эпидидимальной жировой ткани определяли по методу L. Liu и соавт. [15], для чего навески жировой ткани (50 мг) после размораживания переносили в буферный раствор (5 мМ HEPES в PBS, pH 7,4), содержащий 10 мкМ 2,3-дигидродихлорфлуоресцеина диацетат, и инкубировали 1 ч при 37 °С. После инкубации образцы ткани трижды промывали буферным раствором, затем добавляли 300 мкл лизирующего буфера (0,1% SDS, 0,05 M Tris-HCl, pH 7,4) и инкубировали 15 мин при 4 °С с последующим центрифугированием при 16000 g в течение 20 мин. Супернатант собирали и оценивали флуоресценцию при длине волны возбуждения 530 нм и длине волны испускания 485 нм с помощью микропланшет-ного ридера (Infinite 200 Pro M-plex, Tecan, Швейцария).
Для определения содержания восстановленного (GSH) и окисленного (GSSG) глутатиона жировую ткань после размораживания (100 мг) гомогенизировали в 1,9 мл 5% раствора сульфосалициловой кислоты, затем центрифугировали при 15000 g (2–4 °C, 15 мин), собирали супернатант. Принцип метода определения основан на взаимодействии GSH с 5,5-дитиобис-(2-нитробензойной кислотой) (ДТНБ) с образованием тио-2-нитробензой-ной кислоты, имеющей максимум поглощения при длине волны 412 нм [16]. При этом образуется GSSG, который восстанавливается глутатионредуктазой, а GSH вновь взаимодействует с ДТНБ. Для определения GSSG пробы предварительно инкубировали с блокатором SH-групп – 2-винилпиридином. Расчет содержания общего глутатиона и GSSG производили с помощью калибровочных графиков для растворов GSН и GSSG (MP Biomedicals, США) в концентрациях от 0,1 до 150 нМ. Уровень GSН рассчитывали как разницу между концентрацией общего глутатиона и GSSG. Результаты представляли в нмоль/ мг белка.
Для измерения активности антиоксидантных ферментов готовили гомогенат из эпидидимальной жировой ткани в 0,05 М калий-фосфатном буфере, содержащем 1 мM ЭДТА, рН 7,5 (соотношение ткань: буфер составляло 1 : 3) при 2–4 °C. Полученные гомогенаты центрифугировали при 15000 г (2–4 °C, 15 мин), собирали супернатант. Активность глутатионредуктазы оценивали по кинетике изменения концентрации тио-2-нитробензойной кислоты в присутствии НАДФH2 на спектрофотометре СФ-2000 (Спектр, РФ) при длине волны 412 нм.
Глутатионпероксидазную активность определяли в сопряженной глутатионредуктазной системе по скорости окисления НАДФН2 при длине волны 340 нм с гидропероксидом трет-бутила в качестве субстрата. Активность глутатион-S-трансферазы оценивали по скорости реакции образования глутатион-S-конъюгатов между GSH и 1-хлор-2,4-динитробензолом при длине волны 340 нм. Активность ферментов выражали в нмоль/(мин*мг белка). Количественное определение белка выполняли в реакции с бицинхониновой кислотой (BCA Protein Assay Kit, Sigma-Aldrich, США).
Статистическую обработку результатов исследований проводили в программе SPSS STATISTICS 23 (IBM, США). Количественные данные, подчиняющиеся нормальному закону распределения, представлены в виде среднего (М) и стандартного отклонения (± SD ), неподчиняющиеся – в виде медианы ( Me ), 25-го и 75-го перцентилей ( Q 25; Q 75). Для анализа различий между выборками использовали t -критерия Стьюдента или U -критерия Манна – Уитни. Статистически значимыми считали различия при p < 0,05. Для оценки взаимосвязи между показателями определяли коэффициент ранговой корреляции Спирмена.
Результаты
ВЖВУД, использованная в эксперименте для моделирования алиментарного МС у крыс, вызывала увеличение массы тела животных, удельной массы висцеральной жировой ткани. ВЖВУД способствовала повышению уровня глюкозы, инсулина и лептина в сыворотке крови крыс опытной группы (табл. 1). Корреляционный анализ показал сильную прямую корреляционную связь между содержанием глюкозы и инсулина в крови ( r = 0,814; p < 0,001). Величина индекса инсулинорезистентности HOMA-IR у крыс с диет-индуцированным МС статистически значимо превышала таковую у группы контроля. Увеличение концентрации лептина в крови животных опытной группы положительно коррелировало с уровнем глюкозы ( r = 0,839; p < 0,001), массой тела ( r = 0,560; p = 0,005) и массой абдоминального жира ( r = 0,475; p = 0,022). У крыс опытной группы также наблюдалось статистически значимое увеличение содержания триацилгли-церолов и холестерола в крови по сравнению с группой контроля (см. табл. 1).
Таблица 1. Показатели метаболического статуса крыс контрольной и опытной группы, M ± SD
Table 1. Parameters of the metabolic status of rats in the control and experimental groups, M ± SD
|
Параметры Parameters |
Группа Group |
|
|
Контрольная ( n = 11) Control ( n = 11) |
Опытная ( n = 12) Experimental ( n = 12) |
|
|
Масса тела, г Body weight, g |
435,5 ± 27,1 |
481,9 ± 36,6 ( р = 0,003) |
|
Удельная масса жировой ткани, г Adipose tissue/ body weight ratio, g |
2,4 ± 0,8 |
3,7 ± 0,9 ( р = 0,004) |
|
Глюкоза, ммоль/л Glucose, mmol/l |
5,5 ± 0,4 |
7,4 ± 0,8 ( р < 0,001) |
|
Инсулин, пмоль/л Insulin, pmol/l |
11,3 ± 1,9 |
22,2 ± 2,6 ( р < 0,001) |
|
HOMA-IR |
0,4 ± 0,1 |
1,1 ± 0,3 ( р = 0,002) |
|
Лептин, нг/мл Leptin, ng/ml |
2,2 ± 0,4 |
4,2 ± 0,4 ( р < 0,001) |
|
Триацилглицеролы, ммоль/л Triacylglycerols, mmol/l |
0,9 ± 0,2 |
1,6 ± 0,4 ( р = 0,001) |
|
Холестерол, ммоль/л Cholesterol, mmol/l |
1,8 ± 0,3 |
2,5 ± 0,6 ( р = 0,015) |
Примечание: здесь и в таблице 2: р – различия по сравнению с контрольной группой. HOMA-IR – гомеостатическая модель оценки инсулинорезистентности.
Note: here and in table 2: р – significance vs. control group. HOMA-IR – Homeostasis Model Assessment of Insulin Resistance.
Уровень АФК в эпидидимальной жировой ткани крыс с диет-индуцированным МС в 1,4 раза (р = 0,007) превышал значение в контрольной группе животных (табл. 2).
Таблица 2. Содержание общего глутатиона, активность глутатион-за-висимых ферментов и уровень активных форм кислорода в жировой ткани крыс контрольной и опытной группы, Me ( Q 25; Q 75)
Table 2. Total glutathione content, activity of glutathione-dependent enzymes and level of reactive oxygen species in adipose tissue of rats in the control and experimental groups, Me ( Q 25; Q 75)
|
Параметры Parameters |
Группа Group |
|
|
Контрольная ( n = 11) Control ( n = 11) |
Опытная ( n = 12) Experimental ( n = 12) |
|
|
GSH+GSSG, нмоль/мг белка GSH+GSSG, nmol/mg of protein |
9,5 (8,1; 9,8) |
6,4 (5,7; 7,4) р < 0,001 |
|
GSH/GSSG |
24,9 (21,5; 28,0) |
11,6 (9,2; 13,4) р < 0,001 |
|
Глутатионредуктаза, нмоль/(мин × мг белка) Glutathione reductase, nmol/(min × mg of protein) |
31,9 (26,5; 35,5) |
45,2 (41,1; 60,1) р < 0,001 |
|
Глутатионпероксидаза, нмоль/(мин × мг белка) Glutathione peroxidas, nmol/(min × mg of protein) |
154,1 (143,1; 174,9) |
139,4 (105,9; 151,6) р = 0,008 |
|
Глутатион-S-трансфераза, нмоль/(мин × мг белка) Glutathione-S-transferase, nmol/(min × mg of protein) |
397,3 (293,3; 555,3) |
227,9 (145,6; 291,1) р = 0,005 |
АФК, усл. ед. 2,4 (2,1; 2,6)
ROS, a.u. 1,8 (1,3; 2,2) р = 0,007
Уровень общего глутатиона в жировой ткани крыс с экспериментальным МС статистически значимо снизился в 1,5 раза ( p < 0,001) по сравнению с аналогичным показателем у крыс контрольной группы (см. табл. 2), что главным образом было обусловлено снижением содержания восстановленной формы трипептида (рис. 2). При этом у животных опытной группы отмечалось статистически значимое повышение содержания окисленной формы глутатиона (рис. 3).
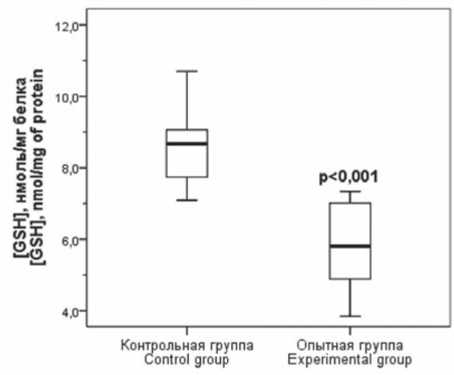
Рис. 2. Содержание воcстановленного глутатиона в эпидидимальной жировой ткани крыс контрольной и опытной группы, р – различия по сравнению с контрольной группой
Fig. 2. Concentration of reduced glutathione in the epididymal adipose tissue of control and experimental rats, р – significance to control group
Примечание: р – различия по сравнению с контрольной группой, АФК – активные формы кислорода, GSH+GSSG – общий глутатион, GSH/GSSG – отношение уровня восстановленного глутатиона (GSH) к окисленному глутатиону (GSSG).
Note: р – significance vs. control group, ROS – reactive oxygen species, GSH+GSSG – total glutathione, GSH/GSSG – reduced glutathione (GSH)/oxidized glutathione (GSSG) ratio.
Анализ показал наличие положительной прямой корреляционной связи между количеством продуцируемых АФК, концентрацией глюкозы ( r = 0,522; p = 0,002), лептина ( r = 0,553; p = 0,006) и удельной массой висцерального жира (рис. 1).
Удельная масса жировой ткани, г Adipose tissue/body weight ratio, g
Рис. 1. Зависимость уровня активных форм кислорода от удельной массы жировой ткани крыс контрольной и опытной группы; r – коэффициент корреляции Спирмена, р – различия по сравнению с контрольной группой
Fig. 1. Relationship of the level of reactive oxygen species with the adipose tissue/body weight ratio in rats of the control and experimental groups; r – Spearman’s correlation coefficient; р – significance vs. control group
Рис. 3. Содержание окисленного глутатиона в эпидидимальной жировой ткани крыс контрольной и опытной группы, р – различия по сравнению с контрольной группой
Fig. 3. Concentration of oxidized glutathione (GSSG) in the epididymal adipose tissue of control and experimental rats, р – significance vs. control group
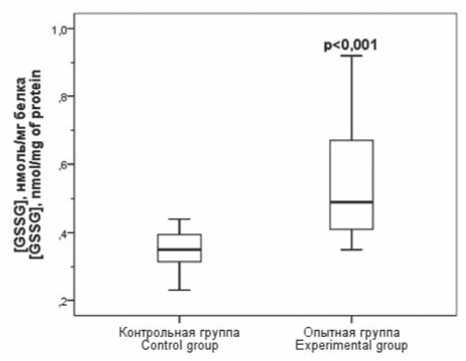
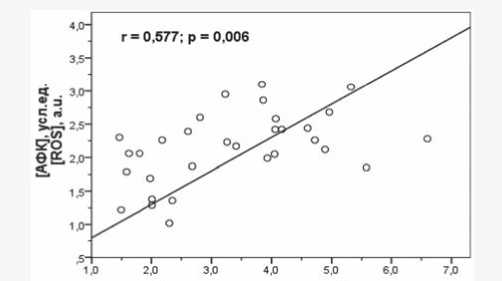
Рис. 4. Зависимость уровня восстановленного глутатиона от удельной массы жировой ткани крыс контрольной и опытной группы. r – коэффициент корреляции Спирмена, р – различия по сравнению с контрольной группой
Fig. 4. Relationship of the level of reduced glutathione with the adipose tissue/body weight ratio in rats of the control and experimental groups. r – Spearman’s correlation coefficient, р – significance vs. control group
Соотношение GSH/GSSG также статистически значимо снижалось у животных с экспериментальным МС (см. табл. 2). Установлено, что между концентрацией GSH в жировой ткани и ее удельной массой наблюдалась от- рицательная корреляция (рис. 4), тогда как между содержанием GSSG и удельной массой жировой ткани существует положительная взаимосвязь (r = 0,573; p = 0,001).
При этом содержание общего глутатиона эпидидимальной жировой ткани отрицательно коррелировало ( r = –0,477; p = 0,005) с концентрацией в ней АФК. Развитие метаболических нарушений при ВЖВУД приводило к снижению активности глутатион-зависимых ферментов антиоксидантной защиты глутатионпероксидазы и глута-тион-S-трансферазы (см. табл. 2) в клетках жировой ткани крыс, но, напротив, вызывало повышение глутатион-редуктазной активности.
Обсуждение
Патогенез МС представляет собой сложную систему взаимодействующих факторов, характеризующих нарушения обменных процессов и внутриклеточного гомеостаза на фоне пониженной чувствительности тканей к инсулину [1, 7]. Висцеральное ожирение как один из компонентов МС является триггером для возникновения множества системных метаболических нарушений, опосредующих нейроиммуноэндокринную дисфункцию на системном уровне [4–6].
Современные исследования показывают, что гипертрофия адипоцитов тесно связана с развитием резистентности к инсулину, хроническим воспалением и окислительным стрессом [6, 9]. Отличительным признаком дисфункции адипоцитов является неспособность клеток накапливать избыток нутриентов в виде внутриклеточных липидов, что приводит к повышению концентрации триацилглицеролов и свободных жирных кислот в крови и сопровождается эктопическим накоплением жиров, например, в печени, скелетных мышцах, поджелудочной железе и миокарде.
На этом фоне в организме реализуются системные липотоксические эффекты, а жировая ткань приобретает провоспалительный функциональный статус вследствие нарушения процессов регуляции секреции адипокинов (гормонов лептина, адипонектина, резистина и др.) и адипоцитокинов (IL-6, IL-8, TNFα, хемокина CCL2, IL-10) [1, 2]. Так, при ожирении уровень лептина, который секретируется почти исключительно адипоцитами, значительно повышается [4], что может провоцировать возникновение окислительного стресса через стимуляцию окисления жирных кислот в митохондриях [6], активацию НАДФН-оксидазы (NOX) и индукцию продукции перекиси водорода (H2O2) и гидроксильных радикалов [10], а также стимулировать активацию моноцитов и макрофагов в жировой ткани [4].
Повышение продукции АФК в жировой ткани является одной из характеристик нарушения функции адипоцитов при их гипертрофии, способствует нарушению окислительно-восстановительного баланса и является одним из факторов формирования инсулинорезистентности [7, 8]. Вместе с тем показано, что значительное возрастание интенсивности наработки АФК в адипоцитах крыс, находившихся на диете с высоким содержанием сахарозы более 15 нед., было тесно связано с развитием гипергликемии [4].
Примечательно, что адипоциты, по-видимому, адаптируются к динамическим изменениям уровней АФК и используют их в качестве вторичных мессенджеров. Было обнаружено, что H2O2 имитирует действие инсулина: воздействие H2O2 на адипоциты приводило к быстрой транслокации переносчиков глюкозы и увеличению поглощения глюкозы, усилению синтеза липидов [8]. Однако избыток АФК провоцирует окислительное повреждение молекулярных компонентов клеток, что приводит к перекисному окислению липидов и/или карбонилированию белков [17, 18]. Окислительная модификация белков преимущественно происходит путем прямого окисления аминокислот пролина, треонина, лизина и аргинина. Результаты исследований свидетельствуют о том, что окислительный стресс приводит к интенсивному окислению и карбонилированию многочисленных белков, опосредующих дисфункцию жировой ткани, включая FABP4 или GLUT4, что, вероятно, вызывает утрату их функциональной активности [17].
В реализованной нами модели МС убедительно показано, что ВЖВУД приводит к изменению физиологических и биохимических показателей, что находит свое отражение в избыточном накоплении жировой ткани, гипергликемии, инсулинемии, инсулинорезистентности, дислипидемии, лептинемии у животных экспериментальной группы. При этом, как нами установлено, повышение удельной массы жировой ткани взаимосвязано с увеличением концентрации глюкозы, лептина в сыворотке крови и уровня АФК в эпидидимальной жировой ткани животных с МС. Полученные результаты соотносятся с данными литературных источников, что служит подтверждением эффективности ВЖВУД для создания животных моделей МС [4, 9], а также подтверждает ее состоятельность для оценки про- и антиоксидантной активности жировой ткани.
Окислительный стресс, возникающий в жировой ткани, может быть обусловлен не только повышением продукции АФК, но и снижением антиоксидантной защиты адипоцитов. Так, у крыс, получавших высокоуглеводный корм, было зафиксировано снижение активности супе-роксиддисмутазы, каталазы, глутатионпероксидазы, глу-татионредуктазы, начиная с 3-й нед. эксперимента [4]. В клинических исследованиях было установлено, что экспрессия глутатионпероксидазы была значительно ниже в жировой ткани пациентов с сахарным диабетом 2-го типа по сравнению со здоровыми добровольцами [12]. Отмечается, что в жировой ткани мышей, содержавшихся на ВЖВУД, концентрация фермента глутатион-S-транс-феразы, участвующего в метаболизме прооксидантного альдегида 4-HNE, была снижена примерно в 3–4 раза вследствие карбонилирования [18].
Наряду с антиоксидантными ферментами важную роль в нейтрализации эндогенных АФК выполняет трипептид GSH [11, 19]. Антиоксидантная функция GSH в основном реализуется за счет реакций, катализируемых глутатионпероксидазой, которая восстанавливают H2O2 и гидроперекиси липидов по мере того, как GSH окисляется до GSSG, последний в свою очередь восстанавливается обратно до GSH глутатионредуктазой за счет НАДФН. Таким образом, важным показателем внутриклеточного редокс-баланса является отношение GSH к GSSG. При окислительном стрессе нарушается способность клеток восстанавливать GSSG до GSH, что приводит к накоплению GSSG и истощению запасов GSH [19].
В нашем исследовании было также установлено, что уровень общего глутатиона в жировой ткани крыс с ожирением снизился главным образом за счет уменьшения содержания GSH. Баланс GSH/GSSG сместился в сторону преобладания окисленной формы трипептида. Причем содержание общего глутатиона уменьшилось пропорционально увеличению уровня АФК в жировой ткани крыс, содержавшихся в течение 12 нед. на ВЖВУД. Кроме того, у животных опытной группы отмечалось снижение активности глутатионпероксидазы и глутатион-S-трансфера-зы, но повышение глутатионредуктазной активности.
Подобное изменение редокс-баланса при МС может свидетельствовать о дисфункции и недостаточности нейтрализующего действия системы глутатиона при образующемся избытке АФК. Однако, несмотря на то, что большинство экспериментальных данных указывает на угнетение активности глутатион-зависимой антиоксидантной ферментативной системы, существуют сведения, что снижение функции глутатионпероксидазы и повышение экспрессии гамма-глутамилцистеин-синтетазы приводили к избыточному накоплению GSH в изолированных 3T3-L1 адипоцитах [20]. Равно как и у трансгенных мышей с гиперэкспрессией глутатионпероксидазы, отмечалось снижение чувствительности адипоцитов к инсулину [11].
Неоднозначность описанных в научной литературе эффектов антиоксидантных ферментов создает предпосылки для дальнейшего изучения их активности в различных тканях на фоне нарушений обмена веществ, характерных для данного синдрома.
Заключение
Ожирение как ключевой компонент МС является триггером для формирования инсулинорезистентности, хронического вялотекущего воспаления с системными проявлениями, в том числе за счет реакций окислительного стресса. В экспериментальной модели МС было исследовано функциональное состояние глутатион-зависимой антиоксидантной системы и ее роль в формировании метаболической дисфункции жировой ткани.
Установлено, что формирование МС и избыточное накопление висцерального жира у крыс на фоне ВЖВУД приводит к сдвигу окислительно-восстановительного баланса адипоцитов в сторону усиления их прооксидантной активности в совокупности с угнетением глутатион-зави-симой антиоксидантной системы. Учитывая высокую распространенность МС и возможные осложнения, необходимо углубленное изучение его патогенеза на клеточном и молекулярном уровнях с целью совершенствования способов профилактики и тактики лечения системных заболеваний, ассоциированных с кардиометаболическим риском.
Список литературы Функциональное состояние системы глутатиона в жировой ткани крыс при метаболическом синдроме
- Bremer A.A. Jialal I. Adipose tissue dysfunction in nascent metabolic syndrome. J. Obes. 2013:393192. DOI: 10.1155/2013/393192.
- Lacobini C., Pugliese G., Blasetti Fantauzzi C., Federici M., Menini S. Metabolically healthy versus metabolically unhealthy obesity. Metabolism. 2019;92:51–60. DOI: 10.1016/j.metabol.2018.11.009.
- Беспалова И.Д., Калюжин В.В., Мурашев Б.Ю., Осихов И.А., Кощавцева Ю.И., Тетенева А.В. и др. Субпопуляционный состав и прооксидантная активность клеток висцеральной жировой ткани пациенток с метаболическим синдромом. Сибирский журнал клинической и экспериментальной медицины. 2022;37(3):114–120. [Bespalova I.D., Kalyuzhin V.V., Murashev B.Yu., Osikhov I.A., Koshchavtseva Y.I., Teteneva A.V. et al. Subpopulation composition and prooxidant activity of visceral adipose tissue cells in patients with metabolic syndrome. The Siberian Journal of Clinical and Experimental Medicine. 2022;37(3):114–120. (In Russ.)]. DOI: 10.29001/2073-8552-2022-37-3-114-120.
- D’Alessandro M.E., Selenscig D., Illesca P., Chicco A., Lombardo Y.B. Time course of adipose tissue dysfunction associated with antioxidant defense, infl ammatory cytokines and oxidative stress in dyslipemic insulin resistant rats. Food Funct. 2015;6(4):1299–1309. DOI: 10.1039/c4fo00903g.
- Maslov L.N., Naryzhnaya N.V., Boshchenko A.A., Popov S.V., Ivanov V.V., Oeltgen P.R. Is oxidative stress of adipocytes a cause or a consequence of the metabolic syndrome? J. Clin. Transl. Endocrinol. 2018;15:1–5. DOI: 10.1016/j.jcte.2018.11.001.
- Masschelin P.M., Cox A.R., Chernis N., Hartig S.M. The impact of oxidative stress on adipose tissue energy balance. Front. Physiol. 2020;10:1638. DOI: 10.3389/fphys.2019.01638.
- Monserrat-Mesquida M., Quetglas-Llabrés M., Capó X., Bouzas C., Mateos D., Pons A. et al. Metabolic syndrome is associated with oxidative stress and proinfl ammatory state. Antioxidants. 2020;9(3):236. DOI: 10.3390/antiox9030236.
- Castro J.P., Grune T., Speckmann B. The two faces of reactive oxygen species (ROS) in adipocyte function and dysfunction. Biol. Chem. 2016;397(8):709–724. DOI: 10.1515/hsz-2015-0305.
- Lasker S., Rahman M.M., Parvez F., Zamila M., Miah P., Nahar K. et al. High-fat diet-induced metabolic syndrome and oxidative stress in obese rats are ameliorated by yogurt supplementation. Sci. Rep. 2019;9(1):20026. DOI: 10.1038/s41598-019-56538-0.
- Taherkhani S., Suzuki K., Ruhee R.T. A brief overview of oxidative stress in adipose tissue with a therapeutic approach to taking antioxidant supplements. Antioxidants (Basel). 2021;10(4):594. DOI: 10.3390/antiox10040594.
- Picklo M.J., Long E.K., Vomhof-DeKrey E.E. Glutathionyl systems and metabolic dysfunction in obesity. Nutrition Reviews. 2015;73(12):858–868. DOI: 10.1093/nutrit/nuv042.
- Langhardt J., Flehmig G., Klöting N., Lehmann S., Ebert T., Kern M. et al. Eff ects of weight loss on glutathione peroxidase 3 serum concentrations and adipose tissue expression in human obesity. Obes. Facts. 2018;11:475–490. DOI: 10.1159/000494295.
- Shin S.K., Cho H.W., Song S.E., Im S.S., Bae J.H., Song D.K. Oxidative stress resulting from the removal of endogenous catalase induces obesity by promoting hyperplasia and hypertrophy of white adipocytes. Redox Biol. 2020;37:101749. DOI: 10.1016/j.redox.2020.101749.
- Бирулина Ю.Г., Иванов В.В., Буйко Е.Е., Быков В.В., Смаглий Л.В., Носарев А.В. и др. Экспериментальная модель метаболического синдрома у крыс на основе высокожировой и высокоуглеводной диеты. Бюллетень сибирской медицины. 2020;19(4):14–20. [Birulina J.G., Ivanov V.V., Buyko E.E., Bykov V.V., Smagliy l.V., Nosarev A.V. et al. High-fat, high-carbohydrate diet-induced experimental model of metabolic syndrome in rats. Bulletin of Siberian Medicine. 2020;19(4): 14–20. (In Russ.)]. DOI: 10.20538/1682-0363-2020-4-14-20.
- Liu L., Zou P., Zheng L., Linarelli L. E., Amarel, S., Passaro A. et al. Tamoxifen reduces fat mass by boosting reactive oxygen species. Cell Death Dis. 2015;6(1):e1586. DOI: 10.1038/cddis.2014.553.
- Rahman I., Kode A., Biswas S. K. Assay for quantitative determination of glutathione and glutathione disulfi de levels using enzymatic recycling method. Nat. Protoc. 2006;1(6):3159–3165. DOI: 10.1038/nprot.2006.378.
- Boden G., Homko C., Barrero C.A., Stein T.P., Chen X., Cheung P. et al. Excessive caloric intake acutely causes oxidative stress, GLUT4 carbonylation, and insulin resistance in healthy men. Sci. Transl. Med. 2015;7:1–10. DOI: 10.1126/scitranslmed.aac4765.
- Navarro-Ruiz M.C., Soler-Vázquez M.C., Díaz-Ruiz A., Peinado J.R., Nieto Calonge A., Sánchez-Ceinos J. et al. Infl uence of protein carbonylation on human adipose tissue dysfunction in obesity and insulin resistance. Biomedicines. 2022;10(12):3032. DOI: 10.3390/biomedicines10123032.
- Lu S.C. Glutathione synthesis. Biochim. Biophys. Acta. 2013;1830(5):3143–3153. DOI: 10.1016/j.bbagen.2012.09.008.
- Kobayashi H., Matsuda M., Fukuhara A., Komuro R., Shimomura I. Dysregulated glutathione metabolism links to impaired insulin action in adipocytes. Am. J. Physiol. Endocrinol. Metab. 2009;296(6):E1326–E1334. DOI: 10.1152/ajpendo.90921.2008.


