Габитус и продуктивность люцерны (Medicago sativa L.) в зависимости от инокуляции штаммами Sinorhizobium meliloti, различающимися по солеустойчивости
Автор: Проворов Н.А., Онищук О.П., Курчак О.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Растительно-микробные взаимодействия в биологизированных агротехнологиях
Статья в выпуске: 3 т.51, 2016 года.
Бесплатный доступ
Симбиотическая эффективность (СЭ) клубеньковых бактерий (ризобий) характеризует их адаптивный потенциал и практическую значимость. Этот признак связан в первую очередь с фиксацией молекулярного азота (N2), которая осуществляется ризобиями в корневых клубеньках и контролируется генотипами обоих партнеров. Наибольшая интенсивность N2-фиксации характерна для быстрорастущих ризобий ( Rhizobium, Sinorhizobium ). Однако СЭ (влияние инокуляции ризобиями на биомассу растений) определяется многими генными системами ризобий, в том числе не участвующими в работе нитрогеназы, в связи с чем N2-фиксирующую активность и СЭ следует рассматривать как два разных симбиотических признака. Так, ризобии способны синтезировать биологически активные вещества (фитогормоны, витамины, люмихром), которые влияют на развитие растений-хозяев. Нашей целью было изучение влияния штаммов ризобий Sinorhizobium meliloti, активно фиксирующих N2, но контрастно различающихся по солеустойчивости, на показатели габитуса (соотношения различных морфометрических показателей) и продуктивности у многолетней тетраплоидной люцерны ( Medicago sativa L.) при действии солевого стресса, а также при мутациях микросимбионтов, снижающих СЭ. В работе использовали штаммы S. meliloti : 1021 (стандартный лабораторный штамм), СХМ1-188 (УФ-индуцированный мутант штамма СХМ1, обладающий повышенной СЭ) и СА67 (штамм, выделенный из почвы в Таджикистане). Кроме того, исследовали Tn5-индуцированные мутанты с пониженной СЭ - F (получен от штамма СА67 в настоящей работе) и GL1 (получен от штамма 1021 в университете г. Дальхаус, Канада). Семена люцерны посевной сорта Агния, устойчивого к эдафическим стрессам, были получены во Всероссийском НИИ кормов им. В.Р. Вильямса (г. Лобня, Московская обл.). Бобово-ризобиальный симбиоз изучали в микровегетационных опытах, анализируя различные морфометрические показатели (масса и длина побегов и корней) и их соотношения. Для анализа действия на СЭ солевого стресса люцерну выращивали на среде с добавлением 0,6 % NaCl. Показано, что в отсутствие стресса инокуляция всеми штаммами S. meliloti вызывала увеличение массы и длины побегов, однако длина корней люцерны снижалась. Это приводило к резкому изменению габитуса растений (соотношение длин побегов и корней возрастало в 2-3 раза), которое, по-видимому, обеспечивало высокую интенсивность их симбиотрофного развития. В условиях солевого стресса существенного изменения в соотношении длин побегов и корней при инокуляции ризобиями выявлено не было, однако соотношение массы побегов к их длине возрастало от 0,16-0,34 мг/мм до 0,52-0,68 мг/мм. У растений люцерны, инокулированных солечувствительным штаммом S. meliloti СА67 (не способен расти в присутствии 3 % NaCl), утрата СЭ сопровождалась удлинением побегов и корней соответственно на 36 и 79 %, хотя их масса не изменялась по сравнению с таковой у неинокулированных растений. У растений, инокулированных солеустойчивыми штаммами СХМ1-188 и 1021, при воздействии стресса СЭ сохранялась, однако стимулирующего действия ризобий на рост побегов и корней не обнаружили. Tn5-мутанты F и GL1, несмотря на сниженную СЭ, оказывали такое же влияние на габитус растений, как и родительские штаммы. В настоящей работе мы впервые показали, что проявление СЭ зависит от факторов двух типов - трофических (определяются интенсивностью симбиотической N2-фиксации) и регуляторных (предположительно связаны с модификациями гормонального статуса растений, влияющими на активность корневых и побеговых меристем). Генетические модификации регуляторной (ростстимулирующей) активности ризобий могут быть важным подходом для оптимизации симбиотрофного питания бобовых культур азотом, а также для их адаптации к эдафическим (осмотическим) стрессам.
Клубеньковые бактерии (ризобии), габитус растений, бобовые растения, азотфиксация, ростстимулирующая активность, симбиотическая эффективность, солевой стресс
Короткий адрес: https://sciup.org/142213943
IDR: 142213943 | УДК: 633.311:631.559:631.461.52 | DOI: 10.15389/agrobiology.2016.3.343rus
Текст научной статьи Габитус и продуктивность люцерны (Medicago sativa L.) в зависимости от инокуляции штаммами Sinorhizobium meliloti, различающимися по солеустойчивости
Симбиотическая эффективность (СЭ), или способность увеличивать продуктивность (массу, накопление азота, количество семян) у бобо-
Работа поддержана грантом Российского научного фонда № 14-26-00094.
вых растений-хозяев, — важнейший признак клубеньковых бактерий (ризобий), характеризующий их адаптивный потенциал и практическую значимость (1, 2). Этот признак определяется в первую очередь фиксацией молекулярного азота (N2), которая осуществляется ризобиями в корневых клубеньках и контролируется генотипами обоих партнеров (3). Однако генетические механизмы контроля СЭ до сих пор остаются малоизученными.
Наибольшая интенсивность N2-фиксации характерна для быстрорастущих ризобий (Rhizobium, Sinorhizobium), которые в условиях симбиоза способны к трансформации в нежизнеспособные внутриклеточные бактероиды. Их высокая ^-фиксирующая активность достигается благодаря необратимому ингибированию клеточных функций, необходимых для автономного существования, включая ряд стадий азотно-углеродного обмена и биогенеза клеточных структур (4).
Известно, что СЭ определяется многими генными системами ризобий, в том числе не связанными с работой нитрогеназы (фермента, катализирующего восстановление N2 в NH3), поэтому следует рассматривать ^-фиксирующую активность и СЭ как два разных симбиотических признака (2).
Так, анализ Тн5-мутантов ризобий люцерны (Sinorhizobium meli-loti), обладающих повышенной СЭ (5), выявил серию негативных регуляторов симбиоза ( ef -генов), ни один из которых не входит в состав nif и //т -оперонов, кодирующих структуру нитрогеназы, активацию ее синтеза и снабжение энергией (6). Функциональная связь с N2-фиксацией выявлена лишь для некоторых ef -генов, например для гена phbA, инактивация которого нарушает синтез предшественника поли- в -гидроксибутирата (ацето-ацетил-КоА), увеличивая количество углерода, направляемого бактериальной клеткой на энергоснабжение нитрогеназы (7).
Ризобии способны синтезировать множество биологически активных веществ, которые влияют на развитие растений-хозяев: фитогормоны (8-10), витамины (11-12), люмихром (14-15). Липохитоолигосахаридные Nod-факторы, с помощью которых ризобии активируют развитие клубеньков, резко изменяют синтез растениями фитогормонов, повышая соотношение цитокининов к ауксинам в корнях, в результате чего активируется деление клеток кортекса и перицикла, приводящее к закладке клубеньковых примордиев (16). Модификации гормонального статуса бобовых, вызываемые ризобиями, могут изменять соотношения ключевых морфометрических параметров надземных и подземных органов (габитус растений), связанных с СЭ (17).
Ранее мы установили, что у однолетней диплоидной люцерны (Medicago truncatula) под действием солевого стресса резко уменьшается длина побегов (в 3-14 раза) при сохранении их массы (18). У некоторых линий M. truncatula габитус нормализуется при инокуляции N2-фикси-рующими штаммами Sinorhizobium meliloti, что подтверждает сходство механизмов развития симбиоза и реакции растений на солевой стресс. Логично предположить, что регуляторные воздействия микросимбионтов на растения будут наиболее выраженными на фоне влияния генотипических или средовых факторов, снижающих интенсивность N2-фиксации.
В настоящей работе мы впервые показали, что проявление СЭ ризобий зависит от факторов двух типов — трофических (определяются интенсивностью симбиотической N2-фиксации) и регуляторных (предположительно связаны с модификациями гормонального статуса растений, влияющими на активность корневых и побеговых меристем).
Целью нашей работы было изучение влияния активно фиксирую- щих N2, но контрастно различающихся по солеустойчивости штаммов ри-зобий Sinorhizobium meliloti на показатели габитуса и продуктивности у многолетней тетраплоидной люцерны (Medicago sativa L.) при действии солевого стресса, а также при мутациях микросимбионтов, снижающих симбиотическую эффективность.
Методика. В работе использовали активно фиксирующие N 2 штаммы клубеньковых бактерий люцерны: 1021 — стандартный лабораторный штамм (19), СХМ1-188 — УФ-индуцированный мутант штамма СХМ1, обладающий повышенной СЭ (20), и СА67 — штамм, выделенный из почвы в Таджикистане (21). Кроме того, исследовали Тп5-индуцированные мутанты — F (получен от штамма СА67 в настоящей работе) и GL1 (получен от штамма 1021 в университете г. Дальхаус, Канада). Солеустойчи-вость штаммов определяли на плотной (1,5 % агар-агара) среде TY с разными концентрациями NaCl (от 2,0 до 4,5 %).
Семена люцерны посевной сорта Агния, устойчивого к эдафиче-ским стрессам, получены во Всероссийском НИИ кормов им. В.Р. Вильямса (Московская обл., г. Лобня).
Бобово-ризобиальный симбиоз изучали в микровегетационных опытах при выращивании растений в стерильных пробирках на агаризо-ванной (0,7 %) безазотной среде Красильникова-Кореняко в 8-10-кратной повторности в течение 30 сут (20). Показателем СЭ служила прибавка сухой массы побегов у инокулированных ризобиями растений по сравнению с контрольными (неинокулированными).
Для анализа действия солевого стресса на показатели развития (длина побегов, длина корней, сухая масса корней) растений люцерны их выращивали в среде с добавлением 0,6 % NaCl.
Статистическую обработку данных проводили посредством дисперсионного анализа (22) в программе Microsoft Office Excel 2007.
Результаты. Штаммы, использованные в работе, контрастно различались по устойчивости к солевому стрессу: 1021 и СХМ1-188 были способны расти на твердой агаризованной среде 79 при добавлении 3 % NaCl (R-фенотип), тогда как рост штамма СА67 на этой среде оказался подавлен (S-фенотип). Тп5-индуцированные мутанты проявляли пониженную СЭ (фенотип Eff+/-), причем мутант F штамма СА67 обладал также повышенной солеустойчивостью (был способен расти в присутствии 3,5 % NaCl).
При симбиозе с люцерной в отсутствие солевого стресса наибольшую СЭ проявил S-штамм СА67: у инокулированных им растений масса и длина побегов повышались соответственно на 163 и 169 % по сравнению с контролем, тогда как длина корней несущественно (на 7 %) снижалась (табл. 1).
1. Относительные изменения (%) показателей развития у растений люцерны Medicago sativa L., инокулированных штаммами ризобий Sinorhizobium meliloti, различающимися по солеустойчивости (микровегетационный опыт)
|
Штамм |
Без солевого стресса |
В условиях солевого стресса (0,6 % NaCl) |
|
МП | ДП | ДК |
МП 1 ДП 1 ДК |
|
СА67 (S) |
+ 163* |
+169* |
- 7 |
+5 |
+36* |
+79* |
|
1021 (R) |
+73* |
+90* |
- 28* |
+138* |
- 1 |
- 7 |
|
СХМ1-188 (R) |
+96* |
+56* |
- 21* |
+160* |
- 24* |
- 6 |
Примечание. В скобках указана способность штаммов к росту на среде с 3 % NaCl: R — наличие, S — отсутствие роста. МП — сухая масса побегов, ДП — длина побегов, ДК — длина корней.
*P q < 0,05 (достоверное отличие от контроля без инокуляции).
Инокуляция R-штаммами СХМ1-188 и 1021 повышала массу и длину побегов на 56-96 %, а длина корней достоверно снижалась (на 2128 %). При этом наблюдались резкие изменения габитуса люцерны: соотношение длины побегов и корней возрастало в 2-3 раза по сравнению с контролем без инокуляции (рис.).
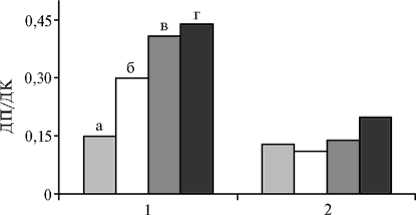
Вариант
Соотношение длины побегов и корней (ДП/ДК) у люцерны Medicago sativa L. в отсутствие (1) и при действии солевого стресса (0,6 % NaCl) (2) при инокуляции различными штаммами Sinorhizobium meliloti. а — КБИ (контроль без инокуляции), б — СХМ1-188, в — 1021, г — СА67 (микровегетацион-ный опыт).
Действие солевого стресса (0,6 % NaCl) приводило к утрате СЭ у S-штамма СА67: масса побегов не изменялась по сравнению с контролем, хотя их длина достоверно возрастала на 36 % (см. табл. 1). Длина корней увеличивалась на 79 %, что могло быть связано с преимущественной стимуляцией бактериями развития корневых меристем. СЭ у R-штаммов в условиях солевого стресса оказалась более высокой, чем без него: масса побегов возрастала на 138-160 % по сравнению с контролем, однако их длина достоверно уменьшалась (для штамма СХМ1-188), либо оставалась прежней (для штамма 1021). При этом наблюдалось недостоверное (на 6-7 %) снижение длины корней, поэтому габитус растений изменялся незначительно (см. рис.).
Поскольку в условиях стресса длина побегов и корней возрастала только при инокуляции люцерны S-штаммом СА67, логично предположить, что оптимальные условия для ростстимулирующего воздействия бактерий на растения создавались именно при подавлении СЭ. Однако у низкоэффективного (Eff+/—) мутанта F, несмотря на его повышенную со-леустойчивость, воздействие на габитус растений оказалось таким же, как у родительского штамма CF67 (табл. 2).
2. Симбиотическая эффективность мутантного (F) и родительского (СА67) штаммов Sinorhizobium meliloti на растениях люцерны Medicago sativa L. в зависимости от действия солевого стресса (микровегетационные опыты)
|
Инокулюм |
МП, мг |
ДП, мм |
ДК, мм |
Габитус растений ДП/ДК 1 МП/ДП |
Без солевого стресса
|
СА67 |
23,7а |
86,1a |
195,3a |
0,44a |
0,28a |
|
F |
17,3b |
64,3a |
140,1b |
0,46a |
0,27a |
|
Отсутствует |
9,0c |
32,5b |
210,9с |
0,15b |
0,28a |
|
НСР 0,05 |
4,85 |
23,27 |
15,53 |
0,08 |
|
|
В |
условиях солевого |
стресса |
(0,6 % NaCl) |
||
|
СА67 |
9,8c |
15,2c |
75,5c |
0,20a |
0,65a |
|
F |
8,0c |
15,3c |
64,7c |
0,23a |
0,52b |
|
Отсутствует |
9,3c |
11,0d |
42,8d |
0,26a |
0,85c |
|
НСР 0 05 |
1,94 |
2,08 |
15,73 |
0,07 |
Примечание. МП — масса побегов, ДП — длина побегов, ДК — длина корней. Разными буквами (a, b, c, d) обозначены достоверно (P o < 0,05) различающиеся значения для каждого признака.
Не было выявлено изменений габитуса растений и у Eff+/- мутанта штамма GL1, не отличающегося по солеустойчивости от родительского штамма 1021 (табл. 3).
Влияние инокуляции клубеньковыми бактериями на габитус люцерны (соотношение длины побегов и корней) проявлялось только в отсутствие солевого стресса. При стрессе этот показатель практически не менялся, однако соотношение массы побегов к их длине возрастало с 0,16346
0,34 до 0,52-0,68 мг/мм (см. табл. 2 и 3). Аналогичное изменение габитуса мы наблюдали ранее при воздействии солевого стресса на инокулированные ризобиями растения диплоидной люцерны M. truncatula (18). Поскольку количество клубеньков при солевом стрессе достоверно не меняется, очевидно, что у обоих видов люцерны активность побеговых меристем подавляется в большей степени, чем активность клубеньковых меристем (18).
3. Симбиотическая эффективность мутантного (GL1) и родительского (1021) штаммов Sinorhizobium meliloti на растениях люцерны Medicago sativa L. в зависимости от действия солевого стресса (микровегетационный опыт)
|
Инокулюм |
МП, мг |
МК, мг |
ДП, мм |
ДК, мм |
Габитус растений |
||
|
МП/МК | |
ДП/ДК | МП/ДП |
||||||
|
1021 |
17,9a |
Бе 4,3a |
з со лев о г 53,1a |
о стресс 129,6a |
а 4,16a |
0,40a |
0,34a |
|
GL1 |
10,5b |
2,4b |
65,6a |
145,5a |
4,38a |
0,45a |
0,16b |
|
Отсутствует |
7,5bd |
6,5c |
27,9b |
181,1b |
1,15b |
0,15b |
0,27a |
|
1021 |
В 10,7b |
условиях солевого стресса (0,6 % NaCl) 5,0a 20,7b 145,2a 2,14c |
0,14b |
0,52c |
|||
|
GL1 |
10,4b |
5,3a |
15,2c |
151,8a |
1,96c |
0,10b |
0,68d |
|
Отсутствует |
4,5cd |
7,3c |
20,8b |
156,0a |
0,61b |
0,13b |
0,22ab |
|
НСР 0 05 |
4,23 |
1,27 |
5,11 |
32,54 |
0,97 |
0,08 |
|
Примечание. МП — масса побегов, МК — масса корней, ДП — длина побегов, ДК — длина корней. Разными буквами (a, b, c, d) обозначены достоверно (P o < 0,05) различающиеся значения для каждого признака.
Логично предположить, что увеличение длины побегов в сочетании с укорочением корней, которое мы наблюдали при инокуляции люцерны ризобиями в отсутствие стресса, улучшало усвоение фиксированного азота, способствуя его транслокации в надземные органы и использованию для развития вегетативной массы и семян. Удлинение побегов и укорочение корней могли быть обусловлены выявленной ранее (16) выработкой ризобиями ингибиторов синтеза ауксинов, которая приводила к снижению соотношения ауксины:цитокинины, стимулируя развитие меристем побегов и клубеньков (сходных по тканевой структуре с побегами), но ингибировала активность корневых меристем. Действительно, у ризобий сои (Bradyrhizobium japonicum) интенсивность синтеза цитокининов коррелирует с числом образуемых клубеньков и с СЭ (23). Выявленное нами возрастание длин корней и побегов у M. sativa при инокуляции S-штаммом СА67 в условиях стресса могло быть обусловлено тем, что при подавлении нитрогеназной активности усиливался синтез фитогормонов, который осуществляют либо бактерии, либо растительные клетки, подвергшиеся воздействию бактериальных сигналов (16, 25).
Описанные нами эффекты, возможно, были обусловлены системной регуляцией клубенькообразования, которая у модельного бобового Lotus japonicus L. начинается с индукции бактериями синтеза сигнальных CLE-пептидов в корнях (16). Воздействие CLE-пептидов на рецепторную киназу HAR1, синтезируемую в побегах, вызывало продукцию ответных сигналов, которые перемещались в корни и блокировали формирование избытка клубеньков. При этом в надземной части растений активировался синтез цитокининов (под контролем белка LjIPT3), которые повышали активность побеговых меристем, но снижали активность меристем корня (24).
Модификации габитуса у растений M. sativa, наблюдаемые нами при сочетании солевого стресса и инокуляции чувствительным к нему штаммом S. meliloti СА67, могли быть связаны с различной направленностью изменений гормонального статуса, вызываемых этими воздействиями в надземных и подземных органах. Известно, что нарушения синтеза фитогормонов, выявленные у сои (26) и у ряда небобовых растений (27) при солевом стрессе, носят сложный характер: они включают изменения со- держания салициловой и жасмоновой кислот, участвующих в реакции растений на инокуляцию фитопатогенными и симбиотическими микроорганизмами. Эти изменения могут отражать эволюционную связь ризобий с ризосферными и эндофитными симбионтами, ростстимулирующая активность которых обусловлена главным образом синтезом фитогормонов (28, 29).
Таким образом, анализ изменений габитуса растений люцерны Medicago sativa при инокуляции штаммами ризобий Sinorhizobium meliloti и под действием солевого стресса показал, что эффективность бобово-ризобиального симбиоза зависит не только от интенсивности ^-фиксации, но и от регуляторных воздействий микросимбионтов, которые определяют гормональный статус растений-хозяев. Логично предположить, что в системе клубенькового симбиоза регуляторные воздействия ризобий на бобовые растения существенно активируют их симбиотрофное развитие (например, улучшая ассимиляцию продуктов N2-фиксации активно растущими надземными органами). Гены, контролирующие эти воздействия, могут быть использованы для конструирования штаммов ризобий с повышенной симбиотической эффективностью, которая определяется активностью усвоения бобовыми фиксированного азота, а также их устойчивостью к эдафическим стрессам.
Авторы признательны Л.А. Луговой за критические замечания по статье и СН. Юргель, предоставившей мутант GL1.
Список литературы Габитус и продуктивность люцерны (Medicago sativa L.) в зависимости от инокуляции штаммами Sinorhizobium meliloti, различающимися по солеустойчивости
- Доросинский Л.М. Клубеньковые бактерии и нитрагин. Л., 1970.
- Мишустин Е.Н., Шильникова В.К. Клубеньковые бактерии и инокуляционный процесс. М., 1973.
- Terpolilli J.J., Hood G.A., Poole P.S. What determines the efficiency of N2-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol., 2012, 60: 325-389 ( ) DOI: 10.1016/B978-0-12-398264-3.00005-X
- Haag A.F., Arnold M.F., Myka K.K., Kerscher B., Dall'Angelo S., Zanda M., Mergaert P., Ferguson G.P. Molecular insights into bacteroid development during Rhizobium-legume symbiosis. FEMS Microbiol. Rev., 2013, 37(3): 364-383 ( ) DOI: 10.1111/1574-6976.12003
- Sharypova L.A., Onishchuk O.P., Chesnokova O.N., Fomina-Eshenko J.G., Simarov B.V. Isolation and characterization of Rhizobium meliloti Tn5 mutants showing enhanced symbiotic effectiveness. Microbiology, 1994, 140: 463-470.
- Проворов Н.А., Онищук О.П., Юргель С.Н., Курчак О.Н., Чижевская Е.П., Воробьев Н.И., Затовская Т.В., Симаров Б.В. Конструирование высокоэффективных симбиотических штаммов бактерий: эволюционные модели и генетические подходы. Генетика, 2014, 50(11): 1273-1285 ( ) DOI: 10.7868/S0016675814110113
- Затовская Т.В. Получение и анализ Tn5-мутантов Sinorhizobium meliloti с измененными поверхностными полисахаридами. Автореф. канд. дис. СПб, 2012.
- Phillips D.A., Joseph C.M., Yang G.P., Martinez-Romero E., Sanborn J.R., Volpin H. Identification of lumichrome as a Sinorhizobium enhancer of alfalfa root respiration and shoot growth. PNAS USA, 1999, 96(22): 12275-12280 ( ) DOI: 10.1073/pnas.96.22.12275
- Gouws L.M., Botes E., Wiese A.J., Trenkamp S., Torres-Jerez I., Tang Y., Hills P.N., Usadel B., Lloyd J.R., Fernie A.R., Kossmann J., van der Merwe M. The plant growth promoting substance, lumichrome, mimics starch, and ethylene-associated symbiotic responses in lotus and tomato roots. Front. Plant Sci., 2012 ( ) DOI: 10.3389/fpls.2012.00120
- Khan W., Prithiviraj B., Smith D.L. Nod factor and lumichrome enhance photosynthesis and growth of corn and soybean. J. Plant Physiol., 2008, 165: 1342-1351 ( ) DOI: 10.1016/j.jplph.2007.11.001
- Phillips D.A., Torrey J.G. Studies on cytokinin production by Rhizobium. Plant Physiol., 1972, 49(1): 11-15 ( ) DOI: 10.1104/pp.49.1.11
- Palacios O.A., Bashan Y., de-Bashan L.E. Proven and potential involvement of vitamins in interactions of plants with plant growth-promoting bacteria -an overview. Biol. Fertil. Soils, 2014, 50: 415-432 ( ) DOI: 10.1007/s00374-013-0894-3
- Kanu S.A., Matiru Y.N., Dakora F.D. Strain and species differences in rhizobial secretion of lumichrome and riboflavin, measured using thin-layer chromatography. Symbiosis, 2007, 43: 37-43.
- Sierra S., Rodelas B., Martinez-Toledo M.V., Pozo C., Gonzalez-Lope J. Production of B-group vitamins by two Rhizobium strains in chemically-defined media. J. Appl. Microbiol., 1999, 86: 851-858 ( ) DOI: 10.1046/j.1365-2672.1999.00765.x
- Streit W.R., Joseph C.M., Phillips D.A. Biotin and other water-soluble vitamins are key growth factors for alfalfa root colonization by Rhizobium meliloti 1021. Mol. Plant-Microbe Interact., 1996, 5: 330-338.
- Ferguson B., Mathesius U. Phytohormone regulation of legume-rhizobia interactions. J. Chem. Ecol., 2014, 40: 770-790 ( ) DOI: 10.1007/s10886-014-0472-7
- Ogutcu H., Kasimogly C., Elkoca E. Effect of Rhizobium strains isolated from wild chickpeas on the growth and symbiotic performance of chickpeas (Cicer arietinum L.) under salt stress. Turkish J. Agric. Res., 2010, 34: 361-371 ( ) DOI: 10.3960/tar-0940-34
- Курчак О.Н., Проворов Н.А., Онищук О.П., Воробьев Н.И., Румянцева М.Л., Симаров Б.В. Воздействие солевого стресса на генетически полиморфную систему Sinorhizobium meliloti-Medicago truncatula. Генетика, 2014, 50(7): 777-786 ( ) DOI: 10.7868/S001667581406006X
- Meade H.M., Long S.R., Ruvkun G.B., Brown S.E., Ausubel F.M. Physical and genetic characterization of symbiotic and auxotrophic mutants of Rhizobium meliloti induced by transposon Tn5 mutagenesis. J. Bacteriol., 1982, 149: 114-122.
- Федоров С.Н., Симаров Б.В. Получение мутантов с измененными симбиотическими свойствами у Rhizobium meliloti под действием УФ-лучей. Сельскохозяйственная биология, 1987, 9: 44-49.
- Roumiantseva M.L., Andronov E.E., Sharypova L.A., Damman-Kalinovski T., Keller M., Young J.P.W., Simarov B.V. Diversity of Sinorhizobium meliloti from the Central Asian alfalfa gene center. Appl. Environ. Microbiol., 2002, 68(9): 4694-4697 ( ) DOI: 10.1128/AEM.68.9.4694-4697.200
- Лакин Г.Ф. Биометрия. М., 1980.
- Драговоз И.В., Леонова Н.О., Иутинская Г.А. Синтез фитогормонов штаммами Bradyrhizobium iaponicum различной симбиотической эффективности. Мiкробiол. журн., 2011, 3: 29-35.
- Okamoto S., Ohnishi E., Sato S., Takahashi H., Nakazono M., Tabata S., Kawaguchi M. Nod factor/nitrate-induced CLE genes that drive HAR1-mediated systemic regulation of nodulation. Plant Cell Physiol., 2009, 50: 67-77 ( ) DOI: 10.1093/pcp/pcn194
- Theunis M., Kobayashi H., Broughton W., Prinsen E. Flavonoids, NodD1, NodD2, and nod-box NB15 modulate expression of the y4wEFG locus that is required for indole-3-acetic acid synthesis in Rhizobium sp. strain NGR234. Mol. Plant-Microbe Interact., 2004, 17(10): 1153-1161 ( ) DOI: 10.1094/MPMI.2004.17.10.1153
- Hamayun M., Khan S.A., Khan A.L., Shinwari Z.K., Hussain J., Song E.Y., Kang S.M., Kim Y.H., Khan M.A., Lee I.J. Effect of salt stress on growth attributes and endogenous growth hormones of soybean cultivar Hwangkeumkong. Pakist. J. Bot., 2010, 42(5): 3103-3112.
- Ryu H., Cho Y.G. Plant hormones and salt stress tolerance. J. Plant Biol., 2015, 58: 147-155 ( ) DOI: 10.1007/s12374-015-0103-z
- Проворов Н.А., Воробьев Н.И. Генетические основы эволюции растительно-микробного симбиоза/Под ред. И.А. Тихоновича. СПб, 2012.
- Yang J., Kloepper J.W., Ryu C.M. Rhizosphere bacteria help plants tolerate abiotic stress. Trends in Plant Sci., 2009, 14(1): 1-4.


