Галектин-9/Tim-3-зависимый механизм регуляции функциональной активности натуральных киллеров при беременности
Автор: Орлова Е.Г., Логинова О.А., Горбунова О.Л., Ширшев С.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 4, 2023 года.
Бесплатный доступ
Галектинами называют семейство β-галактозид-связывающих низкомолекулярных белков (лектинов), гомологичных по аминокислотной последовательности углевод-связывающего сайта. Галектины взаимодействуют с гликанами на поверхности клеток и участвуют в регуляции функциональной активности большинства клеток организма человека. Галектин-9 играет важнейшую роль в контроле функций клеток иммунной системы. Особое значение приобретают иммунорегуляторные эффекты галектина-9 при беременности, когда его продукция клетками трофобласта значительно увеличивается, что ассоциировано с формированием периферической иммунной толерантности. Основным лигандом для галектина-9 является молекула Tim-3 (Т-клеточный иммуноглобулиновый и муциновый домен, содержащий белок 3), высокая экспрессия которой выявляется на натуральных киллерах (NK-клетки). При беременности фенотип и функции NK-клеток существенно меняются, что необходимо для предотвращения цитотоксических реакций на клетки плода. В обзоре систематизированы данные о роли галектина-9 в Tim-3-опосредованной регуляции функций NK-клеток в аспекте беременности. Изучение регуляции функциональной активности NK-клеток необходимо для повышения эффективности NK-клеточной терапии.
Галектин-9, nk-клетки, tim-3, иммунная толерантность, беременность
Короткий адрес: https://sciup.org/147242774
IDR: 147242774 | УДК: 632.939:612.112.94:612.63 | DOI: 10.17072/1994-9952-2023-4-403-413
Текст обзорной статьи Галектин-9/Tim-3-зависимый механизм регуляции функциональной активности натуральных киллеров при беременности
Галектинами называют семейство β-галактозид-связывающих низкомолекулярных белков (лектинов), гомологичных по аминокислотной последовательности углевод-связывающего сайта и распознающих остатки β-галактозы [Рапопорт, Курмышкина, Бовин, 2008; Рапопорт, Бовин, 2015]. В настоящее время у млекопитающих идентифицировано 16 представителей семейства галектинов, которые отличаются друг от друга строением и углеводной специфичностью [там же]. Галектины продуцируются разными типами клеток (эпителиальными, фибробластами, эндотелиальными, дендритными клетками, макрофагами, активированными Т- и В-лимфоцитами, костномозговыми стромальными клетками, натуральными киллерами (NK-клетки), регуляторными Т-лимфоцитами (Treg) и присутствуют во многих тканях и органах: плаценте, легких, печени, костном мозге, селезенке, сердце, лимфатических узлах, предстательной железе и др. [Рапопорт, Бовин, 2015; Iwasaki-Hozumi et al., 2021; Boron et al., 2022; Fuselier et al., 2023]. Галектины синтезируются и локализуются в цитоплазме клетки и в незначительных количествах присутствуют в ядре, а также при активации клетки секретируются в межклеточное пространство [Рапопорт, Курмышкина, Бовин, 2008; Рапопорт, Бовин, 2015]. Секреция галектинов осуществляется, главным образом, в ответ на провоспалительные стимулы при помощи микровезикул, которые образуются выпячиванием мембраны, минуя эндоплазматический ретикулум и аппарат Гольджи [там же]. Галектины оказывают как дистантные эффекты, так и способны связываться с компонентами гликокаликса клеток-продуцентов [там же]. Лигандами для галектинов являются углеводные цепи гликолипидов и гликопротеинов в составе различных клеток организма [там же]. Причем галектины могут вступать во взаимодействие как с гликанами разных клеток, обеспечивая межклеточные коммуникации, так и сшивать углеводные структуры на поверхности одной клетки [Рапопорт, Курмышкина, Бовин, 2008; Рапопорт, Бовин, 2015]. Внутри клетки галектины принимают участие в сигнальной трансдукции, взаимодействуя с другими белками цитоплазмы и ядра. Есть данные о том, что галектины участвуют в сплайсинге матричных РНК. Описаны специфические мембранные и внутриклеточные рецепторы для галектинов [там же].
Галектины играют важную роль в регуляции большинства клеточных процессов, таких как дифференцировка клеток, адгезия, межклеточные коммуникации, реализация эффекторных функций, индукция апоптоза, отторжение трансплантата [Iwasaki-Hozumi et al., 2021]. Концентрация галектинов повышается при воспалительных процессах [Iwasaki-Hozumi et al., 2021; Boron et al., 2022; Fuselier et al., 2023]. Избыточная экспрессия галектинов характерна для опухолевых клеток различного происхождения, что свидетельствует об их важной роли в прогрессии опухолевого роста в результате иммуносупрессии [Fuselier et al., 2023]. Некоторые галектины участвуют в адгезии вирусов к поверхности клеток-мишеней [Elahi et al., 2012].
Эффекты галектинов, главным образом, имеют противовоспалительный характер и направлены на ограничение избыточной активации клеток при воспалительных реакциях, защиту клеток от повреждений и индукции аутоиммунных процессов [Sanchez-Fueyo et al., 2003; Zhu et al., 2005]. Однако разные галектины в зависимости от типа клеток и используемых рецепторов оказывают разнонаправленные эффекты на их функциональную активность. Так, взаимодействие галектина-9 с дендритными клетками, макрофагами, Тreg стимулирует их активность, тогда как его связывание c рецепторами на T-лимфоцитах хелперах (Тh1) вызывает их апоптоз [Sanchez-Fueyo et al., 2003; Zhu et al., 2005; Nagahara et al., 2008; Ocana-Guzman, Torre-Bouscoulet, Sada-Ovalle, 2016]. Все вышесказанное свидетельствует о высокой актуальности изучения регуляторных эффектов разных типов галектинов.
Установлено, что галектин-9, действуя через Tim-3-рецепторы (Т-клеточный иммуноглобулиновый и муциновый домен, содержащий белок 3), препятствует отторжению аллогенного кожного лоскута и ускоряет его приживление [Wang et al., 2008]. Беременность также является феноменом полуаллогенной трансплантации, поскольку плод экспрессирует антигены отца. Ключевыми эффекторами формирования периферической иммунной толерантности при беременности являются натуральные киллеры (NK-клетки), которые в большом количестве экспрессируют Tim-3 [Sun et al., 2016; Li et al., 2017]. Логично полагать, что галектин-9-Tim-3-сигналинг при беременности играет значимую роль в модуляции функций NK-клеток и сохранении беременности. Поэтому целью данного обзора является систематизация знаний о роли галектина-9 в Tim-3-опосредованном контроле функций NK-клеток в аспекте беременности. Понимание механизмов регуляции функциональной активности NK-клеток при беременности необходимо для прогнозирования и предотвращения патологий беременности иммунного генеза (бесплодие, задержку внутриутробного роста, повторные выкидыши и др.), а также для повышения эффективности NK-клеточной терапии.
Галектин-9
Галектин-9 относят к тандемному типу галектинов, для которых характерно наличие двух углевод-связывающих доменов, распознающих разные углеводные лиганды [Рапопорт, Курмышкина, Бовин, 2008; Рапопорт, Бовин, 2015]. Галектин-9 впервые был идентифицирован как хемоаттрактант для эозинофилов [Asakura et al., 2002]. Он продуцируется разными типами клеток: эозинофилами, эндотелиальными клетками, CD4+ и CD8+Т-лимфоцитами, дендритными клетками, макрофагами, лимфоидными клетками, клетками Купфера, эпителиальными клетками кишечника, клетками трофобласта и плаценты [Enninga et al., 2018; Iwasaki-Hozumi et al., 2021]. Продукция галектина-9 усиливается при воспалении, онкологических и аутоиммунных заболеваниях [Chen et al., 2023]. Интерферон-гамма (INF-гамма) повышает экспрессию галектина-9 в эндотелиальных клетках и фибробластах, что объясняет механизм обратной связи в негативной регуляции Th1-воспалительного ответа [Imaizumi et al., 2002; Asakura et al., 2002].
Во время беременности клетки трофобласта активно продуцируют галектин-9, и его концентрация значительно нарастает в периферической крови уже с первых недель беременности и остается повышенной до родов [Meggyes et al. 2014; Enninga et al., 2018; Boron et al., 2022; Pełech et al., 2023]. Так в работе E.A.L. Enninga с соавторами показано, что уже на 8 неделе беременности уровень галектина-9 в периферической крови в три раза выше, чем у небеременных (8 неделя беременности – 1 976 пг/мл; у небеременных – 773 пг/мл), и такой уровень сохраняется до родов [Enninga et al., 2018]. При этом беременные женщины, вынашивающие мужской плод, имеют более высокие концентрации галектина-9 в периферической крови по сравнению с женщинами, которые вынашивают женский плод (2 263 пг/мл и 1 874 пг/мл, соответственно) [там же]. Данный факт дополняет наши представления о возможных причинах предрасположенности к развитию разных осложнений беременности у женщин, которые вынашивают женский и мужской плод. Другими исследователями было показано, что уровень галектина-9 нарастает в периферической крови пропорционально сроку беременности [Meggyes et al., 2014].
В исследовании D.G. Boron с соавторами также выявлялись более высокие значения концентрации галектина-9 в периферической крови (14 760 пг/мл) перед родами (30 неделя беременности) по сравнению с ранее описанными исследованиями [Boron et al., 2022]. В работе A. Pełech с соавторами показано, что концентрация галектина-9 в периферической крови (7 800 пг/мл) перед родами (39 неделя беременности) позитивно коррелирует с индексом массы тела и количеством жировой ткани, однако взаимосвязи с полом плода данные авторы не выявили [Pełech et al., 2023]. По-видимому, различия в определении концентрации галектина-9 в работах разных авторов в определенные сроки беременности обусловлены индивидуальными особенностями обследуемых, определением срока беременности и методами анализа, что требует проведения дальнейших исследований. Следует отметить, что иммуномодулирующая активность галектина-9 напрямую зависит от концентрации этого лектина. Так, в концентрациях, значительно превышающих его уровень при беременности, галектин-9 стимулирует синтез провоспалительного цитокина INF-гамма NK-клетками, тогда как в концентрациях, характерных для беременности, оказывает обратный эффект [Gleason et al., 2012]. У женщин со спонтанными абортами и другими патологиями беременности продукция галектина-9 клетками трофобласта и его уровень в периферической крови значительно снижается [Wu et al, 2015; Boron et al., 2022].
В целом, можно заключить, что галектин-9 играет важную роль в регуляции иммунореактивности организма при различных состояниях.
Структура рецептора Tim-3, механизмы сигнальной трансдукции
Основным лигандом для галектина-9 на NK-клетках является молекула Tim-3, которая экспрессируется на большинстве клеток иммунной системы: NK-клетках, CD4+ и CD8+Т-лимфоцитах, В-лимфоцитах, Treg, натуральных Т-клетках с функциями NK(NKT), моноцитах, макрофагах, тучных и дендритных клетках [Ndhlovu et al., 2012; Sun et al., 2016; Li et al., 2016].
NK-клетки конститутивно экспрессируют молекулы Tim-3, которые рассматривают как маркер их активации и созревания [Ndhlovu et al., 2012; Gleason et al., 2012; So et al., 2019], причем среди лимфоцитов NK-клетки имеют наибольшую экспрессию Tim-3 [Gleason et al., 2012; Ndhlovu et al., 2012]. У здоровых людей цитотоксические CD56dimCD16+NK-клетки как более зрелые демонстрируют повышенную экспрессию Tim-3 по сравнению с менее зрелыми регуляторными CD56brightCD16-NK-клетками [Ndhlovu et al., 2012]. В работе Ndhlovu с соавторами убедительно показано, что повышение экспрессии Tim-3 под влиянием IL-15 коррелирует с созреванием и трансформацией CD56brightCD16-NK в CD56dimCD16+NK [там же].
В отличие от Т-лимфоцитов, Tim-3-позитивные NK-клетки не являются истощенными или анергичными, а проявляют высокую функциональную активность в ответ на активирующие стимулы [там же]. Так, стимуляция NK-клеток цитокинами и их комбинациями (IL-12, IL-18, IL-12+IL-18, IL-15, IL-15+IL-12, IL-2) за исключением INF-гамма, связывание CD16 c Fc-фрагментами иммуноглобулинов, повышает экспрессию Tim-3 на обеих субпопуляциях NK-клеток [там же], что коррелирует с увеличением экспрессии транскрипционного фактора T-bet, который отвечает за дифференцировку наивных Т-лимфоцитов в Т-хелперы 1-го типа (T-box expressed in T-cells) [Gleason et al., 2012; So et al., 2019].
Tim-3 относится к гликопротеиновым рецепторам и имеет мембранную и растворимую форму [Chen et al., 2023]. Молекула Tim-3 включает экстрацеллюлярный, трансмембранный и интрацеллюлярный участки [там же]. Экстрацеллюлярный N–терминальный участок состоит из вариабельного иммуноглобулинового и гликозилированного муцинового доменов [там же]. Муциновый участок обогащен серином и треонином [там же]. Цитоплазматический С–терминальный домен содержит остатки тирозина, фосфорилирование которых играет критическую роль во внутриклеточной трансдукции сигнала [там же].
Галектин-9 взаимодействует с вариабельным иммуноглобулиновым доменом Tim-3 [там же]. Следует отметить, что сигналинг с Tim-3 изучен, главным образом, на Т-лимфоцитах. В состоянии покоя интрацеллюлярный домен рецептора Tim-3 связан с протеином Bat3 (human leukocyte antigen B-associated transcript 3) [там же]. После взаимодействия Tim-3 с галектином-9 тирозиновая протеинкиназа ITK (interleukin-2-inducible T-cell kinase) запускает фосфорилирование остатков тирозина, что приводит к диссоциации Bat3 от интрацеллюлярного домена и запускает инфлюкс кальция в клетку, вызывая апоптоз Th1-лимфоцитов [Ocana-Guzman, Torre-Bouscoulet, Sada-Ovalle, 2016]. Лишь в единичных работах показано, что в NK-клетках трансдукция сигнала с Tim-3 активирует MAPK (mitogen-activated protein kinase) и ERK (extracellular signal-regulated kinase) -сигнальные пути и вызывает деградацию IkBa – ингибитора для транскрипционного фактора NF-kB [Gleason et al., 2012]. Другими авторами показано, что регуляторные эффекты галектин-9-Tim-3-сигналинга на NK-клетках зависят от JNK- и AKT-сигнальных путей и могут быть реализованы путем регуляции активности транскрипционных факторов Id2, Blimp-1, Gata-3 и Eomes [Li et al., 2017].
В большинстве работ убедительно показано, что взаимодействие галектина-9 с Tim-3 на NK-клетках угнетает их цитотоксичность, ограничивает продукцию провоспалительных цитокинов INF-гамма, фактора некроза опухоли-альфа (TNF-альфа), синтез и секрецию перфорина и гранзима [Sun et al., 2016; Li et al., 2016, 2017]. В экспериментах по изучению фибросаркомы у мышей показано, что в присутствии галектин-9–экспрессирующих дендритных клеток NK-клетки проявляют повышенную цитотоксическую активность к опухолевым клеткам, оцениваемую по продукции INF-гамма, перфорина и гранзима [Nagahara et al., 2008]. Ранее были описаны примеры зависимости направленности иммунорегуляторных эффектов от концентрации галектина-9 [Gleason et al., 2012]. Таким образом, плейотропность регуляторных эффектов при активации галектин-9/Tim-3-сигнального пути объясняется многообразием вовлекаемых каскадов вторичных мессенджеров в разных типах клеток, а также условиями активации и факторами микроокружения.
В циркуляции присутствует также растворимая форма (s)Tim-3 [Grossman et al., 2021]. Предполагается, что это продукт деградации мембранной формы рецептора под действие металлопротеиназ [там же]. sTim-3 конкурирует с мембранным рецептором за связывание с галектином-9 [там же]. sTim-3 участвует в регуляции цитотоксичности CD8+Т-лимфоцитов и NK-клеток [Lu et al., 2021]. Уровень sTim-3 повышается при беременности по сравнению с небеременными [Wu et al., 2015; Grossman et al., 2021], что ассоциируется с повышенной экспрессией провоспалительных цитокинов (IFN-гамма и TNF-альфа) и снижением продукции IL-4 и IL-10 [Tang , Rangachari , Kuchroo, 2019]. Таким образом, предполагают, что sTim-3 участвует в поддержании баланса между про- и противовоспалительными иммунными реакциями у беременных женщин.
Tim-3 также является рецептором для фосфатидилсерина, который также связывается с его иммуноглобулиновым доменом [Chen et al., 2023]. Известно, что этот сигнальный путь участвует в регуляции фагоцитарной активности моноцитов, макрофагов, дендритных клеток при клиренсе апоптотирующих клеток [Ocana-Guzman, Torre-Bouscoulet, Sada-Ovalle, 2016; Chen et al., 2023]. Известны и другие лигадны для Tim-3 [Zhu et al., 2005; Wu et al., 2015].
Дизрегуляция экспрессии Tim-3 ассоциируется с развитием аутоиммунных, инфекционных, аллергических, онкологических заболеваний, отторжением трансплантатов [Wang et al., 2008; Han et al., 2013]. При различных типах солидных опухолей экспрессия Tim-3 в опухоль-инфильтрирующих лимфоцитах сопряжена с плохим прогнозом и низкой выживаемостью. При аутоиммунных патологиях экспрессия Tim-3 является маркером тяжести заболевания и эффективности проводимой терапии [Chen et al., 2023].
Галектин-9 также может взаимодействовать с другими мембранными рецепторами (CD137, CD44, PD-1 (programmed cell death protein 1)), некоторыми молекулами адгезии и внутриклеточными молекулами [Chen et al., 2023]. Показано, что взаимодействие галектина-9 с PD-1-рецептором, также, как и с β 3-интегрином (CD61) на CD4-лимфоцитах, способствует проникновению ВИЧ в клетки [Elahi et al., 2012], тогда как галектин-9/Tim-3-сигналинг уменьшает чувствительность CD4-лимфоцитов к проникновению ВИЧ, поскольку угнетает экспрессию корецепторов CXCR4, CCR-5, необходимых для проникновения вируса в клетку и репликацию его в клетке [там же].
В целом можно заключить, что галектин-9-Tim-3-сигнальный путь является важнейшим регуляторным механизмом для большинства клеток иммунной системы. На сегодняшний день молекула Tim-3 рассматривается как одна из перспективных мишеней в иммунотерапии, о чем свидетельствует увеличение количества клинических исследований с применением ингибиторов Tim-3 при различных патологиях.
Галектин-9/Tim-3-опосредованная регуляция функций NK-клеток в аспекте беременности
NK-клетки относятся к лимфоидным клеткам врожденного иммунитета. Популяция NK-клеток периферической крови гетерогенна. Большая часть NK-клеток периферической крови обладает выраженной цитотоксической активностью и имеет фенотип CD16+CD56dimNK (до 90%). Регуляторные CD16-CD56brightNK составляют менее 10% от общего числа NK-клетки. В исследованиях последних лет описывают также минорную субпопуляцию цитотоксических NK-клеток с фенотипом CD16+CD56-NK, которые характеризуются как истощенные [Cocker et al., 2022, Orlova et al., 2023a]. NK-клетки периферической крови распознают вирусинфицированные, опухолевые, поврежденные клетки собственного организма, чужеродные клетки и лизируют их путем контактного взаимодействия (Fas-Fas-L, PD-PD-L) и индукции апоптоза, секретируя гранулы, содержащие литические продукты (перфорин, гранзимы) [Erlebacher et al., 2013].
В процессе беременности плацента продуцирует большое количество гормонов и других биологически активных соединений, что приводит к изменению гормонального фона, метаболизма, иммунореактивности организма матери, необходимых для успешного протекания беременности и родов. При этом количество NK-клеток периферической крови существенно не меняется [Li et al., 2017; Orlova et al., 2023a], но уровень цитотоксических NK-клеток и их функциональная активность снижаются, а число регуляторных NK-клеток, напротив, увеличивается [там же]. По результатам мета-анализа имеющихся в литературе данных женщины с высоким риском спонтанных абортов и бесплодием характеризуются увеличением количества NK-клеток в периферической крови и избыточной продукцией провоспалительных цитокинов (IFN-гамма, TNF-альфа) [Miko et al., 2013; Li et al., 2016], тогда как уровень регуляторных NK-клеток является маркером благополучного исхода беременности [Li et al., 2016; Dixit, Karande, 2020].
Регуляторные NK-клетки периферической крови на ранних сроках беременности мигрируют в зону фетоплацентарного контакта, где трансформируются в децидуальные, которые являются основными эффекторами формирования неспецифической иммунной толерантности на границе раздела мать-плод, а также выполняют фетотрофическую функцию [Koopman et al., 2003; Cerdeira et al., 2013; Fu et al., 2017; Song Yan, 2022]. Они обнаруживаются в непосредственной близости к спиральным артериям плаценты, и, продуцируя факторы роста сосудов (vascular endothelial growth factor (VEGF), инсулиноподобного фактора роста (insulin-like growth factor-binding protein 1, IGFBP-1), плацентарного фактора роста (placental growth factor, PLGF), плейотропина, моделируют рост спиральных артерий и инвазию [там же]. Децидуальные NK-клетки путем контактного взаимодействия и секреции толерогенных цитокинов (TGF-бета1, IL-10) индуцируют формирование адаптивных (индуцибельных) iTreg из наивных CD4+T-лимфоцитов, препятствуя образованию регуляторных Т-лимфоцитов, продуцирующих IL-17 (Th17), которые активируют провоспалительные клеточно-опосредованные реакции [Fu et al., 2017]. Treg также подавляют цитотоксические реакции против трофобласта в зоне фетоплацентарного контакта [Koopman et al., 2003; Cerdeira et al., 2013; Fu et al., 2017; Song Yan et al., 2022]. Хотя в случае инфекции децидуальные CD56brightNK сохраняют способность развивать цитотоксический ответ против патогенов и выполнять защитную функцию [Crespo et al., 2020]. Провоспалительные цитокины IFN-gamma и TNF-alpha, которые продуцируются децидуальными NK-клетками при физиологически протекающей беременности, также участвуют в ангиогенезе [Erlebacher et al., 2013]. Однако при спонтанных абортах доля децидуальных NK-клеток, продуцирующих IFN-гамма и TNF-альфа, увеличивается, что свидетельствует о важной роли этих клеток в регуляции иммунореактивности. Поэтому изучение принципов регуляции функциональной активности NK-клеток значимо для понимания механизмов формирования иммунной толерантности, реализуемых организмом как для сохранения беременности, так и при развитии онкологических процессов, трансплантации тканей.
При беременности Tim-3 экспрессируется на всех субпопуляциях NK-клеток периферической крови: регуляторных CD16-CD56brightNK, цитотоксических CD16+CD56dimNK, цитотоксических истощенных CD16+CD56-NK и децидуальных NK [Li et al., 2016; Orlova et al., 2023b]. При этом в I триместре беременности экспрессия Tim-3 увеличивается в периферической крови только на регуляторных NK (CD16-CD56bright), а в III триместре – на всех субпопуляциях NK-клеток [Orlova et al., 2023a]. В работах других авторов показано, что цитотоксические CD56dimNK-клетки периферической крови демонстрируют повышенную экспрессию Tim-3 по сравнению с CD56brightNK в ранние сроки беременности [Li et al., 2016]. На децидуальных NK-клетках экспрессия Tim-3 также увеличивается в ранние сроки беременности [там же].
Галектин-9/Tim-3-сигналинг играет критическую роль в регуляции функций NK-клеток, включая дегрануляцию, цитотоксичность, выработку про- и противовоспалительных цитокинов, ангиогенных факторов при беременности [Gleason et al., 2012; Ndhlovu et al., 2012; Sun et al., 2016; Li et al., 2016]. Tim-3+NK и Tim-3-NK беременных имеют разный цитокиновый профиль. Tim-3+NK-клетки продуцируют преимущественно противовоспалительные цитокины (TGF-бета 1, IL-10 и IL-4), и в незначительных количествах INF-гамма и TNF-альфа [Meggyes et al. 2014; Li et al., 2016]. Tim-3+NK периферической крови по сравнению с Tim-3-NK имеют сниженную цитотоксическую активность по отношению к клеткам трофобласта и способны эффективно индуцировать пролиферацию Treg [ там же ]. Tim-3-позитивные децидуальные NK также проявляют толерогенные свойства, а именно продуцируют противовоспалительные цитокины (TGF-бета1, IL-10 и IL-4) и факторы роста сосудов, но в незначительных количествах TNF-альфа и перфорин [Li et al., 2016].
В исследованиях in vitro были изучены механизмы иммуномодулирующей активности галектина-9 в отношении NK-клеток. Показано, что инкубация NK-клеток, выделенных из периферической крови небеременных, с галектином-9 в концентрации, характерной для беременности, снижает процент цитотоксических CD16+CD56dimNK в культурах, но не влияет на число регуляторных CD16-CD56brightNK и цитотоксических истощенных CD16+CD56-NK клеток [Orlova et al., 2023b]. При этом галектин-9 увеличивает процент Tim-3-позитивных регуляторных клеток CD16-CD56brightNK и не влияет на количество цитотоксических Tim-3-позитивных CD16+CD56dimNK и CD16+CD56-NK-клеток [Orlova et al., 2023b]. Внесение Tim-3-блокирующих антител отменяло эффекты галектина-9 на трансформацию фенотипа и экспрессию Tim-3 в разных субпопуляциях NK [Orlova et al., 2023b]. Другими авторами также было показано, что галектин-9 влияет на формирование регуляторного фенотипа децидуальных NK, повышая экспрессию Tim-3 на них [Sun et al., 2016; Li et al., 2016]. Суммируя все вышесказанное можно заключить, что при беременности модулирующие эффекты галектина-9 реализуются, главным образом, через Tim-3-зависимые механизмы.
Помимо этого, показано, что Th2-цитокины – IL-4, а также низкие концентрации прогестерона, характерные для первого триместра беременности, эффективно усиливают экспрессию Tim-3 на NK-клетках периферической крови, вовлекая сигналинг с участием STAT6 транскрипционного фактора [Li et al., 2016]. Эстрадиол и хорионический гонадотропин в концентрациях, характерных для разных триместров беременности, подобных эффектов не оказывали [там же]. Хотя в наших исследованиях показано, что инкубация NK периферической крови небеременных женщин in vitro c гормонами, продуцируемыми плацентой (эстрадиол, эстриол, прогестерон, хорионический гонадотропин, лептин, грелин, кисспептин), в концентрациях, характерных для разных триместров беременности, эффективно влияет на трансформацию фенотипа, экспрессию молекул клеточной адгезии, продукцию перфорина и гранзима, цитокинов, а также регуляторных микро-РНК [Shirshev et al., 2017a,b; Orlova et al., 2023a,b,c]. По-видимому, гормонозависимые механизмы в Tim-3-опосредованной регуляции функций NK-клеток при беременности будут изучены в ближайшем будущем.
В исследованиях многих авторов убедительно показано, что концентрация галектина-9 и количество Tim-3-позитивных NK-периферической крови являются важным прогностическим маркером развития патологий беременности. Так, у женщин со спонтанными абортами количество Tim-3+NK снижается, а цитотоксичность и продукция провоспалительных цитокинов NK-клетками, напротив, увеличивается [Miko et al., 2013]. При проведении экспериментах на мышах убедительно показано, что блокада Tim-3 способствует резорбции плода, снижению количества Tim-3+NK-клеток периферической крови и нарушению их регуляторной функции, а адоптивный перенос Tim-3+NK-клеток, напротив, снижает частоту выкидышей [Li et al., 2016]. Суммируя вышеописанные данные литературы, можно заключить, что галектин-9 регулирует экспрессию молекулы Tim-3 и формирование регуляторного фенотипа NK-клеток как in vivo, так и in vitro, а галектин-9-Tim-3-сигналинг необходим для созревания NK-клеток и играет важную роль в сохранении и успешном протекании беременности. Молекулярные механизмы галектин-9/Tim-3-регуляции функций NK-клеток в аспекте беременности представлены на рисунке
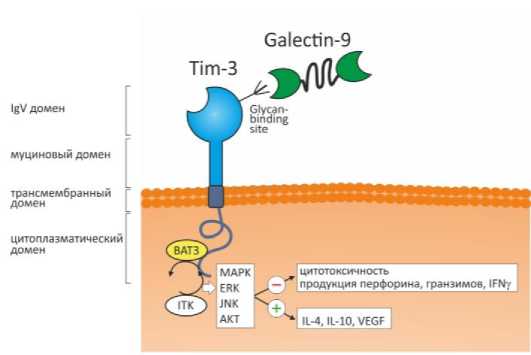
Молекулярные механизмы галектин-9/Tim-3-регуляции функций NK-клеток при беременности
[Molecular mechanisms of Galectin-9/Tim-3-regulation of functional activity of natural killers during pregnancy]
Из схемы видно, что галектин-9 (Galectin-9) взаимодействует с гликан-связывающим сайтом (Glycan-binding site) вариабельного иммуноглобулинового домена (IgV) рецептора Tim-3 на NK-клетках. Молекула Tim-3 включает экстрацеллюлярный (IgV и муциновый домены), трансмембранный и интрацеллюлярный участки. В состоянии покоя интрацеллюлярный домен рецептора Tim-3 связан с протеином Bat3 (human leukocyte antigen B-associated transcript 3). После взаимодействия Tim-3 с галектином-9 тирозиновая протеинкиназа ITK (interleukin-2-inducible T-cell kinase) запускает фосфорилирование остатков тирозина, что приводит к диссоциации Bat3 от интрацеллюлярного домена. Трансдукция сигнала с Tim-3 активирует MAPK (mitogen-activated protein kinase) и ERK (extracellular signal-regulated kinase) -сигнальные пути. Другими авторами показано, что регуляторные эффекты галектин-9-Tim-3-сигналинга на NK-клетках зависят от JNK- и AKT-сигнальных путей и могут быть реализованы путем регуляции активности транскрипционных факторов Id2, Blimp-1, Gata-3 и Eomes. При физиологически протекающей беременности галектин-9/Tim-3-сигналинг способствует формированию толерогенного фенотипа NK-клеток, снижая их цитотоксичность, ограничивая дегрануляцию и выброс литических факторов (перфоринов и гранзимов) и провоспалительного цитокина INF-гамма (INFy), способствуя продукции противовоспалительных цитокинов (IL-4, IL-10) и ангиогенных факторов VEGF (vascular endothelial growth factor).
Заключение
В целом, можно заключить, что галектин-9/Tim-3-сигналинг играет ключевую роль в регуляции функций NK-клеток. Направленность иммунорегуляторных эффектов галектина-9 на NK-клетки, реализуемых через Tim-3-рецептор, зависит от концентрации лектина, активационных стимулов, факторов микроокружения. При физиологически протекающей беременности галектин-9/Tim-3-сигналинг способствует формированию толерогенного фенотипа NK-клеток, снижая их цитотоксичность, ограничивая дегрануляцию и выброс литических факторов (перфоринов и гранзимов), способствуя продукции противовоспалительных цитокинов и пролиферации Treg, что необходимо для успешного протекания и сохранения беременности. Модулирование Tim-3-сигналинга на NK-клетках представляет новый терапевтический подход, перспективный не только для преодоления патологий беременности, но также и для лечения хронических вирусных, онкологических, аутоиммунных заболеваний.
Список литературы Галектин-9/Tim-3-зависимый механизм регуляции функциональной активности натуральных киллеров при беременности
- Рапопорт Е.М., Бовин Н.В. Специфичность галектинов человека в составе клеток // Биохимия. 2015. Т. 80, № 7. С. 1010–1022.
- Рапопорт Е.М., Курмышкина О.В., Бовин Н.В. Галектины млекопитающих: структура, углеводная специфичность и функции // Биохимия. 2008. Т. 73, № 4. С. 483–497.
- Asakura H. et al. Selective eosinophil adhesion to fibroblast via IFN-gamma-induced galectin-9 // J. Immunol. 2002. Vol. 169. P. 5912–5918.
- Boron D.G. et al. Galectin-1 and galectin-9 concentration in maternal serum: implications in pregnancies complicated with preterm prelabor rupture of membranes // Journal of Clinical Medicine. 2022. Vol. 11, № 21. Р. 6330.
- Cerdeira A.S. et al. Conversion of peripheral blood NK cells to a decidual NK-like phenotype by a cocktail of defined factors // J. of immunol. 2013. Vol. 190, № 8. P. 3939–3948.
- Chen H. et al. T-cell immunoglobulin and mucin-domain containing-3 (TIM-3): Solving a key puzzle in autoimmune diseases // Intern. immunopharmacol. 2023. Vol. 121. P. 110418.
- Cocker A.T.H. et al. CD56-negative NK cells: frequency in peripheral blood, expansion during HIV-1 infection, functional capacity and KIR expression. // Frontiers in Immunology. 2022. Vol. 13. P. 992723.
- Crespo A.C. et al. Decidual NK cells transfer granulysin to selectively kill bacteria in trophoblasts // Cell. 2020. Vol. 182, № 5. P. 1125–1139.
- Dixit A., Karande A.A. Glycodelin regulates the numbers and function of peripheral natural killer cells // J. Reprod. Immunol. 2020. Vol. 137. P. 102625.
- Elahi S. et al. Galectin-9 binding to tim-3 renders activated human CD4+ T cells less susceptible to HIV-1 infection // Blood. 2012. Vol. 119, № 18. P. 4192–204.
- Enninga E.A.L. et al. Immune checkpoint molecules soluble program death ligand 1 and galectin-9 are increased in pregnancy // Am. J. of Reprod. Immunol. 2018. Vol. 79, № 2. e12795.
- Erlebacher A. Immunology of the maternal-fetal interface // Annu. Rev. Immunol. 2013. Vol. 31. P. 387–411.
- Fu B. et al. Natural killer cells promote fetal development through the secretion of growth-promoting factors // Immunity. 2017. Vol. 47, № 6. P. 1100–1113.
- Fuselier C. et al. Placental galectins in cancer: why we should pay more attention // Cells. 2023. Vol. 12, № 3. P. 437.
- Gleason M.K. et al. Tim-3 is an inducible human natural killer cell receptor that enhances interferon gamma production in response to galectin-9 // Blood. 2012. Vol. 119, № 13. Р. 3064–3072.
- Grossman T.B. et al. Soluble T cell immunoglobulin mucin domain 3 (sTim-3) in maternal sera: a potential contributor to immune regulation during pregnancy // The J. of maternal-fetal & neonatal medicine: the official J of the Europ. Associat. of Perinat. Med. 2021. Vol. 34, № 24. P. 4119–4122.
- Han G. et al. Tim-3: an activation marker and activation limiter of innate immune cells // Front. Immunol. 2013. Vol. 4. P. 449–455.
- Imaizumi T. et al. Interferon-gamma stimulates the expression of galectin-9 in cultured human endothelial cells // J. Leukoc. Biol. 2002. Vol. 72. P. 486–491.
- Iwasaki-Hozumi H. et al. Blood levels of galectin-9, an immuno-regulating molecule, reflect the severity for the acute and chronic infectious diseases // Biomolecules. 2021. Vol. 11, № 3. P. 430.
- Koopman L.A. et al. Human decidual natural killer cells are a unique NK cell subset with immunomodulatory potential // The J. of exp. medicine. 2003. Vol. 198, № 8. P. 1201–1212.
- Li Y. et al. The Galectin-9/Tim-3 pathway is involved in the regulation of NK cell function at the maternal-fetal interface in early pregnancy // Cellular & molecul. Immunol. 2016. Vol. 13, № 1. Р. 73–81.
- Li Y. et al. Tim-3 signaling in peripheral NK cells promotes maternal-fetal immune tolerance and alleviates pregnancy loss // Science signaling. 2017. Vol. 10, № 498. P. 4323.
- Lu C. et al. An emerging role of TIM3 expression on T cells in chronic kidney inflammation // Front. Immunol. 2021. Vol. 12. P. 798683.
- Meggyes M. et al. Peripheral blood TIM-3 positive NK and CD8+T cells throughout pregnancy: TIM-3/Galectin-9 interaction and its possible role during pregnancy // PLoS One. 2014. Vol. 9, № 3. P. 92371.
- Miko E. et al. Involvement of Galectin-9/TIM-3 Pathway in the Systemic Inflammatory Response in Early-Onset Preeclampsia // PLoS One. 2013. Vol. 8, № 8. P. 71811.
- Nagahara K. et al. Galectin-9 increases Tim-3dendritic cells and CD8 T cells and enhances anti-tumor immunity via galection-9-Tim-3 interactions // J. Immunol. 2008. Vol. 181, № 11. P. 7660–7669.
- Ndhlovu L.C. et al. Tim-3 marks human natural killer cell maturation and suppresses cell-mediated cytotoxicity // Blood. 2012. Vol. 119, № 16. Р. 3734–3743.
- Ocana-Guzman R., Torre-Bouscoulet L., Sada-Ovalle I. TIM-3 regulates distinct functions in macrophages // Front. Immunol. 2016. Vol. 13, № 7. Р. 229.
- Orlova E.G. et al. Expression of TIM-3 and CD9 molecules on natural killer cells (NK) and T-lymphocytes with NK functions (NKT) in the peripheral blood at different trimesters of physiological pregnancy // J. Evol. Biochem. Phys. 2023a. Vol. 59. P. 809–821.
- Orlova E.G. et al. Galectin-9 influences the Tim-3 molecule expression in natural killer different subpopulations // Med. Immunol. (Russia). 2023b. Vol. 25, № 3. P. 469–476.
- Orlova E.G. et al. Hormone-Dependent Reprogramming of NK Cell Functions in the Aspect of Pregnancy // Science and Global Challenges of the 21st Century – Innovations and Technologies in Interdisciplinary Applications. Perm Forum 2022. Lecture Notes in Networks and Systems. 2023c. Vol. 622. Springer, Cham.
- Pełech A. et al. Do Serum galectin-9 levels in women with gestational diabetes and healthy ones differ before or after delivery? A pilot study // Biomolecules. 2023. Vol. 13, № 4. P. 697.
- Sanchez-Fueyo A. et al. Tim-3 inhibits T helper type 1-mediated auto- and allo- immune responses and promotes immunological tolerance // Nat. Immunol. 2003. Vol. 4, № 11. P. 1093–1101.
- Shirshev S.V. et al. Hormonal regulation of NK cell cytotoxic activity // Dokl. Biol. Sci. 2017b. Vol. 472, № 1. P. 28–30.
- Shirshev S.V. et al. MicroRNA in hormonal mechanisms of regulation of NK cell function // Dokl. Biochem. Biophys. 2017a. Vol. 474, № 1. P. 168–172.
- So E.C. et al. NK cell expression of Tim-3: first impressions matter // Immunobiology. 2019. Vol. 224, № 3. Р. 362–370.
- Song Yan et al. The mTORC1 signaling support cellular metabolism to dictate decidual NK cells function in early pregnancy // Front Immunol. 2022. Vol. 13. P. 771732.
- Sun J. et al. Tim-3 is up regulated in NK cells during early pregnancy and inhibits NK cytotoxicity toward trophoblast in galectin-9 dependent pathway // PloS one. 2016. Vol. 11, № 1. P. 0147186.
- Tang R., Rangachari M., Kuchroo V.K. Tim-3: A co-receptor with diverse roles in T cell exhaustion and tolerance // Semin. Immunol. 2019. Vol. 42. P. 101302.
- Wang F. et al. Activation of Tim-3–Galectin-9 pathways improves survival of fully allergenic skin grafts // Transpl. Immunol. 2008. Vol. 19, № 1. P. 12–19.
- Wu M. et al. Soluble co stimulatory molecule sTim3 regulates the differentiation of Th1and Th2 in patients with unexplained recurrent spontaneous abortion // Int. J. Clin. Exp. Med. 2015. Vol. 8, № 6. Р. 8812–8819.
- Zhu C. et al. The Tim-3 ligand galectin-9 negatively regulates T helper type 1 immunity // Nat. Immunol. 2005. Vol. 6, № 12. P. 1245–1252.
- Zhu W. et al. Tim-3: An inhibitory immune checkpoint is associated with maternal-fetal tolerance and recurrent spontaneous abortion // Clin. Immunol. 2022. Vol. 245. P. 109185.


