Галофильный штамм-деструктор бензойной кислоты Halomonas sp. D2
Автор: Д. И. Усанина, А. А. Пьянкова, Е. Г. Плотникова
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2021 года.
Бесплатный доступ
Бензойная кислота используется в промышленности, а также является промежуточным продуктом микробиологического разложения многих ароматических соединений – загрязнителей окружающей среды. Штамм Halomonas sp. D2, выделенный из глинистых отложений соляной шахты Верхнекамского месторождения (г. Соликамск, Пермский край), способен использовать бензойную кислоту (БК) в качестве единственного источника углерода и энергии. Halomonas sp. D2 растет на богатой среде Раймонда в присутствии 10–300 г/л NaCl и на минеральной среде с БК (1 г/л) при 30– 70 г/л соли. В геноме штамма выявлен ген benA, кодирующий α-субъединицу бензоат 1,2диоксигеназы – ключевого фермента разложения БК. Анализ нуклеотидной последовательности гена benA штамма D2 показал наиболее высокий уровень сходства (94.86%) с последовательностью benA-гена типового штамма Halomonas taeanensis BH539T, с которым штамм D2 наиболее филогенетически близок и по гену 16S рРНК (сходство 99.43%). Выявленные свойства штамма Halomonas sp. D2 делают его перспективным для использования в биотехнологиях восстановления засоленных почв и водоемов, загрязненных ароматическими углеводородами.
Галофильные бактерии, Halomonas, разложение бензойной кислоты, секвенирование, ген benA.
Короткий адрес: https://sciup.org/147235109
IDR: 147235109 | УДК: 579.26:57.083.18 | DOI: 10.17072/1994-9952-2021-3-171-177
Текст научной статьи Галофильный штамм-деструктор бензойной кислоты Halomonas sp. D2
способные осуществлять разложение бензойной кислоты и использовать ее в качестве единственного источника углерода и энергии [Field, Sierra-Alvarez, 2008; Егорова, Пьянкова, 2019]. В то же время крайне ограничена информация о галофиль-ных бактериях-деструкторах, строении и функционировании их метаболических, генетических систем, контролирующих разложение бензойной кислоты в условиях засоления [Fathepure, 2014].
Ранее из соляной шахты района промышленных разработок Верхнекамского месторождения калийно-магниевых солей (ВМКС) были выделены галофильные бактерии, которые на основании морфологических, физиологических и генетических исследований были идентифицированы как представители семейства Halomonadaceae (класс Gammaproteobacteria ) [Пьянкова и др., 2020]. На настоящем этапе изучения проводится дальнейшая характеристика выделенных галофилов, в том числе для перспективы использования в биотехнологических целях. Цель настоящей работы – изучение способности галофильного штамма Halomonas sp. D2 разлагать бензойную кислоту в условиях повышенной солености среды, а также выявление и филогенетическая характеристика ключевого гена катаболизма бензойной кислоты ( benA ).
Материалы и методы исследования
Объектом исследования являлся штамм Halomonas sp. D2, выделенный из глинистых донных отложений рассолоотводящей выработки одного из рудников ВМКС [Пьянкова и др., 2020]. Также в работе был использован типовой штамм Halomonas taeanensis BH539T из рабочей коллекции лаборатории микробиологии техногенных экосистем «ИЭГМ УрО РАН».
Среды и условия культивирования. При культивировании бактерий использовали минеральную среду Раймонда (МСР) [Raymond, 1961], а также богатую среду Раймонда (БСР) с триптоном (5 г/л) и дрожжевым экстрактом (2.5 г/л), с разным содержанием NaCl (от 10 до 300 г/л). Для агаризованных сред добавляли 15 г/л агара. Культивирование проводили при 28 °С.
Устойчивость бактерий к различным концентрациям хлорида натрия оценивали по появлению и размеру колоний при росте на агаризо-ванной БСР без соли и с содержанием NaCl от 10 до 300 г/л. Оценку роста колоний проводили через 2 недели после культивирования.
Рост бактерий на ароматических соединениях оценивали при культивировании в жидкой минеральной среде Раймонда (30 г/л NaCl). Бензойную кислоту, нафталин, бифенил, орто-фталат, как единственный источник углерода и энергии, добавляли в среду в количестве 1 г/л, салициловую кислоту – 0.5 г/л. Культивирование проводили на термошейкере при 28°С при 140 об./мин. Рост штаммов оценивали при определении оптической плотности культуры (ОП600) на спектрофотометре UV-Visible BioSpec-mini («Shimadzu», Япония) при длине волны 600 нм в кювете с длиной оптического пути 1 см.
Ростовые характеристики штамма D2 определяли при выращивании в жидкой МСР с бензойной кислотой (1 г/л) и содержанием 30 г/л NaCl, оптимальным для роста культуры. Культивирование проводили на термошейкере при 28°С при 140 об./мин. в течение 2 недель. Рост штаммов оценивали при определении оптической плотности культуры (ОП 600 ). Параметры роста культуры рассчитывали согласно Г. Шлегеля [1987]. Эксперименты были выполнены в трехкратной повторности. Полученные данные обрабатывали с использованием стандартных пакетов компьютерных программ Microsoft Excel.
Выделение бактериальной ДНК. Единичную колонию чистой культуры бактерий при помощи платиновой петли помещали в пробирку «эппен-дорф», содержащую 100 мкл 0.05 NaOH. Смесь инкубировали при 95°C в течение 15 мин., затем охлаждали 15 мин. при температуре -20°C, далее центрифугировали при 12 000 об./мин. 30 сек. Процедуру повторяли 4 раза. Для проведения ам-плифкации отбирали 1 мкл супернатанта.
Амплификация и определение нуклеотидных последовательностей гена benA . Для амплификации гена benA , кодирующего α-субъединицу бензоат 1,2-диоксигеназы, использовали праймеры benA-F (5’-GCCCACGAGAGCCAGATTCCC-3’) и benA-R (5’-GGTGGCGGCGTAGTTCCAGTG-3’) при условиях, приведенных в публикации [Baggi et al., 2008]. Амплификацию осуществляли на приборе C1000 TouchTM Thermal Cycler («Bio-Rad Laboratories», США). В качестве положительного контроля был использован штамм Rhodococcus wratislaviensis КТ112-7, деструктор бензойной кислоты [Егорова и др., 2013]. Анализ продуктов амплификации и документирование полученных результатов осуществляли, как описано ранее [Пьянкова и др., 2020].
Определение нуклеотидных последовательностей гена benA проводили на автоматическом секвенаторе Genetic Analyzer 3500xl («Applied Biosystems», США), с применением реактивов Big Dye Terminator Ready Reaction Kit v 3.1 («Applied Biosystems», США), согласно рекомендациям производителя, на кафедре ботаники и генетики растений Пермского государственного национального исследовательского университета. Поиск гомоло- гичных последовательностей гена benA осуществляли с использованием базы данных GenBank . Множественное выравнивание транслированных аминокислотных последовательностей гена benA и построение филогенетического дерева проводили с использованием программы MEGA 7.0. При построении филогенетического дерева применяли кластерный метод «neighbor-joining». Оценку статистической достоверности ветвления («bootstrap»-анализ) устанавливали на основе 1000 альтернативных деревьев. Нуклеотидная последовательность гена benA депонирована в базу данных GenBank под номером MW862487.
Результаты и их обсуждение
Ранее из образца глинистых отложений соляной шахты ВКМС был выделен грамотрицательный штамм D2. В результате секвенирования и сравнения последовательностей гена 16S рРНК с типовыми штаммами из базы данных EzBioCloud было установлено, что данный штамм относится к се- мейству Halomonadaceae (класс Gammaproteobacteria) и имеет наибольшее сходство (99.43% по гену 16S рРНК) с типовым штаммом Halomonas taeanensis BH539T [Пьянкова и др., 2020].
Проведенные исследования по изучению дегра-дационных свойств штамма D2 показали, что он способен использовать в качестве единственного источника углерода и энергии бензойную кислоту, но не другие моно- и полиароматические соединения (в частности, салициловую, орто -фталевую кислоты, нафталин, бифенил).
Установлено, что штамм Halomonas sp. D2 является галофильным организмом и способен к эффективному росту в БСР при содержании хлорида натрия от 10 до 300 г/л. В сравнении, штамм Halomonas taeanensis BH539T выдерживал не более 250 г/л NaCl при культивировании в аналогичных условиях. Оба штамма не росли при отсутствии соли в среде. В МСР с использованием в качестве субстрата бензойной кислоты (1 г/л) штаммы Halomonas sp. D2 и H. taeanensis BH539T росли в присутствии 10‒70 г/л соли (табл. 1).
Таблица 1
Рост бактерий рода Halomonas в присутствии различных концентраций хлорида натрия
|
Штамм |
Агаризованная БСР, NaCl (г/л) |
Жидкая МСР, бензойная кислота (1 г/л), NaCl (г/л) |
|||||||||
|
Без NaCl |
10 |
100 |
150 |
200 |
250 |
300 |
Без NaCl |
30 |
50 |
70 |
|
|
H. taeanensis DSM 16463T |
– |
+ |
+ |
+ |
+ |
+ |
– |
– |
+++ |
++ |
+ |
|
Halomonas sp. D2 |
– |
+ |
+ |
+ |
+ |
+ |
+ |
– |
+++ |
+++ |
++ |
Примечание. «–» – рост не обнаружен; «+» – на агаризованной среде, колонии размеров больше 2 мм; «+» – в жидкой среде, ОП 600 от 0.1 до 0.3 ед.; «++» – ОП 600 от 0.4 до 0.7 ед.; «+++» – ОП 600 выше 0.7 ед.
Штамм D2 демонстрировал наибольший прирост биомассы при выращивании на бензоате в присутствии 30 г/л NaCl. На рисунке 1 представлена кривая роста штамма D2. На начальных этапах культивирования наблюдался замедленный рост культуры (ОП600 не превышала 0.2 ед.), толь- ко через 150 ч. был отмечен активный прирост биомассы. Максимальная ОП600, равная 1.05 ед., наблюдалась при 259 ч. (11-е сут.) культивирования. Скорость экспоненциального роста (µ) составляла 0.0211±0.003 ч–1.
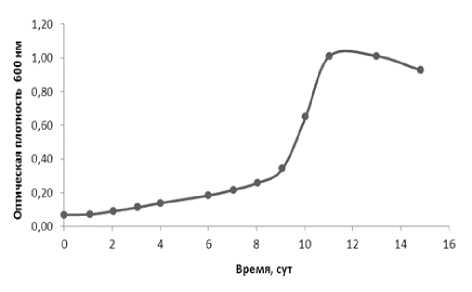
Рис. 1 . Рост штамма Halomonas sp. D2 в МСР (30 г/л NaCl) на бензойной кислоте (1 г/л) в качестве единственного источника углерода и энергии
На ДНК-матрице штамма D2 был амплифици-рован ген benA, кодирующий α-субъединицу бен- зоат 1,2-диоксигеназы – ключевого фермента, участвующего на начальном этапе окислении бен- зоата [Parales, Resnick, 2006]. Также фрагмент аналогичного размера (около 521 п.н.) был обнаружен в ДНК штамма H. taeanensis BH539T, что указывает на присутствие гена benA в ДНК типового штамма (рис. 2).
М 1 2 К+К-
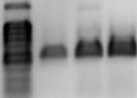
Рис. 2 . Электрофореграмма результатов амплификации гена benA :
M – маркер 100+ bp DNA Ladder (Евроген, Россия), 1 – Halomonas sp. D2, 2 – H. taeanensis BH539 T , K+ – Rhodococcus wratislaviensis
КТ112-7, K- – отрицательный контроль
Полученный ампликон гена benA Halomonas sp. D2 был секвенирован. Проведен сравнительный анализ нуклеотидных последовательностей фрагмента гена benA штамма Halomonas sp. D2 с гомологичными последовательностями из базы данных GenBank (табл. 1). Установлено, что наиболее близким к изучаемому гену является ген α-субъединицы бензоат/толуат-1,2-диоксигеназы типового штамма H. taeanensis BH539T (FNCI01000003). Сходство гена benA штамма Halomonas sp. D2 c гомологичным геном H. taeanensis BH539T составляло 94.86%. С другими подобными генами представителей рода Halomonas уровень сходства не превышал 89.38%, а с генами штаммов других родов семейства Halomonadaceaе – 78.13% (ближайшая последовательность гена benA Chromohalobacter sp. HS2, EU155151) (табл. 2).
Таблица 2
Сравнительный анализ гена benA штамма Halomonas sp. D2 с ближайшими гомологичными последовательностями из базы данных GenBank
|
Гомологичные гены |
Номер в GenBank* |
Номер в GenBank** |
Сходство, % |
Место выделения |
Ссылка |
|
Бензоат/толуат 1,2-ДО, H. taeanensis BH539T |
FNCI01000003 |
SDF94072 |
94.86 |
Солнечная солеварня, Корея |
н.д. |
|
Бензоат 1,2-ДО, H. aestuarii Hb3 |
CP018139 |
APE30514 |
89.38 |
Солеварня, Корея |
н.д. |
|
Белок с кластером Риске [2Fe-2S], Halomonas sp. BM-2019 |
CP071922 |
QTF93273 |
87.90 |
Озерная вода, Танзания |
н.д. |
|
Бензоат 1,2-ДО, H. beime-nensis NTU-111 |
CP021435 |
ATJ82503 |
87.50 |
Солеварня, Тайвань |
Chen et al., 2017 |
|
Бензоат 1,2-ДО, H. organivorans CECT 5995T |
FN997646 |
CBR26855 |
86.74 |
Засоленная почва, Испания |
García et al., 2004 |
|
Белок с кластером Риске [2Fe-2S], Halomonas sp. PGE1 |
CP053032 |
QJQ97940 |
86.70 |
Гиперсоленая экосистема, Нидерланды |
н.д. |
|
Бензоат 1,2-ДО, Chromo-halobacter sp. HS2 |
EU155151 |
ABV82781 |
78.13 |
Солёные ферментированные моллюски |
Kim et al., 2008 |
Примечание: «н.д.» – нет данных; * – нуклеотидные последовательности; ** – аминокислотные последователь- ности.
На основании полученных данных построено филогенетическое дерево, показывающее положение транслированных аминокислотных последовательностей benA штамма Halomonas sp. D2 и гомологичных последовательностей представителей семейства Halomonadaceaе (рис. 3).
Гены benA, кодирующие большую субъединицу ключевого фермента деструкции БК – бензоат 1,2-диоксигеназы, выявлены в геномах бактерий различных таксономических групп [Егорова, Пьянкова, 2019]. На настоящем этапе исследований пока- зано, что ген benA штамма Halomonas sp. D2 является наиболее филогенетически близким benA-генам галофильных бактерий-деструкторов бензоата, рода Halomonas (сем. Halomonadaceae) и, кроме того, имеет высокий процент сходства (94.86%) с benA-геном типового штамма вида H. taeanensis, который является наиболее близкородственным по гену 16S рРНК штамму D2 [Пьянкова и др., 2020]. Таким образом, мы предполагаем, что benA-ген может быть использован в качестве филогенетического маркера для определения бакте- рий рода Halomonas среди деструкторов БК раз- личных таксонов прокариот.
- Бензоат 1,2-ДО, Halonwnas sp. D2 (MW862487)
Бензоат/толуат 1.2-ДО.Я kiwmensis BH539T(SDF94072)
------Бензоат 1.2-ДО.//, aestitarii НЬЗ(АРЕЗО514)
--------Бензоат 1.2-ДО, Н. beimenensisYTO-X 11 (ATJ82503)
-----------Белок с кластером Риске. HalomoiMs sp. ВМ-2019 (QTF93273)
----------Белок с кластером Риске. Halomonas sp. PGE1 (QJQ97940) Бензоат 1.2-ДО. //. organivomns СЕСТ 5995T(CBR26855)
------------Бензоат 1.2-ДО. Chromohalobacter sp HS2 (ABV82781)
।----------------------------------1
Ml
Рис. 3 . Филогенетическое дерево, построенное с использованием метода neighbor-joining, показывающее положение транслированных аминокислотных последовательностей гена benA Halomonas sp. D2 и ближайших последовательностей из базы данных GenBank
Заключение
В результате проведенных исследований было установлено, что штамм Halomonas sp. D2 является активным деструктором бензойной кислоты, способным осуществлять ее разложение (1 г/л) в присутствии высоких концентраций хлорида натрия (30‒70 г/л). Полученные данные указывают на возможность использования штамма при разработке технологий, направленных на очистку объектов окружающей среды от токсичных ароматических поллютантов.
Работа выполнена в рамках государственного задания, номер госрегистрации темы: АААА-А19-119112290008-4.
Список литературы Галофильный штамм-деструктор бензойной кислоты Halomonas sp. D2
- Егорова Д.О. и др. Деструкция ароматических углеводородов штаммом Rhodococcus wratislaviensis KT112-7, выделенным из отходов соледобывающего предприятия // Прикладная биохимия и микробиология. 2013. Т. 49, № 3. С. 267–278.
- Егорова Д.О., Пьянкова А.А. Скрининг гена альфа-субъединицы бензоат диоксигеназы в бактериальных ассоциациях, полученных в результате селекции на (хлор)ароматических соединениях // Вестник Пермского университета. Сер. Биология. 2019. Вып. 4. С. 464–470.
- Пьянкова А.А. и др. Характеристика бактерий, выделенных из рудника Верхнекамского месторождения солей (Пермский край) // Вестник Пермского университета. Сер. Биология. 2020. Вып. 4. С. 312–320.
- Шлегель Г. Общая микробиология: пер. с нем. М.: Мир, 1987. 567 с.
- Baggi G. et al. Co-metabolizm of di- and trichlorbenzoates in a 2-chlorobenzoate-degrading bacterial culture: Effect of the position and number of halosubstituents // International Biodeterioration and Biodegradation. 2008. Vol. 62, № 1. P. 57−64.
- Chen Y. et al. Revealing the saline adaptation strategies of the halophilic bacterium Halomonas beimenensis through high-throughput omics and transposon mutagenesis approaches // Science Reports. 2017. Vol. 7. P. 183−195.
- Fathepure B.Z. Recent studies in microbial degradation of petroleum hydrocarbons in hypersaline environments // Frontiers in Microbiology. 2014. Vol. 5. P. 173.
- Field J.A., Sierra-Alvarez R. Microbial transformation of chlorinated benzoates // Reviews in Environmental Science and BioTechnology. 2008. Vol. 7. P. 191–210.
- García M.T. et al. Halomonas organivorans sp. nov., a moderate halophile able to degrade aromatic compounds // International Journal of Systematic and Evolutionary of Microbiology. 2004. Vol. 54, № 5. P. 1723−1728.
- Kim D. et al. Molecular cloning and functional characterization of the genes encoding benzoate and phydroxybenzoate degradation by the halophilic Chromohalobacter sp. strain HS-2 // FEMS Microbiology Letters. 2008. Vol. 280, № 2. P. 235−241.
- Parales R.E., Resnick S.M. Aromatic ring hydroxylating dioxygenases // Pseudomonas / Eds. J.L. Ramos, R.C. Levesque. Boston: Springer, 2006. P. 287–340.
- Pieper D.H. Aerobic degradation of polychlorinated biphenyls. // Applied Microbiology Biotechnology. 2005. Vol. 67, № 2. P. 170–191.
- Raymond R.L. Microbial oxidation of n-paraffinic hydrocarbons // Developments in Industrial Microbiology. 1961. Vol. 2, № 1. P. 23–32.


