Галотолерантные бактерии-деструкторы полициклических ароматических углеводородов рода Arthrobacter
Автор: Ястребова О.В., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 5, 2007 года.
Бесплатный доступ
Методом накопительных культур из почв и донных отложений района солеразработок выделено пять штаммов бактерий рода Arthrobacter, способных к росту на нафталине как единственном источнике углерода и энергии при содержании 1 М NaCl в среде культивирования. Штамм A. globiformis SF27 утилизирует фенантрен в присутствии 1 М NaCl. Установлены пути метаболизма фенантрена клетками Arthrobacter sp. B1 через образование 1,2-дигидроксинафталина, салицилата и клетками A. globiformis SF27 - через 1-гидрокси-2-нафтоат, 2-карбоксибензальдегид, орто-фталат. В штаммах A. globiformis DF14, SF27 и A. nicotianae SN17 обнаружены плазмиды размером 120 т.п.н. и 85 т.п.н.
Короткий адрес: https://sciup.org/147204390
IDR: 147204390 | УДК: 579.222:579.252.5:579.871.2
Текст научной статьи Галотолерантные бактерии-деструкторы полициклических ароматических углеводородов рода Arthrobacter
2007 Биология Вып. 5 (10)
ГАЛОТОЛЕРАНТНЫЕ БАКТЕРИИ-ДЕСТРУКТОРЫ ПОЛИЦИКЛИЧЕСКИХ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ РОДА ARTHROBACTER
О. В. Ястребоваa, Е. Г. Плотниковаa,b aИнститут экологии и генетики микроорганизмов УрО РАН, 614081, Пермь, ул. Голева, 13 bПермский государственный университет, 614990, Пермь, ул. Букирева, 15
Методом накопительных культур из почв и донных отложений района солеразработок выделено пять штаммов бактерий рода Arthrobacter , способных к росту на нафталине как единственном источнике углерода и энергии при содержании 1 М NaCl в среде культивирования.
Штамм A. globiformis SF27 утилизирует фенантрен в присутствии 1 М NaCl. Установлены пути метаболизма фенантрена клетками Arthrobacter sp. B1 через образование 1,2-дигидроксинафталина, салицилата и клетками A. globiformis SF27 – через 1-гидрокси-2-нафтоат, 2-карбоксибензальдегид, орто- фталат. В штаммах A. globiformis DF14, SF27 и A. nicotianae SN17 обнаружены плазмиды размером 120 т.п.н. и 85 т.п.н.
В большинстве случаев загрязнение объектов окружающей среды в промышленных районах носит комплексный, полихимический характер. Наряду с повышенным содержанием поллютантов, к которым относятся моно- и полиароматические углеводороды (ПАУ), почвы и водоемы могут подвергаться воздействию других экстремальных факторов, в частности высокой минерализации. Возможность микробной деструкции ПАУ в данных условиях определяется устойчивостью бактерий к повышенному содержанию солей и способностью проявлять при этом биодеградативные свойства (Kästner et al., 1998; Boonchan et al., 2000).
В последние годы появляется все больше публикаций о грамотрицательных и грамположитель-ных бактериях, способных разлагать широкий спектр токсичных органических соединений различной химической природы, обладающих устойчивостью к экстремальным условиям существования, в том числе к высокой минерализации среды (Luz et al., 1997; Kästner et al., 1998). В то же время, процессы утилизации ПАУ более подробно изучены у грамотрицательных бактерий, в частности у бактерий родов Pseudomonas и Burkholderia (Yen, Serdar, 1988; Laurie, Lloyd-Jones, 1999). Имеются лишь единичные работы о подробных исследованиях биохимических путей и генетических системах разложения нафталина и фенантрена у грамположительных бактерий (Keuth, Rehm, 1991; Boldrin et al., 1993; Kanaly, Harayama, 2000).
Ранее, из образцов почв и донных отложений района солеразработок нами были выделены бактериальные культуры, отнесенные к родам Pseudomonas, Rhodococcus, Arthrobacter, Bacillus, а также сообщества микроорганизмов, способные использовать нафталин, фенантен и бифенил в качестве единственного источника углерода и энергии (Алтынцева, 2001; Плотникова и др., 2001).
Цель исследования – изучение бактерий рода Arthrobacter, способных к деструкции нафталина и фенантрена в условиях повышенной минерализации среды.
Методы исследования
Бактериальные культуры. В работе использованы бактериальные штаммы, выделенные из почв и донных отложений, загрязненных отходами химических производств (г. Березники, Пермская область): Arthrobacter globiformis SF27, Arthrobac-ter globiformis DF14, Arthrobacter nicotianae SN17, Arthrobacter sp. B45 и Arthrobacter sp. B1 (Алтын-цева, 2001; Плотникова и др., 2001).
Среды и условия культивирования. Для роста микроорганизмов использовали минеральную среду Раймонда (Розанова, Назина, 1982) с разным содержанием хлорида натрия. В качестве полноценной среды использовали модифицированную среду Раймонда при добавлении 5 г/л триптона и 2.5 г/л дрожжевого экстракта. Нафталин, фенантрен, бифенил использовали как субстраты в концентрации 1 г/л при культивировании в жидкой минеральной среде. При выращивании микроорганизмов на агаризованных средах добавляли нафталин и бифенил, которые наносили на крышку перевернутой чашки Петри. Культивирование проводили при температуре 28˚С.
Ростовые характеристики штаммов-деструкторов изучались в периодической культуре. Оптическую плотность (ОД) определяли на ФЭК-56М при длине волны 540 нм и толщине кюветы 0.5 см. Количество колониеобразующих единиц (КОЕ) определяли методом серийных разведений с последующим высевом и подсчетом колоний микроорганизмов на чашках с агаризованной полноценной средой.
Плазмидную ДНК выделяли модифицированным методом щелочного лизиса (Marco et. al., 1982), методом Бабыкина (Бабыкин и др., 1984), методом Портного-Уайта (Методы общей бактериологии, 1983).
Электрофорез в агарозном геле осуществляли в соответствии с рекомендациями (Маниатис и др., 1984).
Элиминация бактериальных плазмид была выполнена согласно стандартной методике (Rheinwald et al., 1973).
Анализ метаболитов проводили методом тонкослойной хроматографии (ТСХ) с применением пластин Silufol UV 254 (Kavalier, Чехия) и системы растворителей гексан : этилацетат : уксусная кислота (10:3:1). Пластины анализировали под ультрафиолетом (254 нм).
Результаты и обсуждение
Характеристика бактерий-деструкторов
Выделенные из почв и донных отложений, загрязненных отходами химических и соледобывающего предприятий, 5 штаммов-деструкторов нафталина и фенантрена были идентифицированы как представители рода Arthrobacter . Штаммы
SF27 (=ВКМ Ас-2063) и DF14 (=ВКМ Ас-2064) отнесены к виду " A. globiformis" , штамм SN17 (=ВКМ Ас-2065) определен как представитель вида " A. nicotianae ". Два бактериальных штамма – B1 и B45 до вида не определены (Алтынцева, 2001; Плотникова и др., 2001).
Исследуемые бактериальные культуры были проверены на способность к утилизации ряда ароматических соединений и продуктов их метаболизма. Установлено, что все штаммы растут на нафталине и салицилате. Два штамма A. globi-formis – SF27 и DF14, способные к эффективному росту на фенантрене, утилизируют возможные продукты его метаболизма – 1-гидрокси-2-нафтоат и орто -фталат, а также растут на гентизате – одном из основных метаболитов нафталина. Штамм A. nicotianae SN17 способен к росту на нафталине и его ключевых метаболитах (табл. 1).
Методом ТСХ были определены продукты метаболизма разложения нафталина и фенантрена у A. globiformis SF27 и Arthrobacter sp. В1. Установлено, что при росте на фенантрене в среде культивирования штамма A. globiformis SF27 присутствуют 1-гидрокси-2-нафтоат и два неидентифици-рованных метаболита. В среде культивирования штамма Arthrobacter sp. В1 были зафиксированы 1-гидрокси-2-нафтоат, 1,2-дигидрокси-нафталин и аналогичные неидентифицированные продукты.
При выращивании штаммов SF27, В1 и В45 на нафталине установлено, что в среде культивирования всех трех штаммов в низкой концентрации присутствует салицилат. В культуральной среде A. globiformis SF27 обнаружен также катехол, являющийся ключевым метаболитом утилизации салицилата.
Таблица 1
|
Штамм |
Ростовые субстраты* |
||||||
|
Нафталин |
Бифенил |
Фенантрен |
Салицилат |
Орто -фталат |
Гентизат |
1H2N |
|
|
DF14 |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
SF27 |
+ |
+ |
+ |
+ |
+ |
± |
|
|
SN17 |
+ |
± |
+ |
+ |
+ |
||
|
B45 |
+ |
+ |
|||||
|
B1 |
+ |
± |
+ |
||||
Примечание. + – выраженный рост; ± – слабый рост; - – нет роста; 1H2N – 1-гидрокси-2-нафтоат; * рост штаммов проверяли в минеральной среде Раймонда в присутствии 0.5 М NaCl.
Характеристика бактерий-деструкторов ПАУ рода Arthrobacter
На основании полученных данных можно предположить, что утилизация нафталина штаммами SF27, В1 и В45 идет по наиболее распространенному у штаммов-деструкторов нафталина пути с образованием салицилата и катехола в качестве ключевых метаболитов и расщеплением катехола по мета- и орто-пути (рис. 1). Утилизация фенантрена штаммом B1 возможна с образо- ванием 1,2-дигидрокси-нафталина и салицилата в качестве основных метаболитов, а штаммом A. globiformis SF27 - с образованием 1-гидрокси-2-нафтоата, 2-карбоксибензальдегида и ортофталата в качестве ключевых метаболитов без участия ферментов утилизации нафталина (Kiyohara et al., 1976; Iwabuchi, Harayama, 1998).
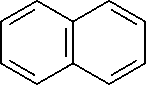
Нафталин
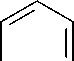
Фенантрен
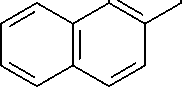
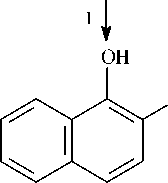
COOH
1-Гидрокси-
2-нафтойная кислота
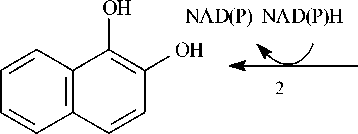
1,2-дигидроксинафталин
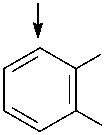
OH
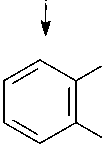
COOH
о -Фталевая кислота
COOH
COOH
Салициловая кислота
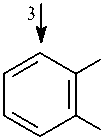
OH
OH Катехол
HO
HO
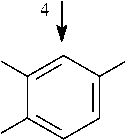
COOH
Протокатеховая кислота
орторасщепление мета расщепление орто - расщепление мета расщепление
Рис. 1. Метаболические пути биодеградации нафталина и фенантрена (Yen, Serdar, 1988; Iwabuchi, Harayama, 1998): 1 – фенантрен диоксигеназа; 2 – 1-гидрокси-2-нафтоат гидроксилаза; 3 – салицилат 1-гидроксилаза; 4 – о- фталат гидроксилаза
Рост бактерий-деструкторов при повышенных концентрациях хлорида натрия
Установлено, что все выделенные штаммы-деструкторы ПАУ рода Artrobacter способны к росту как на средах, не содержащих хлорид натрия, так и на средах с повышенным содержанием NaCl: до 2 М – на полноценной среде и до 1 М – на минеральной среде с нафталином в качестве субстрата. Полученные результаты позволяют отнести исследуемые штаммы к умеренно галотоле-рантным микроорганизмам, по классификации Кашнера (Кашнер, 1981).
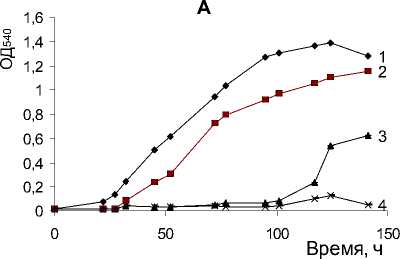
Из литературных источников известна способность ряда грамположительных бактерий к утилизации алифатических и моноароматических со- единений в условиях повышенной минерализации среды (Luz et al., 1997). Нами изучено влияние различных концентраций NaCl на способность штамма A. globiformis SF27 к росту и деструкции фенантрена (рис. 2 А, В). Как показали результаты опыта, повышение концентрации NaCl в среде культивирования штамма SF27 до 0.4 М приводило к снижению максимального значения оптической плотности культуры по сравнению с культурой в контроле, однако количество жизнеспособных клеток культуры оставалось на уровне контроля. В присутствии 0.7 M NaCl в ростовой среде наблюдалось значительное снижение оптической плотности и количества жизнеспособных клеток культуры, а также увеличение лаг-фазы роста культуры. Повышение концентрации NaCl в среде культивирования до 1 М ингибировало рост штамма на фенантрене, однако при определении количества колониеобразующих единиц выявлены жизнеспособные клетки (рис. 2 А, В).
B
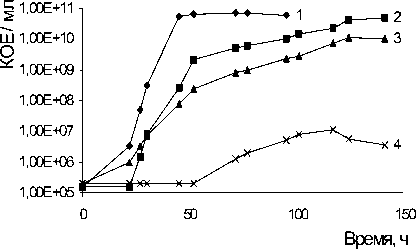
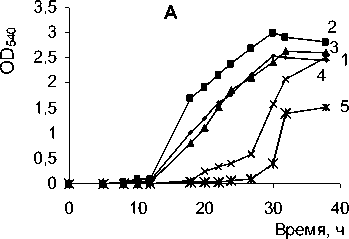
Рис. 2. Рост Arthrobacter globiformis SF27 в минеральной среде с фенантреном при разных концентрациях NaCl (М): 1 – контроль (без NaCl); 2 – 0.4 M; 3 – 0.7 M; 4 – 1 M
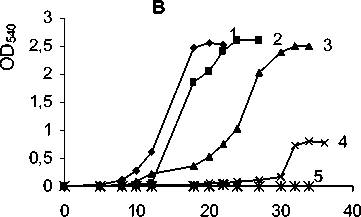
Влияние засоления среды на ростовые характеристики штамма Arthrobacter globiformis SF27 изучалось в сравнении со штаммом Arthrobacter globiformis КЗТ-1, выделенным из огородной почвы Подмосковья (Зайцев, Карасевич, 1981). Культивирование штаммов проводилось на среде Раймонда с добавлением триптона и дрожжевого экстракта в качестве субстратов. При увеличении концентрации NaCl в ростовой среде штамма A. globiformis SF27 до 0.4 М наблюдались более высокие значения оптической плотности культуры по сравнению с показателями, зарегистрированными при культивировании в условиях обычной минерализации (рис. 3 А, В). При концентрации 1 М NaCl максимальная оптическая плотность культуры штамма SF27 достигала уровня контроля, но за более продолжительный период. Значения оптической плотности для штамма КЗТ-1 при данной концентрации NaCl были существенно ниже, чем при выращивании в среде с обычной минерализацией. При повышении содержания NaCl в ростовой среде до 1.5 М отмечалось снижение максимальной оптической плотности культуры штамма SF27 в 2 раза, по сравнению с контролем, а также увеличение лаг-фазы. В присутствии 1.5 М NaCl в среде культивирования рост штамма Arthrobacter globiformis КЗТ1 практически отсутствовал (рис. 3 A, B).
Время, ч
Рис. 3. Рост штаммов Arthrobacter globiformis SF27 (А) и КЗТ-1 (B) в полноценной среде при разных концентрациях NaCl (M): 1 – контроль (без NaCl); 2 – 0.4 M; 3 – 0.7 M; 4 – 1 M; 5 – 1.5 M
Из полученных данных следует, что выделенный из почвы с повышенной минерализацией фе-нантрен-деградирующий штамм Arthrobacter glo-biformis SF27 способен к росту на фенантрене при концентрации NaCl в ростовой среде до 0.7 М и является более устойчивым к высокой минерализации среды, чем представитель того же вида Arth-robacter globiformis КЗТ1, выделенный из подмосковной почвы.
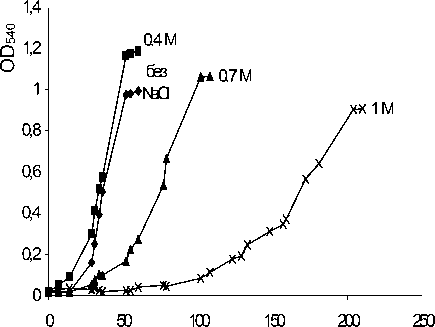
Ростовые характеристики штамма Arthrobacter sp. B45, выделенного из нафталинутилизирующего сообщества микроорганизмов, исследовались в минеральной среде Раймонда разной минерализации. В качестве субстрата был использован нафталин (рис. 4).
Время (ч)
Рис. 4. Рост штамма Arthrobacter globiformis B45 в минеральной среде с нафталином при разных концентрациях NaCl (М)
Опыты показали, что присутствие в среде культивирования NaCl в концентрации 0.4М приводило к небольшому увеличению значений оптической плотности культуры. В литературе описано стимулирующее воздействие небольших концентраций хлорида натрия (1-2%) на ростовые характеристики грамположительных штаммов (Плакунов и др., 1999). В присутствии 1 М NaCl наблюдалось увеличение лаг-фазы роста и снижение ростовых показателей культуры. В то же время сообщество микроорганизмов, включающее штаммы Arthrobacter sp. B45 и В1, способно к утилизации нафталина при концентрации NaCl в среде культивирования до 1.5 М (Алтынцева, 2001).
Роль плазмид в деградации ПАУ
У большинства описанных в литературе штаммов-деструкторов гены, контролирующие разложение нафталина и фенантрена, расположены в плазмидах (Кочетков, Боронин, 1984; Yen, Serdar, 1988;).
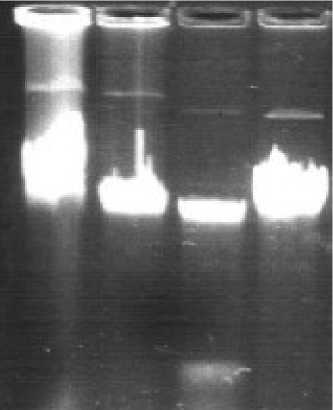
Нами был проведен анализ на наличие плаз-мидной ДНК штамма-деструктора нафталина A. nicotiane SN17 и штаммов-деструкторов нафталина и фенантрена A. globiformis DF14 и SF27.
Анализ электрофореграмм показал, что штамм A. nicotiane SN17 содержит плазмиду размером около 85 тпн. В штаммах A. globiformis DF14 и SF27 зарегистрированы плазмиды размером около 120 тпн.
Известно, что способность к деструкции различных ксенобиотиков бактериями рода Arthro-bacter также часто определяется плазмидными генами (Furukawa, Chakrabarty, 1982; Eaton, 2001). В наших исследованиях при обработке клеток штамма A. globiformis SF27 митомицином С в концентрации 0.6 мкг/мл были получены элиминант-ные штаммы. Установлено, что элиминанты не способны к росту на нафталине, фенантрене и 1-гидрокси-2-нафтоате; в то же время они сохраняют способность к росту на салицилате. Полученные данные позволяют предположить, что ферменты первичной атаки ароматического кольца фенантрена и 1-гидрокси-2-нафтоата, а также ферменты утилизации нафталина до салицилата у штамма A. globiformis SF27 кодируются плазмид-ными генами.
1 2 3 4
Рис. 5. Электрофореграмма плазмидной ДНК: 1 – рSF27; 2 – рDF14; 3 – рSN17; 4 – NAH7 (83 тпн)
Заключение
Выделенные из почв и донных отложений, загрязненных отходами химических и соледобывающего производств, бактерии рода Arthrobacter имеют большой деградативный потенциал. Установлено, что все исследованные штаммы являются деструкторами нафталина и осуществляют его утилизацию по описанному в литературе для ряда штаммов рода Pseudomonas пути с образованием салицилата и катехола (Yen., Serdar, 1988). Штамм Arthrobacter globiformis SF27, вероятно, способен к деградации фенантрена через 1-гидрокси-2-нафтойную кислоту, 2-карбоксибензальдегид и орто- фталат без участия ферментов утилизации нафталина (Kiyohara, Nagao, 1976; Iwabuchi, Harayama, 1998).
Выделенные бактерии-деструкторы ПАУ рода Arthrobacter являются умеренно галотолерантны-ми бактериями (Кашнер, 1981) и способны к росту на нафталине при концентрации 1 М хлорида натрия в среде культивирования. Установлено, что все исследованные штаммы на полноценной среде способны к росту при более высоких концентрациях NaCl, чем на минеральной среде с нафталином. Из литературных данных известно, что аминокислоты могут выступать в качестве осмопротекторов и накапливаться клетками ряда галотоле-рантных штаммов при повышенном засолении среды (Galinski, 1993). Штамм Arthrobacter globiformis SF27 способен к утилизации фенантрена при концентрации NaCl до 1 М и растет при более высоких концентрациях хлорида натрия, чем штамм A. globiformis КЗТ1, выделенный из подмосковной почвы.
Три штамма SN17, SF27 и DF14 содержат плазмиды большого размера. В эксперименте по элиминации плазмиды A. globiformis SF27 получены данные, позволяющие предположить, что ферменты первичной атаки ароматического кольца фенантрена и 1 - гидрокси - 2 - нафтоата, а также ферменты утилизации нафталина до салицилата у данного штамма кодируются плазмидными генами.
На основании полученных результатов можно утверждать, что выделенные бактерии-деструкторы нафталина и фенантрена рода Arthrobacter адаптированы к росту и утилизации ароматических субстратов в условиях повышенной минерализации среды и являются перспективными для использования при биоремедиации почв и стоков с повышенным содержанием солей.
Работа поддержана грантом РФФИ-Урал №0404-96042.
Список литературы Галотолерантные бактерии-деструкторы полициклических ароматических углеводородов рода Arthrobacter
- Алтынцева О.В. Галотолернтные бактерии-деструкторы полициклических ароматических углеводородов: Дис. ¡ канд. биол. наук. Пермь, 2001. 139 с.
- Бабыкин M.M. и др. Плазмиды различных штаммов Pseudomonas spheroides//Молек. генет. микроорг. и вирусов. 1984. ¢ 7. С. 23-28.
- Зайцев Г.М., Карасевич Ю. Н. Утилизация 4-хлорбензойной кислоты штаммом Arthrobacter globiformis//Микробиология. 1981. Т. 50. С. 35-40.
- Кочетков В.В., Боронин А.М. Сравнительное изучение плазмид, контролирующих биодеградацию нафталина культурой Pseudomonas//Микробиология. 1984. Т. 53. С. 639-644.
- Кашнер Д. Жизнь микробов в экстремальных условиях. М.: Мир, 1981. 365 с.
- Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии//Молекулярное клонирование. М.: Мир, 1984. 390 с.
- Методы общей бактериологии/Пер. с англ.; под ред. Ф. Герхардт и др. М.: Мир,1983. Т. 1-3.
- Плакунов В.К. и др. Взаимосвязь кинетики роста и дыхания у родококков в присутствии высоких концентраций солей//Микробиология. 1999. Т. 68, ¢ 1. С. 40-44.
- Плотникова Е.Г. и др. Бактерии-деструкторы полициклических ароматических углеводородов, выделенные из почв и донных отложений района солеразработок//Микробиология. 2001. Т. 70, ¢ 1. С. 61-69.
- Розанова Е.П., Назина Т.Н. Углеводородокисляющие бактерии и их активность в нефтяных пластах//Микробиология, 1982. Т. 51. С. 324-348.
- Boldrin B., Tiehm A., Fritzsche C. Degradation of phenanthrene, fluorene, fluoranthene, and pyrene by a Mycobacterium sp.//Appl. Environm. Microbiol. 1993. Vol. 59, ¢ 6. P. 1927-1930.
- Boonchan S., Britz M.L., Stanley G.A. Degradation and mineralization of high-molecular-weidht polycyclic aromatic hydrocarbons by defined fungalbacterial cocultures//Appl. Environm. Microbiol. 2000. Vol. 66, ¢ 3. P. 1007-1017.
- Furukawa K., Chakrabarty A.M. Involvement of plasmids in total degradation of chlorinated biphenyls//Appl. Envir. Microbiol. 1982. Vol. 44. P. 619-629.
- Galinski E.A. Compatible solutes of halophilic eubacteria: molecular principles, water-solute interaction, stress protection//Experientia. 1993. Vol. 49. P. 487-496.
- Eaton R. W. Plasmid-encoded phthalate catabolic pathway in Arthrobacter keyseri 12B//J. Bacteriol. 2001. Vol. 183. P. 3689-3703.
- Iwabuchi T., Harayama S. Biochemical and genetic characterization of trans?{2?{carboxy-bensalpyruvate hydratase-aldolase from a phenanthrene-degrading Nocardioides strain//J. Bacteriol. 1998. Vol. 180. P. 945-949.
- Kanaly R. A., Harayama S. Biodegradation of highmolecular-weight polycyclic aromatic hydrocarbons by bacteria//J. Bacteriol. 2000. Vol. 182, ¢ 8. P. 2059-2067.
- Kästner M, Breuer-Jammali M, Mahro B. Impact of inoculation protocols, salinity, and pH on the degradation of polycyclic aromatic hydrocarbons (PAHs) and survival of PAH-degrading bacteria introduced into soil//Appl Environ Microbiol. 1998. Vol. 64, ¢ 1. Р. 359-362.
- Keuth S., Rehm H.-J. Biodegradation of phenanthrene by Arthrobacter polychromogenes isolated from a contaminated soil//Applied Microbiology and Biotechnology. 1991. Vol. 34. P. 804-808.
- Kiyohara H. Nagao K., Nomi R. Degradation of phenanthrene through o?{phthalate by Aeromonas sp.//Agric. Biol. Chem. 1976. Vol. 40. P. 1075-1082.
- Laurie Andrew D., Gareth Lloyd-Jones The phn genes of Burkholderia sp. strain RP007 constitute a divergent gene cluster for polycyclic aromatic hydrocarbon catabolism//J. Bacteriol. 1999 Vol. 181. P. 531-540.
- Luz M., Paje F. Brett A., Neilan A., Couperwite I. A Rhodococcus species that thrives on medium saturated with liquid benzene//Microbiology. 1997. Vol. 143. P. 2975-2981.
- Marko M.A., Chipperfield R., Birnboim H.C. A procedure for the large-scale isolation of highly purified plasmid DNA using alkaline extraction and binding to glass powder//Analit. Biochem. 1982. Vol. 121. P. 382.
- Rheinwald J., Chakrabarty A.M., Gunsalus I.C. A transmissible plasmids controlling camphor oxidation in Pseudomonas putida//Proc. Natl. Acad. Sci. USA. 1973. Vol. 70. P. 885-889.
- Yen K.M., Serdar C.M. Genetic of naphthalene catabolism in pseudomonads. CRC//Crit. Rev. Microbiol. 1988. Vol. 15. P. 247-268.


